酮洛芬每日允许摄入量和最高残留限量标准(试行)及残留检测方法标准(试行)
- 格式:doc
- 大小:1012.50 KB
- 文档页数:14


156 食品安全导刊 2021年4月Tlogy科技食品科技兽药是指在防治动物疾病和调节动物生理机能中发挥了不可替代作用的一类药物,主要包括微生态制品、化学药品、抗生素、生化药品、放射性药品及外用杀虫剂、消毒剂等。
随着现代畜牧业生产模式的变化,饲料添加剂、抗生素等化学合成药物被广泛用于畜牧养殖业,这些兽药的大量使用,在防治动物疾病增加动物产品产量的同时,也给动物源性食品的安全性带来隐患。
但动物源性食品兽药残留超标问题时有发生,公众关注度很高,因此,对于动物源性食品建立科学的检测方法从而加强安全监管是至关重要的。
1 我国兽药残留现状1.1 兽药残留定义及种类兽药残留是指用药后蓄积或储存在细胞、组织或器官中的药物原型、代谢产物[1]。
兽药残留具有残留水平低、样品基质复杂、干扰物质多的特点。
兽药残留可以大致分为以下7类:性激素类等激素类和克仑特罗等β-兴奋剂类药品;四环素类、磺胺类、喹诺酮类等抗生素类药物;地西泮等镇静剂类药物;杀虫剂;抗寄生虫类药物;生长促进剂类。
通过对我国近几年来市场监管总局、各省局官方网站公布的动物源性食品不合格信息的梳理分析得出,农兽药残留项目不合格食品约占总不合格食品的30%。
动物源性食品中兽药残留不合格品种主要涉及蛋类(如鸡蛋等)、水产品(如贝类、淡水鱼虾等)、畜禽肉及副产品(如牛肉、猪肉、鸡肉等),不合格检测项目主要为喹诺酮类、孔雀石绿、硝基呋喃、磺胺类(总量)和氯霉素类等药物,此外,还涉及少量的地西泮、金刚烷胺、甲硝唑等。
1.2 兽药残留危害及产生原因兽药残留问题主要有以下3个方面的危害。
①对人类健康产生危害。
兽药残留超标的动物源性食品会对人体产生毒性或造成过敏反应,造成人体肠道菌群失衡,危害人类身体健康,更甚者长期食用还会导致致癌、致畸、致突变的不可逆性危害。
②制约着我国畜牧业的健康发展。
若对畜禽长期过度使用抗生素会导致耐药菌株的产生,影响动物疫苗接种效果,严重危害我国畜牧业的发展,不利于我国畜牧业进出口发展。

酮洛芬检验操作规程1. 目的建立酮洛芬检验标准操作规程,使酮洛芬肠检验操作规范化。
2. 范围适用于酮洛芬的质量检验。
3. 术语或定义3.1 GMP:药品生产质量管理规范(Good Manufacturing Practice)的英文简称。
3.2 SMP:标准管理程序(Standard Management Procedure),用于指导工作的管理类文件。
3.3 SOP:标准操作程序(Standard Operating Procedure),用于指导如何完成一项工作的文件。
4. 职责质量控制部对本规程的实施负责。
5. 程序5.1 检验依据5.1.1 《中国药典》2020年版二部(1730页)。
5.1.2 酮洛芬质量标准(质量标准编号:);5.1.3 《中国药典》2020年版四部。
1.【性状】1.1本品为白色结晶性粉末;无臭或几乎无臭。
本品在甲醇中极易溶,在乙醇、丙酮或乙醚中易溶,在水中几乎不溶。
1.2熔点依熔点测定法操作规程进行测定。
本品的熔点应为93~96℃。
2.【鉴别】2.1鉴别⑴2.1.1试剂乙醇、二硝基苯肼试液2.1.2仪器与用具天平(感量0.1mg)、试管(10ml)、刻度吸管(1ml)、酒精灯、试管夹2.1.3操作方法取本品约50mg,加乙醇1ml使溶解,加二硝基苯肼试液1ml,摇匀,加热至沸,放冷,即产生橙色沉淀。
2.2鉴别⑵2.2.1仪器与用具双光束红外分光光度计、压片机、玛瑙研钵2.2.2操作方法取供试品约1mg,置入玛瑙研钵研细,再取溴化钾粉(约200mg),在玛瑙研钵中充分研磨混匀,移置于直径13mm的压模中,使铺布均匀,加压至20MPa,约60秒取出。
目视检查应均匀,无明显颗粒。
将供试片置于仪器的样品光路中,进行光谱扫描。
供试品的红外光吸收图谱应与对照的图谱(光谱集517图)一致。
3.【检查】3.1甲醇溶液的澄清度与颜色3.1.1仪器与用具天平(感量1mg)、纳氏比色管(25ml)3.1.2操作方法取本品0.30g,加甲醇25ml溶解后,溶液应澄清无色;如显浑浊,与1号浊度标准液比较,不得更浓;如显色,与黄色1号标准比色液10ml加水10ml制成的对照液比较,不得更深。

高效液相色谱紫外检测法测定人血浆中酮洛芬浓度杨斌;谢海棠;芮家亮;童九翠;钟民;贾元威【期刊名称】《安徽医药》【年(卷),期】2009(013)011【摘要】目的建立高效液相色谱紫外法测定人血浆中酮洛芬浓度.方法用乙醚提取血浆样品中酮洛芬及酮洛酸(内标),采用Waters C18色谱柱(5 μm,4.6 mm×150 mm),以甲醇:水:冰醋酸:三乙胺=(48:52:0.2:0.3)为流动相,流速为1.0 ml·min-1,在268 nm波长下检测.结果酮洛芬和酮洛酸的保留时间分别为10.1 min和5.0 min,线性范围为0.10~10.46 mg·L-1,最低检测浓度为0.02 mg·L-1,线性关系良好.高、中、低浓度酮洛芬的准确度在85%~115%之间,批内和批间的变异系数均<15%,提取回收率大于70%.结论本方法简便、准确、重复性好,适用于人血浆中酮洛芬浓度测定及药代动力学研究.【总页数】3页(P1341-1343)【作者】杨斌;谢海棠;芮家亮;童九翠;钟民;贾元威【作者单位】皖南医学院弋矶山医院药物临床评价中心,安徽,芜湖,241000;皖南医学院弋矶山医院药物临床评价中心,安徽,芜湖,241000;皖南医学院弋矶山医院药物临床评价中心,安徽,芜湖,241000;皖南医学院弋矶山医院药物临床评价中心,安徽,芜湖,241000;皖南医学院弋矶山医院药物临床评价中心,安徽,芜湖,241000;皖南医学院弋矶山医院药物临床评价中心,安徽,芜湖,241000【正文语种】中文【中图分类】R9【相关文献】1.高效液相色谱法测定家兔血浆中右旋酮洛芬浓度 [J], 何凤慈;陈亮;孟德胜2.高效液相色谱-紫外检测法测定人血浆中乌拉地尔的质量浓度 [J], 果崇慧;刘德艳;何国云3.高效液相色谱法测定人血浆中米卡芬净浓度及其在重症患者中的应用 [J], 赵明明;陈亚南;路童;李国飞;肇丽梅4.高效液相色谱法测定不同时间人血浆中帕拉米韦的浓度及临床观察 [J], 赵晓娟;赵永红;王淑梅;李浩然;刘秀菊5.高效液相色谱-紫外检测法测定人血浆中法罗培南的浓度及其生物等效性研究 [J], 梁雁;诸兰振;贺春晖因版权原因,仅展示原文概要,查看原文内容请购买。

I C H常用有机溶剂分类及残留限度YKK standardization office【 YKK5AB- YKK08- YKK2C- YKK18】ICH常用有机溶剂分类及残留限度2009-12-04 11:50残留溶剂无防治作用并可能对人体的健康和环境造成危害,本文对国际协调大会(ICH)制订的指导原则及各国执行情况作了较为详尽的介绍。
药品的残留溶剂,又称有机挥发性杂质,是指在活性药物成分、辅料和药品生产过程中使用和产生的有机挥发性化学物质。
药品还可被来自包装、运输、仓储中的有机溶剂污染。
药品生产商有责任确保终产品中的任何一种残留溶剂对人体无害。
各国药监部门曾使用不同的药品残留溶剂指导原则,为此国际组织展开了协调工作。
经相关程序讨论和审查后,国际协调大会的指导原则于1997年7月17日获得通过,被推荐至国际协调大会(ICH)的指导委员会采用。
该指导原则要求,如果某个药品的生产或纯化过程可导致溶剂残留,就应对这个药品进行检测,并且只检测生产过程或纯化中使用或产生的那种溶剂。
根据使用量的多少,可采用累加的方法计算药品中残留溶剂的量。
如果累加量低于或等于指导原则中的推荐量,则该药品无需进行残留溶剂检测;如果累加量高于推荐量,则必须对该药品进行残留溶剂检测。
该指导原则适用于颁布以后上市的所有剂型和给药途径,但不适用于在临床研究阶段使用的潜在新药和新辅料,也不适用于已上市的现有药物。
在某些情况如短期(小于30天)或局部应用下,视具体情况,溶剂的高残留量也可接受。
按照毒性大小和对环境的危害程度,该指导原则将溶剂分成三类(所列举的溶剂并不完全,应对合成和生产过程所有可能的残留溶剂进行评估):第一类溶剂是指已知可以致癌并被强烈怀疑对人和环境有害的溶剂。
在可能的情况下,应避免使用这类溶剂。
如果在生产治疗价值较大的药品时不可避免地使用了这类溶剂,除非能证明其合理性,残留量必须控制在规定的范围内,如:苯(2ppm)、四氯化碳(4ppm)、1,2-二氯乙烷(5ppm)、1,1-二氯乙烷(8ppm)、1,1,1-三氯乙烷(1500ppm)。
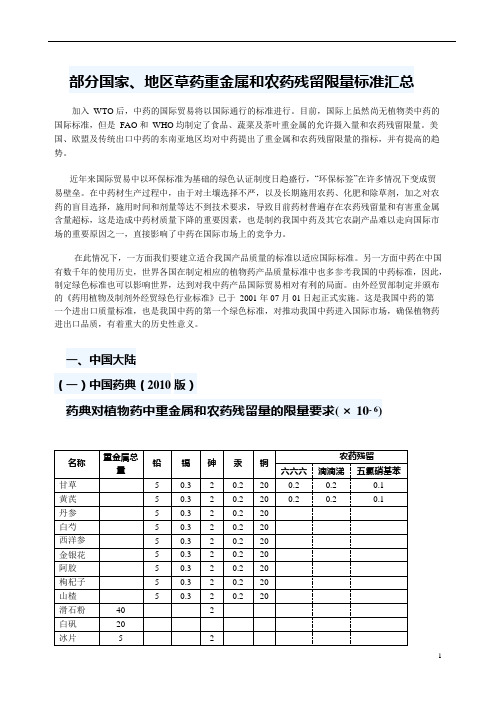
部分国家、地区草药重金属和农药残留限量标准汇总加入WTO 后,中药的国际贸易将以国际通行的标准进行。
目前,国际上虽然尚无植物类中药的国际标准,但是FAO 和WHO 均制定了食品、蔬菜及茶叶重金属的允许摄入量和农药残留限量。
美国、欧盟及传统出口中药的东南亚地区均对中药提出了重金属和农药残留限量的指标,并有提高的趋势。
近年来国际贸易中以环保标准为基础的绿色认证制度日趋盛行,“环保标签”在许多情况下变成贸易壁垒。
在中药材生产过程中,由于对土壤选择不严,以及长期施用农药、化肥和除草剂,加之对农药的盲目选择,施用时间和剂量等达不到技术要求,导致目前药材普遍存在农药残留量和有害重金属含量超标,这是造成中药材质量下降的重要因素,也是制约我国中药及其它农副产品难以走向国际市场的重要原因之一,直接影响了中药在国际市场上的竞争力。
在此情况下,一方面我们要建立适合我国产品质量的标准以适应国际标准。
另一方面中药在中国有数千年的使用历史,世界各国在制定相应的植物药产品质量标准中也多参考我国的中药标准,因此,制定绿色标准也可以影响世界,达到对我中药产品国际贸易相对有利的局面。
由外经贸部制定并颁布的《药用植物及制剂外经贸绿色行业标准》已于2001 年07 月01 日起正式实施。
这是我国中药的第一个进出口质量标准,也是我国中药的第一个绿色标准,对推动我国中药进入国际市场,确保植物药进出口品质,有着重大的历史性意义。
一、中国大陆(一)中国药典(2010 版)药典对植物药中重金属和农药残留量的限量要求( × 10- 6)(二)药用植物及制剂外经贸绿色行业标准(WM/T2-2004)适用范围:药用植物原料及制剂的外经贸行业品质检验重金属及砷盐限量:重金属总量≤20.0 mg/kg。
铅(Pb)≤5.0mg/kg。
镉(Cd)≤0.3mg/kg。
汞(Hg)≤0.2mg/kg。
铜(Cu)≤20.0 mg/kg。
砷(As)≤2.0mg/kg。
右酮洛芬氨丁三醇注射剂质量标准右酮洛芬氨丁三醇注射剂质量标准是指该药品在生产、储存和使用过程中需要符合的各项指标和标准,以确保药品的质量、安全和有效性。
这些标准一般包括药品的理化性质、成分含量、微生物限度、残留溶剂、重金属含量、质量控制等方面的要求。
合格的药品质量标准是保障药品质量和使用安全的重要基础,也是药品监管和质量管理的重要依据。
右酮洛芬氨丁三醇注射剂是一种用于镇痛、解热和抗炎的药品,广泛应用于临床治疗。
其质量标准的制定和执行至关重要。
严格的质量标准可以保证药品的疗效和安全性,降低药品质量不合格和不良反应的风险,保护患者的用药安全和权益。
在制定右酮洛芬氨丁三醇注射剂质量标准时,需要考虑以下几个方面:1. 理化性质:包括外观、溶解度、pH值等指标。
这些指标直接影响药品的稳定性、易用性和生物利用度。
2. 成分含量:主要是指右酮洛芬氨丁三醇和其他辅料的含量。
药品的成分含量需精确控制在一定范围内,以确保药品的疗效和安全性。
3. 微生物限度:药品中微生物的存在会对患者的健康造成威胁,因此需要对药品中的细菌、霉菌等微生物进行严格的检查和限制。
4. 残留溶剂:在药品生产过程中可能使用一些有机溶剂,残留溶剂的含量需符合国家标准,以确保药品的安全性。
5. 重金属含量:重金属对人体有一定的毒性,药品中的重金属含量也需要严格限制。
除了上述基本标准外,药品生产企业还需要建立健全的质量控制体系,包括原辅料的质量控制、生产过程的质量控制、成品药品的质量控制以及质量变更的管理等。
还需要建立质量档案,对生产过程中的每一个环节进行记录和管理,以便溯源和质量追溯。
回顾以上提到的右酮洛芬氨丁三醇注射剂质量标准的内容,我们可以看到,这些标准涵盖了药品的各个方面,并且都是为了确保药品的质量、安全和有效性。
在实际生产和使用中,药品生产企业、药品监管部门以及临床医生和患者都需要严格遵守和执行这些标准,以保证药品的质量和用药的安全。
在个人观点方面,我认为右酮洛芬氨丁三醇注射剂作为一种常用的临床药品,其质量标准的制定和执行至关重要。
(五)违禁物质和药物残留检测制度为保证食品安全执行政府规定的关于待宰生猪违禁物质和药物残留自检的要求,特制定本制度。
一、适用范围:本制度适用于公司的药残检测和违禁物质检。
二、工作职责1、质检部负责药残检测和违禁物质检测。
指定负责人实施违禁药物自检和自检记录工作。
并负责试剂领用、样品采集、检测、结果判定;负责配合政府监管部门开展的监督抽检的采样及监管对接。
2、采购部负责检测试剂的采购和储存。
3、质检部负责告知客户检测结果及与客户的沟通工作。
4、销售部负责不合格品的挑拣及合格品的发货。
5、生产部负责不合格品的挑拣及无害化处理。
三、检测主要内容及方法1、瘦肉精主要检测内容是克仑特罗、莱克多巴胺和沙丁胺醇,检测方法是药残检测法。
检测设备为国家规定使用的克仑特罗、莱克多巴胺和沙丁胺醇残留检测试纸条。
2、抗生素检测。
检测方法是药残检测法。
主要检测设是酶标仪。
四、试剂管理1、采购部按公司要求做好药残检测试剂盒的采购工作,保证检测工作正常开展。
并按日期、种类、储存条件做好试剂盒的储存管理,做好台账。
2、质检部做好出库试剂盒保管,建立使用及余量台账。
五、检验管理1、环境的管理(1)检测室环境的温度要求控制在之间,以防某些化学试剂蒸发,并能使仪器处于良好状态。
(2)检测室的相对湿度不能超过50%,如超过50%,应及时排湿。
(3)检测室内应保持清洁、干燥、有防虫、防鼠措施,有良好的排风设备。
2、卫生的管理(1)每班下班前必须把地面打扫干净,即地面应无水、无垃圾、无泥土、无化学药品后方可下班。
(2)操作台上时时保持无垃圾、无化学药品、无灰尘等。
(3)在检测仪器使用完后,要保证仪器设备和环境卫生,不允许无关的人在里面逗留。
(4)较长时间不使用的试剂,配件等,每周应打扫清洗一次。
(5)检测员必须穿上工作服方可进入检测室,严禁未穿白大褂的人员进行操作;严禁把白大褂穿出检测室。
(6)检测员在上下班前必须洗手,工作服、白大褂必须保持干净,每个星期少清洗一次。
双氯芬酸每日允许摄入量(ADI)和最高残留限量(MRLs)(试行)申报单位参照欧盟有关标准制定了双氯芬酸的每日允许摄入量(ADI)和双氯芬酸在牛组织及牛奶中的最高残留限量(MRL),如下表:双氯芬酸残留检测方法标准(试行)牛可食性组织及牛奶中双氯芬酸残留量的测定液相色谱-串联质谱法1 范围本标准规定了牛可食性组织(肌肉、肝脏、肾脏和脂肪)及牛奶中,双氯芬酸残留量检测的制样和液相色谱-串联质谱测定方法。
本标准适用于牛的肌肉、肝脏、肾脏、脂肪和牛奶中双氯芬酸残留量的测定。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 6682 分析实验室用水规格和试验方法GB/T 6379.1 测量方法与结果的准确度(正确度与精密度)第1部分:总则与定义(GB/T 6379.1—2004,ISO 5725-1:1994,IDT)GB/T 6379.2 测量方法与结果的准确度(正确度与精密度)第2部分:确定标准测量方法重复性与再现性的基本方法(GB/T 6379.2—2004,ISO 5725-2: 1994,IDT)农业部农牧发[2003]1号兽药残留试验技术规范(试行)3 原理将匀浆后的肌肉、肝脏和肾脏样品,以0.9%氯化钠溶液混悬后,样品中的双氯芬酸及双氯芬酸-13C(内标),用乙酸乙酯萃取,将乙酸乙酯提取液浓缩至干,残渣以流动相复溶,液相色谱-串联质谱法检测,内标法定量。
将匀浆后的脂肪样品水浴加热融化后,样品中的双氯芬酸及双氯芬酸-13C(内标),用乙腈-乙酸乙酯溶液提取,上清液脱脂后,将乙腈提取液浓缩至干,残渣以流动相复溶,液相色谱-串联质谱法检测,内标法定量。
将牛奶均质后,样品中的双氯芬酸及双氯芬酸-13C(内标),用乙腈提取,提取时加入乙酸铵,上清液脱脂后,将乙腈提取液浓缩至干,残渣以流动相复溶,液相色谱-串联质谱法检测,内标法定量。
酮洛芬肠溶胶囊检验操作规程1. 目的建立酮洛芬肠溶胶囊成品检验标准操作规程,使酮洛芬肠溶胶囊成品检验操作规范化。
2. 范围适用于酮洛芬肠溶胶囊成品的质量检验。
3. 术语或定义N/A4. 职责质量控制部对本规程的实施负责。
5. 程序5.1 检验依据5.1.1 《中国药典》2020年版二部(第1731页)。
5.1.2 酮洛芬肠溶胶囊质量标准(质量标准编号:);5.1.3 《中国药典》2020年版四部。
5.2 性状:本品内容物为白色粉末。
5.3 鉴别5.3.1 试药与试液乙醇二硝基苯肼试液 75%的甲醇5.3.2仪器与用具紫外-可见分光光度计【鉴别1】取本品10粒,取其内容物,加乙醇5ml振摇使酮洛芬溶解,滤过,加二硝基苯肼试液1ml,摇匀,加热至沸,放冷,即产生橙色沉淀。
【鉴别2】取本品的内容物0.17g,用75%的甲醇稀释至25ml;精密吸取1ml,再用75%的甲醇稀释至100ml(每1ml中约含酮洛芬10μg),滤过,取续滤液,照紫外-可见分光光度法测定,本品在258nm波长处应有最大吸收。
5.4 检查5.4.1释放度5.4.1.1试药与试液酮洛芬对照品磷酸盐缓冲液(pH6.8)、0.1mol/L 盐酸溶液、甲醇5.4.1.2仪器与用具智能药物溶出仪、紫外分光光度计、电子天平取样器、过滤器、容量瓶(50ml )、量筒(1000ml )5.4.1.3操作方法5.4.1.4供试液的制备取本品,采用溶出度测定法第一法(篮法)装置,以0.1mol/L 盐酸溶液750ml 为释放介质,转速为每分钟100转,依法操作,经2小时时,取溶液10ml ,滤过,取续滤液作为供试品溶液(1)。
然后向溶出杯中加入37℃的0.2mol/L 磷酸钠溶液250ml ,混匀(必要时用2mol/L 的盐酸溶液或2mol/L 的氢氧化钠溶液调节pH 值为6.8±0.05),继续运转45分钟,取溶液10ml ,滤过,精密量取续滤液6ml ,用磷酸盐缓冲液(pH6.8)稀释至25ml (每1ml 中约含酮洛芬6μg ),作为供试品溶液(2)。
附件5酮洛芬每日允许摄入量和最高残留限量标准(试行)及酮洛芬残留检测方法标准(试行)酮洛芬每日允许摄入量和最高残留限量标准(试行)申报单位参照日本有关标准制定了酮洛芬的每日允许摄入量(ADI),参照日本肯定列表中酮洛芬残留限量标准制定了酮洛芬在牛组织中的最高残留限量(MRLs),如下表:活性成分ADI残留标志物动物品种靶组织MRLs(μg/kg)酮洛芬0-1μg∙kg-1∙d-1酮洛芬牛牛奶50 肌肉50 肾脏50 肝脏50 脂肪50酮洛芬残留检测方法标准(试行)一、牛奶中酮洛芬残留量的测定液相色谱-串联质谱法1 范围本标准规定了牛奶中酮洛芬残留量检测的制样和液相色谱-串联质谱测定方法。
本标准适用于牛奶中酮洛芬残留量的检测。
2 规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 1.1-2009 标准化工作导则第1部分:标准的结构和编写规则GB/T 6682-1992 分析实验室用水规格和试验方法3 原理试样中酮洛芬残留物用甲醇提取,液相色谱-串联质谱测定,内标法定量。
4 试剂和材料以下所用的试剂,除特别注明者外均为分析纯试剂;水为符合GB/T 6682规定的一级水。
4.1 酮洛芬对照品(分子式:C16H14O3,含量≥98%)。
4.2 酮洛芬-D3内标物(分子式:C16H11D3O3,含量≥99.5%)。
4.3 甲醇:色谱纯。
4.4 乙腈:色谱纯。
4.5 甲酸:色谱纯。
4.6 酮洛芬储备液(1mg/mL):精密称取酮洛芬对照品50mg置于50mL棕色容量瓶,用30mL 甲醇溶解并稀释至刻度,摇匀,即得。
分装,置于-20℃冰箱避光保存,有效期1个月。
4.7 酮洛芬标准工作液:取酮洛芬储备液适量,分别置于10mL棕色容量瓶内,用甲醇稀释至刻度,制得2000ng/mL、1500ng/mL、1000ng/mL、500ng/mL、250ng/mL、100ng/mL、50ng/mL、20ng/mL、10ng/mL系列浓度的酮洛芬标准工作液,现配现用。
4.8 酮洛芬-D3贮备液(1mg/mL):精密称取含酮洛芬-D3对照品10mg置于10mL棕色容量瓶,用5mL甲醇溶解并稀释至刻度,摇匀,即得。
分装,置于-20℃冰箱避光保存,有效期3个月。
4.9 酮洛芬-D3标准工作液:取酮洛芬-D3储备液适量,置于10mL棕色容量瓶,用甲醇稀释至刻度,制得500ng/mL、250ng/mL的酮洛芬-D3标准工作液,避光,现配现用。
4.10 0.1%甲酸溶液:取1.00mL甲酸加入1L容量瓶中,用水稀释至刻度,摇匀,即得,现配现用。
4.11 0.1%甲酸的乙腈溶液:取1.00mL甲酸加入1L容量瓶中,用乙腈稀释至刻度,摇匀,即得,现配现用。
4.12 0.1%甲酸溶液-0.1%甲酸的乙腈溶液(90/10,v/v):量取900mL0.1%甲酸溶液与100mL0.1%甲酸的乙腈溶液,混匀即得,现配现用。
5 仪器和设备5.1 液相色谱仪—串联质谱仪:配电喷雾离子源。
5.2 分析天平:感量0.00001 g。
5.3 天平:感量0.01 g。
5.4 漩涡振荡器。
5.5 水平振荡器。
5.6 数控超声波清洗器。
5.7 高速台式冷冻离心机。
5.8 数显恒温水浴锅。
5.9 离心管:50 mL。
5.10 氮吹仪。
5.11 Millipore-Q超纯水系统。
5.12 两用型隔膜真空泵。
5.13 可调微量移液器。
5.14 滤膜:孔径0.22μm。
6 试料的制备与保存6.1 试料的制备取适量新鲜或冷藏的空白或供试牛奶,混合,并使均质。
——取均质的供试样品,作为供试试料。
——取均质的空白样品,作为空白试料。
——取均质的空白样品,添加适宜浓度的标准工作液,作为空白添加试料。
6.2 试料的保存-20℃以下保存。
7 测定步骤7.1 样品预处理将牛奶样品解冻至室温,涡旋混匀后准确称取1g试料(精确至0.01g)于50mL具塞聚丙烯离心管中,加入“酮洛芬-D3标准工作液”50μL(浓度为500ng/mL),内标的添加浓度为25ng/mL,涡旋3min,避光静置30min后,加甲醇4mL涡旋1min,200r/min水平振荡10min后,超声10min。
于4℃10000r/min离心10min,取上清液转移至10mL离心管中。
40℃水浴下氮吹干燥。
干燥后,离心管中加入1mL复溶液﹝0.1%甲酸溶液-0.1%甲酸的乙腈溶液(90∶10,v/v)﹞,涡旋,超声10min后,于4℃10000r/min离心10min,取上清液过滤,供液相色谱-串联质谱测定。
7.2 标准曲线的制备取空白牛奶样品,按“7.1”方法进行处理后得到空白基质,在8支1.5mL离心管中各加入0.8mL空白基质,除第1管外,其余各管依次加入100μL系列浓度的酮洛芬标准工作液和100μL内标标准工作液(浓度为250ng/mL),涡旋混匀,使牛奶中酮洛芬添加浓度依次为5、10、25、50、100、150、200ng/mL,内标添加浓度为25ng/mL。
第一管不加酮洛芬作空白对照,具体见表1。
按照“7.3”方法上机检测。
将牛奶中酮洛芬浓度,以酮洛芬特征离子峰面积与酮洛芬-D3特征离子峰面积之比作为纵坐标,对应的浓度为横坐标,绘制标准曲线。
求线性回归方程和相关系数。
表1 牛奶中酮洛芬标准曲线系列浓度表编号0 1 2 3 4 5 6 7 空白牛奶提取液量(μL)1000 800 800 800 800 800 800 800 内标的添加体积(μL)0 100 100 100 100 100 100 100内标工作液浓度(ng/mL)0 250 250 250 250 250 250 250 酮洛芬工作液的浓度(ng/mL)0 50 100 250 500 1000 1500 2000 酮洛芬工作液添加体积(μL)0 100 100 100 100 100 100 100 酮洛芬添加浓度(μg/kg)0 5 10 25 50 100 150 200 内标的上机浓度(μg/kg)0 25 25 25 25 25 25 25 酮洛芬上机浓度(μg/kg)0 5 10 25 50 100 150 200 7.3 测定7.3.1 色谱条件色谱柱:Agilent pursuit XRS5-C18,2.0mm×150mm,5μm,或效能相当的色谱柱;柱温:25℃;流动相:A-0.1%甲酸溶液,B-乙腈,梯度条件见表2;流速:0.25mL/min;运行时间:13min;进样量:5μL。
表2 流动相洗脱梯度时间(分钟)A相% B相%0 90 101 90 101.5 10 907.5 10 908 90 1013 90 107.3.2 质谱条件离子源:电喷雾离子源;扫描方式:正离子扫描;干燥气温度:350℃;干燥气流速:9L/min;喷雾气压力:30psig;毛细管电压:4000V;Delta EMV:200V。
表3 酮洛芬和内标的定性、定量离子对及碰撞能量参考值化合物定量离子对(m/z)定性离子对(m/z)碰撞电压(V)碰撞能量(eV)酮洛芬255.1>209.2255.1>209.2 120 9255.1>105.0 120 21酮洛芬-D3内标物258.1>212.1258.1>212.1 120 9258.1>105.0 120 257.4 定性测定通过样品色谱图的保留时间与对照品的保留时间、色谱峰的特征离子与相应浓度对照品色谱峰的特征离子相对照定性。
样品与对照品保留时间的相对偏差不大于2.5%;样品特征离子的相对丰度与浓度相当标准溶液中对应的相对丰度进行比较,若相对丰度偏差不超过表4的规定,则可判断样品中存在相应的被测物。
表4 定性测定时相对离子丰度的最大允许偏差相对离子丰度>50% >20%至50% >10%至20% ≤10%允许的相对偏差±20% ±25% ±30% ±50%7.5 定量测定取试样溶液和相应的基质匹配标准工作液,按内标法定量,标准工作液及试样溶液中的酮洛芬的响应值均应在仪器检测的线性范围内。
对于方法学验证时的添加回收样品,采用单点校正的方式定量。
相关图谱参考附件A。
7.6 空白试验除不加试料外,采用完全相同的测定步骤进行平行操作。
8 结果计算和表述单点校准:由X=(A i×A´is×C s×C is×V×f)/(A is×A s×C´is×m)或基质匹配标准曲线校准:X=(C×V×f)/m式中:X——供试试料中酮洛芬的残留量,μg/kg;C——由基质匹配标准曲线得到的酮洛芬浓度,μg/L;A i——供试试料溶液中酮洛芬的峰面积;A´is——基质匹配标准溶液中酮洛芬-D3的峰面积;C s——基质匹配标准溶液中酮洛芬的浓度,μg/L;C is——供试试料溶液中酮洛芬-D3的浓度,μg/L;A is——供试试料溶液中酮洛芬-D3的峰面积;A s——基质匹配标准溶液中酮洛芬的峰面积;C´is——基质匹配标准溶液中酮洛芬-D3的浓度,μg/L;V——残余物定容体积,mL;m——供试试料质量,g;f——稀释倍数。
注:计算结果需扣除空白值,测定结果用平行测定的算术平均值表示,保留两位有效数字。
9 检测方法灵敏度、准确度、精密度9.1 灵敏度本方法检测限为1.0μg/kg,定量限为10.0μg/kg。
9.2 准确度本方法在10~100μg/kg添加浓度水平的回收率为80%~110%。
9.3 精密度本方法的批内相对标准偏差≤15%,批间相对标准偏差≤20%。
附录A(资料性附录)图A1 牛奶空白试样溶液特征离子色谱图图A2 牛奶基质匹配酮洛芬标准溶液特征离子色谱图(5μg/L)图A3 牛奶空白添加试样溶液特征离子色谱图(10μg/kg)(图A1~A3中由上至下依次为酮洛芬-D3内标物、酮洛芬特征离子质量色谱图258.1>105.0、258.1>212.1、255.1>105.0、255.1>209.2)二、牛可食性组织中酮洛芬残留量的测定液相色谱-串联质谱法1 范围本标准规定了牛可食性组织中酮洛芬残留量检测的制样和液相色谱-串联质谱测定方法。
本标准适用于牛肌肉、肾脏、肝脏和脂肪组织中酮洛芬残留量的检测。
2 规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。