微载体上MRC_5细胞扩大培养的研究_陈余娟
- 格式:pdf
- 大小:2.89 MB
- 文档页数:1



文章编号:0427-7104(2001D 05-0525-05微型腺病毒载体的扩增和纯化研究邰艳红1 2 王飞1 王琪1 卢大儒1 郑尊2 薛京伦1(1.复旦大学生命科学学院遗传学研究所遗传工程国家重点实验室 上海200433;2.第二军医大学基础部细胞生物学教研室 上海200433D 摘要:微型腺病毒(mAd D 是去除所有编码基因 仅保留两侧反向末端重复序列(ITR D 及包装信号(I D 的新型腺病毒载体.它具有包装容量大 免疫原性小等优点.在大量扩增时 需与缺失E 1区及包装信号的辅助腺病毒共转染入包装细胞(293细胞D 内 S 1超离心纯化 将二者分开.再通过琼脂糖覆盖挑斑~在包装细胞内大量扩增~S 1超离心纯化等步骤 最终得到较为纯净的mAd .但因mAd 结构不稳定 易与辅助病毒发生同源重组 在S 1超离心时不能完全与辅助病毒分开 导致外源基因表达逐步下降.关键词:微型腺病毒;扩增;纯化中图分类号:G 39;R 554文献标识码:A腺病毒(AdenoviruS Ad D 因其滴度高~易于制备~转染效率高等优点 现已成为仅次于反转录病毒载体的应用最广泛的一类病毒载体[1].然而 由于腺病毒基因本身转录的病毒蛋白会诱导宿主产生细胞免疫及体液免疫 最终导致外源基因不能长期稳定地表达 且造成二次注射失败[2];目前常用的腺病毒载体(AdV D 包装容量小(约8kb D 不能容纳大片断外源基因.为了提供腺病毒载体的包装容量 降低腺病毒载体的免疫原性 提高外源基因的表达时间及可重复注射的目的 腺病毒载体的结构一直在不断的被改进[3*5].我们尝试构建去除所有病毒编码基因 仅保留两侧反向末端重复序列(ITR D 及包装信号(I D 共500bp 左右的微型腺病毒载体(mini -Ad mAd D 介导凝血F X 基因及绿色荧光蛋白报告基因(GFP D 进行大量扩增~纯化~离体及活体表达检测.由于微型腺病毒缺失所有结构蛋白基因 仅保留复制及包装所必需的顺式结构 在其大量扩增时 就必须与辅助腺病毒(E 1区缺失D 一同转入包装细胞(含腺病毒的E 1区片断D 为其提供复制及包装所需的蛋白.因此 在大量扩增2种病毒混合液后 mAd 的分离纯化是一个关键问题.本文就微型腺病毒载体的大量扩增及纯化作了初步的尝试 为其下一步的外源基因表达打下基础.1材料和方法1.1细胞系及腺病毒混合液293细胞为含有Ad 5的E 1区并持续表达E 1A 及E 1B 功能蛋白的人胚肾细胞系 由加拿大哥伦比亚大学A .Ama1Sitano 赠送;含凝血F X 基因及GFP 报告基因的微型腺病毒(mAdcFIX ;mAd D 和含B -ga1报告基因的辅助腺病毒(Ad~B D 由美国Baxter 公司张维维博士构建 由本实验室负责扩增及纯化.RSF 细胞(兔成纤维细胞系D 购自美国AT 公司.1.2mad 和adHB 混合斑(6D 的制备将高糖DMEM +10%F S (体积分数D 加入在6孔板培养的293细胞中至细胞50%铺满 改用含2%525第5期邰艳红等:微型腺病毒载体的扩增和纯化研究 收稿日期:2000-12-07基金项目:国家 863'项目(863-Z 20-02-01D ;国家自然科学基金(39880019D ;国家教育部优秀青年教师基金;教育部博士点基金(98024620D ;霍英东基金;全国优秀博士论文基金;教育部跨世纪人才基金资助作者简介:邰艳红(1970 D 女 医学硕士.625复旦学报(自然科学版D第40卷FCS的高糖DMEM培养基加入20pL mAd及AdHB混合液转染6h后倒去培养液.将加热的12g/L 琼脂糖与加温的2>DMEM液等量混匀调温至42C取2mL混合液轻轻地加入培养孔中室温冷却凝培养箱中.在转染第3天~第5天如法覆盖.第5~7天挑取含mAdcFIX与AdHB的混合病结后转至CO2毒颗粒的半透明空斑20个分别加入0.5mL Tris-HCl(0.01mol/mL pH=8.1D中反复吹打经37C和-80C(各5min D中冻融3次~3000r/min(4C10min D离心后留上清得到20个初次重组腺病毒斑的粗提液.用上述粗提液分别转染293细胞用琼脂糖覆盖~挑半透明感染空斑20个3次冻融和离心得到1 mL含混合腺病毒颗粒的粗提液.各取300pL粗提液转染293细胞.当观察到部分细胞有CPE反应(细胞毒性效应D时收集含混合腺病毒的293细胞用荧光显微镜和X-gal染色鉴定并筛选出荧光反应强~X-gal染色阳性率适中的克隆.1.3mad的大量扩增将首代鉴定的mAd粗提液感染在6孔板中培养的293细胞用含2%(体积分数D小牛血清的DMEM培养待90%的293细胞出现CPE反应时收集细胞~离心(3000r/min4C10min D;取沉淀细胞用0.01mol/L Tris-HCl(pH8.1D复悬(在约5>106细胞中加入0.3mL Tris-HCl液D经37C和-80 C(各5min D中冻融3次;冻融液离心取上清液为mAd粗提液.以同样方法大量扩增病毒粗提液-20 C保存;待收集培养的293-mAd细胞达150瓶(以100mL的培养瓶计算D一同超离心纯化.在每次收集病毒粗提液后取0.1mL感染105贴壁生长的RSF细胞6h后在492nm波长激发光下用荧光显微镜观察报告基因GFP的表达同时做X-gal染色.确保mAd的转染和包装良好.1.4mad的CSCI超离心纯化[3]共进行连续2次CsCl梯度超离心,在11.5mL的CsCl超离心管中依次加入0.5mL的1.5g/mL CsCl 2.5mL的1.35g/mL CsCl和2.5mL的1.25g/mL CsCl在CsCl液面上缓慢加入mAd及AdHB 5.5mL用石蜡油封顶并配平.离心条件为8150kg(S 41离心机STS型转头D1h.离心后抽取1.35 g/mL和1.25g/mL CsCl之间的单一病毒带.将抽取的病毒液与1.35g/mL CsCl按1:5混匀加入11. 5mL离心管内离心条件为8150kg18h.2条病毒带分别位于距管底2.7cm 3.5cm处.分别抽取至透析盒中用PBS透析3次(每次透析液3000mL D第4次透析液采用10%(体积分数D甘油-PBS每次2 ~3h;纯化产物分装于-20C暂时保存备用.1.5二种病毒的浓度测定取纯化的腺病毒颗粒5pL加120~125pL第4次透析液(PBS+10%(体积分数D甘油D混匀以第4次透析液为空白对照紫外分光光度计(波长260nm D比色根据D(260D值计算Ad颗粒数(mL-1D,即D(260D>稀释倍数>1012.1.6mad的纯度检测将2种病毒纯化液分别加入到70%融合的培养RSF细胞的6孔板内(102particles/cell D6h后在492nm激发光下以荧光显微镜观察一孔细胞的GFP表达另一孔细胞用4%(体积分数D多聚甲醛固定10min X-gal染色4h后再在荧光显微镜下观察GFP的表达同时在普通光学显微镜下观察B-gal的表达情况计算表达报告基因的细胞所占比例.2结果2.1GFP表达的稳定性检测在进行mAd大量扩增的过程中为了使得到的mAd始终保持较高活力我们对每一代扩增的病毒粗提液都进行报告基因GFP的表达检测发现GFP的表达很不稳定其中第1代mAd中GFP表达的细胞约占100%而到第5代降为60%到7代以后降到30%以下(图1所示D.图1mAd 扩增后RSF 细胞GFP 的表达情况Fig .1The expreSSion of GFP in RSF cellS after mAd S amplification .A .第一代;.第五代;C .第七代;D .未感染腺病毒的RSF 细胞.GFP 位于核周(-)2.2mad 的超离心纯化及浓度测定通过连续2次CSCl 梯度超离心 最终在1.35g /mL 和1.25g /mL CSCl 之间得到2条界限不明显的病毒宽带 分别抽取2条病毒带(上方为浮密度小的mAd 距管底3.5cm 下方为浮密度大的Ad~B 距管底2.7cm 测D (26O) 计算病毒颗粒含量 mAd 为2.3>1O 11mL -1;Ad~B 为4.5>1O 11mL -1.2.3mad 的纯度检测感染mAd 组的RSF 细胞在荧光显微镜下可见表达GFP 的细胞占83% X -gal 染色后仅见极少蓝染细胞;感染Ad~B 组RSF 细胞在荧光显微镜下可见GFP 表达占23% X -gal 染色后蓝染细胞占97%(图2所示) 而未感染腺病毒的对照组未见荧光及蓝染(未显示).图2mAd 的纯度检测Fig .2The detection of mAd S purity .A .感染mAd 的RSF 细胞GFP 表达(-);.感染mAd 的RSF 细胞的GFP 表达(Y )及X -gal 染色(-);C .感染Ad~B 的RSF 细胞后GFP 表达(-);D .感染Ad~B 的RSF 细胞的GFP 表达(Y )及X -gal 染色(-)3讨论本实验通过大量扩增~CSCl 超离心纯化 成功地得到了颗粒含量较高且较为纯净的mAd 纯化液.其携带的报告基因GFP 的表达检测证明 mAd 介导外源基因可以在离体培养细胞内较高水平地表达 但同时也发现 mAd 感染的细胞中偶尔也可检测出B -gal 的表达 即mAd 中掺杂有约1%的Ad~B .这种现象应从微型腺病毒载体系统本身的结构分析(图3 此图为本室自制):(1)mAd 缺失所有结构基因 仅保留725第5期邰艳红等:微型腺病毒载体的扩增和纯化研究500bp 左右的顺式结构,它与野生型腺病毒的结构差异性最大,因此其结构的稳定性也最差,因此,Ad~B 的包装能力远大于mAd ,造成Ad~B 的优先包装(3D .(2D 由于mAd 的结构特点,在复制及包装时,必需有Ad~B 与其共转染293细胞(内含E 1区片断D 为其提供反式补偿.(3D mAd 与Ad~B 及293细胞内E 1区之间存在一定的同源序列.在一定条件下可发生同源重组而产生新的病毒(3,7D .由于以上三种原因,使扩增mAd 过程中产生大量重组病毒,其长度介于mAd 与Ad~B 之间.这样就导致mAd 携带的报告基因的逐步丢失,随扩增代数的增加,GFP 表达下降.而且在CSCI 超离心纯化时2种病毒带界限不清或形成宽带,造成分离的困难.因此在大量制备mAd 时,应注意仅保留扩增的前几代病毒,尽量减少同源重组的机会.尽管目前仅有几个实验室在进行微型腺病毒的研究,腺病毒的同源重组问题仍然引起了极大的关注,并尝试了各种解决的方法.除尝试不同的CSCI 超离心条件外,ParkS 等[8~11]在辅助型腺病毒的包装信号两侧插入IoXP 位点后,与mAd 共转染入293Cre (持续表达Cre 重组酶的293细胞D 细胞中扩增,这样可以通过同源重组将IoXP 位点之间的包装信号缺失,并保证辅助型腺病毒结构的稳定性,有效减少了辅助病毒与mAd 及包装细胞之间的同源重组,同时也降低了辅助病毒的包装效率,氯化铯梯度超离心后,辅助病毒的污染率明显降低.但并未从根本上将2种病毒完全分开.因此,要完全将2种病毒分开,从而得到高纯度的mAd ,除进一步摸索最佳的实验条件外,最根本的手段是进一步改进微型腺病毒载体系统本身的结构,增加其结构稳定性,最大限度地降低同源重组的发生.图3介导F X 的微型腺病毒载体系统简图Fig .3The SimpIe deScription of mAd vector Which mediateS factor XCA :CMV 人actin 启动子9EF :人延长因子启动子参考文献:[1]候云德.分子病毒学[M ].北京:学苑出版社,1990.151-180.[2]Piedra P A ,Poveda G A ,RamSey B .Incidence and prevaIence of neutraIizing antibodieS to commonadenoviruSeS in chiIdren With cyStic fibroSiS :ImpIication for gene therapy With adenoviruS vectorS [J ].PeClCtllCS ,1998,lol(6D :1013-1019.[3]AIemany R ,Dai Yi -fan ,Yan Chun -Iou ,et Cl .CompIementation of heIper -dependent adenoviraI vector :Size effectS and titer fIuctuationS [J ].J vllol meth ,1997,68:147-159.[4]Moorhead J M ,CIayton G ~,Smith R L .A repIication -incompetent adenoviruS vector With thepreterminaI protein gene deIeted efficientIy tranSduceS mouSe earS [J ].J vllol ,1999,73(2D :1046-1053.825复旦学报(自然科学版D 第40卷[5]Morsy M A*Gu M C*Motzel S*et al.An adenoviral vector deleted for all viral coding seguences resultsin enhanced safety and extended expression of a leptin transgene[J].P1oc Natl Acac Sci*1998*95:7866-7871.[6]Kochanek S*Clemens P R*Mitani K*et al.Anew adenoviral vector:Replacement of all viral codingseguences with28kb independently expressing both full-length dystrophin and B-galactosidase[J].P1oc Natl Acac Sci*1996*93:5731-5736.[7]Lochmuller~*Jani A*~uaro J*et al.Emergence of early region1-containing replication-competentadenovirus in stocks of replication defective adenovirus recombinants(A E1A E3)during multiple passages in293cells[J].Pum Gene the1*1994*5:1485-1491.[8]Parks R J*Chen L*Anton M*et al.A helper-dependent adenovirus vector system:Removal of helpervirus by Cre-mediated excision of the viral packaging singal[J].P1oc Natl Acac Sci*1996*93:13565-13570.[9]Schiedner G*Morral N*Parks R J*et al.Genomic DNA transfer with a high-capacity adenovirusvector results in improved in UiUo gene expression[J].Natu1e Genet*1998*18:180-183.[10]~aecker S E*~ansell~*Stedman~*et al.Ln UiUo expression of full-length human dystrophin fromadenoviral vectors deleted of all viral genes[J].Pum Gene The1*1996*7:1907-1914.[11]Lieber A*Chen Y~*Kay M A.Adenoviral preterminal protein stabilizes mini-adenoviral genomes inUit1o and in UiUo[J].Natu1e Bioltechnology*1997*15:1383-1387.[12]Lieber A*Steinwaerder D S*Carlson C A*et al.Integrating adenovirus-adeno-associated virus hybridvectors devoid of all viral gene[J].J V i1ol*1999*73(11):9314-9324.[13]Steinwaerder D S*Carlson C A*Lieber A.Generation of adenovirus vectors devoid of all viral genesby recombination between inverted repeats[J].J V i1ol*1999*73(11):9303-9313.Preliminary Study of Mini-AdenoVirus SystemTAl yan-h on g1*2*WAN G Fei1*WAN G Oi1*LU da-r u1*ZHEN G Zu n2*XUE ji n g-l u n1(1.State K ey L a b o1ato1y o f Genetic nginee1ing*Ln S titute o f Genetic S*School o f L i f e Science S*F ucanU niUe1S ity*Shanghai200433*C hina; 2.D e p a1tment o f C yto b iology*Seconc M ilita1yM ecical U niUe1S ity*Shanghai200433*C hina)Abstract:Mini-Adenovirus(mAd)is a novel adenoviral vector that contains only the viral inverted terminal repeat seguences(I T R)*packaging signal and ci S-acting elements reguired for viral DNA replication and packaging.MAd vector has larger capacity and lower immunogenicity*which showed its proprietary prospect in the field of gene therapy.F or amplification of mAd vector*the cells must be co-transfected with mAd and helper Ad that deleted E1region and packaging signal for packaging cells.T hrough plague assay*amplification and propagation*the density of purified mAd was2.3>1011mL-1.~owever*mAd genome was found unstable and with1%contamination of helper Ad.T he amplification and purification of mAd were discussed.Keywords:Mini-Adenovirus;amplification;purification 925第5期邰艳红等:微型腺病毒载体的扩增和纯化研究微型腺病毒载体的扩增和纯化研究作者:邰艳红, 王飞, 王琪, 卢大儒, 郑尊, 薛京伦作者单位:邰艳红(复旦大学生命科学学院遗传学研究所;第二军医大学基础部细胞生物学教研室),王飞,王琪,卢大儒,薛京伦(复旦大学生命科学学院遗传学研究所), 郑尊(第二军医大学基础部细胞生物学教研室)刊名:复旦学报(自然科学版)英文刊名:JOURNAL OF FUDAN UNIVERSITY年,卷(期):2001,40(5)1.候云德分子病毒学 19902.Piedra P A;Poveda G A;Ramsey B Incidence and prevalenc e of neutralizing antibodies to common adenoviruses in children with cystic fibrosis:Implication for gene therapy with adenovirus vectors [外文期刊] 1998(06)3.Alemany R;Dai Yi-fan;Yan Chun-lou Complementation of helper-dependent adenoviral vector: Size effects and titer fluctuations 19974.Moorhead J M;Clayton G H;Smith R L A replication-incompetent adenovirus vector with the preterminal protein gene deleted efficiently transduc es mouse ears[外文期刊] 1999(02)5.Morsy M A;Gu M C;Motzel S An adenovi ral vector deleted for all viral coding sequences resultsin enhanced safety and extended expression of a leptin transgene[外文期刊] 1998(14)6.Kochanek S;Clemens P R;Mitani K Anew adenoviral vect or:Replacement of all viral coding sequences with 28 kb independently expressing both full-length dystrophin and β-galactosidase 19967.Lochmuller H;Jani A;Huaro J Emergence of early regio n 1-containing replication-competent adenovirus in stocks of replication defec tive adenovirus recombinants (△E1+△E3) during multiple passages in 293 cells 1994(05)8.Parks R J;Chen L;Anton M A helper-dependent ade novirus vector system:Removal of helper virus by Cre-mediated excision of the viral packaging singal[外文期刊] 19969.Schiedner G;Morral N;Parks R J Genomic DNA transfer with a high-capacity adenovirus vector results in improved in v i vo gene expression 199810.Haecker S E;Hansell H;Stedman H In vivo express ion of full-length human dystrophin from adenoviral vectors deleted of all viral genes 1996(07)11.Lieber A;Chen Y H;Kay M A Adenoviral preterminal protein sta bilizes mini-adenoviral genomes in vitro and in vivo[外文期刊] 199712.Lieber A;Steinwaerder D S;Carlson C A Integrating a denovirus-adeno-associated virus hybrid vectors devoid of all viral gene 1999(11)13.Steinwaerder D S;Carlson C A;Lieber A Generation of adenovirus vectors devoid of all viral genes by recombination between inverted repeats[外文期刊] 1999(11)引用本文格式:邰艳红.王飞.王琪.卢大儒.郑尊.薛京伦微型腺病毒载体的扩增和纯化研究[期刊论文]-复旦学报(自然科学版) 2001(5)。

生物技术进展2016年㊀第6卷㊀第4期㊀239~243CurrentBiotechnology㊀ISSN2095 ̄2341进展评述Reviews㊀收稿日期:2016 ̄02 ̄22ꎻ接受日期:2016 ̄04 ̄04㊀作者简介:郑惠惠ꎬ技术员ꎬ主要从事真核重组抗原研发研究ꎮE ̄mail:shanjvqiuming@163.comꎮ∗通信作者:江洪ꎬ工程师ꎬ主要从事重组抗原研发研究ꎮE ̄mail:jiang@wondergen.comCHO细胞表达系统研究进展郑惠惠ꎬ㊀江㊀洪∗北京万达因生物医学技术有限责任公司ꎬ北京141017摘㊀要:CHO细胞表达系统是目前重组糖蛋白生产的首选系统ꎮ随着无血清悬浮培养技术㊁基因工程技术和大规模培养技术的应用和不断发展ꎬCHO细胞表达系统已经成为生物技术药物最重要的表达或生产系统ꎬ并被广泛应用于抗体㊁重组蛋白药物和疫苗等产品的研发和生产中ꎮ近年来ꎬ针对CHO细胞表达系统在某些重组蛋白的表达和大规模生产中存在的不足ꎬ研究者们通过利用基因工程技术手段ꎬ结合重组蛋白表达机制的研究成果ꎬ为优化和应用CHO细胞表达系统做出了不懈努力ꎮ从培养基的优化㊁高产重组CHO细胞株的构建㊁大规模培养三个方面综述了CHO细胞表达系统的最近研究进展ꎬ以期为CHO细胞表达系统的研究与应用提供参考ꎮ关键词:CHO细胞培养ꎻ细胞改造ꎻ重组抗原表达DOI:10.3969/j.issn.2095 ̄2341.2016.04.03ProgressofCHOExpressionSystemZHENGHui ̄huiꎬJIANGHong∗BeijingWondergenBio ̄medicineTechnologyCo.Ltd.ꎬBeijing141017ꎬChinaAbstract:CHOcellexpressionsystemisthepreferredsystemforrecombinantglycoproteinproduction.Withtheevolvingdevelopmentandapplicationsofserum ̄freesuspensionculturetechnologyꎬgeneticengineeringandthelarge ̄scaleculturetechnologiesꎬCHOcellexpressionsystemhasbecomethemostimportantexpressionorproductionsystemofbiotechnologyproducts.Thissystemiswidelyusedintheresearchandproductionofantibodiesꎬrecombinantproteinsandvaccines.Inrecentyearsꎬresearchershavemadegreateffortstoimprovetheexpressionandlarge ̄scaleproductionofrecombinantproteinsbyusinglatestbioengineeringtechnologyandthedevelopmentoftherecombinantproteinexpressionmechanism.ThisarticlebrieflyreviewedtherecentdevelopmentoftheCHOcellexpressionsysteminthreeaspects:theoptimizationoftheculturemediumꎬconstructionofengineeredCHOstrainsforhigh ̄levelproductionandlarge ̄scalecultureresearchꎬwhichwasexpectedtoprovidereferenceforresearchandapplicationofCHOcellexpressionsystem.Keywords:CHOcellcultureꎻcellengineeringꎻrecombinantantigenexpression㊀㊀CHO细胞是由Puck于1957年建成的中国仓鼠卵巢成纤维细胞系ꎮ发展至今ꎬCHO细胞已成为生物技术药物最重要的表达或生产系统ꎮ随着无血清悬浮培养技术㊁基因工程技术㊁生物反应器设计放大与强化技术㊁大规模高密度流加和连续灌注培养技术等的发展ꎬCHO细胞系统被广泛应用于抗体㊁基因重组蛋白质药物㊁病毒疫苗等生物技术产品的研究开发和工业化生产中ꎮCHO细胞是目前重组糖基蛋白生产的首选体系ꎮ因为它具有准确的转录后修饰功能ꎬ表达的蛋白在分子结构㊁理化特性和生物学功能方面更接近于天然蛋白分子ꎮ但CHO细胞在无血清培养基中会出现活力差㊁分泌外源蛋白能力弱等问题ꎮ所以建立稳定㊁高产的重组CHO细胞成为很多研究者的目标ꎮ近年来ꎬ研究者从细胞营养㊁代谢㊁凋亡㊁信号传导等角度ꎬ结合蛋白表达机制等研究成果ꎬ对这一目标的实现做出了很多努力ꎮ本文从培养基优化㊁高产重组CHO细胞株的构. All Rights Reserved.建㊁大规模培养三个方面综述了CHO细胞表达系统的最新研究进展ꎬ以期为CHO细胞表达系统的应用提供参考ꎮ1㊀培养基的优化研究发现ꎬ不同的细胞株甚至克隆对营养成分的需求都有差别ꎮ通过筛选比较不同培养基成分对重组抗原生产的影响ꎬ并开发适用于不同重组CHO细胞株的培养基ꎬ成为很多研究者提高CHO细胞表达系统产量的重要方式ꎮ为了维持细胞在无血清培养基中的正常生长ꎬ需要在基础培养基中添加很多其他因子ꎬ如激素㊁生长因子㊁蛋白水解物等ꎮ蛋白质水解物含有丰富的营养成分ꎬ可有效缩短细胞对无血清培养基的适应过程ꎮDavami等[1]通过组合比较不同来源的蛋白水解物对细胞密度及表达产量的影响ꎬ优化得到更适于DG44的培养基ꎮ酵母水解物作为一种成本较低的非动物源蛋白水解物ꎬ可以使细胞密度增加的同时ꎬ使重组表达抗体的表达量大幅提高[2]ꎮ大豆水解物等都可以被添加到基础培养基中[1ꎬ3ꎬ4]ꎮ由于蛋白水解物的构成复杂ꎬ且批间差异大ꎬ因此蛋白水解物的添加会影响细胞培养基批次间的稳定性ꎮ如果去除培养基中的蛋白质水解物ꎬ需要添加氨基酸或微量元素等ꎬ通过优化调整其比例ꎬ仍能支持高密度的CHO细胞培养[5]ꎮ刘兴茂等[6]采用Plackett ̄Burman实验对影响细胞生长的培养添加成分进行了考察ꎬ确定了腐胺㊁胰岛素及转铁蛋白对11G ̄S细胞的悬浮培养有明显的生长促进作用ꎮ设计的培养基可以使细胞最大生长密度达到4.12ˑ106cells/mLꎮXu等[7]采用Plackett ̄Burman设计与支持向量机(SVM)预测并实验确定了硫酸锌㊁转铁蛋白及BSA对CHO ̄K1细胞的生长有促进作用ꎮ另有研究表明ꎬ使用柠檬酸铁作为转铁蛋白的替代物ꎬ可以使细胞的密度达到7.0ˑ106cells/mLꎬ但是会降低转染效率[8]ꎮMiki等[9]研究发现ꎬ添加生长因子IGF ̄1和脂类信号分子溶血磷脂酸(LPA)也可以有效加速CHO细胞生长ꎮ优化培养基能有效提高重组CHO细胞的培养密度ꎮ高密度的CHO细胞培养是CHO细胞表达系统实现工业化生产应用的必要条件之一ꎮ与大肠杆菌和酵母表达系统相比ꎬCHO细胞有生长较慢㊁培养周期较长㊁产量较低等缺点ꎮ为了提高重组蛋白产量㊁扩大CHO细胞表达系统的生产应用范围ꎬ研究者们在优化培养基的实验基础上ꎬ构建高产的重组CHO细胞系ꎬ为大规模的重组蛋白生产提供基础ꎮ2㊀高产重组CHO细胞株的构建研究者们利用发展迅速的基因编辑技术对CHO细胞进行筛选和改造ꎬ得到高产的重组细胞株ꎮ研究者们通过过量表达或敲除某个基因ꎬ调整代谢途径㊁延缓细胞凋亡㊁增强转录表达效率ꎬ有效的增加了重组蛋白产量ꎮ通过结合全基因组测序和基因敲除技术的研究成果ꎬ研究者们为得到反应性更好的糖基化重组蛋白做出了不懈努力ꎮ2.1㊀调整代谢途径乳酸作为糖酵解产生的代谢产物会影响细胞生长ꎮZhou等[10]使用siRNA技术降低乳酸脱氢酶A(LDHa)和丙铜酸脱氢酶激酶(PDHKs)基因的表达ꎬ使乳酸的产生降低了90%ꎬ并增加了单抗的产量ꎮToussaint等[11]通过在rCHO中表达酵母丙酮酸羧化酶(PYC2)ꎬ改变了流加培养方式中葡萄糖的代谢速率ꎬ增长了细胞的对数生长期ꎬ从而增加了细胞密度及产量ꎮ2.2㊀延缓细胞凋亡为了延长细胞培养的时间从而增加产量ꎬ有研究者建立了能表达抗凋亡基因的CHO细胞系ꎮMajos等[12]通过在CHO中表达1个Asp29Asn突变的抑制凋亡基因ꎬ有效延缓了细胞凋亡ꎮ也有研究者通过敲除细胞中的促凋亡基因来延缓细胞凋亡ꎬ如Cost等[13]敲除了BCL2相关蛋白X(BAX)和BAK的基因ꎬ使单克隆抗体产量增加了5倍ꎮRitter等[14]发现8号染色体端粒区的缺失也可以使产物产量成倍增加ꎮ2.3㊀增强转录表达效率有研究者在细胞信号通路研究成果的基础上ꎬ通过表达转录及翻译过程中的相关蛋白ꎬ增强转录和表达效率ꎬ以增加目的重组蛋白的产量ꎮLeFourn等[15]通过在CHO中表达人信号受体蛋白SRP14ꎬ成功增加了分泌表达的重组蛋白的产042生物技术进展CurrentBiotechnology. All Rights Reserved.量ꎮPeng等[16]通过表达转录翻译相关蛋白SLY1㊁MUNC18C和XBP1ꎬ使IgG的产量提高了20倍ꎻRahimpour等[17]在CHO细胞中表达神经酰胺转移蛋白(CERT)的突变基因使t ̄PA的产量增加了35%ꎮ2.4㊀表达糖基化酶能产生糖基化的重组蛋白是CHO细胞表达系统重要的优势ꎬ研究者们通过建立能表达N ̄糖基化途径中不同酶类的细胞系以增加糖基化重组蛋白的反应性ꎮ如Goh[18]建立的一个含有N ̄乙酰氨基葡萄糖转移酶I基因的突变体CHO ̄gmt4细胞系ꎬ其表达的重组葡萄糖脑苷脂酶将不需要多糖重构可直接用于治疗戈谢病患者ꎮZhang等[19]通过CHO ̄gmt5细胞株表达的重组抗体ꎬ其Fc的N ̄多糖缺少岩藻糖和唾液酸能增强ADCC的作用ꎮ根据CHO ̄K1的基因组信息ꎬYang等[20]通过锌指核酸酶(ZFNs)基因敲除的方法ꎬ研究了19种包括作用于N ̄糖基链分支㊁半乳糖基㊁聚LacNAc延伸㊁唾液酸化加盖的N ̄糖基转移酶对N ̄糖基化作用的影响ꎬ为更准确的表达特定糖基化方式的重组蛋白提供了重要参考ꎮ重组CHO细胞表达重组蛋白能力的高低ꎬ不能简单的归结为某些关键基因的作用ꎮ为了得到高产的重组细胞株ꎬ需要研究者们综合考虑细胞的代谢情况㊁培养条件㊁蛋白表达效率和蛋白加工修饰能力等诸多因素ꎮ3㊀大规模培养研究基因工程技术㊁细胞融合技术及抗体类药物的迅速发展ꎬ推进了生物反应器培养技术在生物制药中的应用ꎮ由于CHO细胞能以悬浮培养的方式高密度培养ꎬ培养体积可达1000L以上ꎬ所以在大规模培养和重组蛋白的高产量生产中ꎬCHO细胞表达系统拥有广阔的发展前景ꎮ在大规模生产中ꎬ通常采用流加培养方式ꎬ通过添加营养物质来延长培养时间ꎬ增加细胞密度和目的产品的浓度ꎮ为了更大程度的提高重组蛋白的生产效率ꎬ研究者们需要根据不同细胞株的生长代谢特点ꎬ选择和优化起始培养基㊁补料培养基及补料策略ꎮ现代计算机技术㊁数学算法及理论的应用ꎬ也为研究者对细胞流加培养的优化提供了很大帮助ꎮ3.1㊀优化培养参数选择合适的培养基㊁优化细胞培养的参数(如温度㊁pH㊁溶氧㊁CO2浓度㊁渗透压等)对生产至关重要ꎮ同时ꎬ流加工艺参数(如流加培养基成分㊁流加时间等)均需根据不同的细胞株及反应器的特点来设计优化ꎮFan等[21]采用分批补料方式培养CHO细胞ꎬ实验显示培养基中的氨基酸和葡萄糖浓度对细胞的生长㊁IgG浓度和N ̄糖基化生成都很重要ꎮKim等[22]使用分批补料培养使IgG的产量达到2.3g/Lꎮ通过用小麦蛋白水解物(WGH)代替补料中的谷氨酰胺可以使t ̄PA的产量达到422mg/L[23]ꎮ3.2㊀应用新的培养技术微载体培养是一种动物细胞大规模培养技术ꎮ培养液中大量的微载体为细胞提供了极大的附着表面ꎬ从而可实现细胞的高密度培养ꎮ胡显文等[24]在搅拌式反应器中无血清培养分泌u ̄PA的DNA重组CHO细胞ꎬ通过部分更换Cytopore多孔微载体ꎬ解决了大规模细胞培养中细胞凋亡的问题ꎮ并使用周期变压刺激技术使u ̄PA的产量提高了10倍ꎬ且可以降低葡萄糖厌氧代谢产生乳酸的转化率ꎮVentini等[25]通过Cytodex微载体培养CHO ̄hTSH细胞的实验表明ꎬ培养基中微载体的数量及在rhTSH合成期开始时的细胞浓度是提高目的蛋白产量的重要参数ꎮ李智等[26]利用CHO细胞能在培养过程中自然结团的特性ꎬ采用超声沉降柱二合一灌流系统促进细胞结团和加强截留的特性ꎬ用无血清培养基连续灌流培养基因重组CHO细胞MK3 ̄A2株ꎬ分泌表达的rhTNK ̄tPA生产率平均为89mg/L dꎮ3.3㊀添加保护剂聚醚F68可以有效减少生物反应器中搅拌对细胞产生的机械损伤ꎮ针对F68对某些细胞株的生长及产量降低的情况ꎬ研究者发现0.05%或0.075%的500kDa的γPGA可以替代F68应用于CHODG44细胞的培养中[27]ꎮ在细胞培养工艺逐级放大的过程中ꎬ每一步都需要研究者们监控细胞在生长和表达方面的相关指标ꎮ生物反应器在线监控pH㊁溶氧等参数的功能㊁色谱和在线蛋白分解监测等技术为大规模培养的过程控制提供了帮助ꎮ142郑惠惠ꎬ等:CHO细胞表达系统研究进展. All Rights Reserved.4 展望CHO细胞是表达外源蛋白最多也是最成功的一类细胞ꎬ有其不可比拟的优点ꎬ同时也存在现行技术手段不能弥补的不足之处ꎮ结合生物信息学㊁细胞生物学㊁基因工程技术和生物反应器技术的研究成果ꎬ研究者们可以通过综合考虑细胞代谢特性㊁蛋白表达特性等影响因素ꎬ通过研发个性化培养条件及培养工艺ꎬ构建高表达载体ꎬ筛选稳定高产的重组细胞株ꎬ改造宿主细胞等角度继续优化CHO细胞表达系统ꎬ为产业化生产重组蛋白提供基础ꎮ用于产业化生产的重组CHO细胞ꎬ需要具备生长特性良好㊁能在无血清培养基中高密度培养㊁表达重组蛋白能力强㊁能正确的进行翻译后修饰等特点ꎮ糖基化是蛋白翻译后最重要的修饰之一ꎬ直接影响重组蛋白的空间结构㊁生物活性㊁稳定性㊁免疫原性和生物反应性等ꎮ对重组蛋白的糖基化研究一直是研发和生产真核重组蛋白的热点课题ꎮ随着基因编辑技术的发展ꎬ研究者们通过表达特定糖基化相关酶从而得到完整㊁准确的特定形式的糖链结构ꎬ为糖基化蛋白在免疫诊断㊁临床治疗等领域的持续发展奠定了基础ꎮ随着基因技术的不断发展ꎬ对细胞代谢㊁信号传导等方面研究的持续深入ꎬ构建能表达准确修饰的糖基化重组蛋白的高产重组CHO细胞株仍将成为研究热点ꎮ参㊀考㊀文㊀献[1]㊀DavamiFꎬEghbalpourFꎬNematollahiLꎬetal..EffectsofpeptonesupplementationindifferentculturemediaongrowthꎬmetabolicpathwayandproductivityofCHODG44cells:anewinsightintoaminoacidprofiles[J].Iran.Biomed.J.ꎬ2015ꎬ19(4):194-205.[2]㊀SungYHꎬLimSWꎬChungJYꎬetal..Yeasthydrolysateasalow ̄costadditivetoserum ̄freemediumfortheproductionofhumanthrombopoietininsuspensionculturesofChinesehamsterovarycells[J].Appl.Microbiol.Biotechnol.ꎬ2004ꎬ63(5):527-536.[3]㊀DavamiFꎬBaldiLꎬRajendraYꎬetal..PeptonesupplementationofculturemediumhasvariableeffectsontheproductivityofCHOcells[J].Int.J.Mol.CellMed.ꎬ2014ꎬ3(3):146-156.[4]㊀ChunBHꎬKimJHꎬLeeHJꎬetal..Usabilityofsize ̄excludedfractionsofsoyproteinhydrolysatesforgrowthandviabilityofChinesehamsterovarycellsinprotein ̄freesuspensionculture[J].Bioresour.Technol.ꎬ2007ꎬ98(5):1000-1005.[5]㊀张大鹤ꎬ易小萍ꎬ张元兴ꎬ等ꎬ适于重组CHO细胞培养的无血清培养基的制备[J].中国生物制品学杂志ꎬ2011(10):1152-1156.[6]㊀刘兴茂ꎬ刘红ꎬ叶玲玲ꎬ等ꎬCHO工程细胞无血清悬浮分批培养的生长代谢特征及动力学模型[J].生物工程学报ꎬ2010ꎬ(1):85-92.[7]㊀XuJꎬYanFRꎬLiZHꎬetal..Serum ̄freemediumoptimizationbasedontrialdesignandsupportvectorregression[J].Biomed.Res.Int.ꎬ2014ꎬdoi:10.1155/2014/269305. [8]㊀EberhardySRꎬRadzniakLꎬLiuZ.Iron(III)citrateinhibitspolyethylenimine ̄mediatedtransienttransfectionofChinesehamsterovarycellsinserum ̄freemedium[J].Cytotechnologyꎬ2009ꎬ60:1-9.[9]㊀MikiHꎬTakagiM.Designofserum ̄freemediumforsuspensioncultureofCHOcellsonthebasisofgeneralcommercialmedia[J].Cytotechnologyꎬ2015ꎬ67(4):689-697.[10]㊀ZhouMꎬCrawfordYꎬNgDꎬetal..DecreasinglactatelevelandincreasingantibodyproductioninChineseHamsterOvarycells(CHO)byreducingtheexpressionoflactatedehydrogenaseandpyruvatedehydrogenasekinases[J].J.Biotechnol.ꎬ2011ꎬ153(1-2):27-34.[11]㊀ToussaintCꎬHenryOꎬDurocherY.MetabolicengineeringofCHOcellstoalterlactatemetabolismduringfed ̄batchcultures[J].J.Biotechnol.ꎬ2015ꎬ217:122-131.[12]㊀MajorsBSꎬChiangGGꎬPedersonNEꎬetal..Directedevolutionofmammaliananti ̄apoptosisproteinsbysomatichypermutation[J].ProteinEng.Des.Sel.ꎬ2012ꎬ25(1):27-38.[13]㊀CostGJꎬFreyvertYꎬVafiadisAꎬetal..BAKandBAXdeletionusingzinc ̄fingernucleasesyieldsapoptosis ̄resistantCHOcells[J].Biotechnol.Bioeng.ꎬ2010ꎬ105(2):330-40. [14]㊀RitterAꎬVoedischBꎬWienbergJꎬetal..Deletionofatelomericregiononchromosome8correlateswithhigherproductivityandstabilityofCHOcelllines[J].Biotechnol.Bioeng.ꎬ2016ꎬ113(5):1084-1093.[15]㊀LeFournVꎬGirodPAꎬBucetaMꎬetal..CHOcellengineeringtopreventpolypeptideaggregationandimprovetherapeuticproteinsecretion[J].Metab.Eng.ꎬ2014ꎬ21:91-102.[16]㊀PengRWꎬFusseneggerM.MolecularengineeringofexocyticvesicletrafficenhancestheproductivityofChinesehamsterovarycells[J].Biotechnol.Bioeng.ꎬ2009ꎬ102(4):1170-1181.[17]㊀RahimpourAꎬVaziriBꎬMoazzamiRꎬetal..EngineeringthecellularproteinsecretorypathwayforenhancementofrecombinanttissueplasminogenactivatorexpressioninChinesehamsterovarycells:effectsofCERTandXBP1sgenes[J].J.Microbiol.Biotechnol.ꎬ2013ꎬ23(8):1116-1122. [18]㊀GohJSꎬLiuYꎬChanKFꎬetal..ProducingrecombinanttherapeuticglycoproteinswithenhancedsialylationusingCHO ̄gmt4glycosylationmutantcells[J].Bioengineeredꎬ2014ꎬ5242生物技术进展CurrentBiotechnology. All Rights Reserved.(4):269-273.[19]㊀ZhangPꎬHaryadiRꎬChanKFꎬetal..IdentificationoffunctionalelementsoftheGDP ̄fucosetransporterSLC35C1usinganovelChinesehamsterovarymutant[J].Glycobiologyꎬ2012ꎬ22(7):897-911.[20]㊀YangZꎬWangSꎬHalimAꎬetal..EngineeredCHOcellsforproductionofdiverseꎬhomogeneousglycoproteins[J].Nat.Biotechnol.ꎬ2015ꎬ33(8):842-844.[21]㊀FanYꎬJimenezDelValIꎬMullerCꎬetal..Aminoacidandglucosemetabolisminfed ̄batchCHOcellcultureaffectsantibodyproductionandglycosylation[J].Biotechnol.Bioeng.ꎬ2015ꎬ112(3):521-535.[22]㊀KimBJꎬZhaoTꎬYoungLꎬetal..Batchꎬfed ̄batchꎬandmicrocarriercultureswithCHOcelllinesinapressure ̄cycledrivenminiaturizedbioreactor[J].Biotechnol.Bioeng.ꎬ2012ꎬ109(1):137-145.[23]㊀KimdoYꎬChaudhryMAꎬKennardMLꎬetal..Fed ̄batchCHOcellt ̄PAproductionandfeedglutaminereplacementtoreduceammoniaproduction[J].Biotechnol.Prog.ꎬ2013ꎬ29(1):165-175.[24]㊀胡显文ꎬ肖成祖ꎬ高丽华ꎬ等.用多孔微载体大规模长期培养动物细胞的方法[J].生物技术通报ꎬ2001ꎬ(1):45-48. [25]㊀VentiniDCꎬDamianiRꎬSousaAPꎬetal..ImprovedbioprocesswithCHO ̄hTSHcellsonhighermicrocarrierconcentrationprovideshigheroverallbiomassandproductivityforrhTSH[J].Appl.Biochem.Biotechnol.ꎬ2011ꎬ164(4):401-409.[26]㊀李智ꎬ肖成祖ꎬ杨琴ꎬ等.CHO细胞无血清结团灌流培养:超声-沉降柱二合一灌流系统[J].中国生物工程杂志ꎬ2008ꎬ(4):53-58.[27]㊀ChunBHꎬLeeYKꎬChungN.Poly ̄gamma ̄glutamicacidenhancesthegrowthandviabilityofChinesehamsterovarycellsinserum ̄freemedium[J].Biotechnol.Lett.ꎬ2012ꎬ34(10):1807-1810.342郑惠惠ꎬ等:CHO细胞表达系统研究进展. All Rights Reserved.。

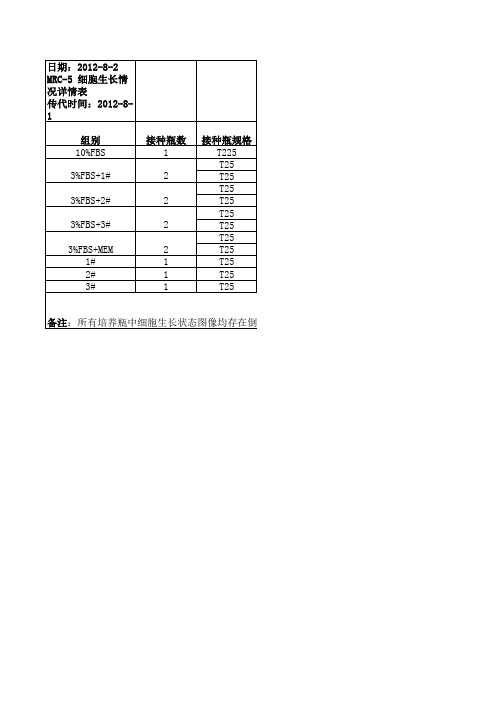
MRC-5体外培养细胞生长曲线测定一.实验目的认识细胞接种和传代培养中细胞生长增殖规律。
二.实验原理在培养接种或每一次传代培养过程中,培养物都要经历相似的恢复和生长过程。
细胞生长曲线反映的是培养细胞从接种到传代之前的生长状况,也是判定细胞活力的重要指标。
一般细胞传代之后,经过短暂的悬浮然后贴壁,随后度过长短不同的潜伏期,紧接着进入大量分裂的指数生长期。
在细胞达到饱和密度后,停止生长,进入平台期,然后退化衰亡。
为了准确描述整个过程中细胞数目的动态变化,典型的生长曲线可分为生长缓慢的潜伏期,斜率较大的指数生长期,呈平台状的平台期及退化衰亡4个部分。
以培养时间为横坐标、细胞密度为纵坐标绘制细胞的生长曲线坐标图。
三.实验准备3.1实验人员用品工作服、帽子、口罩、手套、肥皂、医用手臂消毒桶、0.1%新洁尔灭消毒液;3.2消毒和灭菌用品电炉、高压蒸汽灭菌锅、铝盒、24孔细胞培养板、移液管、枪头、洗耳球、离心管(规格:1.5mL/5mL/10mL);3.3药品和试剂DMEM细胞培养液(10%血清)、0.25%胰蛋白酶-0.53Mm EDTA、PBS(-);3.4 细胞MRC-5人二倍体细胞;3.5设备与器材CO2培养箱、离心机、移液枪(规格:1000uL、200uL)、二级生物安全柜、血细胞计数板、显微镜、记号笔、废液瓶;四.实验步骤4.1细胞接种4.1.1选择生长良好的MRC-5人二倍体细胞,移液管移除原细胞培养液至废液瓶中;4.1.2 DPBS润洗三次,每次5mL;4.1.3 吸管吸取1mL胰蛋白酶溶液浸润培养层细胞,37℃恒温消化2~10min;4.1.4用含10%血清的DMEM培养液4mL终止消化;4.1.5将终止消化后的细胞悬液用移液管转移至离心管中,1000r/min离心8min,弃上清;4.1.6吸管吸取2mL DMEM细胞培养液悬浮细胞;4.1.7对细胞悬浮液进行细胞计数;4.1.8调整悬浮液的细胞浓度分别为5×103个/mL(A) 、2×104个/mL(B)、 5×104个/mL(C)3种不同的细胞浓度(细胞理论数:1.575×104个);4.2 细胞培养4.2.1依次将浓度为5×103个/mL(A) 、2×104个/mL(B)、 5×104个/mL(C)的细胞悬液分装于3个有盖的24孔细胞培养板,分别按每孔接种1mL,每种浓度各接21孔,进行细胞的悬浮培养;4.3 细胞换液细胞接种培养后,分别按照每间隔3d和5d换液一次。
272生物技术世界 BIOTECHWORLD在生物医药领域,许多基因工程药物、疫苗等都离不开最基本的细胞培养技术,人二倍体细胞系的建立使人用疫苗得到了长足的发展。
[1]到目前为止,mrc-5 细胞被世界各地很多疫苗生产厂家用于疫苗生产,比如人二倍体细胞狂犬疫苗(HDCV)。
HDCV安全性好,具有很好的免疫原性,同其他狂犬病疫苗相比,接种后副作用极少发生,因此被WHO推荐为评价任何一种人用狂犬病疫苗的标准疫苗[2]。
1 材料1.1 细胞:中国成都康华生物制品有限公司MRC-5工作细胞库细胞。
1.2 微载体:GE公司的cytodex I型。
1.3 生物反应器:中国广州奇志BC-15L、BC-100L型生物反应器。
1.4 培养液 :日本株式会社日水 MEM 培养液, 10%的小牛血清(山西太原润生) ,0.03%L-谷氨酰胺,1%非必须氨基酸(Gbico)1.5 消化液:0.01%EDTA-0.25%胰蛋白酶溶液。
1.6 缓冲液液:pH7.2 0.01mol/l PBS 溶液。
2 方法2.1 微载体培养 mrc-5 细胞2.1.1 微载体处理按照 GE 公司说明处理微载体,高压灭菌。
2.1.2 细胞接种将细胞悬液以60、80、100、120、150rpm的搅拌转速分别接种到BC-15L 细胞培养罐内,接种密度(2×105个/ml),培养浓度 5g/L,取样观察细胞贴壁状况。
每天更换培养液,每天显微镜下观察细胞生长状况,细胞在微载体上长满单层后可进行扩大培养。
2.1.3 微载体扩大培养种子罐细胞长满后,用PBS洗涤细胞三次,加入0.01%EDTA-0.25%胰蛋白酶溶液。
消化细胞,分别用60、80、100、120、150rpm消化15分钟后取样观察细胞状态并测定细胞活力,细胞从微载体上脱离下来后,将细胞悬液转入到BC-100L细胞培养罐,培养浓度5g/L。
2.1.4 培养参数筛选接种细胞到BC-100L 细胞培养罐后设置相同的细胞接种浓度(2×105cells/ml)、微载体浓度(5g/L)、液体更换程序,所有培养参数中确保唯一参数变化。
丹贝益肺方对人胚肺成纤维细胞(MRC-5)增殖及胶原蛋白合成的影响目的:本实验通过观察丹贝益肺方对人胚肺成纤维细胞增殖的抑制,观察统计不同浓度丹贝益肺方溶液对人胚肺成纤维细胞胶原蛋白表达的影响,研究其是否对人胚成纤维细胞有抑制和干预的作用,来证明丹贝益肺方对肺纤维化的作用,为丹贝益肺方治疗肺纤维化提供实验基础。
方法:1.体外培养人胚肺成纤维细胞,用不同浓度丹贝益肺方进行处理,分为(1)空白对照组、(2)丹贝益肺方1×10<sup>-3 </sup>mg/ml组、(3)丹贝益肺方1×10<sup>-2 </sup>mg/ml组、(4)丹贝益肺方1×10<sup>-1 </sup>mg/ml组、(5)丹贝益肺方1 mg/ml,在温度为37℃,浓度为5%的培养箱中,培养的时间分别为:24 h、48 h以及72 h。
在显微镜镜下观察并记录细胞的不同形态变化,然后应用MTT法,对不同浓度丹贝益肺方作用不同时间进行记录和检测,以及肺成纤维细胞在双波长(490 nm,630 nm)的吸光度A值。
通过记录并对比A值做时效、量效图表,最终对得到的不同浓度以及不同时间丹贝益肺方对肺成纤维细胞增殖的影响进行比较。
2.通过体外培养MRC-5细胞,并将培养的细胞分为四组:(1)空白对照组、(2)地塞米松组(5×10<sup>-2 </sup>mg/ml)、(3)丹贝益肺方低浓度组(1×10<sup>-3 </sup>mg/ml)、(4)丹贝益肺方高浓度组(1×10<sup>-1 </sup>mg/ml)。
通过细胞爬片免疫组化法观察细胞内Ⅰ型胶原蛋白(COLⅠ)、Ⅲ型胶原蛋白(COL Ⅲ)表达的变化,同时采用Image pro-plus图像分析系统,把各组对应COLⅠ、COLⅢ表达的IOD计算出来。
expressionofinterferonregulatoryfactor9(IRF9)proteinaswellasmyxovirusresistanceprotein1(MxA)proteinintheJAK/STATsignalingpathway.Results InHepG2cellsexpressingHBVtransientlyandHepG2 2 15cellsstablyexpressingHBV,theexpressionofPTENproteinbothdecreased;theexpressionofHBV relatedantigensandHBVpgRNAdecreasedinPTEN OEHepG2 2 15cellscomparedwiththecontrolgroup.Afterthetreatmentbypoly(I∶C),thelevelofIFN αmRNAwassignificantlyhigherthanthatofthecontrolgroup,andtheexpressionofIRF9andMxAptoteinrelatedtotheJAK/STATsignalingpathwaybothincreased.Conclusion HBVmayplayaroleinantagonizingtheantiviralactivityofIFN αbydown regulatingtheexpressionofPTEN.Keywords hepatitisBvirus;PTEN;IFN α;JAK/STATsignalingpathway;chronichepatitisB网络出版时间:2022-05-2814:26 网络出版地址:https://kns.cnki.net/kcms/detail/34.1065.R.20220526.1018.021.html达格列净通过丝氨酸/苏氨酸蛋白激酶/内皮型一氧化氮合酶途径调节高糖环境下的内皮祖细胞功能解丹丹,巫婷婷,赵晓彤,许慕蓉,陈明卫摘要 目的 探讨达格列净(DAPA)对高糖环境下体外培养的大鼠内皮祖细胞(EPCs)功能的影响。