B.用过量氨水除去Fe3+溶液中的少量Al3+
C.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤
液中通入过量CO2后过滤
D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干
燥得到MgO
解析:Al(OH)3难溶于氨水,故向含少量Al3+的Fe3+溶液中加入过量氨水
2CuO+H2O+CO2↑。
②CuSO4·5H2O为蓝色晶体,俗称蓝矾、胆矾,其受热分解的化学方程式
为CuSO4·5H2O
CuSO4+5H2O,蓝色晶体受热转化为白色粉末。无水
CuSO4遇水变蓝色(生成CuSO4·5H2O),据此可用来检验水的存在。
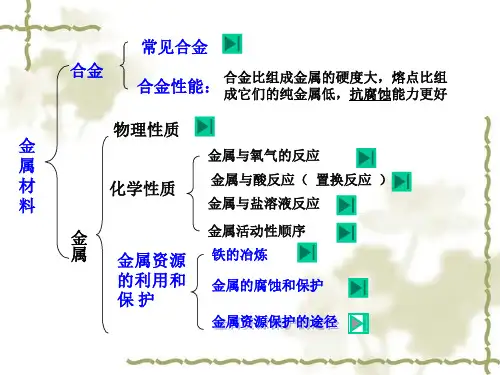
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
中的铝及铝的化合物。
(1)Mg、Fe(Al):加足量NaOH溶液;
(2)Fe2O3(Al2O3):加足量NaOH溶液;
(3)Mg(OH)2[Al(OH)3]:加足量NaOH溶液;
(4)Mg2+(Al3+):加过量NaOH溶液,过滤,再加酸充分溶解。
训练突破
1.下列各组物质,不能按下图所示关系转化的是( C )。(“→”表示反应
D.18 mol·L-1 H2SO4溶液
解析:将镁、铝混合物加入HNO3和浓硫酸中都不产生H2;加入NaOH溶液
2Al+2NaOH+6H2O══2Na[Al(OH)4]+3H2↑
(1)等质量的铝与足量的盐酸、氢氧化钠溶液分别反应:
①产生H2的物质的量相等。
②消耗H+、OH-的物质的量之比为n(H+)∶n(OH-)=3∶1。