(浙江专版2017_2018学年高中化学专题1化学家眼中的物质世界第三单元人类对原子结构的认识学案苏教版必修1
- 格式:doc
- 大小:613.50 KB
- 文档页数:14


![(浙江专高中化学专题1化学家眼中的物质世界第三单元人类对原子结构的认识学案苏教版必修1[1]](https://img.taocdn.com/s1/m/062a65ba9b6648d7c0c746dd.png)
(浙江专版)2018版高中化学专题1 化学家眼中的物质世界第三单元人类对原子结构的认识学案苏教版必修1编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((浙江专版)2018版高中化学专题1 化学家眼中的物质世界第三单元人类对原子结构的认识学案苏教版必修1)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(浙江专版)2018版高中化学专题1 化学家眼中的物质世界第三单元人类对原子结构的认识学案苏教版必修1的全部内容。
第三单元人类对原子结构的认识知识内容必考要求加试要求1。
原子结构模型的演变。
2.原子的构成,原子符号。
3.核素、同位素的概念。
4.常见离子化合物的形成过程.abaabbb目标定位1.知道原子结构模型的演变.2.熟知原子的构成,能书写原子结构示意图,会分析元素在形成化合物时表现的化合价等性质的原因.3.认识同位素的概念,能进行有关质量数、质子数、中子数、核外电子数的计算.一原子结构模型的演变1.古希腊原子学说古希腊哲学家曾经提出,物质由不可分割的微粒(即原子)构成的。
2.道尔顿原子学说19世纪初,道尔顿认为,物质由原子组成,原子不能被创造,也不能被毁灭,在化学变化中不可再分割,在化学反应中保持本性不变。
3.汤姆生原子结构模型1897年,汤姆生发现原子中存在电子,并提出了一个被称为“葡萄干面包式"的原子结构模型。
4.卢瑟福原子结构模型原子由原子核和核外电子构成,原子核带正电荷,位于原子中心,电子带负电荷,在原子核周围空间做高速运动。
5.玻尔原子结构模型原子核外,电子在一系列稳定的轨道上运动,每个轨道都有一个确定的能量值。

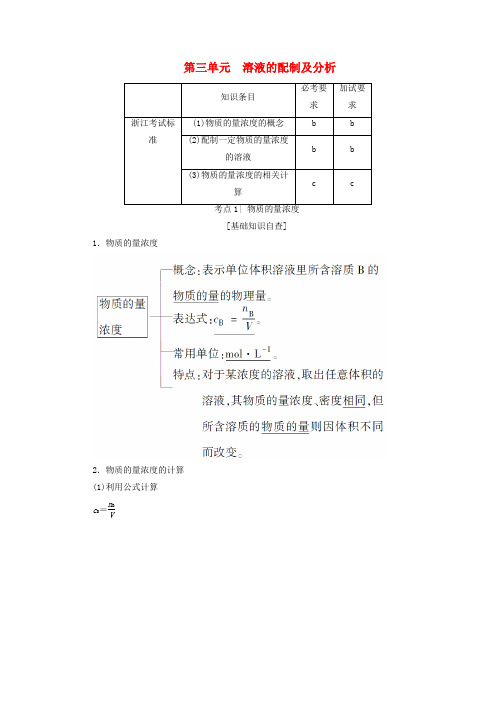
第三单元 溶液的配制及分析[基础知识自查]1.物质的量浓度2.物质的量浓度的计算 (1)利用公式计算c B =n BV其中n B的计算⎩⎪⎨⎪⎧①n=m B M②标准状况下的气体溶质⎩⎪⎨⎪⎧n =V气22.4 L·mol -1。
溶液体积V =m ρ=m 气+m H 2Oρ(2)物质的量浓度与质量分数的换算在已知某溶液溶质的质量分数为w ,密度为ρ(g·mL -1)时,可假设该溶液的体积为1 000 mL ,则有公式:c B =ρ-1w M B-1=1 000·ρ·w M B(mol·L -1)。
[核心要点提升]1.物质的量浓度与溶质质量分数的比较2.(1)将某物质投入水中注意溶液中溶质的判断如SO 3――→H 2O H 2SO 4,Na 2O(或Na 2O 2)――→H 2ONaOH ,CuSO 4·5H 2O ――→H 2O CuSO 4等。
(2)气体溶于水,溶质是该气体与水反应生成的物质,NH 3溶于水后主要溶质是NH 3·H 2O ,但以NH 3计算。
(3)气体溶于水,溶液的体积不是溶剂的体积更不是气体体积与溶剂体积之和,应根据V =m 气体+m 溶剂ρ进行计算。
3.溶液稀释或混合的相关计算对于任何溶液来说,稀释前后溶质的质量和溶质的物质的量都是不变的,这就是溶液的稀释定律。
依据溶质的物质的量不变可得公式:c 稀·V 稀=c 浓·V 浓。
依据溶质的质量不变可得公式:m 1·w 1=m 2·w 2=V 1·ρ1·w 1=V 2·ρ2·w 2=c 1·V 1·M =c 2·V 2·M 。
说明:上述符号m 代表溶液的质量,w 代表溶质的质量分数,V 代表溶液的体积,ρ代表溶液的密度,c 代表溶质的物质的量浓度。

专题1 化学家眼中的物质世界专题检测(一)(时间:90分钟满分:100分)一、选择题(本题包括16小题,每小题3分,共48分.每小题只有一个选项符合题意)1.我国安徽发现了全国最大的钼矿,下图是钼元素的相关信息,下列有关钼的说法错误的是()A.95Mo原子核内有53个中子B.95Mo原子核外有42个电子C.92Mo、95Mo、98Mo互为同位素D.92Mo、95Mo、98Mo的化学性质有较大的不同答案D解析由图可知,95Mo表示质子数为42,质量数为95,中子数为53,则A、B正确。
92Mo、95Mo、98Mo质子数相同,质量数(中子数)不同,互为同位素,C正确。
92Mo、95Mo、98Mo核外电子排布相同,化学性质相同,D错误.2.下列属于电解质的是( )A.石墨B.HClC.SO2D.酒精答案B解析电解质必须是化合物,石墨是单质,A错误;HCl是电解质,B正确;电解质必须是自身能电离出自由移动的离子的化合物,SO2 自身不能电离,C错误;酒精溶于水不电离,属于非电解质,D错误。
3.某校化学兴趣小组在实验室发现一瓶溶液,标签上标有“CaCl20.1 mol·L-1”的字样,下面是该小组成员对溶液的叙述,正确的是( )A.配制1 L该溶液,可将0.1 mol CaCl2溶于1 L水中B.Ca2+和Cl-的物质的量浓度都是0。
1 mol·L-1C.从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.05 mol·L-1D.将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0。
1 mol·L-1答案D解析A项,溶液的体积多于1 L,不正确;B项,Cl-物质的量浓度为0.2 mol·L-1;C项,所取溶液物质的量浓度为0.1 mol·L-1,不正确;D项,原溶液c(Cl-)=0.2 mol·L-1,将溶液稀释一倍后,则溶液的c(Cl-)=0.1 mol·L-1。
专题1 化学家眼中的物质世界本专题重难点突破一物质的分类依据与方法依据物质组成及性质分为纯净物和混合物纯净物一种成分Error!混合物多种成分Error!(1)氧化物的分类(2)酸的分类1(3)碱的分类(4)盐的分类[特别提醒]1.酸性氧化物与碱性氧化物的理解(1)酸(碱)性氧化物都有对应的水化物,且其氧化物与对应的水化物中相应元素的化合价相同:如CO2—H2CO3,SO2—H2SO3,SO3—H2SO4,N2O5—HNO3,SiO2—H2SiO3,Fe2O3—Fe(OH)3等。
如果没有对应价态的水化物,则不是酸(碱)性氧化物,如CO、NO、NO2等。
(2)酸性氧化物不一定是非金属氧化物,如Mn2O7、Cr2O3等;非金属氧化物不一定是酸性氧化物,如CO、NO等;金属氧化物不一定是碱性氧化物,如Al2O3(两性氧化物)等;碱性氧化物一定是金属氧化物。
(3)酸性氧化物和碱性氧化物不一定与水反应,如Fe2O3、CuO、SiO2等不与水反应。
(4)不能认为酸性氧化物、碱性氧化物、两性氧化物的分类包括了所有的氧化物,如CO、NO、NO2、Na2O2等均不属于这3种类型中的任何一种。
2.酸的“元”是根据酸在水中电离出来的H+数目来确定的,酸分子中含有几个氢原子,它不一定是几元酸,如CH3COOH分子中有4个氢原子,但它是一元酸。
【典例1】下列十种物质:①水②空气③铁④二氧化碳⑤H2SO4⑥熟石灰[Ca(OH)2]⑦胆矾⑧FeCl3溶液⑨碱式碳酸铜[Cu2(OH)2CO3]⑩碳酸氢钠(NaHCO3)其中属于混合物的是________(填序号,下同);属于氧化物的是________;属于碱的是________;属于酸的是________;属于盐的是________。
解析碱式盐[Cu2(OH)2CO3]、酸式盐(NaHCO3)、结晶水合物(如胆矾CuSO4·5H2O)都有固定的组成,均为纯净物,而FeCl3溶液包含FeCl3和水,属于混合物。
化学家眼中的物质世界专项训练一、物质的分类胶体分散系1.下列物质的分类正确的是()答案 D解析A项,NaHSO4不是酸,错误;B项,纯碱不是碱,CO不是酸性氧化物,错误;C项,SiO2不是碱性氧化物,错误。
2.“纳米材料”是粒子直径为1~100 nm(纳米)的材料,纳米碳就是其中的一种。
若将纳米碳均匀地分散到蒸馏水中,所形成的物质()①是溶液②是胶体③能产生丁达尔效应④能透过滤纸⑤不能透过滤纸⑥静置后,会析出黑色沉淀A.①④⑥B.②③④C.②③⑤D.①③④⑥答案 B解析由题意可知,将纳米碳分散到蒸馏水中形成的是胶体,胶体能产生丁达尔效应,能透过滤纸;胶体较稳定,静置不会出现沉淀。
二、电解质和非电解质3.下列说法正确的是()A.硫酸钡不溶于水,所以硫酸钡是非电解质B.氨气溶于水可以导电,所以氨气是电解质C.固态磷酸是电解质,所以磷酸在熔融时和溶于水时都能导电D.液态氯化氢不能导电,但氯化氢是电解质答案 D解析A项,硫酸钡虽在水中溶解度较小,但溶于水的部分能够电离,熔融状态下能够电离,它是电解质;B项,氨气溶于水可以导电,但氨气不是电解质;C项,磷酸是电解质,它溶于水时能导电,但熔融时不导电;D项,液态氯化氢不能导电,但在水溶液中能导电,所以氯化氢是电解质。
4.下列电离方程式正确的是()A.MgSO4===Mg+2+SO-24B.Ba(OH)2===Ba2++OH-2C.Al2(SO4)3===2Al3++3SO2-4D.KClO3===K++Cl-+3O2-答案 C解析A项中“===”右边的离子符号表示是错误的,应改为MgSO4===Mg2++SO2-4;B项中“OH-2”应改为“2OH-”;D项中ClO-3不电离,应改为KClO3===K++ClO-3。
三、物质的分离、提纯和检验5.下列实验操作中,不能用于物质分离的是()答案 C6.下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)()答案 A解析A项,加盐酸,Na2CO3+2HCl===2NaCl+H2O+CO2↑,然后将溶液蒸发、结晶,可得到NaCl固体;B项,在CO2中CO很难点燃且除去CO的同时混入了O2;C项,Cu与稀硫酸不反应,Zn可溶于稀硫酸,过滤后所得固体为Cu而不是Zn;D项,Fe(OH)3胶体和FeCl3都能透过滤纸,过滤不能除去FeCl3。
第三单元人类对原子结构的认识——————————————————————————————————————[考试要求]1.原子结构模型的演变(a/ a)2.原子的构成,原子符号(b/ b)3.核素、同位素的概念(a/ b)4.常见离子化合物的形成过程(/ b)1.原子结构模型先后经历了道尔顿、汤姆生、卢瑟福、玻尔等多位科学家的研究。
2.在化学反应中原子核不发生变化,原子的最外层电子数可能发生变化。
3.A Z X表示一个质量数为A,质子数为Z的原子,其中子数为A-Z。
4.同种元素(质子数相同)的不同原子(中子数不同)互称同位素。
核素的种类与原子种类相同。
原子结构模型的演变1.古希腊原子学说万物由间断的、不可分的原子构成,原子的结合和分离是万物变化的根本原因。
2.道尔顿原子学说19世纪初,道尔顿认为,物质由原子构成,原子不能被创造,不能被毁灭,在化学变化中不可再分割。
3.汤姆生原子结构模型1897年,汤姆生发现原子中存在电子,并提出了一个“葡萄干面包式”的原子结构模型。
4.卢瑟福原子结构模型原子由原子核和核外电子构成,原子核带正电荷,电子带负电荷,在原子核周围做高速运动。
5.玻尔原子结构模型原子核外,电子在一系列稳定的轨道上运动,每个轨道都有一个确定的能量值。
6.现代原子结构学说——电子云模型原子核外电子的运动不遵循经典力学的原理,必须用量子力学方法描述核外电子的运动。
1.提出原子结构模型的科学家,从时间的先后顺序来看,下列排列正确的是( ) A.汤姆生、玻尔、卢瑟福、道尔顿B.汤姆生、玻尔、道尔顿、卢瑟福C.卢瑟福、道尔顿、汤姆生、玻尔D.道尔顿、汤姆生、卢瑟福、玻尔解析:选D 19世纪初,道尔顿提出了原子学说;1904年汤姆生提出了一个被称为“葡萄干面包式”的原子结构模型;1911年卢瑟福提出了带核的原子结构模型;1913年玻尔提出了新的原子结构模型。
2.如图所示的原子结构模型的演变图中,(1)为道尔顿实心球式原子模型,(2)为卢瑟福行星运转式原子模型,(3)为汤姆生葡萄干面包式原子模型,(4)为近代量子力学原子模型,(5)为玻尔轨道式原子模型。
其中符合历史演变的顺序的一组为( )A.(1)(3)(2)(5)(4) B.(1)(2)(3)(4)(5)C.(1)(5)(3)(2)(4) D.(1)(3)(5)(4)(2)答案:A原子核外电子排布 (对应学生用书P25)1.原子结构(1)原子结构(2)表示方法:原子结构示意图如O:;Mg:2.元素的化学性质与原子核外电子排布的关系(1)化学反应的特点:原子核不发生变化,但最外层电子数可能发生变化。
(2)元素的化学性质与原子结构的关系活泼金属元素的原子最外层电子数较少,易失去,而活泼非金属元素的原子最外层电子数较多,易从外界获得电子;稀有气体原子最外层有8个(He 2个)电子,化学性质稳定,不易得失电子。
(3)化合价和核外电子排布的关系①活泼金属在反应中,一般失去电子,表现正化合价。
②活泼非金属在反应中,一般得到电子,表示负化合价。
3.核外电子排布规律(1)能量最低原理:电子总是尽先排布在能量最低的电子层里。
(2)每个电子层最多只能容纳2n2电子,①最外层最多只能容纳8个电子(氦原子是2个);②次外层最多只能容纳18个电子;③倒数第三层最多只能容纳32个电子。
4.离子化合物的形成过程[仅供选考考生使用]在活泼金属与活泼非金属的反应中,金属元素的原子失去电子,表现为正化合价,非金属元素的原子得到电子,表现为负化合价,而形成离子化合物。
如氧化镁的形成:1.下列微粒结构示意图中,不正确的是( )解析:选D 当原子核外第一电子层是最外电子层时,其中的最多电子数为2,当原子核外其他电子层作为最外层时,其中的最多电子数为8,因此是错误的。
2.根据给出的原子或离子结构示意图,回答下列问题(填字母):(1)电子层排布相同的是________。
(2)属于同种元素的是________。
(3)属于金属元素的是________。
(4)属于稀有气体元素的是______,稀有气体一般不参与化学反应的原因是________________________________________________________________________。
(5)写出D 参加化学反应后所得离子的结构示意图 ______________。
解析:电子层排布相同是指电子层数和各电子层上的电子数均相同;决定元素种类的是核内质子数,即核电荷数;金属元素原子的最外电子层上的电子数一般较少;稀有气体原子最外电子层上一般为8个电子,He 最外层为2个电子。
答案:(1)BC (2)AB (3)D (4)C 原子的最外层电子已达到8(或2)电子稳定结构,既不易失去电子也不易得到电子 (5)[方法技巧](1)最外层电子数等于次外层电子数的元素:Be 、Ar 。
(2)最外层电子数是次外层电子数2倍的元素:C 。
最外层电子数是次外层电子数3倍的元素:O 。
最外层电子数是次外层电子数4倍的元素:Ne 。
(3)电子层数与最外层电子数相等的元素:H 、Be 、Al 。
(4)电子总数为最外层电子数2倍的元素:Be 。
(5)次外层电子数是最外层电子数2倍的元素:Li 、Si 。
(6)内层电子总数是最外层电子数2倍的元素:Li 、P 。
原子核的组成1.原子的组成原子⎩⎨⎧原子核⎩⎪⎨⎪⎧质子:带1个单位正电荷中子:不带电电子:带1个单位负电荷2.质量数(1)概念:将原子核内所有的质子和中子的相对质量取整数加起来所得的数值,用A 表示。
(2)构成原子的微粒间的两个关系 ①质量数(A )=质子数(Z )+中子数(N )②质子数=核外电子数=核电荷数=原子序数。
3.原子组成的表示方法AZ X质量数质子数元素符号如作为相对原子质量标准为126C表示质子数为6,质量数为12的碳原子。
[特别提醒]并不是所有原子都是由质子、中子和电子构成的。
如11H是由质子和核外电子构成。
4.核素(1)概念具有一定质子数和一定中子数的一种原子称为一种核素。
(2)氢元素的三种核素(3)碳元素的三种核素126C、136C、146C,质子数均为6,中子数分别为6、7、8。
5.同位素(1)概念质子数相同、质量数(或中子数)不同的核素互称为同位素。
(2)特点——两同两不同①两同:质子数相同,元素相同;②两不同:中子数不同,原子不同。
(3)性质①同一元素的各同位素虽然质量数不同,但它们的化学性质基本相同。
②天然存在的同位素,相互间保持一定的比率。
(4)用途①放射性的146C用于考古断代。
②21H和31H用于制造氢弹。
③放射性同位素释放的射线可用于育种、治疗恶性肿瘤等。
[特别提醒]“同位”是指核素的质子数相同,在元素周期表中占有相同的位置。
如168O与188O互为同位素,而40K和40Ca不互为同位素。
6.元素、核素、同位素的区别1.判断正误(正确的打“√”,错误的打“×”)。
(1)不同元素的核素的质量数一定不同( ) (2)146C 和147N 互为同位素( ) (3)23592U 与23892U 是同一种核素( )(4)14C 可用于文物的年代鉴定,14C 与12C 为同种单质( ) 答案:(1)× (2)× (3)× (4)× 2.在63Li 、73Li 、2311Na 、2412Mg 、146C 、147N中: (1)________和________互为同位素;(2)________和________的质量数相等,但不能互称同位素;(3)________和________的中子数相等,但质子数不等,所以不是同种元素。
解析:答案:(1)63Li 736711123.填写下列表格中的内容。
8 10 8 1816 16 16 3217 18 17 35[三级训练·节节过关]1.元素的种类和原子的种类相比较( )A.前者大B.后者大C.相等 D.不能确定解析:选B 一种元素可能存在多种同位素,所以元素种类小于原子种类。
2.简单原子的原子结构可用如图所示的表示方法形象地表示。
下列关于粒子①、②、③的叙述正确的是( )A.①、②、③不互为同位素B.①、②、③表示三种核素C.①、②、③是三种化学性质不同的粒子D.①、②、③具有相同的质量数解析:选B 由于三种结构中均只有一个质子,中子数不同,所以它们表示氢元素的三种核素,A项错误,B项正确;它们的化学性质相同,C项错误;三者的质量数分别为1、2、3,D项错误。
3.国际纯粹与应用化学联合会宣布,将合成化学元素第115号( 281115Mc)提名为化学新元素。
下面有关说法不正确的是( )A.281115Mc中的中子数比质子数多51B.281115Mc与283115Mc互为同位素C.281115Mc与283115Mc化学性质基本相同D.Mc元素是在化学变化中产生的解析:选D 理清质子数、中子数、质量数、元素相对原子质量的关系,同位素的化学性质相似,物理性质不同。
化学变化有新物质产生,但不会产生新的元素。
4.某微粒用符号A Z M n+表示,下列关于该微粒的叙述中正确的是( )A.所含质子数为(A-n)B.所含中子数为ZC.所含电子数为(Z+n)D.中子数-电子数=A-2Z+n解析:选D 对于微粒A Z M n+,M代表元素符号,A是该元素某原子的质量数,Z是该原子的质子数,n是该原子所带的正电荷数,即表示M原子失去n个电子。
由于原子变成离子时,一般只是最外层电子数的变化,而原子核内的质子数和中子数不变,A项不正确;中子数为(A-Z),B项不正确;A Z M n+的电子数为(Z-n),C项不正确;中子数-电子数=(A-Z)-(Z -n)=A-2Z+n,D项正确。
5.用A表示质子数、B表示中子数、C表示核外电子数、D表示最外层电子数、E表示电子层数,填写下列空格。
(1)同位素种类由________决定;(2)元素种类由________决定;(3)某元素有无同位素由________决定;(4)质量数由________决定;(5)元素的化学性质主要由________决定;(6)核电荷数由________决定。
解析:(1)同位素指质子数相同、中子数不同的同一元素的不同原子的互称,故同位素由质子数、中子数决定;(2)元素指具有一定核电荷数(质子数)的一类原子。
(3)中子数决定了元素有无同位素。
(4)由于电子的质量很小,原子的质量主要集中在原子核上,故质量数由质子数和中子数决定。
(5)由于电子的得失难易程度直接决定元素的化学性质,因此,元素的化学性质与原子核外最外层电子数有密切关系。
(6)核电荷数=质子数。
答案:(1)A、B (2)A (3)B (4)A、B (5)D (6)A1.H、D、T、H+可以用来表示( )A.同一种原子B.化学性质不同的氢原子C.氢元素 D.氢的四种核素解析:选C H、D和T是氢原子,H+是氢离子,它们都是氢元素,其中H+是离子态的氢元素。