常见的晶体结构与离子晶体结构
- 格式:ppt
- 大小:6.82 MB
- 文档页数:35




晶体结构的类型分类晶体是由原子、离子或分子按照一定的规则排列而成的固体物质。
晶体结构的类型分类是根据晶体中原子、离子或分子的排列方式和空间群的不同来进行的。
不同的晶体结构类型具有不同的物理和化学性质,对于研究晶体的性质和应用具有重要的意义。
本文将介绍几种常见的晶体结构类型分类。
1. 离子晶体结构离子晶体结构是由正负离子按照一定的比例和排列方式组成的晶体。
离子晶体结构可以分为两种类型:离子-离子晶体和离子-极化离子晶体。
离子-离子晶体是由正负离子按照一定的比例排列而成的,如氯化钠晶体。
离子-极化离子晶体是由正负离子和极化离子按照一定的比例排列而成的,如氯化钾晶体。
2. 原子晶体结构原子晶体结构是由原子按照一定的规则排列而成的晶体。
原子晶体结构可以分为两种类型:金属晶体和共价晶体。
金属晶体是由金属原子按照一定的规则排列而成的,如铁晶体。
共价晶体是由非金属原子按照一定的规则排列而成的,如硅晶体。
3. 分子晶体结构分子晶体结构是由分子按照一定的规则排列而成的晶体。
分子晶体结构可以分为两种类型:分子-分子晶体和分子-离子晶体。
分子-分子晶体是由分子按照一定的比例排列而成的,如葡萄糖晶体。
分子-离子晶体是由分子和离子按照一定的比例排列而成的,如氯化铵晶体。
4. 复合晶体结构复合晶体结构是由不同类型的原子、离子或分子按照一定的规则排列而成的晶体。
复合晶体结构可以分为两种类型:复合离子晶体和复合分子晶体。
复合离子晶体是由不同类型的离子按照一定的比例排列而成的,如硫酸铜铵晶体。
复合分子晶体是由不同类型的分子按照一定的比例排列而成的,如葡萄糖-脱氧核糖晶体。
总结:晶体结构的类型分类包括离子晶体结构、原子晶体结构、分子晶体结构和复合晶体结构。
不同类型的晶体结构具有不同的物理和化学性质,对于研究晶体的性质和应用具有重要的意义。
通过对晶体结构的分类和研究,可以深入了解晶体的组成和性质,为晶体材料的设计和应用提供理论基础。

晶体结构与晶体的物理性质晶体是一种具有高度有序排列的固体,由于其独特的结构和组成,赋予了晶体许多特殊的物理性质。
本文将探讨晶体结构与晶体的物理性质之间的关系,介绍晶体结构的分类及其对晶体性质的影响。
一、晶体结构的分类晶体的结构可以按照其原子、离子或分子的排列方式进行分类。
常见的晶体结构包括离子晶体、共价晶体、金属晶体和分子晶体。
离子晶体是由正负离子按照一定的比例排列形成的,典型的例子是氯化钠晶体(NaCl)。
这种晶体结构具有高度的电荷平衡,通常具有良好的电导性和熔点较高的特点。
共价晶体是由共价键连接的原子网格组成,例如钻石。
这种晶体结构非常坚固,通常具有高硬度和高熔点的性质。
金属晶体是由金属元素的原子形成的,具有典型的金属键。
这种晶体结构常常是由“海洋模型”描述的,即正电荷的金属离子在电子“海洋”中自由移动,因此具有优良的导电性和热导性。
分子晶体是由分子间弱力作用力连接而成的,典型的例子是冰。
这种晶体结构通常具有较低的熔点和较低的硬度,分子之间的相互作用力较弱。
二、晶体结构与物理性质的关系晶体的物理性质直接取决于其结构特点,下面将重点介绍晶体结构对热学、光学和电学性质的影响。
热学性质:晶体的热导性和热膨胀系数与其结构有密切关系。
一般来说,具有金属晶体结构的物质通常具有较高的热导性和较低的热膨胀系数。
这是因为金属晶体中金属离子之间的电子能够在晶体内自由传递热能,而共价或离子晶体结构中的典型原子并不具备这种自由传导的能力。
光学性质:晶体的透明度和折射率与其晶格排列方式密切相关。
分子晶体通常具有较低的折射率,因为分子之间的间隙较大,光线能够较容易地通过。
而离子晶体由于正负离子的高度有序排列,通常具有较高的折射率。
电学性质:晶体中的离子、原子和分子的排列方式对电学性质具有重要影响。
离子晶体由于正负离子排列有序,具有良好的电导性。
而共价晶体由于电子的共用和共价键的形成,通常具有较高的电阻率。
此外,晶体的结构还会影响其磁学性质、机械性质等方面。
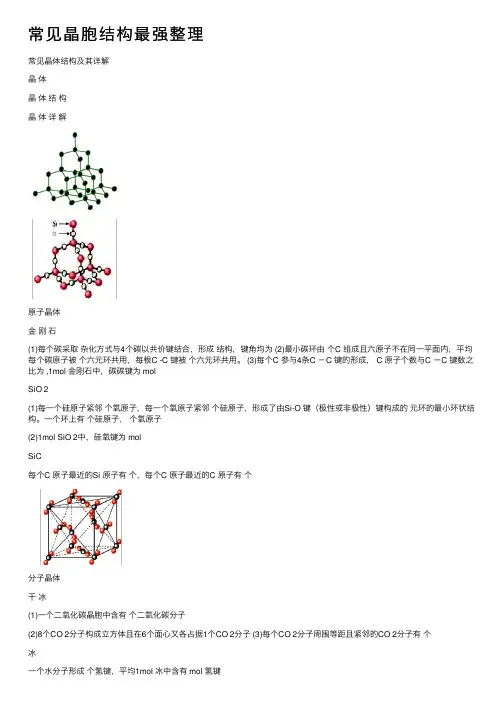
常见晶胞结构最强整理常见晶体结构及其详解晶体晶体结构晶体详解原⼦晶体⾦刚⽯(1)每个碳采取杂化⽅式与4个碳以共价键结合,形成结构,键⾓均为 (2)最⼩碳环由个C 组成且六原⼦不在同⼀平⾯内,平均每个碳原⼦被个六元环共⽤,每根C -C 键被个六元环共⽤。
(3)每个C 参与4条C -C 键的形成, C 原⼦个数与C -C 键数之⽐为 ,1mol ⾦刚⽯中,碳碳键为 molSiO 2(1)每⼀个硅原⼦紧邻个氧原⼦,每⼀个氧原⼦紧邻个硅原⼦,形成了由Si-O 键(极性或⾮极性)键构成的元环的最⼩环状结构。
⼀个环上有个硅原⼦,个氧原⼦(2)1mol SiO 2中,硅氧键为 molSiC每个C 原⼦最近的Si 原⼦有个,每个C 原⼦最近的C 原⼦有个分⼦晶体⼲冰(1)⼀个⼆氧化碳晶胞中含有个⼆氧化碳分⼦(2)8个CO 2分⼦构成⽴⽅体且在6个⾯⼼⼜各占据1个CO 2分⼦ (3)每个CO 2分⼦周围等距且紧邻的CO 2分⼦有个冰⼀个⽔分⼦形成个氢键,平均1mol 冰中含有 mol 氢键C 60(1)⾜球烯的分⼦是由60个碳原⼦构成的,空间构型有12个正五边形,20个正六边形(2)⼀个C 60分⼦中含有根单键,根双键 (3)C 60晶胞中与⼀个C 60最近的C 60分⼦有个(与⼲冰的晶胞相似)离⼦晶体NaCl (型)(1)每个Na +周围等距且紧邻的Cl -有个,每个Cl -周围等距且紧邻的Na +有个。
每个Na +周围等距且紧邻的Na +有个,同理Cl -也然。
(2)每个晶胞中含个Na +和4个Cl -。
CsCl (型)(1)每个Cs +周围等距且紧邻的Cl -有个,每个Cl -周围等距且紧邻的Cs +有个。
(2)左图为个晶胞;右图为⼀个晶胞,每个晶胞中含个Cs +,个Cl -。
CaF 21、1个晶胞中含有个Ca 2+,个F -,Ca 2+的配位数为个,F -配位数为个2、Ca 2+周围等距离最近的Ca 2+ 个,F —周围等距离最近的F — 个⾦属晶体简单⽴⽅堆积典型代表空间利⽤率配位数为体⼼⽴⽅堆积典型代表空间利⽤率配位数为⾯⼼⽴⽅堆积典型代表空间利⽤率配位数为六⽅最密堆积典型代表空间利⽤率配位数为混合晶体⽯墨1、碳原⼦的杂化⽅式为,键⾓为2、⽯墨晶体的⽚层结构中,每个六元碳环含有个碳原⼦数,每个六元碳环所含有的共价健数是个3、⽯墨同层C 原⼦间以连接,熔化需要破坏碳碳之间作⽤⼒,故熔沸点较⾼;层与层之间的作⽤⼒为,作⽤⼒⽐较弱,故⽯墨的硬度较低。


几种常见晶体结构分析河北省宣化县第一中学 栾春武 邮编 075131栾春武:中学高级教师,张家口市中级职称评委会委员。
河北省化学学会会员。
市骨干教师、市优秀班主任、模范教师、优秀共产党员、劳动模范、县十佳班主任。
联系电话: E-mail :一、氯化钠、氯化铯晶体——离子晶体由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在。
阴阳离子在晶体中按一定的规则排列,使整个晶体不显电性且能量最低。
离子的配位数分析如下:离子数目的计算:在每一个结构单元(晶胞)中,处于不同位置的微粒在该单元中所占的份额也有所不同,一般的规律是:顶点上的微粒属于该单元中所占的份额为18,棱上的微粒属于该单元中所占的份额为14,面上的微粒属于该单元中所占的份额为12,中心位置上(嚷里边)的微粒才完全属于该单元,即所占的份额为1。
1.氯化钠晶体中每个Na +周围有6个Cl -,每个Cl -周围有6个Na +,与一个Na +距离最近且相等的Cl -围成的空间构型为正八面体。
每个Na +周围与其最近且距离相等的Na +有12个。
见图1。
| 晶胞中平均Cl -个数:8×18 + 6×12 = 4;晶胞中平均Na +个数:1 + 12×14 = 4因此NaCl 的一个晶胞中含有4个NaCl (4个Na +和4个Cl -)。
2.氯化铯晶体中每个Cs +周围有8个Cl -,每个Cl -周围有8个Cs +,与一个Cs +距离最近且相等的Cs +有6个。
晶胞中平均Cs +个数:1;晶胞中平均Cl -个数:8×18 = 1。
因此CsCl 的一个晶胞中含有1个CsCl (1个Cs +和1个Cl -)。
二、金刚石、二氧化硅——原子晶体1.金刚石是一种正四面体的空间网状结构。
每个C 原子以共价键与4个C 原子紧邻,因而整个晶体中无单个分子存在。
由共价键构成的最小环结构中有6个碳原子,不在同一个平面上,每个C 原子被12个六元环共用,每C —C 键共6个环,因此六元环中的平均C 原子数为6×112 = 12 ,平均C —C 键数为6×16 = 1。



典型的晶体结构范文晶体是由原子、分子或离子按照一定的规律排列而组成的固体物质。
晶体结构是指晶体中原子、分子或离子的空间排列方式。
不同的晶体结构决定了晶体的物理性质和化学性质。
下面将介绍几种典型的晶体结构。
1.离子晶体结构:离子晶体是由带正电荷的阳离子和带负电荷的阴离子构成的晶体。
它们之间通过离子键相互结合。
典型的离子晶体如氯化钠(NaCl)。
在氯化钠晶体中,钠离子和氯离子按照八面体配位的方式排列。
每个钠离子被六个氯离子包围,每个氯离子被六个钠离子包围。
2.共价晶体结构:共价晶体是由原子通过共用电子而形成的晶体。
原子之间的共价键保持着晶体的稳定性。
典型的共价晶体如金刚石(C),其中每个碳原子通过共价键与周围四个碳原子相连。
金刚石晶体的结构是由不同的碳原子和碳原子之间的关系构成的。
3.金属晶体结构:金属晶体是由金属原子构成的晶体,金属原子之间通过金属键相互结合。
金属晶体的典型例子是铁(Fe)和铜(Cu)。
在金属晶体中,金属原子形成密堆积结构,具有非常高的导电性和热导性。
4.分子晶体结构:分子晶体是由分子构成的晶体,分子之间通过范德华力相互结合。
分子晶体的典型例子是冰(H2O)。
在冰晶体中,水分子通过氢键连接在一起,形成六角形密堆积结构。
5.网络共价晶体结构:网络共价晶体是由原子通过共价键形成复杂的网状结构的晶体。
典型的例子是二硫化碳(CS2)。
在二硫化碳晶体中,碳原子通过共价键和硫原子形成复杂的网状结构。
以上是一些典型的晶体结构,每种晶体结构都有其独特的特点和性质。
了解晶体的结构对于研究晶体的物理性质和化学性质具有重要意义。