2过氧化氢分解反应速率常数的测定
- 格式:xlsx
- 大小:18.81 KB
- 文档页数:4

实验14--过氧化氢催化分解反应速率常数的测定实验目的:1. 了解过氧化氢的催化分解反应。
2. 掌握反应速率常数的测定方法。
实验原理:过氧化氢在水溶液中会自发分解,产生氧气和水。
但是过氧化氢自身的分解速度非常慢,因此需要催化剂来加速反应速率。
催化剂可以降低活化能,使反应更容易进行。
H2O2(aq) → O2(g) + 2H2O(l)该反应为一级反应,其反应速率可以表示为:r = k[H2O2]其中,r为反应速率,k为反应速率常数,[H2O2]为过氧化氢浓度。
为了方便起见,我们可以使用实验时测得的氧气体积来代替反应速率,即:在反应中,过氧化氢的浓度随时间而减少,因此反应速率常数k也随时间而变化。
为了得到反应速率常数k的准确值,我们需要使[H2O2]在整个反应过程中变化量相对较小,通常可以在反应初期进行。
实验仪器和试剂:1. 实验室盛装设备2. 10 mL 滴定管3. 过氧化氢溶液(30%)4. 硫酸铜催化剂溶液6. 蒸馏水实验步骤:1. 将实验室盛装设备清洗干净,取出等压瓶并将其放入水中,保持水平。
使用10 mL 滴定管向等压瓶中滴加10 mL的过氧化氢溶液,尽量不在氧气冒出的条件下加入。
等压瓶中应剩余20 mL空气。
2. 在反应开始前,将硫酸铜催化剂溶液加入等压瓶中。
使用10 mL 滴定管向等压瓶中滴加0.5 mL的硫酸铜催化剂溶液,并轻轻摇荡等压瓶使催化剂充分混合。
3. 在反应开始后,使用滴定管向等压瓶中滴加氢氧化钠溶液。
每滴加入1 mL,滴加后轻轻摇荡等压瓶,注意观察等压瓶中气体体积变化。
反应开始前应先注意精密加水前的气体体积,以作为实验的参考。
4. 在反应过程中,每隔30秒记录一次氧气体积V和反应时间t,记录10分钟。
记录时,将等压瓶放在室温下,以保持反应温度稳定。
5. 测量完毕后,关闭水龙头,使用滴定管向等压瓶中滴加足量氢氧化钠溶液,并等待反应结束。
注意:反应结束后,等压瓶中还有一定量的过氧化氢未反应完全,因此等压瓶不能直接倒掉,要用蒸馏水清洗干净。


过氧化氢催化分解反应速率常数的测定标签:分类:药学资料化学实验报告过氧化氢反应速率常数教育一、实验目的(1)了解过氧化氢催化分解反应速率常数的测定方法。
(2)熟悉一级反应的特点,了解催化剂对反映速率的影响。
(3)掌握用图解计算法求反应速率常数。
二、实验用品1、仪器玻璃反应容器1个、水准瓶1个、50mL量气管1个、超级恒温槽1套、三通活塞1个、秒表1块、10mL量筒1个、5mL吸量管2支、胶管3m。
2、药品-1KI溶液。
质量分数为2%的H2O2溶液(新鲜配制)、0.1mol·L三、实验原理与技术过氧化氢很不稳定,在常温下的分解反应式为:H2O2→H2O+1/2O2(Ⅰ)在KI作用下的分解反应机理为:H2O2+KI→KIO+H2O(慢)(Ⅱ)KIO→KI+1/2O2(快)(Ⅲ)(Ⅱ)式是H2O2分解的速控步骤,H2O2分解反应的反应速率方程为:-dc H2O2/dt=k′c H2O2·c KI(Ⅳ)因为c KI近似不变,(Ⅳ)式可简化为:-dc H2O2/dt=kc H2O2(Ⅴ)(其中k=k′c KI)。
H2O2的催化分解反应为一级反应,对(Ⅴ)式积分可得:ln(c/c0)=-kt(Ⅵ)(其中c0为H2O2的初始浓度;c为反应至t时刻H2O2的浓度;k为H2O2的催化分解反应的速率常数)。
反应的半衰期为:t1/2=ln2/k=0.693/k(Ⅶ)在等温等压条件下,在H2O2的分解反应中,氧气体积增长速率反映了H2O2的分解速率,本实验就是通过测定不同时刻放出的氧气的体积,间接地求出H2O2在相应时刻的浓度,这种方法称为物理法。
令ⅴ∞表示H2O2全部分解放出的O2的体积;ⅴt表示反应至t时刻放出的O2的体积;则由(Ⅰ)式可看出:定温定压下反的O 2的体积ⅴt 与被消耗的H 2O 2的浓度成正比,而ⅴ∞则与H 2O 2的初始浓度成正比,且两者比例系数,则:c 。
∝ⅴ∞;c ∝(ⅴ∞-ⅴt )。

过氧化氢催化分解反应速率常数的测定一、实验目的(1)了解过氧化氢催化分解反应速率常数的测定方法。
(2)熟悉一级反应的特点,了解催化剂对反映速率的影响。
(3)掌握用图解计算法求反应速率常数。
二、实验用品1、仪器玻璃反应容器1个、水准瓶1个、50mL量气管1个、超级恒温槽1套、三通活塞1个、秒表1块、10mL量筒1个、5mL吸量管2支、胶管3m。
2、药品质量分数为2%的H2O2溶液(新鲜配制)、0.1mol·L-1KI溶液。
三、实验原理与技术过氧化氢很不稳定,在常温下的分解反应式为:H2O2→H2O+1/2O2(Ⅰ)在KI作用下的分解反应机理为:H2O2+KI→KIO+ H2O (慢)(Ⅱ)KIO→KI+1/2O2 (快)(Ⅲ)(Ⅱ)式是H2O2分解的速控步骤,H2O2分解反应的反应速率方程为:-dc H2O2/d t=k´c H2O2·c KI (Ⅳ)因为c KI近似不变,(Ⅳ)式可简化为:-dc H2O2/d t=k c H2O2 (Ⅴ)(其中k=k´c KI)。
H2O2的催化分解反应为一级反应,对(Ⅴ)式积分可得:ln(c/ c0)=-kt (Ⅵ)(其中c0为H2O2的初始浓度;c为反应至t时刻H2O2的浓度;k为H2O2的催化分解反应的速率常数)。
反应的半衰期为:t1/2= ln2/k=0.693/k (Ⅶ)在等温等压条件下,在H2O2的分解反应中,氧气体积增长速率反映了H2O2的分解速率,本实验就是通过测定不同时刻放出的氧气的体积,间接地求出H2O2在相应时刻的浓度,这种方法称为物理法。
令ⅴ∞表示H2O2全部分解放出的O2的体积;ⅴt表示反应至t时刻放出的O2的体积;则由(Ⅰ)式可看出:定温定压下反应产生的O2的体积ⅴt与被消耗的H2O2的浓度成正比,而ⅴ∞则与H2O2的初始浓度成正比,且两者比例系数为定值,则:c。
∝ⅴ∞;c∝(ⅴ∞-ⅴt)。
代入(Ⅵ)式可得:ln[(ⅴ∞-ⅴt)/ⅴ∞]=-kt (Ⅷ)→ln(ⅴ∞-ⅴt)=-kt+lnⅴ∞(Ⅸ)(其中ⅴ∞可以通过外推法或加热法求得)。

实验 量气法测定过氧化氢催化分解反应速率常数一、实验目的1. 学习使用量气法研究过氧化氢的分解反应2. 了解一级反应的特点,掌握用图解计算法求反应速率常数。
二、实验原理H 2O 2在室温下,没有催化剂存在时,分解反应进行得很慢,但加入催化剂(如Pt 、Ag 、MnO 2、碘化物)时能促使其较快分解,分解反应按下式进行:H 2O 2H 2O +12O 2→(C2-1)在催化剂KI 作用下,H 2O 2分解反应的机理为:H 2O 2H 2O ++KI KIO(慢)→(C2-2)K IO K I +12O 2(快)→(C2-3)整个分解反应的速度由慢反应(C2-2)决定:222222O H KI O H O H c c k dtdc =- (C2-4)式中c 表示各物质的浓度(mol ·L -1),t 为反应时间(s ),22O H k 为反应速率常数,它的大小仅决定于温度。
在反应中作为催化剂的KI 的浓度保持不变,令KIO H122c k k ⋅=,则2222O H 1O H c k dtdc =- (C2-5)式中k 1为表观反应速率常数。
此式表明,反应速率与H 2O 2浓度的一次方成正比,故称为一级反应。
将上式积分得:1ln ln c t k c t +-= (C2-5)式中c 0、c t 分别为反应物过氧化氢在起始时刻和t 时刻的浓度。
反应半衰期为:112/1693.02ln k k t ==(C2-6)由反应方程式可知,在常温下,H 2O 2分解的反应速度与氧气析出的速度成正比。
析出的氧气体积可由量气管测量。
令V ∞表示H 2O 2全部分解所放出的O 2体积,V t 表示H 2O 2在t 时刻放出的O 2体积,则)(t t V V c -∝∞。
将该关系式带入(C2-5),得到∞∞+-=-V t k V V t ln )ln(1 (C2-7)本实验采用静态法测定H2O2分解反应速率常数,实验装置见图C2-1。

实验 量气法测定过氧化氢催化分解反应速率常数一、实验目的1. 学习使用量气法研究过氧化氢的分解反应2. 了解一级反应的特点,掌握用图解计算法求反应速率常数。
二、实验原理H 2O 2在室温下,没有催化剂存在时,分解反应进行得很慢,但加入催化剂(如Pt 、Ag 、MnO 2、碘化物)时能促使其较快分解,分解反应按下式进行:H 2O 2H 2O +12O 2→(C2-1)在催化剂KI 作用下,H 2O 2分解反应的机理为:H 2O 2H 2O ++KI KIO(慢)→(C2-2)K IO K I +12O 2(快)→(C2-3)整个分解反应的速度由慢反应(C2-2)决定:222222O H KI O H O H c c k dtdc =- (C2-4)式中c 表示各物质的浓度(mol ·L -1),t 为反应时间(s ),22O H k 为反应速率常数,它的大小仅决定于温度。
在反应中作为催化剂的KI 的浓度保持不变,令KIO H122c k k ⋅=,则2222O H 1O H c k dtdc =- (C2-5)式中k 1为表观反应速率常数。
此式表明,反应速率与H 2O 2浓度的一次方成正比,故称为一级反应。
将上式积分得:1ln ln c t k c t +-= (C2-5)式中c 0、c t 分别为反应物过氧化氢在起始时刻和t 时刻的浓度。
反应半衰期为:112/1693.02ln k k t ==(C2-6)由反应方程式可知,在常温下,H 2O 2分解的反应速度与氧气析出的速度成正比。
析出的氧气体积可由量气管测量。
令V ∞表示H 2O 2全部分解所放出的O 2体积,V t 表示H 2O 2在t 时刻放出的O 2体积,则)(t t V V c -∝∞。
将该关系式带入(C2-5),得到∞∞+-=-V t k V V t ln )ln(1 (C2-7)本实验采用静态法测定H2O2分解反应速率常数,实验装置见图C2-1。
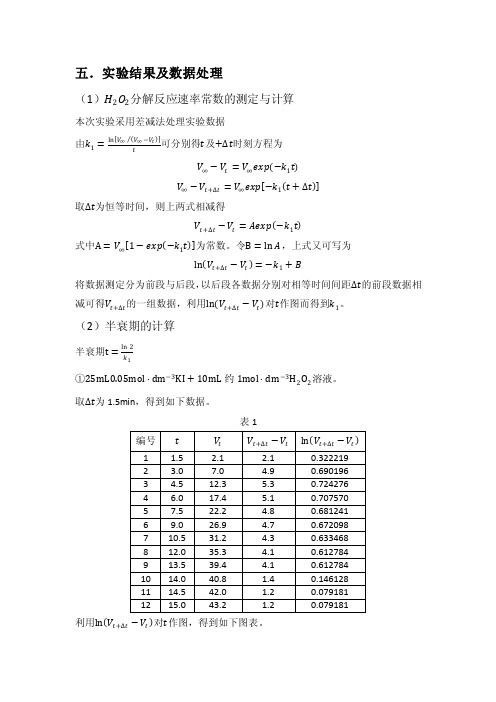
五.实验结果及数据处理(1)H2O2分解反应速率常数的测定与计算本次实验采用差减法处理实验数据可分别得t及+∆t时刻方程为由k1=ln V∞V∞−V ttV∞−V t=V∞exp−k1tV∞−V t+∆t=V∞exp−k1t+∆t取∆t为恒等时间,则上两式相减得V t+∆t−V t=Aexp−k1t式中A=V∞1−exp−k1t为常数。
令B=ln A,上式又可写为ln V t+∆t−V t=−k1+B将数据测定分为前段与后段,以后段各数据分别对相等时间间距∆t的前段数据相减可得V t+∆t的一组数据,利用ln V t+∆t−V t对t作图而得到k1。
(2)半衰期的计算半衰期t=ln2k1①25mL0.05mol∙dm−3KI+10mL约1mol∙dm−3H2O2溶液。
取∆t为1.5min,得到如下数据。
表1利用ln V t+∆t−V t对t作图,得到如下图表。
故k 1=0.0136t =ln 20.0136=50.97②25mL0.1mol ∙dm −3KI +10mL 约1mol ∙dm −3H 2O 2溶液。
取∆t 为1.0min ,得到如下数据。
表2利用ln V t +∆t −V t 对t 作图,得到如下图表。
故k 1=0.0262t =ln 20.0262=26.46③25mL0.1mol∙dm−3KI+5mL约1mol∙dm−3H2O2溶液+10mL约1mol∙dm−3H2O。
取∆t为1.5min,得到如下数据。
表3利用ln V t+∆t−V t对t作图,得到如下图表。
=25.96故k1=0.0267t=ln20.0267。

实验 量气法测定过氧化氢催化分解反应速率常数一、实验目的1. 学习使用量气法研究过氧化氢的分解反应2. 了解一级反应的特点,掌握用图解计算法求反应速率常数。
二、实验原理H 2O 2在室温下,没有催化剂存在时,分解反应进行得很慢,但加入催化剂(如Pt 、Ag 、MnO 2、碘化物)时能促使其较快分解,分解反应按下式进行:H 2O 2H 2O +12O2→ (C2-1)在催化剂KI 作用下,H 2O 2分解反应的机理为:H 2O 2H 2O ++KI KIO (慢)→ (C2-2)KIO KI +12O2(快)→ (C2-3)整个分解反应的速度由慢反应(C2-2)决定:222222O H KI O H O H c c k dt dc =- (C2-4)式中c 表示各物质的浓度(mol ·L -1),t 为反应时间(s ),22O H k 为反应速率常数,它的大小仅决定于温度。
在反应中作为催化剂的KI 的浓度保持不变,令KI O H 122c k k ⋅=,则2222O H 1O H c k dtdc =-(C2-5)式中k 1为表观反应速率常数。
此式表明,反应速率与H 2O 2浓度的一次方成正比,故称为一级反应。
将上式积分得:01ln ln c t k c t +-= (C2-5)式中c 0、c t 分别为反应物过氧化氢在起始时刻和t 时刻的浓度。
反应半衰期为:112/1693.02ln k k t ==(C2-6) 由反应方程式可知,在常温下,H 2O 2分解的反应速度与氧气析出的速度成正比。
析出的氧气体积可由量气管测量。
令V ∞表示H 2O 2全部分解所放出的O 2体积,V t 表示H 2O 2在t 时刻放出的O 2体积,则)(t t V V c -∝∞。
将该关系式带入(C2-5),得到∞∞+-=-V t k V V t ln )ln(1 (C2-7)本实验采用静态法测定HO2分解反应速率常数,实验装置见图C2-1。

实验 量气法测定过氧化氢催化分解反应速率常数一、实验目的1.学习使用量气法研究过氧化氢的分解反应2.了解一级反应的特点,掌握用图解计算法求反应速率常数。
二、实验原理H 2O 2在室温下,没有催化剂存在时,分解反应进行得很慢,但加入催化剂(如Pt 、Ag 、MnO 2、碘化物)时能促使其较快分解,分解反应按下式进行:(C2-1)H 2O 2H 2O +12O2¡ú在催化剂KI 作用下,H 2O 2分解反应的机理为:(C2-2)H 2O 2H 2O ++KI KIO £¨Âý£©¡ú(C2-3)KIO KI +12O2£¨¿ì£©¡ú整个分解反应的速度由慢反应(C2-2)决定:(C2-4)222222O H KI O H O H c c k dt dc =-式中c 表示各物质的浓度(mol·L -1),t 为反应时间(s ),为反应速率常数,它的大小仅决22O H k 定于温度。
在反应中作为催化剂的KI 的浓度保持不变,令,则KI O H 122c k k ⋅= (C2-5)2222O H 1O H c k dtdc =-式中k 1为表观反应速率常数。
此式表明,反应速率与H 2O 2浓度的一次方成正比,故称为一级反应。
将上式积分得:(C2-5)01ln ln c t k c t +-=式中c 0、c t 分别为反应物过氧化氢在起始时刻和t 时刻的浓度。
反应半衰期为:(C2-6)112/1693.02ln k k t ==由反应方程式可知,在常温下,H 2O 2分解的反应速度与氧气析出的速度成正比。
析出的氧气体积可由量气管测量。
令V ∞表示H 2O 2全部分解所放出的O 2体积,V t 表示H 2O 2在t 时刻放出的O 2体积,则。

过氧化氢分解速率常数的测定Determ in ati On Of H2QDeComPoSition Rate Con Sta nt一.实验目的及要求1. 熟悉一级反应的特点2. 测定过氧化氢分解反应的速率常数和级数3. 了解各种因素对反应速率的影响4. 用图解法求过氧化氢分解反应的速率常数二.实验原理凡是反应速度只是与反应物浓度的一次方成正比的反应称为一级反应。
实验证明.过氧化氢分解的反应为H2O2一H^O+ 10?如果该反应属于一级反应.则其反应速度方程应遵守下式:^ =kC t ⑴式中:k为反应速度常数;G为时间为t式的反应物浓度。
将式(1)积分得:=-⅛+lnC" (2) InCt式中:为反应开始时H2O2的浓度。
如将⑵变换•可得:In总7 ⑶该式子式是InCt〜t的直线方程。
反应进行过程中.测定不同时刻t 时反应系统中H2Q的浓度G.取得若干组C .t数据后.以InCt对时间 t作图.可得一直线.表明该反应为一级反应.其斜率为反应速度常数得负值—k.截距为In-O三.实验方法1. 实验条件的设计:化学反应速度取决于许多因素.例如反应物的浓度、搅拌速度、反应压力、温度、催化剂等等。
某些催化剂可以明显地加快反应速度。
能加速H2O分解的催化剂Pt、Ag、碘化物等等。
本实验用KI作为催化剂.在静态装置里测定HQ分解反应的速度常数(实验装置见第三部分)。
HQ在水溶液中分解释放出氧气的速率较慢.加入KI时.速率加快.其反应按下面的步骤进行.即Kl+HO====KIQ+HQ (慢)(1)KIQ====KI+1∕2Q(快)⑵由于第一步的速率比第二步慢得多.所以第一步为反应得控制步骤。
因而可以假定其反应的速率方程式为式中.Ct为反应系统中反应到t时刻HQ浓度.因KI在反应过程中浓度不变.故上式可以简化为式中,k = k!×ca,将上式分离变量积分t = 0 时.Ct = C 定积分式为积分结果InC t = —kt + ln Co (5)式(5)是InC t〜t的直线方程。

过氧化氢分解速率常数的测定Determination of H2O2 DecompositionRate Constant一.实验目的及要求1.熟悉一级反应的特点2.测定过氧化氢分解反应的速率常数和级数3.了解各种因素对反应速率的影响4.用图解法求过氧化氢分解反应的速率常数二.实验原理凡是反应速度只是与反应物浓度的一次方成正比的反应称为一级反应。
实验证明,过氧化氢分解的反应为如果该反应属于一级反应,则其反应速度方程应遵守下式:式中:k为反应速度常数;C t为时间为t式的反应物浓度。
将式(1)积分得:式中:为反应开始时H2O2的浓度。
如将(2)变换,可得:该式子式是lnC t~t的直线方程。
反应进行过程中,测定不同时刻t 时反应系统中H2O2的浓度C t,取得若干组C t ,t数据后,以lnC t对时间t作图,可得一直线,表明该反应为一级反应,其斜率为反应速度常数得负值-k,截距为㏑。
三.实验方法1.实验条件的设计:化学反应速度取决于许多因素,例如反应物的浓度﹑搅拌速度﹑反应压力﹑温度﹑催化剂等等。
某些催化剂可以明显地加快反应速度。
能加速H2O2分解的催化剂Pt﹑Ag﹑碘化物等等。
本实验用KI作为催化剂,在静态装臵里测定H2O2分解反应的速度常数(实验装臵见第三部分)。
H2O2在水溶液中分解释放出氧气的速率较慢,加入KI时,速率加快,其反应按下面的步骤进行,即KI+H2O2====KIO+H2O (慢) (1)KIO====KI+1/2O2 (快)(2)由于第一步的速率比第二步慢得多,所以第一步为反应得控制步骤。
因而可以假定其反应的速率方程式为式中,C t为反应系统中反应到t时刻H2O2浓度,因KI在反应过程中浓度不变,故上式可以简化为当t=0时, C t=C0t=t时, C t=C t定积分式为积分结果lnC t=-kt+㏑C0(5)式(5)是 lnC t~t的直线方程。
反应进行过程中,测定不同时刻t时反应系统中H2O2的浓度 C t,取得若干组C t,t的数据后,以㏑C t对t作图,得一直线,表明该反应为一级反应(准一级反应),直线斜率为-k。
![[试题]物理化学量气法测定过氧化氢催化分解反应速率常数](https://img.taocdn.com/s1/m/6f08f8a8c67da26925c52cc58bd63186bceb92b6.png)
实验 量气法测定过氧化氢催化分解反应速率常数一、实验目的1. 学习使用量气法研究过氧化氢的分解反应2. 了解一级反应的特点,掌握用图解计算法求反应速率常数。
二、实验原理H 2O 2在室温下,没有催化剂存在时,分解反应进行得很慢,但加入催化剂(如Pt 、Ag 、MnO 2、碘化物)时能促使其较快分解,分解反应按下式进行:H 2O 2H 2O +12O2→ (C2-1)在催化剂KI 作用下,H 2O 2分解反应的机理为:H 2O 2H 2O ++KI KIO (慢)→ (C2-2)KIO KI +12O2(快)→ (C2-3)整个分解反应的速度由慢反应(C2-2)决定:222222O H KI O H O H c c k dtdc =- (C2-4)式中c 表示各物质的浓度(mol ·L -1),t 为反应时间(s ),22O H k 为反应速率常数,它的大小仅决定于温度。
在反应中作为催化剂的KI 的浓度保持不变,令K I O H 122c k k ⋅=,则2222O H 1O H c k dtdc =-(C2-5)式中k 1为表观反应速率常数。
此式表明,反应速率与H 2O 2浓度的一次方成正比,故称为一级反应。
将上式积分得:01ln ln c t k c t +-= (C2-5)式中c 0、c t 分别为反应物过氧化氢在起始时刻和t 时刻的浓度。
反应半衰期为:112/1693.02ln k k t ==(C2-6)由反应方程式可知,在常温下,H 2O 2分解的反应速度与氧气析出的速度成正比。
析出的氧气体积可由量气管测量。
令V ∞表示H 2O 2全部分解所放出的O 2体积,V t 表示H 2O 2在t 时刻放出的O 2体积,则)(t t V V c -∝∞。
将该关系式带入(C2-5),得到∞∞+-=-V t k V V t ln )ln(1 (C2-7)本实验采用静态法测定H 2O 2分解反应速率常数,实验装置见图C2-1。


过氧化氢分解速率常数的测定Determination of H2O2Decomposit ion Rate Constant一.实验目的及要求1. 熟悉一级反应的特点2. 测定过氧化氢分解反应的速率常数和级数3. 了解各种因素对反应速率的影响4. 用图解法求过氧化氢分解反应的速率常数二.实验原理凡是反应速度只是与反应物浓度的一次方成正比的反应称为一级反应。
实验证明.过氧化氢分解的反应为如果该反应属于一级反应.则其反应速度方程应遵守下式:式中:k为反应速度常数;C t为时间为t式的反应物浓度。
将式(1)积分得:式中:为反应开始时H2O2的浓度。
如将(2)变换.可得:该式子式是lnC t~t的直线方程。
反应进行过程中.测定不同时刻t 时反应系统中H2O2的浓度C t.取得若干组C t .t数据后.以lnC t对时间t作图.可得一直线. 表明该反应为一级反应.其斜率为反应速度常数得负值-k.截距为㏑。
三.实验方法1.实验条件的设计:化学反应速度取决于许多因素.例如反应物的浓度﹑搅拌速度﹑反应压力﹑温度﹑催化剂等等。
某些催化剂可以明显地加快反应速度。
能加速H2O2分解的催化剂Pt﹑Ag﹑碘化物等等。
本实验用KI作为催化剂.在静态装置里测定H2O2分解反应的速度常数(实验装置见第三部分)。
H2O2在水溶液中分解释放出氧气的速率较慢.加入KI时.速率加快.其反应按下面的步骤进行.即KI+ H2O2====KIO+H2O (慢) (1)KIO====KI+1/2O2(快) (2)由于第一步的速率比第二步慢得多.所以第一步为反应得控制步骤。
因而可以假定其反应的速率方程式为式中.C t为反应系统中反应到t时刻H2O2浓度.因KI在反应过程中浓度不变.故上式可以简化为当 t=0时. C t=C0t=t时. C t=C t定积分式为积分结果lnC t=-kt+㏑C0(5)式(5)是lnC t~t的直线方程。
反应进行过程中.测定不同时刻t时反应系统中H2O2的浓度C t .取得若干组的数据后.以㏑C t对t 作图.得一直线.表明该反应为一级反应(准一级反应).直线斜率为-k 。


过氧化氢分解速率常数的测定Determination of H2O2Decomposit ion Rate Constant一.实验目的及要求1. 熟悉一级反应的特点2. 测定过氧化氢分解反应的速率常数和级数3. 了解各种因素对反应速率的影响4. 用图解法求过氧化氢分解反应的速率常数二.实验原理凡是反应速度只是与反应物浓度的一次方成正比的反应称为一级反应。
实验证明.过氧化氢分解的反应为如果该反应属于一级反应.则其反应速度方程应遵守下式:式中:k为反应速度常数;C t为时间为t式的反应物浓度。
将式(1)积分得:式中:为反应开始时H2O2的浓度。
如将(2)变换.可得:该式子式是lnC t~t的直线方程。
反应进行过程中.测定不同时刻t 时反应系统中H2O2的浓度C t.取得若干组C t .t数据后.以lnC t对时间t作图.可得一直线. 表明该反应为一级反应.其斜率为反应速度常数得负值-k.截距为㏑。
三.实验方法1.实验条件的设计:化学反应速度取决于许多因素.例如反应物的浓度﹑搅拌速度﹑反应压力﹑温度﹑催化剂等等。
某些催化剂可以明显地加快反应速度。
能加速H2O2分解的催化剂Pt﹑Ag﹑碘化物等等。
本实验用KI作为催化剂.在静态装置里测定H2O2分解反应的速度常数(实验装置见第三部分)。
H2O2在水溶液中分解释放出氧气的速率较慢.加入KI时.速率加快.其反应按下面的步骤进行.即KI+H2O2====KIO+H2O (慢)(1)KIO====KI+1/2O2 (快)(2)由于第一步的速率比第二步慢得多.所以第一步为反应得控制步骤。
因而可以假定其反应的速率方程式为式中.C t为反应系统中反应到t时刻H2O2浓度.因KI在反应过程中浓度不变.故上式可以简化为当t=0时. C t=C0t=t时. C t=C t 定积分式为积分结果lnC t=-kt+㏑C0(5)式(5)是 lnC t~t的直线方程。
反应进行过程中.测定不同时刻t时反应系统中H2O2的浓度 C t.取得若干组C t.t的数据后.以㏑C t对t作图.得一直线.表明该反应为一级反应(准一级反应).直线斜率为-k 。
