12.1碰撞理论
- 格式:ppt
- 大小:646.00 KB
- 文档页数:15




碰撞理论的基本概念及应用碰撞理论是一种用于研究分子和反应动力学的重要工具。
这种理论已经发展了数十年,并且是一种被广泛采用的方法来描述复杂的化学反应。
在本文中,我们将介绍碰撞理论的基本概念以及它在化学反应中的应用。
1. 碰撞理论的基本概念碰撞理论是一种关于反应速率的想法,认为反应的速率与反应物分子之间碰撞的频率和能量有关。
在碰撞理论中,反应只有在分子之间相互碰撞并且具有足够的能量时才会发生。
碰撞理论中有一个重要概念叫做活化能。
活化能是指反应物必须具有的最小能量,以便在其间发生反应。
当反应物碰撞时,它们需要一定的能量才能使他们到达一个足够的能量水平,以克服反应物之间的吸引力,从而克服其反应阈值。
这个能量称为活化能。
只有当反应物碰撞并具有这种能量时,反应才会发生。
2. 碰撞理论的应用应用碰撞理论的一个主要领域是化学动力学。
化学反应的速率取决于反应物之间相互碰撞的次数和能量。
碰撞理论将反应速率与温度,反应物浓度和反应物的能量有关。
例如,我们考虑一个具有两个不同气体的反应体系。
当这些气体相互碰撞时,反应就会发生。
反应发生的速度比较慢,原因是反应只有在两种气体分子确实相遇并且具有足够的能量时才会发生。
在实际应用中,化学反应通常是在化学反应器中进行。
反应器通常是一个带有内部加热器的容器,可以使反应物达到需要的温度。
化学反应的速率还可以通过调整反应物浓度和反应物的相对速度来控制。
另一个应用碰撞理论的领域是表面化学。
当分子吸附到固体表面时,它们将与表面上的其他分子相互作用。
表面上发生的反应速率取决于分子的相互碰撞次数和能量。
因此,表面化学反应也可以用碰撞理论来描述。
更进一步的应用是在分子碰撞反应中的仿真和计算化学。
这种技术可以用机器进行复杂的化学反应中分子之间的碰撞和反应的模拟。
这种方法非常有用,因为它可以帮助我们更好地理解反应性质,并为设计新的化学反应提供有用的见解。
3. 碰撞理论的局限性碰撞理论在描述某些化学反应时具有局限性。
物理化学讲稿第十二章化学动力学基础(二)(10学时)物理化学教研室第十二章化学动力学基础(二)(教学方案)第十二章 化学动力学基础(二)人们在测量了大量反应的速率常数,并对反应速率常数于温度的依赖关系有了相当了解以后,对于为什么会有这些宏观规律存在必须从理论给予回答。
在反应速率理论的发展过程中,先后形成了碰撞理论、过渡态理论和单分子反应理论等。
动力学理论与,发展较迟。
先后形成的碰撞理论、过渡态理论都是20世纪后建立起来的。
而且与热力学的经典理论相比尚有明显不足之处。
速度理论是研究化学反应的速率系数与温度的关系,描述反应过程的动力学性质。
速率理论的共同点:首先选定一个微观模型,用气体分子运动论(碰撞理论)或量子力学(过渡态理论)的方法,并经过统计平均,导出宏观动力学中速率系数的计算公式。
由于所采用模型的局限性,使计算值与实验值不能完全吻合,还必须引入一些校正因子,使理论的应用受到一定的限制。
§12.1 碰撞理论(Simple Collision theory )(SCT )碰撞理论是接受了阿伦尼乌斯关于“活化状态”和“活化能”概念的基础上,利用已经建立起来的气体分子运动论的基础上,在20世纪初由路易斯建立起来的。
路易斯把气相中的双分子反应看作是两个分子激烈碰撞的结果。
在这里只学习简单的硬球碰撞理论(SCT )。
气相双分子简单反应如A + B → 产物,2A → 产物。
一、碰撞理论1、微观模型(1) 反应物分子可看作简单的刚球,无内部结构; (2) 分子间除碰撞间外无其它相互作用;(3) 在反应过程中,反应分子的速率分布遵守麦克斯韦-玻耳兹曼分布。
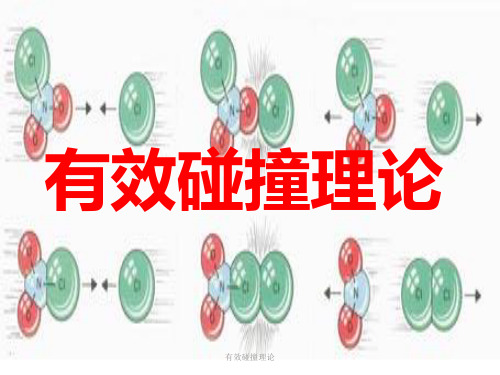
2、碰撞理论的基本要点(1) 分子必须通过碰撞才能发生反应,反应物分子间的接触碰撞是发生反应的前提。
即要反应,先碰撞;(2) 不是任何两个反应物分子碰撞都能发生反应,只有当两个反应物碰撞分子的能量超过一定的数值ε0时,并满足一定的空间配布几何条件的碰撞反应才能发生反应;(3)活化分子的能量较普通能量高,它们碰撞时,松动并部分破坏了反应物分子中的旧键,并可能形成新键,从而发生反应,这样的碰撞称为有效碰撞或非弹性碰撞,活化分子愈多,发生化学反应的可能性就愈大。