3、酶-(3)影响酶催化作用的因素
- 格式:ppt
- 大小:2.45 MB
- 文档页数:41

《酶工程》课后知识题目解析第一章酶工程基础1.名词解释:酶工程、比活力、酶活力、酶活国际单位、酶反应动力学①酶工程:由酶学与化学工程技术、基因工程技术、微生物学技术相结合而产生的一门新技术,是工业上有目的地设计一定的反应器和反应条件,利用酶的催化功能,在常温常压下催化化学反应,生产人类所需产品或服务于其它目的地一门应用技术。
②比活力:指在特定条件下,单位质量的蛋白质或RNA所拥有的酶活力单位数。
③酶活力:也称为酶活性,是指酶催化某一化学反应的能力。
其大小可用在一定条件下,酶催化某一化学反应的速度来表示,酶催化反应速度愈大,酶活力愈高。
④酶活国际单位: 1961年国际酶学会议规定:在特定条件(25℃,其它为最适条件)下,每分钟内能转化1μmol底物或催化1μmol产物形成所需要的酶量为1个酶活力单位,即为国际单位(IU)。
⑤酶反应动力学:指主要研究酶反应速度规律及各种因素对酶反应速度影响的科学。
2.说说酶的研究简史酶的研究简史如下:(1)不清楚的应用:酿酒、造酱、制饴、治病等。
(2)酶学的产生:1777年,意大利物理学家 Spallanzani 的山鹰实验;1822年,美国外科医生Beaumont 研究食物在胃里的消化;19世纪30年代,德国科学家施旺获得胃蛋白酶。
1684年,比利时医生Helment提出ferment—引起酿酒过程中物质变化的因素(酵素);1833年,法国化学家Payen和Person用酒精处理麦芽抽提液,得到淀粉酶;1878年,德国科学家K?hne提出enzyme—从活生物体中分离得到的酶,意思是“在酵母中”(希腊文)。
(3)酶学的迅速发展(理论研究):1926年,美国康乃尔大学的”独臂学者”萨姆纳博士从刀豆中提取出脲酶结晶,并证明具有蛋白质的性质;1930年,美国的生物化学家Northrop分离得到了胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶结晶,确立了酶的化学本质。
3.说说酶工程的发展概况I.酶工程发展如下:①1894年,日本的高峰让吉用米曲霉制备淀粉酶,酶技术走向商业化:②1908年,德国的Rohm用动物胰脏制得胰蛋白酶,皮革软化及洗涤;③1911年,Wallerstein从木瓜中获得木瓜蛋白酶,用于啤酒的澄清;④1949年,用微生物液体深层培养法进行-淀粉酶的发酵生产,揭开了近代酶工业的序幕;⑤1960年,法国科学家Jacob和Monod 提出的操纵子学说,阐明了酶生物合成的调节机制,通过酶的诱导和解除阻遏,可显著提高酶的产量;⑥1971年各国科学家开始使用“酶工程”这一名词。



第一章绪论一、名词解释1、酶: 是具有生物催化功能的生物大分子2、酶工程:酶的生产与应用的技术过程称为酶工程。
它是利用酶的催化作用进行物质转化的技术,是将酶学理论与化工技术、微生物技术结合而形成的新技术,是借助工程学手段利用酶或细胞、细胞器的特定功能提供产品的一门科学3、核酸类酶:为一类具有生物催化功能的核糖核酸分子。
它可以催化本身RNA 剪切或剪接作用,还可以催化其他RNA,DNA多糖,酯类等分子进行反应4、蛋白类酶:为一类具有生物催化功能的蛋白质分子,它只能催化其他分子进行反应。
5、酶的生产:是指通过人工操作获得所需酶的技术过程。
主要包括微生物发酵产酶,动植物培养产酶,酶提取和分离纯化等6、酶的改性是通过各种方法改进酶的催化特性的技术过程,主要包括酶分子的修饰,酶固定化,酶非水相催化等7、酶的应用:是通过酶的催化作用获得人们所需要的物质或者不良物质的技术过程,主要包括酶反应器的选择和设计以及酶在各领域的应用等。
8、酶的专一性:又称为特异性,是指酶在催化生化反应时对底物的选择性,即在一定条件下,一种酶只能催化一种或一类结构相似的底物进行某种类型反应的特性。
亦即酶只能催化某一类或某一种化学反应.9、酶的转换数:酶的转换数Kp。
又称为摩尔催化活性,是指每个酶分子每分钟催化底物转化的分子数二、填空题1、根据分子中起催化作用的主要组分的不同,酶可以分为_________和____________两大类。
2、核酸类酶分子中起催化作用的主要组分是__________,蛋白类酶分子中起催化作用的主要组分是________________.3、进行分子内催化作用的核酸类酶可以分为________________,_________________。
4、酶活力是_______________的量度指标,酶的比活力是_______________的量度指标,酶的转换数的主要组分是________________的度量指标。


第一章1.酶是具有生物催化功能的生物大分子。
2.酶活力是指在一定条件下,酶所催化的反应初速度。
3酶活力单位:在特定条件下(温度可采用25℃,pH值等条件均采用最适条件),每1min催化1µmol的底物转为产物的酶量定义为一个酶活力单位,这个单位称为国际单位(IU)。
4酶转换数Kp,又称为摩尔催化活性,是指每个酶分子每分钟催化底物转化的分子数。
即每摩尔酶每分钟催化底物转化为产物的摩尔数,是酶催化效率的一个指标。
5转换数的倒数称为酶的催化周期,即催化周期是指酶进行一次催化所需的时间,单位为毫秒(ms)或微秒(µs)的。
6酶结合效率又称为酶的固定化效率,是指酶与载体结合的百分率。
酶结合效率的计算一般由固定化的总活力减去未结合的酶活力所得到的差值,再除以用于固定化的总酶活力而得到。
7酶活力回收率是指固定化酶的总活力与用于固定化的总酶活力的百分率。
8.核酸酶(ribozyme):即具有催化活性的RNA。
抗体酶(Abzyme):具有催化活力的抗体。
9.酶催化作用的特点(一)、酶催化作用的专一性强:酶的专一性是指在一定的条件下,一种酶只能催化一种或一类结构相似的底物进行某种类型反应的特性。
①绝对专一性:一种酶只能催化一种底物进行一种反应,这种高度的专一性称为绝对专一性。
②相对专一性:一种酶能够催化一类结构相似的底物进行某种相同类型的反应,这种专一性称为相对专一性。
(二)、酶催化作用的效率高:酶催化效率高,比非酶催化反应的速度高107~1013倍。
(三)、酶催化作用的条件温和:酶的催化作用一般都在常温、常压、pH值近乎中性的条件下进行。
(四)酶活性受到调节和控制10. 影响酶催化作用的因素①、底物浓度的影响②、酶浓度的影响③、产物浓度的影响④、温度的影响⑤、pH值的影响⑥、抑制剂的影响⑦、激活剂的影响11从如下实验方法和结果分析酶生物合成的调节作用。
实验方法:将大肠杆菌细胞接种于营养肉汤培养中,于37℃振荡培养,当OD550达到0.3左右时,将培养液分装到4个小三角瓶中,每瓶17ml培养液。

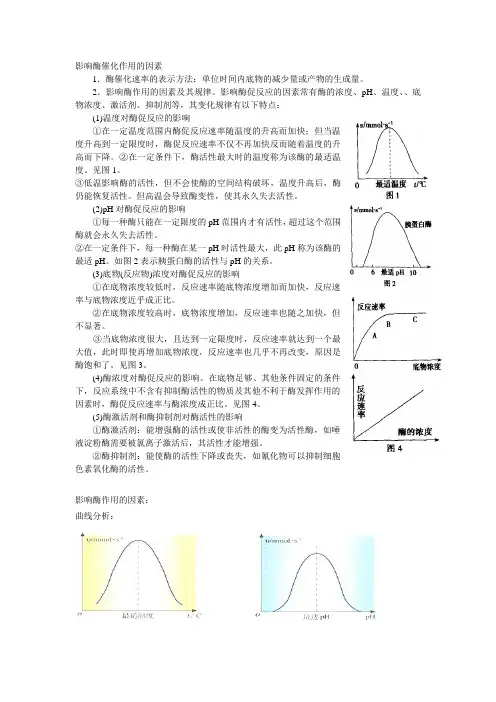
影响酶催化作用的因素1.酶催化速率的表示方法:单位时间内底物的减少量或产物的生成量。
2.影响酶作用的因素及其规律。
影响酶促反应的因素常有酶的浓度、pH、温度、、底物浓度、激活剂、抑制剂等,其变化规律有以下特点:(1)温度对酶促反应的影响①在一定温度范围内酶促反应速率随温度的升高而加快;但当温度升高到一定限度时,酶促反应速率不仅不再加快反而随着温度的升高而下降。
②在一定条件下,酶活性最大时的温度称为该酶的最适温度。
见图1。
③低温影响酶的活性,但不会使酶的空间结构破坏,温度升高后,酶仍能恢复活性。
但高温会导致酶变性,使其永久失去活性。
(2)pH对酶促反应的影响①每一种酶只能在一定限度的pH范围内才有活性,超过这个范围酶就会永久失去活性。
②在一定条件下,每一种酶在某一pH时活性最大,此pH称为该酶的最适pH。
如图2表示胰蛋白酶的活性与pH的关系。
(3)底物(反应物)浓度对酶促反应的影响①在底物浓度较低时,反应速率随底物浓度增加而加快,反应速率与底物浓度近乎成正比。
②在底物浓度较高时,底物浓度增加,反应速率也随之加快,但不显著。
③当底物浓度很大,且达到一定限度时,反应速率就达到一个最大值,此时即使再增加底物浓度,反应速率也几乎不再改变,原因是酶饱和了。
见图3。
(4)酶浓度对酶促反应的影响。
在底物足够、其他条件固定的条件下,反应系统中不含有抑制酶活性的物质及其他不利于酶发挥作用的因素时,酶促反应速率与酶浓度成正比。
见图4。
(5)酶激活剂和酶抑制剂对酶活性的影响①酶激活剂:能增强酶的活性或使非活性的酶变为活性酶,如唾液淀粉酶需要被氯离子激活后,其活性才能增强。
②酶抑制剂:能使酶的活性下降或丧失,如氰化物可以抑制细胞色素氧化酶的活性。
影响酶作用的因素:曲线分析:曲线含义的准确表述:B 点:该酶发挥催化作用的最适温度或最适pH 值AB 段:达到最适温度(pH 值)前,随着温度(pH 值)升高,酶的催化效率提高酶的最适pH 值往往随底物种类、浓度等的变化而不同,因此,并不是一个常数,只是在一定条件下才有意义。

第一章绪论【内容提要】1.重点介绍酶和酶工程的研究简史和发展概况;2.简要回顾酶催化特点、影响酶活性的因素、测定酶活力方法以及酶反应动力学。
【习题】一、名词解释酶工程;转换数;催化周期;比活力;酶活力;酶活国际单位;酶反应动力学异构酶变构酶核酶抗体酶竞争性抑制反竞争性抑制非竞争性抑制酶结合效率酶活力回收率固定化酶的相对酶活力二、填空1.酶是具有功能的生物大分子。
2.酶催化作用的专一性包括和。
3.影响酶催化作用的因素有、、、、、。
4.按照酶分子中起催化作用的主要组分不同可分为和。
5.分子内催化的R酶可分为和。
6.分子间催化的R酶可分为、、、、、。
7.固定化酶的活力测定方法主要有、和。
8.固定化酶的比活力一般用所具有的酶活力单位数来表示。
9.酶的生产方法主要有、和。
三、判断1.核酸类酶的作用底物均为核酸2.核酸类酶仅能作用于其他分子3.核酸类酶可以以DNA为底物4.酶的化学本质是蛋白质五、简答题1. 简述酶的研究简史。
2. 简述酶工程的发展概况。
3. 简要回答酶的催化特点。
4. 简要回答影响酶催化作用的因素。
5. 简要回答米氏方程的意义。
6. 简述酶工程的研究内容及主要任务。
答案:酶的生产与应用的技术过程称为酶工程,其主要内容包括酶的生产、分离纯化、酶的固定化、酶及固定化的反应器、酶和固定化酶的应用。
7. 举例说明酶活力的测定在酶的研究、生产和应用过程中的重要性。
酶活力是指在一定条件下,酶催化某一反应的反应速度(一般测初速度)。
酶促反应速度是指单位时间、单位体积中底物的减少量或产物的增加量。
单位:浓度/单位时间(2分)酶的活力单位(U)国际单位(IU单位):在最适反应条件下,每分钟催化1umol底物转化为产物所需的酶量,称一个国际单位(IU),1 IU = 1umol /min国际单位(Katal, Kat单位):在在最适反应条件下,每秒钟催化1mol底物转化为产物所需的酶量,称Kat单位。
1 Kat=60 X 106 IU酶活力的测定方法:分光光度法;荧光法;同位素法;电化学法。

![[工学]《酶工程》教案](https://uimg.taocdn.com/9fe9e605a31614791711cc7931b765ce05087abe.webp)
《酶工程》教案安排:本课总学时为48,其中理论课40,实验课8,周学时为3学时。
要求:要求同学们课前预习教材,带着问题听课,这样学习效果好;学生上课作笔记,动动脑;学生课后复习和整理笔记,教师作课后小结和布置作业,达到教学相长的目的。
绪论1教学目标:使学生掌握酶、酶工程的概念,酶的化学性质与催化特性,了解酶的分类与命、酶活力测定、酶的生产方法。
2教学内容:主要讲酶和酶工程的基本概念与发展史、影响酶催化作用的因素、酶的分类与命名、酶的化学性质与催化特性、酶活力测定、酶的生产方法。
3重点和难点:酶、酶工程、酶活力有关的概念;酶的化学性质与催化特性、酶活力测定。
4教学方法:采用讲授式、启发式、图示法、问答式相结合的教学方法。
5板书设计:从上至下,从左至右;大标题始终留在黑板的左边;书写规范。
6学时分配:理论3学时,实验2学时。
7教学进程:第一节酶和酶工程的基本概念与发展史1酶的基本概念酶是生物体内进行新陈代谢不可缺少的受多种因素调节控制的具有催化能力的生物催化剂。
按化学组成分:蛋白类酶(Enzyme proteins)和核酸类酶(Ribozyme RNAs)。
a蛋白类酶(Enzyme proteins)酶是由生物体产生的具有催化活性的蛋白质。
b核酸类酶(Ribozyme RNAs)本身就是一段RNA,不需要额外的蛋白酶就可以对自身进行剪切。
提问:酶一定是蛋白质吗?2酶的发展史1.2.1酶在中国的发展史人们对酶的认识起源于生产与生活实践。
夏禹时代,人们掌握了酿酒技术。
公元前12世纪周朝,人们酿酒,制作饴糖和酱。
春秋战国时期已知用麴(曲)治疗消化不良的疾病。
酶者,酒母也。
1.2.2酶在西方的发展史1878年, 给酶一个统一的名词,叫Enzyme,这个字来自希腊文,其意思“在酵母中”。
1896年,日本的高峰让吉首先从米曲霉中制得高峰淀粉酶,用作消化剂,开创了有目的的进行酶生产和应用的先例。
西方国家19世纪对酿酒发酵过程进行了大量研究。
酶作为生物催化剂的特点:1,用量少而催化效率高;2,专一性高;3,反应条件温和4,可调节性影响酶催化作用的因素:1,底物浓度对酶促反应速度的影响在低底物浓度时, 反应速度与底物浓度成正比,表现为一级反应特征。
当底物浓度达到一定值,几乎所有的酶都与底物结合后,反应速度达到最大值(Vmax),此时再增加底物浓度,反应速度不再增加,表现为零级反应。
2. pH 的影响在一定的pH 下, 酶具有最大的催化活性,通常称此pH 为最适pH。
pH影响酶活力的原因可能有以下几个方面:(1)过酸或过碱可以使酶的空间结构破坏,引起酶构象的改变,酶活性丧失。
(2)当pH改变不很剧烈时,酶虽未变性,但活力受到影响。
(3)pH影响维持酶分子空间结构的有关基团解离,从而影响了酶活性部位的构象,进而影响酶的活性3. 温度的影响一方面是温度升高,酶促反应速度加快。
另一方面,温度升高,酶的高级结构将发生变化或变性,导致酶活性降低甚至丧失。
因此大多数酶都有一个最适温度。
在最适温度条件下,反应速度最大。
4.酶浓度的影响在一个反应体系中,当[S]>>[E]反应速率随酶浓度的增加而增加(v=k[E]),这是酶活测定的基础之一。
5 抑制剂对酶活性的影响使酶的活性降低或丧失的现象,称为酶的抑制作用。
能够引起酶的抑制作用的化合物则称为抑制剂酶的抑制剂一般具备两个方面的特点:a.在化学结构上与被抑制的底物分子或底物的过渡状态相似。
能够与酶的活性中心以非共价或共价的方式形成比较稳定的复合体或结合物。
6.激活剂对酶反应的影响凡能提高酶活力的物质都称为激活剂,有的酶反应的系统需要一定的激活剂。
酶的分类与命名(1) 氧化还原酶AH2 + B = A +BH2主要包括脱氢酶(dehydrogenase)和氧化酶例,醇+NAD+=醛或酮+NADH +H+→氢供体是醇,氢受体是NAD+系统命名→醇:NAD+氧化还原酶;推荐名→采用某供体脱氢酶,如醇脱氢酶(2) 转移酶AB +C =A +BC系统命名:“供体:受体某基团转移酶”。
第一章绪论一.1 酶的变性与失活失活作用:凡可使酶蛋白变性而引起酶活力丧失的作用称为酶的失活作用。
2 酶的回收率与纯化比3 酶的结合效率及酶活力回收率酶的结合效率又称酶的固定化率,是指酶与载体结合的百分率酶的结合效率=(加入的总酶活力-未结合的酶活力)/加入的总酶活力*100%酶活力回收率是指固定化酶的总活力与用于固定化的总酶活力的百分率酶活力回收率=固定化酶总活力/用于固定化的总酶活力*100%4 底物抑制及其产生的三个原因(1)、竟争性抑制某些抑制剂的化学结构与底物相似,因而能与底物竟争与酶活性中心结合。
当抑制剂与活性中心结合后,底物被排斥在反应中心之外,其结果是酶促反应被抑制了(2)、非竟争性抑制酶可以同时与底物及抑制剂结合,但是,中间产物ESI不能进一步分解为产物,因此,酶的活性降低。
(3)、反竞争性抑制作用酶只有在与底物结合后,才能与抑制剂结合,引起酶活性下降。
二.1 什么是酶工程?酶工程(Enzyme Engineering))又称为酶技术,是指酶的生产与应用的技术过程。
是将酶学理论与化工技术、微生物技术结合起来利用酶的催化作用进行物质转化的技术它是借助工程学手段利用酶或细胞、细胞器的特定功能提供产品的一门科学。
就酶工程本身的发展来说,包括下列主要内容:酶的产生、酶的制备、酶和细胞固定化、酶分子改造、有机介质中的酶反应、酶传感器、酶反应器、抗体酶、人工酶和模拟酶2 什么是酶的最适PH及其影响酶的反应机理在一定的pH 下, 酶具有最大的催化活性,通常称此pH 为最适pH(optimum pH)。
a.过酸或过碱影响酶蛋白的构象,使酶变性失活。
b.影响酶分子中某些基团的解离状态(活性中心的基团或维持构象的一些基团)c.影响底物分子的解离状态故酶反应一般在一定的缓冲液体系中进行3 简述酶活力的测定方法(要求:快速,两个阶段,四个步骤)要求:快速、简便、准确两个阶段:酶在一定条件下与底物反应一段时间然后再测定反应物中底物或产物的浓度变化量。