物理化学中科大第六章反应的标准自由能变化
- 格式:ppt
- 大小:412.50 KB
- 文档页数:39

化学反应中的自由能变化与反应方向实验在化学反应中,自由能变化与反应方向是两个重要的概念。
自由能变化是指反应前后的能量差异,而反应方向则决定了反应是朝着生成产物的方向进行还是向着反应物进行。
为了研究化学反应的自由能变化与反应方向,科学家们进行了一系列的实验。
一、实验目的本实验的目的是通过测量不同反应物浓度下反应的自由能变化,来探究化学反应中自由能的变化与反应方向的关系。
二、实验原理化学反应的自由能可以通过吉布斯自由能(ΔG)来表示,其计算公式为ΔG = ΔH - TΔS,其中ΔH为反应焓变,ΔS为反应熵变,T为温度。
根据吉布斯自由能变化的正负可以判断反应方向:当ΔG < 0时,反应是自发的,趋向生成产物;当ΔG > 0时,反应是不自发的,趋向反应物;当ΔG = 0时,反应处于平衡状态。
三、实验步骤1. 准备实验装置:取一个试管,加入适量的反应物A和反应物B,装置好实验装置,并接上温度控制装置(热水浴)。
2. 测量温度:将温度计放入反应物溶液中,测量初始温度,记录下来。
3. 开始反应:开启温度控制装置,将反应物溶液加热至一定温度。
4. 观察反应:观察反应过程中的颜色变化、气体释放等现象,并记录下来。
5. 停止反应:当反应完成或反应时间到达预设时间后,停止加热,将温度控制装置关闭,待溶液冷却至室温。
6. 测量温度:用温度计测量反应结束后的溶液温度,并记录下来。
7. 重复实验:按照不同浓度的反应物A和反应物B的比例,重复步骤1-6,记录对应的温度和反应观察结果。
四、实验数据处理与分析根据实验得到的温度变化数据,可以计算反应的ΔH值。
根据观察到的颜色变化、气体释放等现象,可以初步判断反应的熵变ΔS的正负。
通过实验数据计算得到ΔH和ΔS的数值,代入吉布斯自由能计算公式ΔG = ΔH - TΔS,可以得到不同温度下的吉布斯自由能变化ΔG。
根据ΔG值的正负判断反应的方向:当ΔG < 0时,反应是自发的,趋向生成产物;当ΔG > 0时,反应是不自发的,趋向反应物;当ΔG = 0时,反应处于平衡状态。

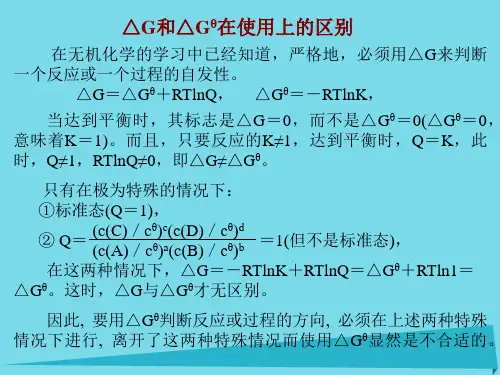
3标准摩尔吉布斯自由能变()的计算和反应方向的判断标准态时,吉布斯公式(2.1.2)变为:=- T(2.1.3)显然,等温、等压下反应在标准态时自发反应判据是: < 0除可根据式(2.1.3)求算外,还可由标准摩尔生成吉布斯自由能求算。
在标准态下,由最稳定的纯态单质生成单位物质的量的某物质时的吉布斯自由能变称为该物质的标准摩尔生成吉布斯自由能(以表示)。
根据此定义,不难理解,任何最稳定的纯态单质(如石墨、银、铜、氢气等)在任何温度下的标准摩尔生成吉布斯自由能均为零。
反应的吉布斯自由能变()与反应焓变()、熵变()的计算原则相同,即与反应的始态和终态有关,与反应的具体途径无关。
在标准态下,反应的标准摩尔吉布斯自由能变()可按下式计算:=Σνi(生成物) + Σνi(反应物) (2.1.4) 这里需要指出,由于温度对焓变和熵变的影响较小,通常可认为(T) ≈(298.15K)、(T) ≈ (298.15K)这样任一温度T时的标准摩尔吉布斯自由能变可按下式作近似计算:(T) =(T) - T(T) ≈ (298.15K) - T(298.15K) (2.1.5) 4非标准态摩尔吉布斯自由能变(Δr G m)的计算和反应方向的判断在实际中的很多化学反应常常是在非标准态下进行的。
在等温等压及非标准态下,对任一反应来说:c C +d D─→ y Y +z Z根据热力学推导,反应摩尔吉布斯自由能变有如下关系式:Δr G m = + RT ln J(2.1.6) 此式称为化学反应等温方程式,式中J为反应商。
对于气体反应:对于水溶液中的(离子)反应:由于固态或液态处于标准态与否对反应的Δr G m影响较小,故它们在反应商(J)式中不出现。
例如反应:MnO2(s) + 4H+(aq) + 2Cl-(aq)─→ Mn2+(aq) + Cl2(g) + 2H2O (l)非标态时:Δr G m = + RT ln J其中:。

标准吉布斯自由能变吉布斯自由能变是指系统在恒温、恒容条件下,由于不同相之间的平衡条件不同而引起的相变。
标准吉布斯自由能变是指在标准状态下,系统由一种物质转变为另一种物质时,系统的吉布斯自由能的变化。
吉布斯自由能是描述系统能量变化和非体积功的重要物理量,而标准吉布斯自由能变则是描述在标准状态下物质相变的重要物理量。
在化学和物理学中,标准吉布斯自由能变常常用于描述化学反应和相变过程中系统的能量变化。
在标准状态下,物质的吉布斯自由能可以通过热力学表得到,从而可以计算出物质在不同相变过程中的标准吉布斯自由能变化。
标准吉布斯自由能变的计算可以通过以下公式得到:ΔG° = ΔH° TΔS°。
其中,ΔG°表示标准吉布斯自由能变,ΔH°表示标准焓变,T 表示温度,ΔS°表示标准熵变。
通过这个公式,我们可以计算出系统在标准状态下的吉布斯自由能变化,从而可以了解系统在不同相变过程中的能量变化情况。
标准吉布斯自由能变的计算对于化学反应和相变过程的研究具有重要意义。
通过计算标准吉布斯自由能变化,我们可以预测化学反应和相变过程是否会发生,以及发生的方向和速率。
这对于工业生产和科学研究都具有重要意义。
此外,标准吉布斯自由能变也可以用于比较不同物质之间的相变过程。
通过计算不同物质的标准吉布斯自由能变化,我们可以了解不同物质之间的相变条件和能量变化情况,从而可以选择合适的材料用于特定的工艺和应用。
总之,标准吉布斯自由能变是描述化学反应和相变过程中系统能量变化的重要物理量,它的计算和应用对于化学工业和科学研究具有重要意义。
通过对标准吉布斯自由能变的研究和应用,我们可以更好地理解物质的相变规律,为工业生产和科学研究提供重要参考。


标准吉布斯自由能变吉布斯自由能变(Gibbs free energy change)是热力学中一个重要的概念,它描述了在恒温恒压条件下系统发生化学反应时的自由能变化。
自由能是描述系统能量转化和可用能量的指标,而吉布斯自由能变则是描述了系统在化学反应中的可用能量变化情况。
在化学工程、生物化学、环境科学等领域,吉布斯自由能变的概念都有着重要的应用价值。
吉布斯自由能变的计算公式为ΔG=ΔH-TΔS,其中ΔG表示吉布斯自由能变,ΔH表示焓变,T表示温度,ΔS表示熵变。
通过这个公式,我们可以了解系统在化学反应中的自由能变化情况。
当ΔG小于0时,化学反应是自发进行的;当ΔG等于0时,系统处于平衡状态;当ΔG大于0时,化学反应是不自发进行的。
在实际应用中,我们可以利用吉布斯自由能变来预测化学反应的进行方向以及反应的平衡位置。
通过对反应物和产物的热力学性质进行分析,我们可以计算出吉布斯自由能变的大小,从而判断反应的进行方向。
这对于化学工程领域的反应设计和优化具有重要意义。
此外,吉布斯自由能变还可以帮助我们理解生物体内的代谢过程。
生物体内的化学反应同样受到吉布斯自由能变的影响,通过对代谢途径中各个反应的吉布斯自由能变进行分析,我们可以了解生物体内能量转化的方式以及代谢途径的调控机制。
这对于生物化学领域的研究具有重要意义。
在环境科学领域,吉布斯自由能变也被广泛应用于描述环境中的化学反应和平衡。
例如在水体中溶解气体的过程中,可以利用吉布斯自由能变来预测气体的溶解度,从而帮助我们理解水体中的气体平衡以及环境中的气体交换过程。
总之,吉布斯自由能变是热力学中一个重要的概念,它在化学工程、生物化学、环境科学等领域都有着重要的应用价值。
通过对吉布斯自由能变的理解和应用,我们可以更好地理解化学反应和能量转化的规律,为相关领域的研究和应用提供重要的理论支持。

化学反应中的自由能变化与反应方向实验相关应用与案例分析自由能变化是描述化学反应方向和能量变化的重要概念,它在化学实验和应用中有着广泛的应用。
本文将通过分析一些相关实验和案例,探讨在化学反应中如何利用自由能变化来确定反应方向和评估反应条件。
一、热力学自由能变化与反应方向在化学反应中,反应物的自由能变化(△G)可以用来判断反应的方向。
当△G为负值时,反应是自发进行的,反应物转变为生成物。
反之,当△G为正值,则反应是不自发的,生成物会转变回反应物。
当△G等于零时,反应处于平衡状态。
二、实验方法一:酶催化反应中的自由能变化酶催化反应是生物化学中常见的一类反应,其中酶通过降低活化能来加速反应。
在实验中,可通过测量反应物和生成物的浓度变化来计算反应的△G值。
例如,在酶催化的葡萄糖氧化反应中,可以测量反应物葡萄糖和辅酶NAD+的浓度变化。
根据反应物和生成物的浓度差别,可以计算出△G,从而确定该反应是否能够自发进行。
三、实验方法二:电化学反应中的自由能变化电化学反应中的自由能变化与电池电势有关。
在实验中,可以通过测量电池的电势变化来计算△G值。
例如,在锌和铜的电池中,可以测量电池两端的电势差。
利用Nernst方程,可以将电池电势转化为△G值。
如果△G为负值,则反应自发进行;如果△G为正值,则反应是不自发的。
通过这种方法,可以对电化学反应的方向进行判断。
四、案例分析一:氧化还原反应中的自由能变化氧化还原反应是化学反应中一类重要的反应类型,其中电子的转移导致反应物的氧化和还原。
自由能变化在氧化还原反应中有着重要的应用。
例如,在铁的氧化反应中,铁原子失去电子氧化成Fe2+离子,可以根据Fe3+和Fe2+的自由能来计算△G。
如果△G为负值,则该反应是自发进行的,反之则是不自发的。
五、案例分析二:化学平衡与自由能变化化学平衡是指反应物和生成物浓度达到稳定状态的情况,自由能变化在化学平衡的研究中具有重要意义。
例如,在H2和I2的反应中,可以通过测量各组分的浓度变化来计算反应的△G。

标准摩尔吉布斯自由能变标准摩尔吉布斯自由能变是化学领域中一个重要的概念,它描述了在一定温度和压力下,物质的自由能与其摩尔数的关系。
在化学反应中,了解和计算标准摩尔吉布斯自由能变对于预测反应的方向和速率至关重要。
首先,让我们来了解一下什么是自由能。
自由能是指在恒定温度和压力下,系统能够做功的最大能量,也可以理解为系统可以释放的能量。
而标准摩尔吉布斯自由能变则是指在标准状态下,物质参与化学反应时的自由能变化。
在标准状态下,气体的摩尔吉布斯自由能为零,这是因为在标准状态下,气体的压强为1个大气压,温度为298K。
因此,标准状态下的物质的自由能可以通过实验测定或计算得出。
标准摩尔吉布斯自由能变可以通过以下公式进行计算:ΔG° = ΔH° TΔS°。
其中,ΔG°表示标准摩尔吉布斯自由能变,ΔH°表示标准焓变,T表示温度,ΔS°表示标准熵变。
通过这个公式,我们可以看出标准摩尔吉布斯自由能变与焓变、熵变以及温度之间存在着密切的关系。
当ΔG°为负值时,表示反应是自发进行的,当ΔG°为正值时,表示反应是不自发进行的。
而当ΔG°等于零时,则表示系统处于平衡状态。
在实际应用中,我们可以利用标准摩尔吉布斯自由能变来预测化学反应的方向。
如果一个化学反应的标准摩尔吉布斯自由能变为负值,那么这个反应是自发进行的,反之则是不自发进行的。
这为化学工程师们设计和优化工业生产过程提供了重要的理论依据。
除了预测反应的方向外,标准摩尔吉布斯自由能变还可以用来计算反应的平衡常数。
根据ΔG°与反应的平衡常数K之间的关系,我们可以通过ΔG°来推断反应的平衡位置,从而更好地控制和调节化学反应的平衡。
总之,标准摩尔吉布斯自由能变是化学领域中一个重要的概念,它不仅可以帮助我们理解化学反应的方向和速率,还可以为工业生产和实验室研究提供重要的指导。


化学反应中的自由能变化一、自由能的定义自由能是一个系统的最大可能做功能力,是热力学中一个非常重要的概念。
在化学反应中,自由能的变化可以反映出反应的进行方向和能量变化。
二、自由能变化与反应自发进行的关系一个化学反应是否自发进行,可以通过自由能变化来判断。
当一个化学反应的自由能变化为负值时,说明反应是自发的;当自由能变化为正值时,反应是非自发的。
三、自由能变化与反应热的关系自由能变化与反应热有密切的关系。
一个化学反应的自由能变化等于反应热与反应熵变的和。
即:[ G = H - TS ]其中,( G ) 表示自由能变化,( H ) 表示反应热,( T ) 表示温度,( S ) 表示反应熵变。
四、自由能变化与能量转化的关系化学反应中的自由能变化反映了反应物和生成物之间能量的转化。
自由能变化为负值的反应,说明反应物中的能量转化为生成物中的能量;自由能变化为正值的反应,说明生成物中的能量转化为反应物中的能量。
五、自由能变化与化学势的关系自由能变化与化学势也有密切的关系。
一个化学反应的自由能变化等于反应物化学势的降低与生成物化学势的升高的差。
即:[ G = _f - _i ]其中,( G ) 表示自由能变化,( _f ) 表示生成物的化学势,( _i ) 表示反应物的化学势。
六、自由能变化在实际应用中的例子自由能变化在实际应用中有很多例子,如:1.燃烧反应:燃烧反应的自由能变化为负值,说明燃烧过程中,化学能转化为热能和光能;2.电池反应:电池反应的自由能变化为负值,说明电池放电过程中,化学能转化为电能;3.蛋白质折叠:蛋白质折叠的自由能变化为负值,说明折叠过程中,无规则的热运动能转化为蛋白质的空间能。
综上所述,化学反应中的自由能变化是一个非常重要的概念,它反映了反应的进行方向、能量变化以及能量转化。
掌握自由能变化的相关知识,有助于我们深入理解化学反应的本质。
习题及方法:1.习题:判断以下反应是否自发进行:2H2(g) + O2(g) = 2H2O(l)解题方法:首先计算反应的ΔG值,然后判断ΔG是否小于0。

标准生成自由能
标准生成自由能(ΔG°)是指在标准状况下,一摩尔物质在其
标准状态下生成的自由能变化。
标准状态是指物质在1个大气压下
的纯物质的状态。
ΔG°可以通过下面的公式来计算:
ΔG° = ΔH° TΔS°。
其中,ΔH°代表在标准状态下反应的焓变,T代表温度(单位
为开尔文),ΔS°代表在标准状态下反应的熵变。
根据这个公式,
我们可以看到标准生成自由能与焓变和熵变之间的关系。
在化学反应中,ΔG°可以用来判断一个反应是否是自发进行的。
当ΔG°小于0时,反应是自发进行的,即反应会朝着生成物的方
向进行。
当ΔG°等于0时,反应处于平衡状态,生成物和反应物
的浓度不再发生变化。
当ΔG°大于0时,反应是不自发进行的,
即需要外界提供能量才能进行。
对于工程设计来说,标准生成自由能的计算可以帮助工程师选
择最合适的反应条件,以便最大限度地提高反应的产率和效率。
此外,对于工业生产来说,通过控制反应条件来使ΔG°保持在一个
合适的范围内,可以最大限度地减少能量损耗,提高生产效率。
总之,标准生成自由能是一个非常重要的热力学概念,它在化学反应和工程设计中起着至关重要的作用。
通过对标准生成自由能的理解和计算,我们可以更好地控制化学反应的进行,提高生产效率,减少能量损耗,为工程设计和工业生产提供更好的支持。
希望本文能够帮助读者更好地理解标准生成自由能的概念和应用。
第四章 化学平衡4.1 化学平衡的条件和反应的亲和势1.化学反应体系: 封闭的单相体系,不作非膨胀功,发生了一个化学反应,设为:D E F G d e f g ++⋅⋅⋅→++⋅⋅⋅各物质的变化量必须满足 B B0B ν=∑根据反应进度的定义,可以得到: B B d d n ξν=B B d d n νξ=2. 热力学基本方程B B B d d d d G S T V p n μ=-++∑等温、等压条件下,,B B B B B Bd d d T p G n μνμξ==∑∑() B B (d d )n νξ= ,B B B() T p G νμξ∂=∂∑ (a) 当 1 mol ξ=时:r m ,B B BT p G νμ∆=∑() (b)这两个公式适用条件:(1) 等温、等压、不作非膨胀功的一个化学反应;(2) 反应过程中,各物质的化学势保持不变。
公式(a )表示有限体系中发生微小的变化;公式(b)表示在大量的体系中发生了反应进度等于1 mol 的变化。
这时各物质的浓度基本不变,化学势也保持不变。
3. 化学反应的方向与限度 用,B r m ,B() , ()T p B T p G G νμξ∂∆∂∑ 或 判断都是等效的。
r m ,()0T p G ∆< 反应自发地向右进行r m ,()0T p G ∆> 反应自发地向左进行,不可能自发向右进行r m ,()0T p G ∆= 反应达到平衡 用,()T p G ξ∂∂判断,这相当于~G ξ图上曲线的斜率,因为是微小变化,反应进度处于0~1 mol 之间。
,()0T p G ξ∂<∂ 反应自发向右进行,趋向平衡 ,()0T p G ξ∂>∂ 反应自发向左进行,趋向平衡 ,()0T p G ξ∂=∂ 反应达到平衡4. 为什么化学反应通常不能进行到底?严格讲,反应物与产物处于同一体系的反应都是可逆的,不能进行到底。
只有逆反应与正反应相比小到可以忽略不计的反应,可以粗略地认为可以进行到底。
第七单元 生物氧化一、生物能学的几个概念〔一〕化学反响中的自由能变化及其意义1.化学反响中的自由能自由能:在一个体系中,能够用来做有用功的那一局部能量称自由能,用符号G 表示。
在恒温、恒压下进行的化学反响,其产生有用功的能力可以用反响前后自由能的变化来衡量。
自由能的变化:△G = G 产物 — G 反响物 = △H _ T △S△G 代表体系的自由能变化,△H 代表体系的焓变化,T 代表体系的绝对温度,△S 代表体系的熵变化。
焓与熵都是体系的状态函数。
焓代表体系的内能与压力P 乘以体积V 之和:H = U + PV ,dH = dU + PdV + VdP熵代表体系中能量的分散程度,也就是体系的无序程度:△S = dQ /T ,△S = △S 体系+△S 环境 ,只有△S ≥0,过程才能自发进行。
2.△G 是判断一个过程能否自发进行的根据△G<0,反响能自发进行,能做有用功。
△G>0,反响不能自发进行,必须供应能量。
△G=0,反响处于平衡状态。
一个放热反响(或吸热反响)的总热量的变化〔△H 〕,不能作为此反响能否自发进行的判据,只有自由能的变化才是唯一准确的指标。
△G<0仅是反响能自发进行的必要条件,有的反响还需催化剂才能进行,催化剂〔酶〕只能催化自由能变化为负值的反响,如果一个反响的自由能变化为正值,酶也无能为力。
当△G 为正值时,反响体系为吸能反响,此时只有与放能反响相偶联,反响才能进行。
3.标准自由能变化及其与化学反响平衡常数的关系aA+bB →cC+dD标准自由内能变化:在规定的标准条件下的自由能变化,用△G°表示。
标准条件:25℃,参加反响的物质的浓度都是1mol∕L〔气体那么是1大气压〕。
假设同时定义pH =7.0,那么标准自由能变化用△G°′表示。
△G°′=-GTln K/K/是化学反响的平衡常数,因此,△G°/ 也是一个常数。
3标准摩尔吉布斯自由能变()的计算和反应方向的判断=- T显然,等温、等压下反应在标准态时自发反应判据是: < 0求算。
在标准态下,由最稳定的纯态单质生成单位物质的量的某物质时的吉布斯自由能变称为该物质的标准摩尔生成吉布斯自由能(以表示)。
根据此定义,不难理解,任何最稳定的纯态单质(如石墨、银、铜、氢气等)在任何温度下的标准摩尔生成吉布斯自由能均为零。
反应的吉布斯自由能变()与反应焓变()、熵变()的计算原则相同,即与反应的始态和终态有关,与反应的具体途径无关。
在标准态下,反应的标准摩尔吉布斯自由能变()可按下式计算:=Σνi(生成物) + Σνi(反应物)这里需要指出,由于温度对焓变和熵变的影响较小,通常可认为(T) ≈ (298.15K)、(T) ≈ (298.15K)这样任一温度T时的标准摩尔吉布斯自由能变可按下式作近似计算:(T) =(T) - T(T) ≈ (298.15K) - T(298.15K)4非标准态摩尔吉布斯自由能变(Δr G m)的计算和反应方向的判断在实际中的很多化学反应常常是在非标准态下进行的。
在等温等压及非标准态下,对任一反应来说:c C +d D─→ y Y +z Z根据热力学推导,反应摩尔吉布斯自由能变有如下关系式:Δr G m = + RT ln J此式称为化学反应等温方程式,式中J为反应商。
对于气体反应:对于水溶液中的(离子)反应:由于固态或液态处于标准态与否对反应的Δr G m影响较小,故它们在反应商(J)式中不出现。
例如反应:MnO2(s) + 4H+(aq) + 2Cl-(aq)─→ Mn2+(aq) + Cl2(g) + 2H2O (l)非标态时:Δr G m = + RT ln J其中:。