高中化学《1.1.3物质的聚集状态》 苏教版必修1
- 格式:ppt
- 大小:369.00 KB
- 文档页数:16


1.1.3 课时作业[对点训练]学问点1气体摩尔体积1.当温度和压强肯定时,打算气体体积大小的主要因素是()A.分子直径的大小B.分子间距离的大小C.分子间引力的大小D.分子数目的多少【答案】 D2.下列有关气体摩尔体积的描述中正确的是()A.相同物质的量的气体摩尔体积也相同B.通常状况下的气体摩尔体积约为22.4 LC.标准状况下的气体摩尔体积约为22.4 L/molD.肯定物质的量的气体所占的体积就是气体摩尔体积【答案】 C学问点2气体摩尔体积的应用3.在标准状况下,由0.5 g H2、11 g CO2和4 g O2组成的混合气体,其体积约为() A.8.4 L B.11.2 LC.14.0 L D.16.8 L【解析】求标准状况下互不反应的混合气体的体积与单一气体求法相同,只要求出总物质的量,然后乘以22.4 L/mol即可。
【答案】 C4.在标准状况下,与12 g H2的体积相等的N2()A.质量为12 gB.物质的量为6 molC.体积约为22.4 LD.分子数约为6.02×1023【解析】12 g H2的物质的量为6 mol,则N2的物质的量也为6 mol;6 mol N2的质量为168 g;体积约为134.4 L(标准状况);分子数约为3.612×1024。
故应选B。
【答案】 B学问点3阿伏加德罗定律的简洁应用5.下列两种气体的分子数肯定相等的是()A.质量相等的N2和COB.体积相等的CO和C2H4C.等温、等体积的O2和N2D.等压、等体积的N2和CO2【解析】只要物质的量相等,则气体的分子数必相等。
等质量的N2和CO,摩尔质量也相等,都是28 g/mol,则其物质的量相等,分子数也相等。
【答案】 A6.相同条件下,等物质的量的两种气体肯定满足()A.体积均为22.4 L(4)y/N A_________________________________________________________;(5)m/V__________________________________________________________;(6)m/M_______________________________________________________。


第一单元丰富多彩的化学物质第3课时物质的聚集状态学习目标:1. 知道物质的聚集状态以及聚集状态对物质性质的影响。
2. 了解影响气体体积的主要因素,初步学会运用气体摩尔体积等概念进行简单的计算。
3.掌握阿伏加德罗定律及其推论。
学习重点:气体摩尔体积的理解,阿伏加德罗定律及其推论。
学习难点:气体摩尔体积概念的建立,阿伏加德罗定律及其推论的理解。
教学过程:一、导入新课引入]在日常生活中,我们所接触的物质并不是单个原子或分子,而是它们的聚集体。
物质的聚集状态主要有气态、液态和固态三种。
物质在不同的温度和压强下,可以呈现不同的状态。
例如常温常压下,水呈现三种状态,液态的水、固态的冰和气态的水蒸气。
那么,同学们还知道哪些物质存在不同的聚集状态?讨论并归纳]二氧化碳和干冰;氧气和贮存在钢瓶里的液氧;固态的钢铁和液态的钢水、铁水等。
二、推进新课教学环节一:物质的聚集状态板书]一、物质的聚集状态1、常温常压下,物质存在三种状态:气态、液态和固态。
提问]同学们,你们知道吗?生活经验告诉我们:固体有一定的形状,液体没有一定的形状,但有固体的体积,气体没有固定的形状和体积;气体容易被压缩,固体、液体不容易被压缩。
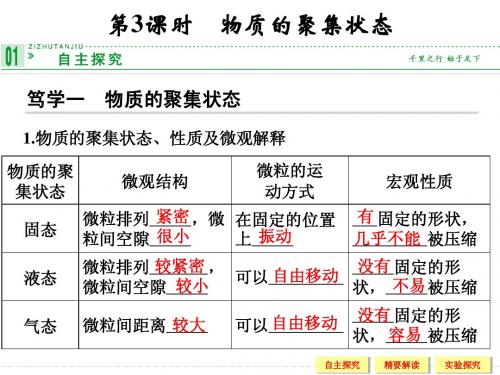
为什么固态、液态和气态物质的某些性质存在差异?这与物质的微观结构特点有何联系?归纳]物质的状态,主要与构成物质的微粒的运动方式、微粒之间的距离有关。
展示]图片1讨论]根据图片,归纳整理出不同聚集状态的物质的特征。
归纳]固体:排列紧密,间隙很小,不能自由移动,只能在固定位置上振动,有固定的形状,几乎不能被压缩。
液体:排列较紧密,间隙较小;可以自由移动,没有固定的形状,具有流动性,不易被压缩。
气体:间距很大,排列无序;不规则,可以自由移动,没有固定的形状,容易被压缩。
投影]不同聚集状态物质的结构和性质交流与讨论]通过学习,我们已经知道,1 mol任何微粒的集合体所含的微粒数目都相等,约为6.02×1023个,1mol微粒的质量往往不同。

第一单元丰富多彩的化学物质第3课时物质的聚集状态学习目标:1. 知道物质的聚集状态以及聚集状态对物质性质的影响。
2. 了解影响气体体积的主要因素,初步学会运用气体摩尔体积等概念进行简单的计算。
3.掌握阿伏加德罗定律及其推论。
学习重点:气体摩尔体积的理解,阿伏加德罗定律及其推论。
学习难点:气体摩尔体积概念的建立,阿伏加德罗定律及其推论的理解。
教学过程:一、导入新课引入]在日常生活中,我们所接触的物质并不是单个原子或分子,而是它们的聚集体。
物质的聚集状态主要有气态、液态和固态三种。
物质在不同的温度和压强下,可以呈现不同的状态。
例如常温常压下,水呈现三种状态,液态的水、固态的冰和气态的水蒸气。
那么,同学们还知道哪些物质存在不同的聚集状态?讨论并归纳]二氧化碳和干冰;氧气和贮存在钢瓶里的液氧;固态的钢铁和液态的钢水、铁水等。
二、推进新课教学环节一:物质的聚集状态板书]一、物质的聚集状态1、常温常压下,物质存在三种状态:气态、液态和固态。
提问]同学们,你们知道吗?生活经验告诉我们:固体有一定的形状,液体没有一定的形状,但有固体的体积,气体没有固定的形状和体积;气体容易被压缩,固体、液体不容易被压缩。
为什么固态、液态和气态物质的某些性质存在差异?这与物质的微观结构特点有何联系?归纳]物质的状态,主要与构成物质的微粒的运动方式、微粒之间的距离有关。
展示]图片1讨论]根据图片,归纳整理出不同聚集状态的物质的特征。
归纳]固体:排列紧密,间隙很小,不能自由移动,只能在固定位置上振动,有固定的形状,几乎不能被压缩。
液体:排列较紧密,间隙较小;可以自由移动,没有固定的形状,具有流动性,不易被压缩。
气体:间距很大,排列无序;不规则,可以自由移动,没有固定的形状,容易被压缩。
投影]不同聚集状态物质的结构和性质交流与讨论]通过学习,我们已经知道,1 mol任何微粒的集合体所含的微粒数目都相等,约为6.02×1023个,1mol微粒的质量往往不同。
第3课时物质的聚集状态目标与素养:1.知道物质常见的聚集状态及影响物质体积的因素。
(宏观辨识与微观探析)2.知道气体摩尔体积的含义,熟记标准状况下的气体摩尔体积。
(宏观辨识与微观探析)3.能进行气体体积、物质的量、微粒数目之间的换算。
(证据推理与模型认知)一、物质的聚集状态1.对物质从宏观聚集状态、微观组成的角度分类(1)晶体:具有规则的几何外形和固定熔点的固体,如氯化钠、纯碱、冰。
(2)非晶体:没有固定的熔点,也不具备规则几何外形的固体,如石蜡、玻璃。
2.物质的聚集状态、性质及微观解释二、气体摩尔体积1.概念:单位物质的量的气体所占的体积叫做气体摩尔体积,用V m表示,常用单位为L·mol-1或m3·mol-1。
2.计算公式:V m =V n。
3.影响气体摩尔体积的因素 (1)气体摩尔体积的数值取决于气体所处的温度和压强。
(2)标准状况下(即0_℃和101_kPa),气体摩尔体积约为22.4_L·mol -1。
微点拨温度越高、压强越小V m 越大;温度、压强不同时V m 不同,温度、压强相同时V m 相等,但不一定是22.4 L·mol -1。
1.判断正误(正确的打“√”,错误的打“×”)(1)在相同条件下,1 mol 任何物质的体积均相同 ( × )(2)同温同压下,1 mol 任何气体的体积均为22.4 L ( × )(3)标准状况下,不论是纯净气体还是混合气体,V m 均等于22.4 L·mol -1 ( √ )(4)如果不是标准状况,气体摩尔体积一定不是22.4 L·mol-1 ( × )2.下列有关气体体积叙述正确的是( )A .一定温度、压强下,气体体积由其分子的大小决定B .一定温度、压强下,气体体积由其物质的量的多少决定C .气体摩尔体积是指1 mol 任何气体所占的体积约为22.4 LD .不同的气体,若体积不等,则它们所含的分子数一定不等B [在温度、压强一定时,气体的体积与其物质的量成正比;当分子数目相同时,气体体积的大小主要决定于气体分子之间的距离,而不是分子本身体积的大小,所以A、D错误,B正确;非标准状况下气体摩尔体积不一定为22.4 L·mol-1,C错误。