电子传递
- 格式:ppt
- 大小:904.00 KB
- 文档页数:26

氧化还原反应的电子传递氧化还原反应是化学反应中最基本和常见的一种类型。
在这类反应中,电子的转移起着重要的作用,称为电子传递。
通过电子传递,原子或离子发生氧化或还原,以实现反应的平衡。
电子是带负电的基本粒子,在化学反应过程中可以从一个物质转移到另一个物质。
氧化还原反应中的电子传递可以通过多种方式实现,其中最常见的是通过化学物质之间的直接接触或通过电子载体分子。
在氧化还原反应中,氧化剂接受电子而被还原,而还原剂提供电子并被氧化。
这种电子传递的过程可以用氧化态和还原态的变化来描述。
氧化态是给定化学物质中原子或离子的电荷状态。
正电荷表示氧化态,负电荷表示还原态。
电子传递导致氧化剂的氧化态变大,还原剂的氧化态变小。
在氧化还原反应中,电子是通过化学键或离子之间的转移来传递的。
例如,金属与非金属之间的反应通常涉及到电子传递。
金属原子失去电子变成正离子,被氧化,而非金属原子获得电子变成负离子,被还原。
电子可以通过电子载体分子进行传递。
这些分子具有特殊的结构,能够接受和释放电子。
最常见的例子是辅酶NAD+和FAD,它们能够在氧化还原反应中接受和释放电子。
辅酶NAD+(烟酰胺腺嘌呤二核苷酸)在接受电子时被还原成NADH,而在释放电子时被氧化成NAD+。
辅酶FAD(烟酰胺腺嘌呤二核苷酸)也具有类似的还原和氧化过程。
除了金属离子和辅酶之外,还有一些其他的电子载体分子在氧化还原反应中发挥作用。
例如,细胞呼吸过程中的细胞色素C就是一种能够接受和释放电子的电子载体。
总的来说,氧化还原反应的电子传递是化学反应中至关重要的步骤之一。
通过电子的转移,原子和离子之间发生了氧化或还原反应,完成了反应的平衡。
电子可以通过直接接触或通过电子载体分子进行传递。
了解和理解电子传递的机制对于深入理解氧化还原反应的本质和特点至关重要。

电子从参考电势到样品流动,氧化还原电势为正样品具有较强的受电子影响氧化剂,受电子体例如:O 2,Fe 3+等标准氢电极测试电极盐桥电子从样品流动到参考电势,氧化还原电势为负样品具有较强的电子转移势能还原剂,供电子体例如:NADH,FADH2等氧呼吸链呼吸链膜间腔NADH → NADH-Q 还原酶 → Q → 细胞色素还原酶 → 细胞复合体酶名称多肽链数辅基复合体 Ⅰ复合体 Ⅱ复合体 Ⅲ复合体 ⅣNADH-泛醌还原酶琥珀酸-泛醌还原酶泛醌-细胞色素C还原酶细胞色素C氧化酶3941013FMN,Fe-SFAD,Fe-S铁卟啉,Fe-S铁卟啉,Cu四种具有传递电子功能的酶复合体(complex) 人线粒体呼吸链复合体- 测定各载体的E’o - 测定各载体被氧化的速率- 测定各载体的氧-还状态呼吸链及其相关电子载体的标准还原电势由E ’o 推断的载体顺序:NADH → Q → cyt b → cyt c 1 → cyt c → cyt a → cyt a 3 → O 2e–趋向于自发从E’o较低的载体流向较高在整条载体链被还原后测定各载体的氧化速率ⅠⅣCytcQNAD H +H +延胡索酸琥珀酸1/2O 2+2H +H 2O胞液侧基质侧线粒体内膜e -e -e -e-e-ⅡⅢ以氢负离子( H-)形式转移进入水溶剂异咯嗪结构FMN组成成分作用传递机制2Fe-2S型4Fe-4S型参与单电子转移:Fe-S簇中只有1个Fe被氧化或还原蓝细菌Anabaena7120的铁氧还蛋白为2Fe-2S型仅指无机S为一种脂溶性醌类化合物。
泛醌半醌泛醇5元含氮吡咯环(卟啉)共价原态复合体Ⅰ→FMN; Fe-SN-1a,b; Fe-SN-4;Fe-SN-3; Fe-SN-2膜间隙NADH+H++FMN FMNH2+NAD+复合体ⅡFe-S1; b560; FAD; Fe-S2 ; Fe-S3酶结合位点Fe-S中心细胞质辅酶Q亚铁血红素外周胞质双磷脂酰甘油复合体Ⅲb562; b566; Fe-S; c1细胞色素 c1细胞间隙细胞色素 b细胞色素 c1和细胞色素 b结构示意图细胞色素 c 细胞色素 c1铁硫蛋白细胞色素 b复合体ⅣCuA→a→a3→CuB复合体IV:细胞色素氧化酶激活分子氧H+离子泵鱼藤酮,安密妥,杀粉蝶菌素抗酶素A氰化物,叠氮化物,一氧化碳。

氧化还原反应的电子传递方向氧化还原反应是化学反应中常见的一种类型,它涉及物质之间电子的转移过程。
在氧化还原反应中,电子的传递方向是非常重要且有着明确规律的。
本文将对氧化还原反应中电子传递方向的相关知识进行探讨和解析。
1. 电子传递的概念在化学反应中,电子是带有负电荷的基本颗粒,它在原子或分子之间进行传递。
电子的传递可以导致物质的氧化或还原。
在氧化还原反应中,原子或离子损失电子被认为是氧化的,而原子或离子获得电子则被认为是还原的。
因此,氧化还原反应是电子传递的过程。
2. 电子传递的方向在氧化还原反应中,电子传递的方向可以通过氧化态和还原态的变化来确定。
一般而言,电子的传递是从氧化态高的物质向氧化态低的物质。
2.1 氧化态的变化氧化态是指物质中元素的电子分布状态,通过氧化态的变化可以确定电子传递的方向。
在氧化反应中,元素的氧化态会增加,即电子从该元素转移到其他物质上,同时实现了其他物质的还原。
而在还原反应中,元素的氧化态会降低,即电子从其他物质转移到该元素上,实现了该元素的还原。
例如,考虑以下氧化还原反应:Cu + 2Ag^+ → Cu^2+ + 2Ag在这个反应中,铜(Cu)从0的氧化态转变为+2的氧化态,而银(Ag)从+1的氧化态转变为0的氧化态。
因此,电子的传递方向是从铜向银,即电子从铜离子转移到银离子,实现了铜的氧化和银的还原。
2.2 还原态的变化与氧化态的变化相对应,还原态的变化也可以确定电子传递的方向。
在氧化反应中,还原态会下降,即电子从还原剂转移到氧化剂上;而在还原反应中,还原态会升高,即电子从氧化剂转移到还原剂上。
例如,考虑以下氧化还原反应:2Fe^3+ + 3I^- → 2Fe^2+ + 3I2在这个反应中,亚铁离子(Fe^2+)的还原态上升为三价铁离子(Fe^3+),而碘离子(I^-)的还原态下降为碘分子(I2)。
因此,电子的传递方向是从碘离子向亚铁离子,即电子从碘离子转移到亚铁离子,实现了碘的还原和亚铁的氧化。


电化学反应中的电子传递过程电化学反应是一种通过电子交换来进行的化学反应,在这样的反应中,电子的传递过程至关重要。
电子可以在不同物质之间和反应中传递,这个过程可以让我们了解分子之间的化学交互。
本文将深入探讨电化学反应中电子传递的过程。
电子在电化学反应中的作用在电化学反应中,电子扮演了重要的角色。
电子是负电荷,它能够与离子和分子发生相互作用导致反应发生变化。
特别地,电子在化学反应中充当还原剂或氧化剂。
还原剂能够失去电子,氧化剂则能够接收电子。
在反应中,还原剂与氧化剂之间的电子传递是一种被称为氧化还原反应(redox reaction)的过程。
电子转移的方式化学反应中的电子传递是通过电子转移的方式进行的。
电子转移是一种特殊的化学反应,其中电子从一个物质转移到另一个物质中。
这一过程可以以两种方式进行:通过基态转移或过渡态转移。
基态转移中,电子直接转移到成为还原剂、它们会被氧化剂氧化的分子。
过渡态转移与基态转移类似,不同之处在于分子必须先形成一个过渡态分子成为完成反应,然后电子才能转到氧化剂中。
而氧化剂在生成的过程中也会形成过渡态化学物质。
电子的传递机制在电化学反应中,电子传递的机制有原子轨道内和超分子级别上的电子传递。
在原子轨道内电子传递中,电子从一原子轨道向另一原子轨道传递。
例如,直接雷诺拓忒的实验英语语法,氧化剂将捕获还原剂的一个电子并形成第一个中间体物质(中间体)。
过程中,电子从还原剂的HOMO(最高占据分子轨道)向氧化剂的LUMO(最低未占据分子轨道)传递。
反之,还原剂和氧化剂之间的电子向还原剂捐赠。
在超分子级别上,电子传递过程是通过化学分子之间的作用力完成的。
在这个过程中,电子在分子之间做一个大的跳跃。
例如,在一个电子传递反应中,电子从一个分子跳到另一个分子中。
这种跳跃在大量存在的乙醇、水、二氧化碳等环境下可以发生,是很常见的反应方式之一。
电子传递的动力学过程电化学反应中的电子传递本质上是一个动力学过程。

化学反应的电子转移机理在化学反应中,电子转移机理是指在反应发生过程中,电子从一个原子或离子转移到另一个原子或离子的过程和机制。
电子转移是化学反应中的重要步骤,它在不同类型的反应中起到至关重要的作用,决定了反应的方向和速率。
本文将详细介绍化学反应的电子转移机理。
一、氧化还原反应的电子转移机理氧化还原反应是化学反应中最常见的一类反应。
在氧化还原反应中,电子从一个物质转移到另一个物质,从而导致物质的氧化和还原。
这种电子转移可以通过电子的传递或者电子对的转移来实现。
1. 电子的传递在电子的传递过程中,电子从一个物质转移到另一个物质,而不伴随着原子或离子的转移。
这种电子传递通常发生在物质的溶液中,电子可以通过溶液中的电子传递体系(如过渡金属离子等)传递。
例如,铁离子与铜离子之间的反应:Fe2+ + Cu2+ → Fe3+ + Cu+,在这个反应中,铁离子Fe2+捐赠一个电子给铜离子Cu2+,同时铁离子被氧化为Fe3+,铜离子被还原为Cu+。
这个反应中的电子传递只发生在溶液中,通过电子传递体系进行。
2. 电子对的转移除了电子的传递,电子对的转移也是氧化还原反应中常见的电子转移机理。
在电子对的转移中,电子对从一个物质转移到另一个物质,伴随着原子或离子的转移。
例如,氯的氧化反应:Cl2 + 2e- → 2Cl-,在这个反应中,氯分子Cl2接受两个电子,同时发生裂解,生成两个氯离子Cl-。
这个反应中的电子对转移伴随着氯分子的裂解和氯离子的生成。
二、有机化学反应的电子转移机理有机化学反应中的电子转移机理通常涉及到共轭体系和键的形成和断裂。
共轭体系的存在使得电子转移更加容易发生,并且决定了反应的速率和产物的稳定性。
1. 共轭体系的电子转移在共轭体系中,π电子能够在分子结构中自由地传递。
当一个共轭体系中的化合物参与反应时,π电子的转移会导致反应的发生。
例如,芳香族化合物的取代反应:C6H6 + Br2 → C6H5Br + HBr,在这个反应中,溴分子Br2的一个溴原子被芳香环上的氢原子取代,同时形成溴代芳烃C6H5Br。


氧化还原反应中电子传递的机制在化学中,氧化还原反应是一种广泛应用的反应类型。
在氧化还原反应中,化学物质会失去或获得电子,从而发生氧化和还原反应。
电子传递是氧化还原反应中的关键过程。
本文将介绍氧化还原反应中电子传递的机制。
一、电子传递的基础在化学中,原子的电子结构决定了其化学行为。
原子的电子结构包括原子核周围的电子云和电子自旋。
在原子的化学性质中,电子云扮演了至关重要的角色。
电子云是由电子构成的一层云状区域,它被围绕在原子核周围。
原子中的电子分布在不同的能级上,这些能级与电子的能量有关。
当电子从一个能级向另一个能级跃迁时,它会吸收或放出能量。
在氧化还原反应中,电子传递是通过离子或原子的电荷变化实现的。
离子的电荷变化通过氧化还原反应来完成。
离子的氧化状态由它带有的电子数量决定,而还原状态则是电子数量减少。
电子是一种负电荷粒子,因此在氧化还原反应中,当一个物质失去一个电子时,它就被氧化了,并失去了一个负电荷。
相反,当一个物质获得一个电子时,它被还原了,并获得了一个负电荷。
二、化学键是电子传递的关键过程在化学中,化学键是原子之间的相互作用。
化学键的形成和断裂涉及电子的传递。
化学键的强度取决于原子之间共享或转移的电子数量。
在共价键中,原子通过共享电子来形成共价键。
在离子键中,电子从一个原子转移至另一个原子。
离子键的形成涉及一个原子失去电子,而另一个原子获得电子。
在金属键中,金属原子之间的电子形成电子气。
因此,通过共享或转移电子来形成化学键是电子传递的关键过程。
在氧化还原反应中,当一种物质失去电子时,它的氧化态上升,而当一种物质获得电子时,它的还原态上升。
三、氧化还原反应中的氧化和还原在氧化还原反应中,氧化和还原是电子传递的过程。
氧化是指失去电子,而还原则是指获得电子。
这两种过程通常同时发生。
例如,在下列反应中:Cu + 2AgNO3 → Cu(NO3)2 + 2Ag铜被氧化为铜离子(Cu2+),而银离子(Ag+)被还原为银(Ag)。

化学反应中的传递电子机制研究化学反应中的能量转化是由电子的传递而引起的。
传递电子机制是化学反应的核心过程之一。
人们一直在研究这个机制,以便更好地理解化学反应并开发新的反应体系。
传递电子机制的基本概念在化学反应中,传递电子是指电子从一个原子或分子传递到另一个原子或分子。
这通常会导致化学键的形成或断裂,或者引起氧化还原反应。
在传递电子的过程中,电子发生从高能态到低能态的跃迁。
电子从电子供体传递到电子受体时,电子受体的能级会下降,而电子供体的能级会上升。
这种能量转移可以引起反应的能垒的改变,促进反应的进行。
传递电子机制的类型有两种类型的传递电子机制:单电子传递和双电子传递。
单电子传递是指从一个原子或分子中输送一个电子到另一个原子或分子中。
在一个化学反应中,多个单电子传递可以同时发生。
例如,三脚蟹催化的Kolbe-Schmitt反应就是通过一个单电子传递机制来完成的。
双电子传递是指同时从一个原子或分子中输送两个电子到另一个原子或分子中。
双电子传递通常涉及到结构中的双键。
电子可以从一个双键传递到另一个双键上,或者从一个单键传递到另一个双键上。
传递电子机制与催化剂催化剂能够促进化学反应的发生,通常通过改变反应能垒或提高反应速率来实现。
传递电子机制与催化剂密切相关。
一些催化剂可以通过提供电子来促进电子传递机制。
这些催化剂通常具有完整的电子结构,并且可以与反应物发生氢键和离子键。
例如,亲核试剂质子在催化SN2反应中发挥了重要作用,因为它可以同时提供一个互补的空穴和一个电子。
其他催化剂可以通过强化能垒来促进反应。
这些催化剂通常能够与反应物形成复合物,提高反应物之间的接触面积,从而降低反应能垒。
例如,金属络合物可以通过与反应物形成共价键来提高反应速率。
结论传递电子机制是化学反应中重要的能量转移过程之一。
深入研究传递电子机制可以帮助我们更好地理解化学反应的本质,同时为开发新的反应体系提供思路。
催化剂是传递电子机制中不可或缺的因素,在化学反应中发挥着重要的作用。
光合作用中的电子传递过程光合作用是指将光能转化为化学能的一系列化学反应,是所有生命能量的源泉。
在光合作用过程中,植物通过吸收太阳能量来合成糖类。
而电子传递是光合作用中至关重要的一环, 它将光能转化为化学能,同时也是光合作用的最终产物。
光合作用的原理光合作用是一种以光为能量的化学反应,主要发生在植物的叶片中的叶绿体内。
光合作用可以被分为两个基本阶段,即光反应和暗反应。
在光反应中,光能被吸收,并转化为化学能;在暗反应中,此过程会在半暗或暗中进行,包括卡尔文循环和光合糖类合成反应。
其中,电子传递过程是光反应不可或缺的一部分。
电子传递过程电子传递过程是指光线激发叶绿体后,释放出电子,并把这些电子转移到其他化学物质的过程。
电子首先从叶绿体的光反应中心中被激发出来,然后在电子传递链中传递。
在电子传递链中,电子的能量逐渐转移,直到最终到达还原剂,将还原剂还原为氢原子。
第一步:电子激发在光合作用的光反应阶段,光子会激发叶绿体中的色素分子,将其从低能到高能的状态。
这个过程激发了光合作用中的电子,使其处在高能状态。
这些高能电子最终被转移到一系列叶绿体复合物中的反应中心,以进行下一步反应。
第二步:电子传递链电子从反应中心传递到电子传递链中,一旦电子离开反应中心,反应中心中的在原子核中的另一个电子会被引入以填补电子空位。
这些电子通过一系列辅助色素分子和蛋白质进行传递。
在电子传递链上,电子的能量逐渐降低,并产生能量。
第三步:电子接受在电子传递链中,电子捐赠给了一个叫做还原剂的化学物质,使其被还原为氢原子。
氢原子可以与其他物质形成化学键,从而合成新的分子。
这些新分子最终会被用来在光反应和糖类合成反应中生产能量和生命。
而在光合作用中,最终产物为氧气和葡萄糖。
电子传递过程的重要性电子传递过程对植物的生存至关重要。
首先,这个过程可以通过把光能转化为化学能,使植物能够维持生命活动。
其次,在电子传递链中,高能电子会与低能电子结合,从而产生释放出的能量。
生物体内电子传递机制的研究生命是由无数个分子组成的,而分子之间的交互作用才能让生命体得以运作。
在这一过程中,电子传递机制的研究显得尤为重要。
虽然电子的传递机制早已被发现,但在细胞水平上,电子的传递机制却是一个仍然值得我们进行深入探究的领域。
一、电子传递的基本概念与过程电子的传递是一种发生在分子内部的物理过程,它专门研究的就是电子在分子内部的移动,以及由于电子移动所引起的分子或原子的反应。
传统的电子传递过程是指基于单个分子或离子间跳跃式的电子传递,但这样的理论却只能解释极少数反应。
在生物体中,电子的传递是由一组激发态分子构成的传输体系来完成的。
这个传输体系通常被称为电子传递链。
电子传递链的组成不固定,但一般不包含自由基。
电子传递链中会存在类似于色素、维生素K1和铁硫蛋白等含有金属离子或金属簇的蛋白质分子。
二、具体生物体内的电子传递机制具体来说,细胞呼吸中的酶群利用功能复杂的物质将氧气转化为水,并从中释放出能量。
在这个过程中,电子传递链发挥了非常重要的作用。
这个过程中,电子被一个细胞色素c氧化而产生,细胞色素c再将电子传递给另一个电子接受体,从而引发异位电子传递链。
最终,电子被接受体NAD+还原成NADH,并通过质膜中氧化磷酸化的ATP合成过程被清除。
三、电子传递链中膜的作用膜在电子传递链中的作用很重要。
它能够限制电子的跨膜传递,以及维持化学梯度。
这种化学梯度的存在可以使电子传递链朝着更加稳定的方向运转,从而保证人体的能量供应。
同时,膜的化学性质也能够对电子传递所需的结构物质起到相应的作用。
四、影响电子传递链的因素电子传递链中的蛋白质分子扮演了非常关键的角色。
如果其结构发生变化,就会对整个电子传递链的运作带来影响。
此外,电子传递链的肽链长度、极性、氨基酸序列等等都能影响其形态和结构。
此外,电子传递链中的金属离子和有机分子也对整个电子传递链的运行产生至关重要的影响。
总之,电子传递是一种在分子水平上的过程,它涉及到大量的物理、化学、分子生物学等领域。
电化学生物学中的电子传递过程探究电子传递是电化学生物学中极为关键的一个过程。
通过电子传递,生物体内的电子可以在不同的分子间传导,从而驱动细胞呼吸、光合作用等生物过程。
本文将探究电化学生物学中的电子传递过程,并深入了解其背后的原理。
一、细胞内电子传递过程的重要性在生物体内,电子传递是驱动细胞代谢过程的关键环节。
通过电子传递,细胞内的能量可以从一个分子传递到另一个分子,从而激活不同的酶和代谢途径。
在呼吸和光合作用中,通过电子传递可以产生ATP等生命所需要的能量物质。
因此,电子传递过程对于生物体内能量代谢和生命活动具有重要作用。
二、电子传递发生的位置电子传递可以发生在细胞内的多个位置。
在呼吸和光合作用中,电子传递通常发生在膜上的色素复合物和细胞色素等蛋白质分子中。
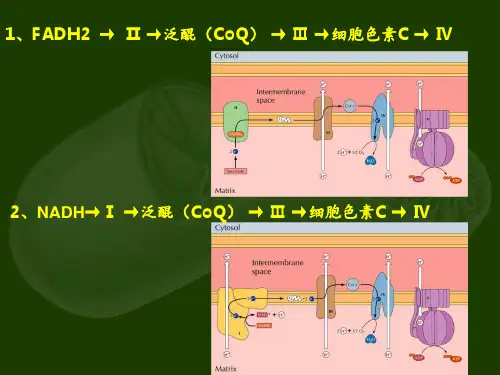
例如,在线粒体呼吸链中,电子可以通过复合物I、复合物III和复合物IV等酶的介导下,在细胞膜上进行传递。
在光合作用中,电子可以通过类囊体膜上的色素复合物(如光合色素II和光合色素I)进行传递。
三、电子传递的机制在电子传递中,电子通常由较强的还原剂(如NADH和FADH2)转移到较弱的氧化剂(如细胞色素和氧分子)。
在这个过程中,电子可以通过电子传递链的多个步骤进行传递,进而激活ATP合成。
同时,通过电子传递链,ATP合成酶会利用传递过来的电子来将ADP和磷酸酯化成ATP。
四、电子传递中的蛋白质分子在电子传递中,有很多蛋白质分子扮演了重要角色。
例如,在呼吸链中,NADH被氧化成NAD+并释放出电子,这些电子随后传递给复合物I中的NADH:细胞色素c还原酶。
在这里,电子传递引起复合物I中的质子泵浦活动,从而将膜外的质子泵进细胞内。
这样,就在细胞膜上建立了质子电势差,进而可以用来推动ATP合成。
五、电子传递的测量方法在研究电子传递过程的时候,可以使用一系列的测量方法。
其中,最常用的方法是光电子发射光谱和过渡吸收光谱。
通过这些方法,可以研究色素复合物和氧化还原酶之间电子传递的细节,以及分析反应机制中的动力学变化。
电子传递链名词解释第一节电子传递链的组成与原理1.链中电子分布与电荷,电荷、电子状态均匀、对称,离核最近的电子先得到,其他电子按能量从高到低依次获得。
2.每个电子通过核和邻近电子的作用及其间相互作用来传递能量和动量,但电子在运动时,自己不带电,必须靠库仑力的作用才能保持稳定。
3.若不考虑电子热运动产生的自由电子和离核远的电子,可以认为电子一直处于“失”电子的状态。
因此,电子的运动是一种热运动,电子也没有足够的能量使它保持很高的速度。
第二节电子传递链模型的建立如图所示,简单地建立电子传递链模型。
在绝大多数情况下,都假设各电子的位置是不变的,只在链中传递电子。
电子在电场中作匀速圆周运动,电场在空间作变速直线运动,形成一条闭合曲线,这条曲线就是传递链,图中电子作圆周运动,两个电子之间的距离为,电子的初动能为,电子的终末动能为,将式代入式后,解得:由式知道,系统的总动能:在式中电子能级之间的跃迁不仅受到电场力的作用,而且还受到核外电子之间库仑力的作用。
在系统的动能大于或等于零时,系统只能从高能级向低能级跃迁。
当系统的能级间隔比较大时,则这些电子不能完全传给其它电子,即不存在跃迁过程。
1.链中电子分布与电荷,电荷,电子状态均匀、对称,离核最近的电子先得到,其他电子按能量从高到低依次获得。
2.每个电子通过核和邻近电子的作用及其间相互作用来传递能量和动量,但电子在运动时,自己不带电,必须靠库仑力的作用才能保持稳定。
3.若不考虑电子热运动产生的自由电子和离核远的电子,可以认为电子一直处于“失”电子的状态。
因此,电子的运动是一种热运动,电子也没有足够的能量使它保持很高的速度。
第三节从简单的热运动到真正的定态过渡但是,由于电子热运动的影响,会引起各能级上电子浓度的变化,这个变化将导致各能级间电子浓度的差异。
所以,在通常情况下,电子总是由高能级向低能级运动,同时释放部分电子来补充被吸收的电子,逐渐达到新的平衡状态。
电子传递链的名词解释电子传递链(Electron Transport Chain,简称ETC)是生物体内电子转移的一种重要过程。
在呼吸过程中,电子传递链在线粒体内发挥着关键作用。
它是一系列的酶和蛋白质分子,通过电子接收和释放的过程来驱动细胞内能量的产生。
本文将对电子传递链的原理、功能和与生命活动的关系进行探讨。
【引言】生命的维持离不开能量的合理利用,而能量的最终释放和利用过程便是电子传递链的重要组成部分。
通过对电子传递链的解析,我们可以了解细胞内能量转换的基本原理,进而进一步了解生命活动的表现形式。
【电子传递链的原理】电子传递链是由线粒体膜蛋白组成的复杂网络,包括多个酶和电子接收体。
线粒体内膜分为内膜和外膜,两者之间形成了小空间--间隙。
这些蛋白质和酶通过一系列的氧化还原反应,将电子从高能态的分子转移到低能态的分子上。
电子传递链的过程中,氧分子起着重要的作用。
它是氧化还原反应的最终受体,接受电子后与氢离子结合形成水。
这一过程产生的能量通过电子传递链依次释放,最终驱动细胞内腺苷三磷酸(ATP)的合成。
【电子传递链的功能】电子传递链的主要功能是产生和储存细胞内能量。
在线粒体膜上,电子通过不同的蛋白质复合物进行传递,并在过程中释放能量。
这些能量通过质子泵将质子从基质侧积聚到间隙侧,形成质子梯度。
而质子梯度的触发,将使电子从低能态的分子接收体转移至高能态的分子。
当电子最终被氧分子接收,氧化还原反应发生并释放出能量。
电子传递链释放的能量最终用于合成ATP。
细胞利用ATP作为能量库进行各种生物化学反应。
通过电子传递链释放出的能量,驱动ADP和无机磷酸根结合形成ATP,使细胞能够进行代谢、生长和分裂等基本生理活动。
【电子传递链与生命活动的关系】电子传递链在生物体内起着重要的作用,与生命活动密切相关。
无论是动物细胞还是植物细胞,电子传递链都是维持细胞正常运作的必要条件。
例如,人体的呼吸过程就依赖于电子传递链的产生的能量。
细胞信号和电子传递是生命体系中至关重要的两个方面,它们互相依存,共同维持了生物体正常的生命活动。
在本文中,我们将介绍这两个方面的一些基础知识,其中包括它们的定义、作用、相关机制等内容。
一、细胞信号细胞信号是指生物体内部不同细胞之间的信息传递。
这些信息可以是化学物质、电信号等不同形式的传递方式。
其作用是协调、调节各细胞之间的生理活动,从而实现全身的生命活动的协调。
在细胞信号过程中,发信细胞通过释放信号分子向外界发送信号,接收信号的细胞通过表面受体将信息传递到细胞内部,启动下一步生化过程。
细胞信号可以分为内源性和外源性两大类。
内源性信号来源于生物体内部,主要包括各种生物化学物质如激素、神经递质、细胞因子等;而外源性信号通过环境因素如温度、气味、光线等介导。
在不同类型的细胞中,不同的信号分子、受体以及信号传递通路都有需要,从而实现细胞间的信息传递和调节。
这其中涉及的一些重要机制包括离子通道、蛋白激酶、酶等生物大分子的活性调节、代谢物分泌、核酸代谢等生化过程。
二、电子传递电子传递是生命体系中用于维持能量代谢和进行化学反应所必需的过程。
它涉及到的生理机制主要包括代谢途径、纤维化过程、膜通透性调节等。
电子传递过程中涉及到的核心生物分子是酶、蛋白质和核酸等。
在细胞的能量代谢中,电子传递起到了非常重要的作用,其机制类似于一个接力棒的传递过程。
首先,一个能够捕获电子的化合物,如脱氢酶辅助酶(coenzyme of dehydrogenases,简称辅酶),捕获了高能电子,形成高能物质,接着这个高能物质向相邻的酶传递电子,如此往复,这些高能物质就被释放出来,使得相应的底物被加工为高价能产物,如ATP等。
在这种过程中,电子传递链上的细胞内膜发挥了被称为氧化磷酸化的作用,它能够释放出足够的能量,从而使细胞能够持续吸收和利用营养。
值得一提的是,电子传递链在生命体系中的重要性是不言而喻的。
如果电子传递链出现问题,可能会引起诸如多种慢性疾病的发生,例如肌无力和舞病等。