第二章合成气1
- 格式:ppt
- 大小:1.04 MB
- 文档页数:49



本章达标检测(满分:100分;时间:90分钟)一、选择题(本题共10小题,每小题2分,共20分,每小题只有一个选项符合题意)1.(2020北京昌平高二上期末)被称为人体冷冻学之父的罗伯特·埃廷格在1962年写出《不朽的前景》一书。
他在书中列举了大量事实,证明了冷冻复活的可能。
比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。
下列结论中与上述信息相关的是( )A.化学反应前后质量守恒B.低温下分子无法运动C.温度降低,化学反应停止D.温度越低,化学反应越慢2.(2020吉林榆树五校期末联考)一定能增大反应物分子中活化分子的百分数的是( )A.降低温度B.增大压强C.使用催化剂D.增大浓度3.向四个相同容积的密闭容器中分别充入一定量的CO、H2,发生反应:CO(g)+2H2(g)CH3OH(g)。
按开始反应时正反应速率由大到小的顺序排列的是( )①在500 ℃时,5 mol CO和10 mol H2反应②在500 ℃时,加入催化剂,10 mol H2与5 mol CO反应③在450 ℃时,6 mol H2和3 mol CO反应④在500 ℃时,6 mol H2和3 mol CO反应⑤在450 ℃时,4 mol H2和2 mol CO反应A.②①③④⑤B.②①④③⑤C.⑤②①③④D.②④⑤③①4.对于平衡CO2(g) CO2(aq) ΔH=-19.75 kJ·mol-1,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )A.升温、增压B.降温、减压C.升温、减压D.降温、增压5.设NO+CO2 NO2+CO(正反应吸热)反应速率为v1,N2+3H2 NH3(正反应放热)反应速率为v2。
对于上述反应,当温度升高时,v1和v2变化情况为( )A.v1增大,v2减小B.v1减小,v2增大C.同时增大D.同时减小6.(2020陕西西安中学高二上期中)某化学反应的ΔH=-125 kJ·mol-1,ΔS=-8 kJ·mol-1·K-1,则此反应在下列哪种情况下可自发进行( )A.在任何温度下都能自发进行B.在任何温度下都不能自发进行C.仅在高温下自发进行D.仅在低温下自发进行7.二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,也是未来实现低碳经济转型的重要环节。



《化学工艺学》复习题第一章绪论1、化学工业(化学加工工业):指生产过程中化学方法占主导地位的制造工业。
2、化学工业按产品的物质组成可分为:有机化工(碳氢化合物及其衍生物)和无机化工(非碳氢化合物)两大类。
3、一般综合考虑产品的性质、用途和生产量,化学工艺分为如下几类:无机化学工业、基本有机化学工业、高分子化学工业、精细化学工业、生物化学工业。
4、化学工业按原料的性质和来源分:石油化工、煤化工、生物化工、矿产化工、海洋化工。
5、化学工艺:将原料物质主要经过化学反应转变为产品的方法和过程,其中包括实现这种转变的全部化学和物理的措施。
6、原油按其组成大体分为:石蜡基、中间基、环烷基三大类。
7、辛烷值:将异辛烷规定为100,正庚烷为0,两者以不同比例混合,制成标准汽油。
将待测汽油与标准汽油相比较,若两者在标准汽油机中炕爆性能相同,则待测汽油的辛烷值就是同测标准汽油中异辛烷的百分含量。
8、原油的常压蒸馏和减压蒸馏过程称为石油的一次加工,常减压蒸馏馏分油的进一步化学加工过程称为石油的二次加工。
9、石油的二次加工工艺主要包括:重整、催化裂化、催化加氢裂化、烃类热裂解这四种化学加工方法。
10、物料衡算和热量衡算的意义与用途:①进行方案比较,参数值确定的基本方法。
②化工设计的基础。
③通过衡算,找出生产的薄弱环节,工艺参数值是否合理,提出生产的方向,提供设计数据。
11、物料衡算的依据——质量守恒定律12、热量衡算的依据—热力学第一定律第二章合成气1、合成气的生产包括两个主要步骤:合成气的制取和净化。
2、合成气的制取(造气)即制备含H2 和CO 的气体。
3、合成气的净化即将原料气中的杂质如CO、CO2、S 等脱除到ppm级(10-6)。
4、合成气制备中,影响甲烷蒸汽转化反应平衡组成的因素有:水碳比、反应温度和反应压力。
5、合成气制备中,甲烷蒸汽转化在高温、高水碳比和低压下进行有利。
6、烃类蒸汽转化所使用的催化剂组成:NiO为最主要活性成份。
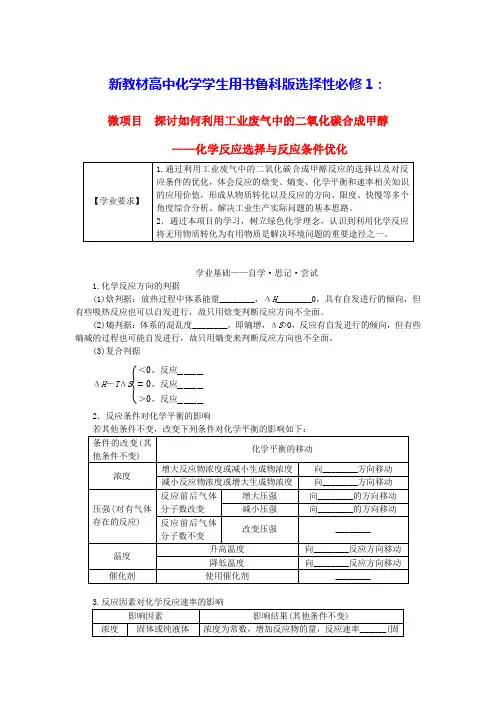
新教材高中化学学生用书鲁科版选择性必修1:微项目探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化学业基础——自学·思记·尝试1.化学反应方向的判据(1)焓判据:放热过程中体系能量________,ΔH________0,具有自发进行的倾向,但有些吸热反应也可以自发进行,故只用焓变判断反应方向不全面。
(2)熵判据:体系的混乱度________,即熵增,ΔS>0,反应有自发进行的倾向,但有些熵减的过程也可能自发进行,故只用熵变来判断反应方向也不全面。
(3)复合判据ΔH-TΔS{<0,反应________=0,反应________>0,反应________ 2.反应条件对化学平衡的影响核心素养——合作·探究·分享目标一选择合适的化学反应甲醇是一种基础有机化工原料,广泛应用于有机合成、医药、燃料、高分子等化工生产领域,其消费量在有机原料中仅次于乙烯、丙烯和苯,位居第四位。
利用工业废气中的二氧化碳合成甲醇,还需要寻找氢源。
如果选取常见的氢气或水作为氢源,可能设计出以下两个反应。
①CO2(g)+3H2(g)===CH3OH(g)+H2O(g)O2(g)②CO2(g)+2H2O(g)===CH3OH(g)+32【活动探究】1.分析判断利用CO2合成甲醇的两个反应能否正向自发进行,应选用哪个反应合成甲醇?2.在利用反应①合成甲醇时,可能会伴随如下副反应:CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41.17 kJ·mol-1ΔS=+42.08 J·mol-1·K-1。
判断此反应能否正向自发进行。
状元随笔反应①更适宜于甲醇的工业生产。
在ΔG=ΔH-TΔS中,ΔG<0时反应能自发进行。
在反应①中,当T<48.97×1 000K时,ΔG<0;在反应②中,[676.48×1 000-T(-177.1643.87)]恒大于0。




学习合成气制备的感受
今天我们学习了合成气的制备,我感受到了得到了制备合成起很不易。
合成气天然气作为一种活洁、环境友好的能源,越来越受到广泛的重视。
合成气天然气作为一种活洁、环境友好的能源,越来越受到广泛的重视。
制合成气是间接利用天然气的重要步骤,也是天然气制氢的基础,充分了解天然气制合成气的工艺与催化剂对我们进一步研究天然气的利用将有很大帮助。
天然气中甲烷含量一般,其余为小量的乙烷、丙烷等气态烷轻,有些还含有少量氨和硫化物。
其他含甲烷等气态轻的气体,如炼厂气、焦炉气、油田气和煤层气等均可用来制造合成气。
目前工业上有天然气制合成气的技术主要有蒸汽转化法和部分氧化法。