最新整理练 习 (电化学)厦大演示教学
- 格式:doc
- 大小:180.00 KB
- 文档页数:12


电化学及其应用课件一、教学内容本节课的教学内容选自人教版初中化学九年级下册第14章“电化学及其应用”。
本章节主要内容包括原电池的原理、原电池的应用、电解质的电离以及电解质溶液的酸碱性等。
其中,原电池的原理和应用是本章节的重点内容。
二、教学目标1. 让学生了解原电池的构成条件和工作原理,能解释一些有关原电池的实际问题。
2. 培养学生运用化学知识解决实际问题的能力。
3. 通过对电化学的学习,使学生认识到化学知识在生产、生活等方面的应用价值,提高学生的学习兴趣。
三、教学难点与重点重点:原电池的构成条件和工作原理。
难点:原电池工作原理的理解和应用。
四、教具与学具准备教具:多媒体课件、实验器材(如干电池、导线、电极等)。
学具:课本、笔记本、导线、电极等。
五、教学过程1. 实践情景引入:展示一些常见的原电池应用实例,如干电池、蓄电池等,引导学生思考这些设备的工作原理。
2. 知识讲解:通过多媒体课件,详细讲解原电池的构成条件和工作原理。
3. 实验演示:进行原电池实验,让学生直观地观察原电池的工作过程。
4. 例题讲解:选取一些与原电池相关的实际问题,如干电池的电压是如何产生的?为什么电池用久了会变得不够劲?等进行讲解。
5. 随堂练习:让学生结合所学内容,完成课后练习题。
6. 知识拓展:介绍一些与电化学相关的新技术和应用,如新型电池、电镀技术等。
六、板书设计板书内容主要包括原电池的构成条件、工作原理以及应用实例等。
七、作业设计1. 请用文字和图示说明原电池的构成条件和工作原理。
2. 举例说明原电池在生产、生活中的应用。
3. 试述电解质的电离和电解质溶液的酸碱性之间的关系。
八、课后反思及拓展延伸本节课通过引入实践情景、讲解知识、演示实验、讲解例题和进行随堂练习等方式,让学生掌握了原电池的构成条件和工作原理,以及电解质的电离和电解质溶液的酸碱性等知识。
在教学过程中,学生积极参与,课堂气氛活跃。
通过课后作业的布置,可以进一步巩固所学知识,提高学生运用化学知识解决实际问题的能力。


练习Ⅰ1.用铂电极电解CuCl2溶液。
通过的电流为20A,经过15min 后,问(1)在阴极上能析出多少克的Cu?(2)在阳极上能析出多少体积的27℃、100kPa 下的Cl2(g)?提示答案:〔(1) 5.928g、(2) 2.328dm3〕2.铜电量计、气体电量计和碘电量计串联在同一电路上,今测得气体电量计上析出气体换算为STP 时体积为34.0ml。
试问在铜电量计上析出的铜及在碘电量计上析出的碘的质量分别为多少克?提示答案:(Cu 0.09638g、I0.3855g)23.下列说法是否正确?为什么?(1)用已知电导率的KC1 溶液作标准,测定未知电解质溶液的电导率时,只要保证两次测定过程的温度一致而不需要温度恒定在某一数值。
(2)电导率就是体积为1m3的电解质溶液的电导。
(3)根据摩尔电导率的定义,溶液中能导电的电解质的物质的量已经给定,因此,摩尔电导率与溶液的浓度无关。
(4)无限稀释的电解质溶液可近似于纯溶剂,因此,强电解质溶液的近似等于纯溶剂的摩尔电导率。
提示答案:〔(1) 错,电导率与浓度有关,对应于不同温度χ(KCl)不同。
(2) 错,指l=1m,A=1m2时,电解质溶液的电导。
(3) 错,。
(4) 错,两者是不同的概念。
〕4.273.15k 时,在(1),(2)两个电导池中分别盛以不同的液体并测其电阻。
当在(1)中盛汞时,测得电阻为0.99895Ω;当(1)和(2)中均盛有浓度约为3mol·dm-3的H2SO4溶液时,测得(2)的电阻为(1)的0.107811 倍;若在(2)中盛以浓度为 1.0mol·dm-3的KC1 溶液,测得电阻为17565Ω。
试求273.15k 时KC1 溶液的电导率。
提示答案:(6.519S·m-1)5.已知25℃时0.02mol·dm-3KCl 溶液的电导率为0.2768S·m-1一电导池中充以此溶液,在25℃时测知其电阻为453Ω。

2017春高中化学第4章电化学基础第4节金属的电化学腐蚀与防护课堂达标验收新人教版选修4编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2017春高中化学第4章电化学基础第4节金属的电化学腐蚀与防护课堂达标验收新人教版选修4)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2017春高中化学第4章电化学基础第4节金属的电化学腐蚀与防护课堂达标验收新人教版选修4的全部内容。
金属的电化学腐蚀与防护1.钢铁在潮湿的空气中往往因电化学过程而被腐蚀.下列反应式在钢铁的吸氧腐蚀过程中不存在的是错误!( D )A.Fe-2e-===Fe2+B.2H2O+O2+4e-===4OH-C.2Fe+2H2O+O2===2Fe(OH)2 D.Fe-3e-===Fe3+解析:钢铁发生吸氧腐蚀时,负极反应式为Fe-2e-===Fe2+,不会生成Fe3+,正极反应式为2H2O+O2+4e-===4OH-,总反应式为2Fe+2H2O+O2===2Fe(OH)2,故选D。
2.结合下图判断,下列叙述正确的是错误!( A )A.Ⅰ是验证牺牲阳极的阴极保护法的实验装置B.Ⅰ和Ⅱ中负极反应式均是Fe-2e-===Fe2+C.Ⅰ和Ⅱ中正极反应式均是O2+2H2O+4e-===4OH-D.Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀解析:金属的活泼性:Zn>Fe>Cu,故Ⅰ中锌作负极,铁作正极,电解质溶液呈中性,锌发生吸氧腐蚀,铁被保护,负极反应式是Zn-2e-===Zn2+,属于牺牲阳极的阴极保护法,A正确;Ⅱ中铁作负极,电解质溶液呈酸性,铁发生析氢腐蚀,负极反应式为Fe-2e-===Fe2+,正极反应式为2H++2e-===H2↑,因为Ⅰ中铁被保护,溶液中无Fe2+,故加入少量K3Fe(CN)6溶液,无蓝色沉淀产生,B、C、D错误。


电化学基础知识点总结归纳(实用版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如小学资料、初中资料、高中资料、大学资料、文言文、中考资料、高考资料、近义词、反义词、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this store provides you with various types of practical materials, such as primary school materials, junior high school materials, senior high school materials, university materials, classical Chinese, senior high school examination materials, college entrance examination materials, synonyms, antonyms, other materials, etc. If you want to know different data formats and writing methods, please pay attention!电化学基础知识点总结归纳电化学的知识点很多,学生们需要扎实掌握,本店铺整理了一些重要电化学知识点。


大 学 化 学Univ. Chem. 2024, 39 (4), 125收稿:2023-11-20;录用:2024-01-09;网络发表:2024-02-01*通讯作者,Email:**************.cn基金资助:教育部第三批虚拟教研室建设试点“101计划”化学测量学实验课程虚拟教研室;基础学科拔尖学生培养计划2.0研究课题(20222108);厦门大学本科思政示范课程“基础化学实验(三) — (物理化学部分)”•专题• doi: 10.3866/PKU.DXHX202311057 报国赤心∙守正创新∙倾心育新——电动势法测定化学反应热力学函数实验的课程思政设计袁汝明*,吴平平,张来英,徐晓明,傅钢厦门大学化学化工学院,化学国家级实验教学示范中心(厦门大学),福建 厦门 361005摘要:课程思政的有效融入是教学质量提升和高素质人才培养的关键。
我们以“电动势法测定化学反应的热力学函数”这一实验项目为例,构建了一次深入的实验探究与思政教育相结合的教学实践活动。
通过对电动势测定原理和方法的探讨以及反应热力学量的导出,学生们不仅深化了对相关基础理论知识的理解,提升了他们解决实际问题的实验技能和创新能力;同时强化了学生的家国情怀以及责任担当意识。
关键词:电动势;热力学函数;课程思政中图分类号:G64;O6Patriotic Devotion, Upholding Integrity and Innovation,Wholeheartedly Nurturing the New: The Ideological and Political Design of the Experiment on Determining the ThermodynamicFunctions of Chemical Reactions by Electromotive Force MethodRuming Yuan *, Pingping Wu, Laiying Zhang, Xiaoming Xu, Gang FuNational Demonstration Center for Experimental Chemistry Education (Xiamen University), College of Chemistry and Chemical Engineering, Xiamen University, Xiamen 361005, Fujian Province, China.Abstract: The effective integration of ideological and political education into the curriculum is the key to improving teaching quality and cultivating high-quality talent. Taking the experiment “Determining the Thermodynamic Functions of Chemical Reactions by Electromotive Force Method” as an example, we have constructed a deep exploratory laboratory inquiry combined with ideological and political education. Through the exploration of the principles and methods of electromotive force determination, as well as the derivation of thermodynamic quantities of reactions, students have not only deepened their understanding of related fundamental theoretical knowledge, enhanced their experimental skills and innovation ability to solve practical problems; they have also strengthened their patriotic sentiments and sense of responsibility.Key Words: Electromotive force; Thermodynamic functions; Curriculum ideology and politics1 引言在新时代背景下,我们不仅要学习科学知识和技能,更要学会如何运用这些知识服务社会、报效国家。
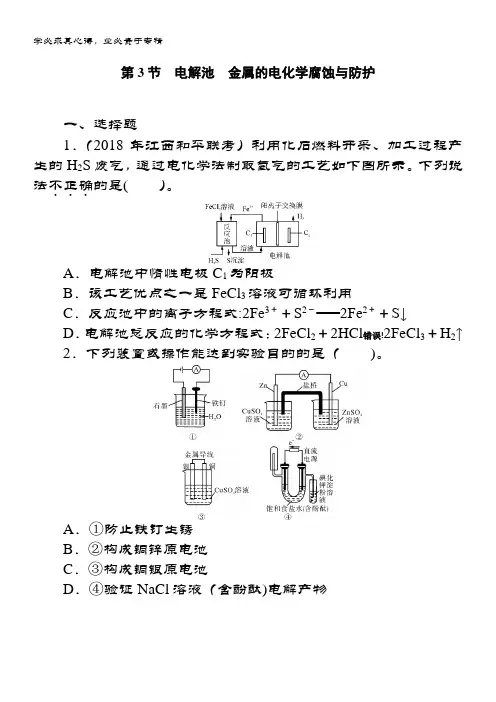
第3节电解池金属的电化学腐蚀与防护一、选择题1.(2018年江西和平联考)利用化石燃料开采、加工过程产生的H2S废气,通过电化学法制取氢气的工艺如下图所示。
下列说法不正确...的是()。
A.电解池中惰性电极C1为阳极B.该工艺优点之一是FeCl3溶液可循环利用C.反应池中的离子方程式:2Fe3++S2-===2Fe2++S↓D.电解池总反应的化学方程式:2FeCl2+2HCl错误!2FeCl3+H2↑2.下列装置或操作能达到实验目的的是()。
A.①防止铁钉生锈B.②构成铜锌原电池C.③构成铜银原电池D.④验证NaCl溶液(含酚酞)电解产物3.按如右图所示装置进行下列不同的操作,其中不正确...的是( )。
A .铁腐蚀的速度由大到小的顺序:只闭合K 3>只闭合K 1>都断开>只闭合K 2B .只闭合K 3,正极的电极反应式:2H 2O +O 2+4e -===4OH -C .先只闭合K 1,一段时间后,漏斗内液面上升,然后再只闭合K 2,漏斗内液面上升D .只闭合K 2,U 形管左、右两端液面均下降4.下列说法正确的是( )。
大功率的镍氢电池使用在油电混合动力车辆中。
镍氢电池NiMH 电池正极板材料为NiOOH ,负极板材料为吸氢合金.下列关于该电池的说法中正确的是( )。
A .放电时电池内部H +向负极移动B .充电时,将电池的负极与外接电源的正极相连C .充电时阳极反应为Ni (OH)2+OH --e -===NiOOH +H 2OD .放电时负极的电极反应式为MH n -n e -===M +n H +6.(2018年广东潮州联考)工业上,在强碱性条件下用电解法除去废水中的CN -,装置如下图所示,依次发生的反应有:①CN --2e -+2OH -===CNO -+H 2O②2Cl --2e -===Cl 2↑③3Cl 2+2CNO -+8OH -===N 2+6Cl -+2CO 错误!+4H 2O下列说法正确的是( ).A .铁电极上发生的反应为Fe -2e -===Fe 2+B .通电过程中溶液pH 不断增大C .为了使电解池连续工作,需要不断补充NaClD .除去1 mol CN -,外电路至少需转移5 mol 电子7.(2018届安徽安庆六校联考)下列图示中关于铜电极的连接错误..的是( ). A B C D二、非选择题8.(2018届北京海淀期末)某小组同学利用下图装置对电解氯化铜实验进行了研究。
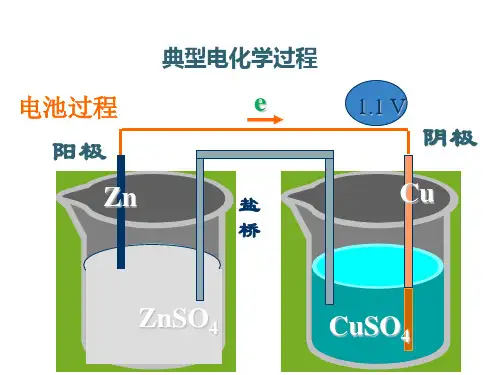
第 6 讲电化学基础[ 考大纲求 ]1. 理解原电池和电解池的组成、工作原理及应用,能书写电极反响式和总反应方程式。
2. 认识常有化学电源的种类及其工作原理。
3. 认识金属发生电化学腐化的原由、金属腐化的危害以及防备金属腐化的举措。
[ 学科修养 ]1. 变化观点与均衡思想:认识电化学反响的实质是氧化复原反响,能多角度、动向剖析电化学反响,并运用电化学原理解决实质问题。
2. 凭证推理与模型认知:能运用原电池、电解池模型表示图解说电极及电池反响现象,揭露“放电”“充电”“电解”时现象的实质与规律。
3. 科学研究与创新意识:能够发现和提出有研究价值的新式化学电源、环境污染与防治等电化学识题,确立研究目的,设计研究方案,进行实验研究,能依据实验现象总结规律,并勇于提出自己的独到看法。
4. 科学精神与社会责任:拥有可连续发展意识和绿色化学观点,研究新式高效、绿色化学电源,能对与电化学有关的社会热门问题做出正确的价值判断。
[ 网络建立 ][ 中心加强 ]1.原电池工作原理表示图2.原电池正极和负极的 5 种判断方法3.微粒流向(1)电子流向:负极→正极 ( 电流的方向正好相反 ) 。
注意:电子沿导线传达但不可以经过电解质溶液。
(2)离子流向:阳离子移向正极,阴离子移向负极。
4.电解池工作原理( 阳极为惰性电极) 表示图5.电解池阳极和阴极的判断 4 方法(1)依据所连结的外加电源判断,与直流电源正极相连的为阳极,与直流电源负极相连的为阴极。
(2)依据电子的流向判断,输出电子的一极为阳极,输入电子的一极为阴极。
(3)依据电解池里电解质溶液中离子的挪动方向判断,阳离子向阴极挪动,阴离子朝阳极挪动。
(4)依据电解池两极产物判断,一般状况下:①阴极上的现象是:析出金属 ( 质量增添 ) 或有无色气体 (H2) 放出;②阳极上的现象是:有非金属单质生成 ( 呈气态的有 Cl 2、O2) 或电极质量减小 ( 活性电极作阳极 )。
2024年新人教版高考化学一轮复习讲义(新高考版)第43讲多池、多室的电化学装置复习目标1.了解串联装置的连接特点,了解离子交换膜的特点及作用。
2.掌握多池、多室问题分析的一般方法。
3.能熟练用电子守恒、关系式法等进行有关电化学计算。
内容索引考点一 多池串联的两大模型及原理分析考点二 多室装置的分析真题演练 明确考向课时精练><多池串联的两大模型及原理分析1.常见多池串联装置图模型一 外接电源与电解池的串联(如图)必备知识A 、B 为两个串联电解池,相同时间内,各电极得失电子数相等。
模型二 原电池与电解池的串联(如图)甲、乙两图中,A均为原电池,B均为电解池。
2.二次电池的充电(1)可充电电池原理示意图充电时,原电池负极与外接电源负极相连,原电池正极与外接电源正极相连,记作“正接正,负接负”。
(2)可充电电池有充电和放电两个过程,放电时是原电池反应,充电时是电解池反应。
充电、放电不是可逆反应。
(3)放电时的负极反应和充电时的阴极反应相反,放电时的正极反应和充电时的阳极反应相反。
将负(正)极反应式变换方向并将电子移项即可得出阴(阳)极反应式。
+2OH-===Fe(OH)2Fe-2e-Fe(OH)2+2e-===Fe+2OH-3.电化学计算的三种方法如以电路中通过4 mol e -为桥梁可构建以下关系式:222O 2Cl (Br ) ~阳极产物22H 2C 4u 4A g M n ~~~阴极产物4e -~ ~ (式中M 为金属,n 为其离子的化合价数值)该关系式具有总览电化学计算的作用和价值,熟记电极反应式,灵活运用关系式便能快速解答常见的电化学计算问题。
1.如图所示,甲池的总反应式为N 2H 4+O 2===N 2+2H 2O ,下列关于该装置工作时的说法正确的是A.该装置工作时,Ag 电极上有气体生成B.甲池中负极反应式为N 2H 4-4e -=== N 2+4H +C.甲池和乙池中溶液的pH 均减小D.当甲池中消耗3.2 g N 2H 4时,乙池中理 论上最多产生6.4 g 固体关键能力√该装置图中,甲池为燃料电池,其中左边电极为负极,右边电极为正极,乙池为电解池,石墨电极为阳极,Ag电极为阴极,阴极上Cu2+得电子生成铜,无气体生成,A错误;甲池溶液呈碱性,电极反应式不出现H+,B错误;3.2 g N2H4的物质的量为0.1 mol,转移电子的物质的量为0.4 mol,产生0.2 mol Cu,质量为12.8 g,D错误。
练习Ⅰ1.用铂电极电解CuCl2溶液。
通过的电流为20A,经过15min 后,问(1)在阴极上能析出多少克的Cu?(2)在阳极上能析出多少体积的27℃、100kPa 下的Cl2(g)?提示答案:〔(1) 5.928g、(2) 2.328dm3〕2.铜电量计、气体电量计和碘电量计串联在同一电路上,今测得气体电量计上析出气体换算为STP 时体积为34.0ml。
试问在铜电量计上析出的铜及在碘电量计上析出的碘的质量分别为多少克?提示答案:(Cu 0.09638g、I0.3855g)23.下列说法是否正确?为什么?(1)用已知电导率的KC1 溶液作标准,测定未知电解质溶液的电导率时,只要保证两次测定过程的温度一致而不需要温度恒定在某一数值。
(2)电导率就是体积为1m3的电解质溶液的电导。
(3)根据摩尔电导率的定义,溶液中能导电的电解质的物质的量已经给定,因此,摩尔电导率与溶液的浓度无关。
(4)无限稀释的电解质溶液可近似于纯溶剂,因此,强电解质溶液的近似等于纯溶剂的摩尔电导率。
提示答案:〔(1) 错,电导率与浓度有关,对应于不同温度χ(KCl)不同。
(2) 错,指l=1m,A=1m2时,电解质溶液的电导。
(3) 错,。
(4) 错,两者是不同的概念。
〕4.273.15k 时,在(1),(2)两个电导池中分别盛以不同的液体并测其电阻。
当在(1)中盛汞时,测得电阻为0.99895Ω;当(1)和(2)中均盛有浓度约为3mol·dm-3的H2SO4溶液时,测得(2)的电阻为(1)的0.107811 倍;若在(2)中盛以浓度为 1.0mol·dm-3的KC1 溶液,测得电阻为17565Ω。
试求273.15k 时KC1 溶液的电导率。
提示答案:(6.519S·m-1)5.已知25℃时0.02mol·dm-3KCl 溶液的电导率为0.2768S·m-1一电导池中充以此溶液,在25℃时测知其电阻为453Ω。
在同一电导池中装入同样体积的浓度为0.555g·dm-3的CaCl2溶液,测得电阻为1050Ω。
计算:(1)电导池常数;(2) CaCl2溶液的电导率;(3) CaCl2溶液的摩尔电导率。
提示答案:〔(1) 125.4m-1、(2) 0.1194S·m-1、(3) 0.02388S·m2·mol-1〕6.已知25℃时0.01mol·dm-3的KCl 溶液的电导率为0.141S·m-1。
一电导池中充以此溶液,在25℃时测得其电阻为484Ω。
在同一电导池中盛入同样体积的浓度分别为0.0005,0.0010,0.0020 和0.0050mol·dm-3的NaCl 溶液,测出其电阻分别为10910、5494、2772 和1128.9Ω。
试用外推法求无限稀释时NaCl 的摩尔电导率(NaCl)。
提示答案:(0.01270S·m2·mol-1)7.在一定温度下稀释电解质溶液,χ 和将如何变化?今有一种酸的水溶液A 和一种碱的水溶液B,两者浓度相等而测定电导则 B 大。
将 A 和 B 都稀释100 倍后发现χ(A)>χ(B),据此推断它们是什么样的酸和碱?8.有一电导池,电极的有效面积为2×10-4m2,两极片间的距离为0.10m,电极间充以1-1 价型的强电解质MN 的水溶液,浓度为30mol·m-3。
两电极间的电势差E=3V,电流强度I 为0.003A,且正、负离子传输的电量相同。
试求(1)MN 的摩尔电导率;(2)正离子的离子摩尔电导率;(3)正离子在上述电场中的移动速率。
提示答案:〔(1) 1.67×10-2S·m-2·mol-1,(2) 8.35×10-3S·m-2·mol-1,(3)2.60×10-2S·m-2·mol-1〕9.在电场作用下,正、负离子传输的电量是否相等?它们所传输的电量与总电量有什么联系?有人说,若测定了溶液中某种离子的迁移数,则可得到其余离子的迁移数。
你认为这种说法对吗?为什么?提示答案:〔(1)一般不相等,因为t+≠t-。
(2) t+=Q+/Q。
(3) 只有在只含两种离子的溶液中适用。
〕10.一AgNO3溶液每克水中含0.01478g AgNO3今将此溶液置于迁移数管中并插入二银电极进行电解。
实验中银电量计中析出0.1560g 银。
实验后分析阳极区溶液组成为每40.00g 水中含0.7211g AgNO3。
试求Ag+和NO3-离子的迁移数。
提示答案:〔t(Ag+)=0.471、t(NO3-)=0.529〕11.在一个细管中,于0.03327mol·dm-3的GdCl3溶液的上面放入0.073mol·dm-3的LiCl 溶液,使它们之间有一个明显的界面。
令5.594mA 的电流自上而下通过该管,界面不断向下移动,并且一直是很清晰的。
3976S 以后,界面在管内向下移动的距离相当于1.002cm3的溶液在管中所占的长度。
计算在实验温度25℃下,GdCl3溶液中离子的迁移数t(Gd3+) 和t(Cl-) 提示答案:〔t(Gd3+=0.434、t(Cl-1)=0.566〕12.下列各式是否成立?为什么?(1)某弱电解质溶液的电导率为χ 则;(2)某难溶盐溶液的电导率为χ,则;(3)某强电解质溶液的电导率为χ,则。
提示答案:〔(1)(2)成立,(3)只在极稀溶液中成立。
〕13.已知25℃时某碳酸水溶液的电导率为1.87×10-4S·m-1,配制此溶液的水的电导率为6×10-6S·m-1。
假定只需考虑H2CO3的一级电离,且已知其解离常数。
又知25℃无限稀释时离子的摩尔电导率为,试计算此碳酸溶液的浓度。
提示答案:〔5.348×10-5S·dm-3〕14.18℃时,测得CaF2饱和水溶液及配制该溶液的纯水之电导率分别为38.6×10-4和1.5×10-4S·m-1,已知18℃时无限稀溶液中下列物质的极限摩尔电导率为:求18℃时CaF2的溶度积。
提示答案:(2.714×10-11)15.在一定温度下用电导滴定法以0.5mol·dm-3的NH3·H2O 滴定体积为0.1dm-3的CH3COOH 溶液,滴定过程中测得电导与NH3·H2O 体积V 的变化如下:V/cm38.009.0010.0011.0013.0015.0017.00L×102/S 1.333 1.471 1.613 1.754 1.968 1.942 1.92016.试求CH3COOH 的浓度(以mol·dm-3表示)提示17.答案:〔0.063mol·dm-3〕18.计算在298K 时与空气成平衡的水的电导率。
该空气中含CO2为0.05%(体积百分数),水的电导率仪由H+和CO3-贡献。
已知H+和HCO3-在无限稀释时的摩尔电导率分别为349.7×10-4和44.5×10-4S·m2·mol-1,且已知298K、下每1dm-3水溶解CO2 0.8266dm3,H2CO3的一级电离常数为4.7×10-7,计算时在数值上可用浓度代替活度提示答案:〔1.02×10-4S·m-1〕19.某溶液中含KCl 0.2mol·kg-1和CaCl2 0.2mol·kg-1试求:(1)KCl 的平均浓度m±(KCl);(2)CaCl2的平均浓度m±(CaCl2)。
提示答案:〔(1) 0.346mol·kg-1、(2) 0.416mol·kg-1〕20.同时含0.1mol·kg-1的KCl 和0.01mol·kg-1BaCl2的水溶液,其离子强度为多少?提示答案:〔0.13mol·kg-1〕21.比较德拜-休克尔极限公式与路易斯经验公式的异同点。
它们能适用于所有浓度的强电解质溶液吗?为什么?提示答案:(路易斯公式是从实验总结出来的所求的是平均活度系数γi,两者均只适用于稀溶液。
)22.25℃时Ba(IO3) 在纯水中的溶解度为5.46×10-4mol·dm-3。
假定可以应用德拜-休克尔极限公式,试计算该盐在0.01mol×·dm-3 CaCl 溶液中的溶解度。
提示答案:(V=7.566×10-4mol·dm3)练习Ⅱ1.在对消法回路中,电流一般为0.1mA,现若实际电流偏离此数值但保证测量过程中不变化,问对测量结果影响如何?如果由于标准电池的实际电动势偏离其标准值而引起电流偏离0.1mA,则影响又将如何?为什么?提示答案:(前者无影响,后者有影响。
当E标减小,i减小,E测增加。
)2.试将下列化学反应设计成电池3.下列说法对吗?为什么?(1)若,则ΔS〈0,因此该电池反应不能自发进行。
(2)若某电池反应的,则该电池的热效率。
(3)电池短路时,E=0,则。
提示答案:〔(1) 错,ΔS指体系,而不是指ΔS总。
(2) 理论上是对的。
(3) 短路时,E=0,但,故〕4.298K 时,电池Pb(Hg齐)|PbCl2(m)|AgCl(s),Ag 在不同的m 时有下列电动势值2.348 1.337 1.0340.61970.2116E/V0.56770.58700.59600.61430.65375.(1)试求此电池的(2)计算m=0.001034mol·kg-1时,PbCl2的平均活度系数γ±。
提示6.答案:〔(1) 0.3426V、(2) 0.85〕7.电池Cu(s)|CuAc2(0.1mol·kg-1)AgAc(s),Ag(s) 在298K 时,电动势E=0.372V,当温度升至308K 时,E=0.374V, 已知298K 时E(Ag+/Ag)=0.800V,E(Cu2+/Cu)=0.340V(1)写出电极反应和电池反应;(2)298K 时,当电池有2F 电量流过时的为多少?(3)计算AgAc 的溶度积K sp。
提示答案:〔(2) -71.8kg·mol-1,38.6J·K-1·mol-1,-60.3kJ·mol-1、(3)2.15×10-3〕8.电池Zn|ZnCl2(0.05mol·kg-1)|AgCl(s),Ag 的电动势与温度的关系为E/V=1.015-4.92×10-4(T/K-298)(1)写出电池反应;(2)计算298K 时上述电池可逆输出2F 电量时,电池反应的以及反应的热效应;(3)若将电池短路,上述各值为多少?(4)若该电池以0.8V 工作电压放电,上述各值又为多少?提示答案:9.在298K 时,电池Pt|H2(g)|H+||OH-1|O2(g)|Pt 的,水的,求电离过程和水的离子积K w。