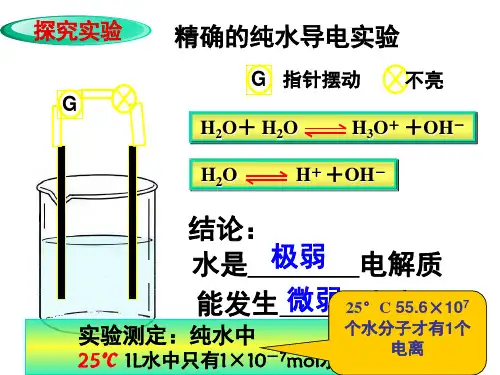
3、溶液酸碱性与
pH
c(H+液酸碱性与c(H+)、pH的关 4
系:
5
⑴ pH 越小, c(H+) 越大, 6
7
酸性越强;
8
(2)pH 越大,c(OH-)越大, 碱性越强。
9 10 11
12
常温下
13 14
C(H+) C(OH-)
100
酸
10-1 性
10—2 10—3 10—4
例:25 ℃时,10mL 0.1mol/L NaOH和10mL 0.05 mol/L Ba(OH)2 混合,计算混合溶液的pH值
解:c(OH-)Ⅰ=0. 1mol/L c (OH-)Ⅱ=0.1mol/L
c (OH-)混合=
0.110 0.110 0.1mol / L 20
c(H+)混合=
Kw c(OH )
pH = - lg 0.1 = 1
关键:抓住氢离子进行计算!
练习:pH=2的盐酸溶液和0.00005 mol/L的硫酸溶液等体积混合, 试计算混合溶液的pH值
解:c (H+)Ⅰ=0.01 mol/L c (H+)Ⅱ=0.0001 mol/L
c
(H+)混合= 0.01V
0.0001V 2V
0.005mol / L
①强酸溶液稀释,先求出稀释后的c(H+),再求pH ②强碱溶液稀释,先求出稀释后的c(OH-),再求 pOH或pH ③ 无限稀释的溶液应考虑水的电离,25℃,溶液pH无限接近于7。
即酸溶液无论怎样稀释pH不可能大于7成为碱溶液,碱 溶液无论怎样稀释pH不可能小于7成为酸溶液
c(H+) = c(OH-)= Kw 常温下,c(H+) = c(OH-)= Kw =10-7mol/L