铝及其化合物有关反应现象及图象
- 格式:doc
- 大小:6.37 MB
- 文档页数:3




与铝有关的图像分析一、向AlCl 3溶液中滴加NaOH 溶液 O ~A 段:()Al OH Al OH 333+-+=↓A ~B 段:()Al OH OH AlO H O 3222+=+--从图1不难看出,向氯化铝溶液中滴加氢氧化钠溶液,若达不到最大沉淀量时,对应的氢氧化钠溶液的体积有两种情况:一是氯化铝过量即加入的氢氧化钠不足;二是加入的氢氧化钠将生成的氢氧化铝溶解了一部分。
图1二、向强碱溶液中滴入铝盐溶液:先无沉淀,当Al 3+全部转化为AlO 2-时,再加入铝盐溶液,则偏铝酸盐与铝盐溶液发生了相互促进水解的反应,产物都是()Al OH 3。
如图3所示:图3发生反应的离子方程式为: O ~A 段:Al OH AlO H O 32242+--+=+A ~B 段:()AlAlO H O Al OH 3223364+-++=↓三、向铝盐溶液中滴入氨水或向氨水中滴加铝盐溶液(I )向铝盐中滴加氨水时,当氨水增加到()()n Aln NH H O 33213+=:·:时,产生最大沉淀量如图4所示。
图4(II )向氨水中滴加铝盐溶液时,开始时氨水过量,如图5所示,离子反应方程式为:()3332334NH H O Al Al OH NH ·+=↓+++图5由图4与图5不难看出,氢氧化铝沉淀是不溶于弱碱氨水中的。
四、向偏铝酸盐溶液中滴入强酸当()()n AlO n H 211-+=::时,产生最大沉淀量,继续滴入强酸,沉淀逐渐溶解。
如图6所示。
图6五、向盐酸中滴加偏铝酸盐溶液滴入的偏铝酸钠先与盐酸反应生成()Al OH 3沉淀,继而马上被盐酸溶解,反应方程式为:42232H AlO Al H O +-++=+继续滴加的NaAlO 2则与Al3+发生水解反应,离子方程式为:()Al AlO H O Al OH3223364+-++=↓沉淀量的变化可用图7表示。
图7六、向NaAlO2溶液中通入CO2由于产生的()Al OH3沉淀不溶解在碳酸中,产生的沉淀不消失,如图8所示。



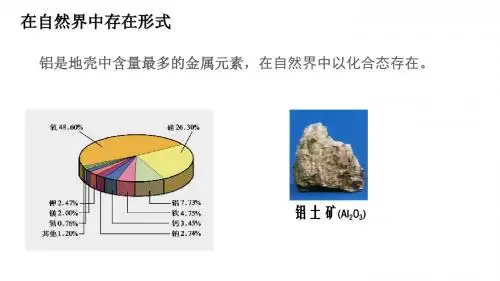
铝及其重要化合物一、铝1.物理性质:银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
2.化学性质:(1)与非金属单质的反应:①铝与O 2反应:Al+3O 22Al 2O 3(在纯氧中,剧烈燃烧,发出耀眼的白光)②铝与S 反应:2Al+3SAl 2S3③铝与Cl 2反应:2Al +3Cl 2=====点燃2AlCl 3(2)与金属氧化物的反应(铝热反应):2Al+Fe 2O 32Fe+Al 2O 3 ;4Al+3MnO 23Mn+2Al 2O 3(3)铝与非氧化性酸反应:2Al + 6HCl =2Al Cl 3 + 3H 2↑ 2Al + 3H 2SO 4 =Al 2(SO 4)3 + 3H 2↑(4)铝与氧化性酸反应:遇冷的浓硫酸或浓硝酸钝化。
在加热条件下可与浓硫酸、浓硝酸反应但无H 2产生。
(5)铝与氢氧化钠溶液的反应:铝和碱溶液反应,不是直接和碱反应,而是铝先和强碱溶液中的水反应生成Al(OH)3,然后Al(OH)3再和强碱反应生成偏铝酸盐。
2Al +6H 2O=2Al(OH)3+3H 2↑, Al(OH)3+NaOH=2NaAlO 2+2H 2O总反应化学方程式为:2Al +2H 2O +2NaOH=2NaAlO 2+3H 2↑,其中氧化剂只是H 2O ,而不是NaOH 。
3.制备:工业上采用电解法:2Al 2O 3=====电解4Al +3O 2↑4.用途:纯铝用作导线(不能用作电缆线),铝合金用于制造汽车、飞机、生活用品等。
二、氧化铝(1)物理性质:高熔点,高沸点,高硬度,难溶于水的白色固体。
(2)化学性质:氧化铝难溶于水,却能溶于酸或强碱溶液中。
Al 2O 3 + 6HCl =2AlCl 3 + 3H 2O Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O因此说Al 2O 3是两性氧化物(既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氧化物。


铝及其重要化合物一、铝1.物理性质:银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
2.化学性质:(1)与非金属单质的反应:①铝与O 2反应:Al+3O 22Al 2O 3(在纯氧中,剧烈燃烧,发出耀眼的白光)②铝与S 反应:2Al+3SAl 2S3③铝与Cl 2反应:2Al +3Cl 2=====点燃2AlCl 3(2)与金属氧化物的反应(铝热反应):2Al+Fe 2O 32Fe+Al 2O 3 ;4Al+3MnO 23Mn+2Al 2O 3(3)铝与非氧化性酸反应:2Al + 6HCl =2Al Cl 3 + 3H 2↑ 2Al + 3H 2SO 4 =Al 2(SO 4)3 + 3H 2↑(4)铝与氧化性酸反应:遇冷的浓硫酸或浓硝酸钝化。
在加热条件下可与浓硫酸、浓硝酸反应但无H 2产生。
(5)铝与氢氧化钠溶液的反应:铝和碱溶液反应,不是直接和碱反应,而是铝先和强碱溶液中的水反应生成Al(OH)3,然后Al(OH)3再和强碱反应生成偏铝酸盐。
2Al +6H 2O=2Al(OH)3+3H 2↑, Al(OH)3+NaOH=2NaAlO 2+2H 2O总反应化学方程式为:2Al +2H 2O +2NaOH=2NaAlO 2+3H 2↑,其中氧化剂只是H 2O ,而不是NaOH 。
3.制备:工业上采用电解法:2Al 2O 3=====电解4Al +3O 2↑4.用途:纯铝用作导线(不能用作电缆线),铝合金用于制造汽车、飞机、生活用品等。
二、氧化铝(1)物理性质:高熔点,高沸点,高硬度,难溶于水的白色固体。
(2)化学性质:氧化铝难溶于水,却能溶于酸或强碱溶液中。
Al 2O 3 + 6HCl =2AlCl 3 + 3H 2O Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O因此说Al 2O 3是两性氧化物(既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氧化物。
铝元素重要图象剖析1. 向AlCl 3溶液中滴加NaOH 溶液直至过量 原理:↓=+-+33)OH (Al OH 3Al (先)O H 2AlO OH )OH (Al 223+=+--(后)现象:先沉淀后溶解。
图1图象1的特点:图象通过坐标原点,且横坐标上的比值为3:1,A 点坐标为(3n ,n )。
2. 向NaOH 溶液中滴加AlCl 3溶液直至过量原理:OH 2AlO OH 4Al 223+=+--+(先) ↓=++-+3223)OH (Al 4O H 6AlO 3Al (后)现象:开始没有沉淀产生,中间产生沉淀,且最终沉淀不溶解。
图2图象2的特点:横坐标上的比值为“3:1”,A 点坐标为(4n ,4n )。
3. 向NaAlO 2溶液中滴加HCl 溶液直至过量原理:↓=+++-322)OH (Al O H H AlO (先)O H 3Al H 3)OH (Al 233+=+++(后)现象:先沉淀后溶解。
图3图象3的特点:图象通过坐标原点,横坐标上的比值为“1:3”,A 点坐标为(n ,n )。
4. 向盐酸溶液中滴加NaAlO 2溶液直至过量原理:O H 2AlH 4AlO 232+=+++-(先) ↓=++-+3223)OH (Al 4O H 6AlO 3Al (后)现象:首先没有沉淀,中间产生沉淀,且最终沉淀不溶解。
图4图象4的特点:横坐标上的比值为“1:3”,A 点坐标为(4n ,4n )。
5. 向NaAlO 2溶液中通入CO 2气体至过量原理:222CO O H 3AlO 2++-(少量)-+↓=233CO )OH (Al 2 222CO O H 2AlO ++-(足量)-+↓=33HCO )OH (Al现象:产生的沉淀逐渐增多,且最终沉淀不溶解。
图5图象5的特点:图象通过坐标原点,先上升后平行(平行于横坐标)。
6. 向AlCl 3溶液中滴加氨水原理:+++↓=⋅+43233NH 3)OH (Al O H NH 3Al 现象:产生沉淀逐渐增多,达到最大值后保持不变。
实验操作实验现象离子方程式化学反应图象折点坐标
①AlCl3溶液中逐滴滴加氨水溶液至过量立即产生白
色沉淀→渐
多→最多→
沉淀不消失
Al3++3NH3·H2O═
Al(OH)3↓+3NH4+
Al(OH)3+NH3·H2O不反应
(3n,n)
②AlCl3溶液中滴加NaOH 溶液至过量立即产生白
色沉淀→渐
多→最多→
渐少→消失
Al3++3OH-═Al(OH)3↓
Al(OH)3+OH-═AlO2- +2H2O
(3n,n)
③NaAlO2溶液中缓慢通人CO2立即产生白
色沉淀→渐
多→最多→
沉淀不消失
2AlO2-+CO2+3H2O═
2Al(OH)3↓+CO32-
Al(OH)3+CO2+H2O不反应
CO2少量(,
n)
或CO2过量
(n,n)
④NaAlO2溶液中逐滴滴加稀盐酸溶液至过量立即产生白
色沉淀→渐
多→最多→
渐少→消失
AlO2-+H++H2O═Al(OH)3↓
Al(OH)3+3H+═Al3++2H2O
(n,n)
⑤NaOH 溶液中逐滴加入AlCl3溶液至过量无沉淀(有但
即溶)→出现
沉淀→渐多
→最多→沉
淀不消失
Al3++4OH-═AlO2-+2H2O
3AlO2-+Al3++6H2O═4Al(OH)3↓
(4n,4n)
⑥盐酸中逐滴加入NaAlO2溶液至过量无沉淀(有但
即溶)→出现
沉淀→渐多
→最多→沉
淀不消失
AlO2-+4H+═Al3++2H2O
3AlO2-+Al3++6H2O═4Al(OH)3↓
(4n,4n)
⑦AlCl3溶液中滴加NaAlO2溶液立即产生白
色沉淀→渐
多→最多→
沉淀不消失
3AlO2-+Al3++6H2O═4Al(OH)3↓
(3n,4n)
⑧NaAlO2溶液中滴加AlCl3溶液立即产生白
色沉淀→渐
多→最多→
沉淀不消失
3AlO2-+Al3++6H2O═4Al(OH)3↓
(n,4n)
1
实验操作实验现象化学反应图象离子方程式折点坐标
①AlCl3溶液中逐滴滴加氨水溶液至过量立即产生白
色沉淀→渐
多→最多→
沉淀不消失
Al3++3NH3·H2O═Al(OH)3↓+3NH4+
Al(OH)3+ NH3·H2O不反应
(3n,n)
②AlCl3溶液中滴加NaOH溶液至过量立即产生白
色沉淀→渐
多→最多→
渐少→消失
Al3++3OH-═ Al(OH)3↓
Al(OH)3+OH- ═AlO2- +2H2O
(3n,n)
③NaAlO2溶液中缓慢通人CO2立即产生白
色沉淀→渐
多→最多→
沉淀不消失
2AlO2-+CO2+3H2O═
2Al(OH)3↓+CO32-
Al(OH)3+CO2+H2O不反应
CO2少量(,n)
或CO2过量
(n,n)
④NaAlO2溶液中逐滴滴加稀盐酸溶液至过量立即产生白
色沉淀→渐
多→最多→
渐少→消失
AlO2 - +H++H2O═Al(OH)3↓
Al(OH)3+3H+═Al3++2H2O
(n,n)
⑤NaOH 溶液中逐滴加入AlCl3溶液至过量无沉淀(有但
即溶)→出现
沉淀→渐多
→最多→沉
淀不消失
Al3++4OH- ═ AlO2-+2H2O
3AlO2-+Al3++6H2O ═ 4Al(OH)3↓
(4n,4n)
⑥盐酸中逐滴加入NaAlO2溶液至过量无沉淀(有但
即溶)→出现
沉淀→渐多
→最多→沉
淀不消失
AlO2- +4H+═Al3++2H2O
3AlO2- +Al3++6H2O═4Al(OH)3↓
(4n,4n)
⑦AlCl3溶液中滴加NaAlO2溶液立即产生白
色沉淀→渐
多→最多→
沉淀不消失
3AlO2-+Al3++6H2O═4Al(OH)3↓
(3n,4n)
⑧NaAlO2溶液中滴加AlCl3溶液立即产生白
色沉淀→渐
多→最多→
沉淀不消失
3AlO2-+Al3++6H2O═4Al(OH)3↓
(n,4n)
3
Al
3+
AlO 2
-
Al (OH )3
(1) (2) (3) (4)
(5)
(6)
(8)
(7)。