乙醇和乙酸的性质
- 格式:doc
- 大小:16.24 KB
- 文档页数:14


乙醇和乙酸互溶乙醇和乙酸是常见的有机化合物,它们都是由碳、氢、氧三种元素组成的。
乙醇,化学式为C2H5OH,是一种无色、可燃的液体,常用作溶剂和消毒剂。
而乙酸,化学式为CH3COOH,是一种无色的液体,常用作食品添加剂和溶剂。
两者在一定条件下可以互溶,下面将详细介绍乙醇和乙酸的性质及其互溶性。
乙醇是一种醇类化合物,具有独特的物化性质。
乙醇在常温下为无色液体,具有特殊的香味。
它可与水混溶,因此被广泛应用于饮料和药物制造等领域。
乙醇具有较小的分子量和弱的分子间相互作用力,因此其沸点和熔点相对较低。
此外,乙醇还具有可燃性,能够与空气形成可燃气体混合物。
乙酸是一种有机酸,具有酸性和刺激性的气味。
它在常温下为无色液体,可与水混溶。
乙酸可由乙醇氧化制得,因此常用作酸度调节剂、食品保存剂和溶剂等。
乙酸的酸性较强,能够与碱反应生成盐和水。
乙醇和乙酸在一定条件下可以互溶。
这是因为乙醇和乙酸之间存在着一定的相容性。
乙醇和乙酸分子中都含有羟基(-OH)和羧基(-COOH),这两个官能团具有相似的化学性质,容易发生氢键作用。
乙醇和乙酸的氢键作用能够促使它们在一定比例下互相溶解。
在混合乙醇和乙酸的溶液中,乙醇和乙酸的分子会相互作用,形成氢键。
这些氢键会破坏纯乙醇和纯乙酸的分子间相互作用力,使得乙醇和乙酸的溶液具有较好的相容性。
当乙醇和乙酸的比例适当时,它们可以形成一个稳定的混合溶液,各自的分子均匀分散在其中。
乙醇和乙酸的互溶性受到温度和浓度的影响。
一般情况下,随着温度的升高,乙醇和乙酸的互溶性增强。
在较低的温度下,乙醇和乙酸的互溶性较差,可能会出现相分离的现象。
而在较高的温度下,乙醇和乙酸的互溶性较好,能够形成稳定的混合溶液。
乙醇和乙酸的互溶性还与浓度有关。
当乙醇和乙酸的浓度较低时,它们的互溶性较好;而当浓度较高时,互溶性会减弱。
这是因为较高浓度的乙醇和乙酸分子之间的相互作用力增强,使得它们更倾向于形成各自的相。
乙醇和乙酸是常见的有机化合物,它们在一定条件下可以互溶。



乙酸和乙醇共沸点
(实用版)
目录
1.乙酸和乙醇的物理性质
2.乙酸和乙醇的共沸点现象
3.乙酸和乙醇共沸点的应用
正文
乙酸和乙醇是两种常见的有机化合物,它们具有许多相似之处,但也存在一些不同点。
乙酸的分子式为 C2H4O2,是一种无色、有刺激性气味的液体,常用于调味品、制药和塑料制造等领域。
乙醇的分子式为 C2H6O,是一种无色、具有特殊香味的液体,常用于饮料、消毒和化工原料等方面。
乙酸和乙醇的一个重要共同特点是它们的共沸点。
共沸点是指两种或多种物质在恒定压力下,其蒸汽压与混合物的总压相等时的温度。
当乙酸和乙醇混合在一起并加热时,它们会在一个特定的温度下同时沸腾,这个温度就是它们的共沸点。
乙酸和乙醇的共沸点现象可以通过实验观察到。
将乙酸和乙醇混合在一起,然后加热,会发现在一个温度范围内,混合物的沸点保持不变,即使继续加热,也不会有明显的沸腾现象。
这是因为在这个温度下,乙酸和乙醇的蒸汽压与混合物的总压相等,达到了共沸状态。
乙酸和乙醇共沸点的应用主要体现在化工生产和实验研究中。
共沸点现象可以帮助研究人员了解两种物质的相互作用,以及它们在不同温度和压力下的行为。
此外,共沸点还可以用于提纯和分离混合物。
例如,在化工生产中,可以通过控制温度和压力,使乙酸和乙醇在一定条件下共沸,然后通过冷却或蒸馏等方法,将它们分离出来,以获得高纯度的产品。
第1页共1页。

乙醇和乙酸的分离乙醇和乙酸是常见的有机化合物,它们在实验室和工业生产中都有广泛的应用。
本文将探讨乙醇和乙酸的分离方法以及其在实际应用中的意义。
一、乙醇和乙酸的性质乙醇,化学式为C2H5OH,是一种无色、具有特殊气味的液体。
乙酸,化学式为CH3COOH,也是一种无色液体,具有刺激性的酸味。
乙醇和乙酸在物理性质和化学性质上都有一定的区别。
乙醇和乙酸的分离方法主要有蒸馏法和萃取法。
1. 蒸馏法蒸馏法是一种常用的分离纯化方法,适用于乙醇和乙酸的分离。
乙醇和乙酸的沸点分别为78.5℃和118℃,通过调控温度可以使乙醇和乙酸分别蒸发并收集。
这种方法简单、成本低,但对纯度要求较高,且不能分离含水的乙醇和乙酸。
2. 萃取法萃取法是一种将混合物中的成分分离的方法,通过溶剂的选择性溶解性来实现。
乙醇和乙酸在水中溶解度不同,可以利用这一特点进行分离。
例如,可以将乙醇和乙酸混合物与正己烷等非极性有机溶剂进行萃取,乙酸会更容易溶解于有机溶剂中,从而实现分离。
三、乙醇和乙酸的应用乙醇和乙酸在工业生产和日常生活中都有广泛的应用。
1. 乙醇的应用乙醇是一种重要的有机溶剂,在化学实验室和工业生产中被广泛使用。
它可以用于制备药物、染料、涂料等化学品,也可用作燃料和消毒剂。
此外,乙醇还是酒精饮料的主要成分之一,具有一定的生活应用价值。
2. 乙酸的应用乙酸是一种重要的化学原料,在染料、塑料、橡胶等行业中有广泛的应用。
它还可以用于制备醋酸纤维、乙酸乙酯等化学品。
此外,乙酸还被广泛用作食品酸味剂和防腐剂,在食品加工和保鲜中发挥重要作用。
四、乙醇和乙酸的分离在实际应用中的意义乙醇和乙酸的分离对于实验室和工业生产都具有重要意义。
在实验室中,乙醇和乙酸的分离可以用于纯化化学试剂,提高实验的准确性和可重复性。
同时,乙醇和乙酸的分离也为进一步研究它们的性质和应用提供了基础。
在工业生产中,乙醇和乙酸的分离可以用于纯化工业原料,提高产品的质量和纯度。
此外,乙醇和乙酸的分离还有助于减少对环境的污染,提高资源利用效率。
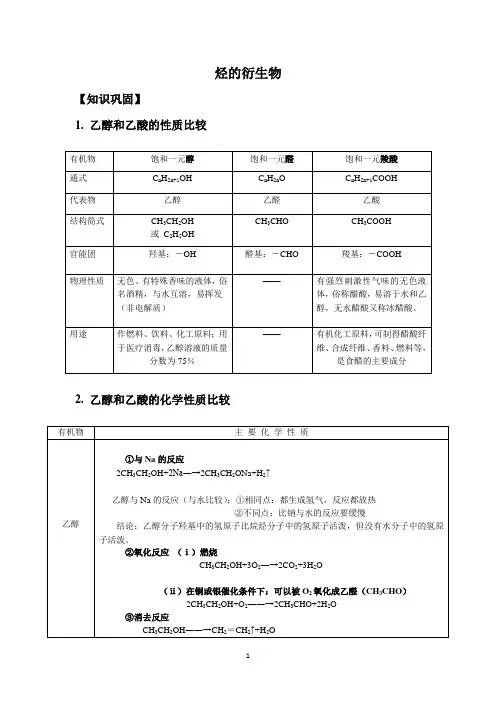
烃的衍生物【知识巩固】1. 乙醇和乙酸的性质比较2. 乙醇和乙酸的化学性质比较【专题练习】1.羟基的符号是( )A. OH B OH ―C -OHD HO ∙∙∙∙∙∙∙∙2.下列关于乙醇的物理性质的叙述中,错误的是( )A. 能与水任意比例互溶B. 可溶解多种无机物和有机物C.密度比水小D. 沸点比水高 3.比较乙烷和乙醇的结构,下列说法错误的是( )A.两个碳原子以单键相连B.分子里都含6个相同的氢原子C.乙基与一个氢原子相连就是乙烷分子D.乙基与一个羟基相连就是乙醇分子 4.CH 3CH 2OH 是生活中常见的有机物,下列对其性质的描述中不.正确的是: A .能够与金属Na 反应放出H 2 B .能够燃烧放出大量热量 C .能够使酸性高锰酸钾溶液褪色 D .能够使紫色石蕊溶液变红5. 若乙酸分子中的氧都是18O ,乙醇分子中的氧都是16O ,二者在浓H 2SO 4作用下发生反应,一段时间后,分子中含有18O 的物质有 ( ) A 1种 B 2种 C 3 种 D 4种6. 关于乙酸的下列说法中不正确的是 ( ) A .乙酸易溶于水和乙醇B.无水乙酸又称冰醋酸,它是纯净物C.乙酸是一种重要的有机酸,是有刺激性气味的液体D.乙酸分子里有四个氢原子,所以不是一元酸7. 某有机物蒸气,完全燃烧时需要三倍于其体积的氧气,产生二倍于其体积的二氧化碳,该有机物可能是()A.C2H4B.C2H5OH C.CH3CHO D.CH3COOH8. 只用水就能鉴别的一组物质是()A.苯,乙酸,四氯化碳B.乙醇,乙醛,乙酸C.乙醇,硝基苯,乙酸乙酯D.己烷,乙醇,甲醇9. 用一种试剂可以区分乙醇和乙酸的是()A.氢氧化钠溶液B.氨水C.碳酸钠溶液D.氢氧化铜10. 下列5个有机化合物中,能够发生酯化、加成和氧化3种反应的是①CH2=CHCOOH ②CH2=CHCOOCH3③CH2=CHCH2OH ④CH3CH2CH2OH⑤CH3CHCH2CHO|OHA.①③④B.②④⑤C.①③⑤D.①②⑤11. 质量为a g的铜丝放在空气中灼烧变黑,趁热放入下列物质中,铜丝变红,质量仍为a g 的是()A.CH3COOHB.HNO3C.CH3CH2OCH3D.CH3CH2CH2OH12. 下列物质中,能与醋酸发生反应的是:①石蕊②乙醇③甘油④金属铝⑤氧化镁⑥碳酸钙⑦氢氧化铜A.①③④⑤⑥⑦B.②③④⑤C. ①②④⑤⑥⑦D.全部13. 丙烯醇(CH2==CH—CH2OH)可发生的化学反应有()①加成②氧化③燃烧④加聚⑤取代A.只有①②③B.只有①②③④C.只有①②③④⑤D.只有①③④14. “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。

乙醇乙酸的知识点总结一、乙醇乙酸的化学性质1. 乙醇乙酸的化学式为C4H8O2,是一种无色、有毒的液体。
2. 乙醇乙酸是一种饱和脂肪酸,属于羧酸类化合物。
3. 乙醇乙酸是一种具有药物效果的化合物,可以用于制药工业及医药领域。
4. 乙醇乙酸是一种重要的化工原料,广泛应用于合成酯类化合物、溶剂、香料等。
5. 乙醇乙酸是一种具有腐蚀性的化合物,应注意其安全使用和储存。
6. 乙醇乙酸的密度为1.049 g/cm3,沸点为141°C,熔点为16.6°C。
二、乙醇乙酸的制备方法1. 乙醇乙酸可以通过乙烯氧化法制备,将乙烯与氧气经过催化剂的作用,生成乙醇,再通过氧化反应生成乙醇乙酸。
2. 乙醇乙酸还可以通过乙醇氧化法制备,将乙醇经过氧气氧化反应生成乙醇乙酸。
3. 乙醇乙酸还可以通过醋酸酐和乙醇反应生成,醋酸酐与乙醇反应生成乙酸乙酯,再通过水解反应生成乙醇乙酸。
三、乙醇乙酸的应用领域1. 乙醇乙酸是一种重要的工业原料,在化工领域广泛用于合成其他化合物,如醋酸丁酯、醋酸乙酯等。
2. 乙醇乙酸在医药领域具有抗菌、杀菌的功效,常用于制药工业生产药物。
3. 乙醇乙酸可以用作有机溶剂,在涂料、油墨、香料等行业有重要应用。
4. 乙醇乙酸也被广泛应用于食品添加剂领域,用作食品酸化剂和防腐剂。
四、乙醇乙酸的安全性及注意事项1. 乙醇乙酸是一种有毒化合物,长期暴露或高浓度接触可能对人体造成伤害,并且会对环境产生一定的危害。
2. 在使用乙醇乙酸时应注意其防护措施,避免接触皮肤和眼睛,同时避免吸入其蒸气。
3. 乙醇乙酸应储存在阴凉、干燥、通风的仓库中,远离火源和氧化剂,避免高温或直接阳光照射。
4. 在使用乙醇乙酸时应注意其蒸气的排放,避免对周围环境造成污染。
五、乙醇乙酸的环境影响及处理方法1. 乙醇乙酸对环境会产生一定的危害,长期暴露会导致土壤酸化、水源污染等问题。
2. 在工业生产和使用乙醇乙酸时,应采取相应的环保措施,减少其对环境造成的影响。

高考化学常见有机物知识点:乙醇、乙酸的性质乙醇结构简式CH?CH?OH或C?H?OH,化学式C?H?O,是最常见的一元醇,下文整理了高考化学常见有机物知识点:乙醇、乙酸的性质,希望可以帮助到大家!乙酸物理性质:乙酸在常温下是一种有强烈刺激性酸味的无色液体.乙酸的熔点为16.6℃(289.6 K).沸点117.9℃(391.2 K).相对密度1.05,闪点39℃,爆炸极限4%~17%(体积).纯的乙酸在低于熔点时会冻结成冰状晶体,所以无水乙酸又称为冰醋酸.乙酸易溶于水和乙醇,其水溶液呈弱酸性.乙酸盐也易溶于水.下为中华人民共和国关于工业乙酸的国家标准.乙醇物理性质:乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物,所以常用乙醇来溶解植物色素或其中的药用成分,也常用乙醇作为反应的溶剂,使参加反应的有机物和无机物均能溶解,增大接触面积,提高反应速率.例如,在油脂的皂化反应中,加入乙醇既能溶解NaOH,又能溶解油脂,让它们在均相(同一溶剂的溶液)中充分接触,加快反应速率,提高反应限度.乙酸化学性质:1、铁、镁和锌,反应生成氢气和金属乙酸盐.2、同样,乙酸也可以成酯或氨基化合物.如乙酸可以与乙醇在浓硫酸存在并加热的条件下生成乙酸乙酯(本反应为可逆反应,反应类型属于取代反应中的酯化反应).3、乙酸的酸性促使它还可以与碳酸钠、氢氧化铜、苯酚钠等物质反应等等.乙酸鉴别:乙酸可以通过其气味进行鉴别.若加入氯化铁(III),生成产物为深红色并且会在酸化后消失,通过此颜色反应也能鉴别乙酸.乙酸与三氧化砷反应生成氧化二甲砷,通过产物的恶臭可以鉴别乙酸.乙醇化学性质:1、乙醇分子中含有极化的氧氢键,电离时生成烷氧基负离子和质子.2、乙醇的酸性很弱,但是电离平衡的存在足以使它与重水之间的同位素交换迅速进行.CH3CH2OH+D2O→(可逆)CH3CH2OD+HOD3、因为乙醇可以电离出极少量的氢离子,所以其只能与少量金属(主要是碱金属)反应生成对应的醇金属以及氢气4、消去反应5、乙醇可以与空气中氧气发生剧烈的氧化反应产生燃烧现象,生成水和二氧化碳.6、乙醇可以在浓硫酸和高温的催化发生脱水反应,随着温度的不同生成物也不同7、乙醇具有还原性,可以被氧化成为乙醛.酒精中毒的罪魁祸首通常被认为是有一定毒性的乙醛,而并非喝下去的乙醇.小编为大家提供的高考化学常见有机物知识点:乙醇、乙酸的性质大家仔细阅读了吗?最后祝大家可以考上理想的大学。

乙酸和乙醇共沸点
摘要:
一、引言
二、乙酸和乙醇的性质
三、乙酸和乙醇共沸点的原理
四、影响共沸点的因素
五、实际应用与意义
正文:
乙酸和乙醇共沸点在化学领域是一个有趣的现象。
为了更好地理解这一现象,我们首先需要了解乙酸和乙醇的性质。
乙酸是一种有机酸,具有羧基(-COOH),具有酸性。
乙醇是一种醇类有机化合物,具有羟基(-OH),具有醇性。
当这两种物质混合在一起时,它们会发生相互作用,导致共沸点降低。
那么,乙酸和乙醇共沸点的原理是什么呢?这是因为混合物中的乙酸和乙醇分子间存在氢键。
氢键是一种较强的分子间作用力,可以降低混合物的沸点。
因此,当乙酸和乙醇混合时,它们的沸点会低于各自单独的沸点。
影响乙酸和乙醇共沸点的因素包括混合物的比例、压强和温度。
当混合物的比例发生变化时,共沸点也会相应地发生变化。
在一定压强下,共沸点随温度的升高而升高。
实际应用方面,乙酸和乙醇共沸点现象在化工生产中有重要意义。
例如,在酯化反应中,通过控制反应温度和压力,可以使反应更加完全。
此外,共沸
点现象还可以用于分离和提纯乙酸和乙醇等有机化合物。
总之,乙酸和乙醇共沸点是一个有趣的化学现象,其原理与实际应用具有重要意义。

乙醇和乙酸的结构与性质乙醇(C2H5OH),也被称为酒精,是最简单的醇类化合物。
乙醇的结构由乙基基团和一个羟基组成,它的化学式为C2H5OH,分子式为CH3CH2OH。
在乙醇分子中,碳原子通过共价键与氢原子和氧原子相连接。
乙基基团是一个碳原子和三个氢原子组成的基团,而羟基是一个氧原子和一个氢原子组成的基团。
乙醇分子中的碳原子是一个 sp3 杂化的碳原子。
乙醇具有无色、具有冰镇酒精的特有气味的液体。
乙醇是可溶的,可以与水、醚和大多数有机溶剂混合。
它的熔点为-114.14°C,沸点为78.24°C,密度为0.789 g/cm3乙醇的性质:1.对于人类来说,乙醇是一种中毒物质。
当人体摄取乙醇时,它会通过肝脏进行代谢,进而变成醋酸和二氧化碳,并最终以能量的形式释放出来。
2.乙醇可被氧化成乙醛,然后继续被氧化成乙酸。
乙酸(CH3COOH),也被称为醋酸,是一种有机酸。
乙酸的结构由一个乙基基团和一个羧基组成,它的化学式为CH3COOH。
在乙酸分子中,乙基基团是一个由一个碳原子和三个氢原子组成的基团,而羧基是一个由一个碳原子、一个氧原子和一个氢原子组成的基团。
乙酸分子中的碳原子是一个 sp2 杂化的碳原子。
乙酸是无色液体,具有强烈的刺激性气味。
它是可溶于水的,与醚和许多有机溶剂相容。
乙酸的熔点为16.635°C,沸点为118.1°C,密度为1.049 g/cm3乙酸的性质:1.在水中部分解为正离子氢离子和乙酸根离子。
这使得乙酸具有酸性反应,能与碱反应生成盐和水。
例如,乙酸与氢氧化钠反应生成乙酸钠和水。
2.乙酸可以与醇类反应,生成酯。
这个过程被称为酯化反应。
酯是由羧基的氧原子和醇的氧原子之间形成的酯键连接的。
在实际应用中,乙醇和乙酸都有广泛的用途。
乙醇被广泛用作溶剂、消毒剂和燃料。
乙酸主要用作化学中间体,在制药、涂料、食品和饮料等方面都有应用。
总之,乙醇和乙酸是两种重要的有机化合物,它们具有不同的结构和性质。
乙醇和乙酸互溶乙醇和乙酸是两种常见的有机物质,它们在化学性质上有很大的不同,但在一定条件下也可以相互溶解。
本文将从乙醇和乙酸的性质、溶解性以及应用等方面进行探讨。
我们来了解一下乙醇和乙酸的基本性质。
乙醇,也被称为酒精,是一种无色液体,具有刺激性气味,可溶于水和有机溶剂。
乙醇是一种饮用酒精,常用于酒精饮料的制作以及工业上的溶剂和燃料。
乙酸是一种具有酸性的有机化合物,常见的乙酸为无色液体,具有刺激性气味。
乙酸主要用于食品添加剂、工业溶剂和酸化剂等方面。
乙醇和乙酸在化学性质上有很大的不同。
乙醇是一种醇类化合物,具有羟基(-OH)官能团,因此具有醇的一般性质,如醇酸反应、氧化反应等。
乙酸则是一种酸类化合物,具有羧基(-COOH)官能团,因此具有酸的一般性质,如酸碱中和反应、酯化反应等。
乙醇和乙酸的化学性质差异使得它们在许多方面的应用都有所不同。
乙醇和乙酸在一定条件下可以相互溶解。
乙醇和乙酸都是极性分子,因此它们之间存在一定的相互作用力,使得它们能够互相溶解。
在一定温度下,当乙醇和乙酸的摩尔比例适当时,它们可以形成一种混合溶液。
这种混合溶液在化学实验和工业生产中有着广泛的应用。
乙醇和乙酸的溶解性与温度、压力以及溶剂的性质等因素都有关系,因此需要根据具体情况来确定最佳的溶解条件。
乙醇和乙酸的溶解性对一些实际问题有着重要的影响。
例如,在酿酒过程中,乙醇是主要的溶剂,可以将酿酒原料中的香气、色素和味道等物质溶解出来,从而提高酒的质量。
而乙酸则可以用作酸化剂,调节酒的酸度。
此外,乙醇和乙酸还可以用于制备醋酸乙酯等有机化合物,这些化合物在工业上有着广泛的应用。
总结起来,乙醇和乙酸是两种常见的有机物质,它们具有不同的化学性质和应用。
尽管乙醇和乙酸在化学性质上有所不同,但在一定条件下它们可以相互溶解,形成混合溶液。
乙醇和乙酸的溶解性对于一些实际问题具有重要的意义,它们在酿酒、有机合成等领域都有着广泛的应用。
通过对乙醇和乙酸的研究,我们可以更好地理解它们的性质和应用,为相关领域的发展和应用提供理论和实践支持。
乙酸与乙醇的反应方程式乙酸与乙醇的反应方程式引言乙酸和乙醇是常见的有机化合物,它们在日常生活中有广泛的应用。
乙酸是一种有机酸,常用于制作食品、药品和化妆品。
乙醇是一种有机醇,常见于酒精饮料、溶剂和清洁剂中。
本文将探讨乙酸与乙醇的反应方程式及其化学性质。
一、乙酸与乙醇的反应方程式乙酸(CH3COOH)与乙醇(C2H5OH)可以发生酯化反应,形成乙酸乙酯(醋酯)和水。
反应方程式如下:CH3COOH + C2H5OH →CH3COOC2H5 + H2O该反应是一个酯化反应,也是醇和酸之间常见的反应类型。
在反应中,羧酸中的羧基(COOH)脱去酸性氢离子(H+),形成酰基(COO-),而醇中的羟基(OH)脱去氢离子(H+),形成氧阴离子(O-)。
然后,酰基和氧阴离子通过一个酯键(C-O)结合在一起,形成酯分子。
二、乙酸乙酯的化学性质乙酸乙酯(醋酯)是一种无色液体,具有水果香味。
它易燃,可溶于有机溶剂如醇、醚和芳烃。
以下是乙酸乙酯的一些重要化学性质:1. 酯水解乙酸乙酯可以与水发生反应,水解成乙酸和乙醇。
反应如下:CH3COOC2H5 + H2O → CH3COOH +C2H5OH 该反应在酸性条件下进行,因为生成的乙酸作为催化剂加速了水解反应的进行。
2. 酯酸酯交换反应乙酸乙酯可以与其他羧酸酯发生酯酸酯交换反应。
在该反应中,酯的酰基与另一个酸酯的羟基发生交换,生成两个不同的酯。
CH3COOC2H5 +CH3COOCH3 → CH3COOCH3 + CH3COOC2H53. 酯在碱性条件下水解酯也可以在碱性条件下水解。
在此情况下,酯与碱反应生成相应的羧酸盐和醇。
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH 该反应常用于醋酸乙酯的工业合成中,通过碱水解醋酸乙酯制备醋酸。
三、应用乙酸乙酯在工业和日常生活中有广泛的应用。
以下是一些常见的应用领域:1. 溶剂由于乙酸乙酯具有良好的溶解性,它经常被用作有机溶剂。
高考乙醇乙酸知识点一、引言高考化学中的乙醇和乙酸是重要的有机化合物,学好它们的相关知识点,对于理解有机化学的基本概念和原理具有重要意义。
本文将重点介绍高考化学中与乙醇和乙酸相关的知识点。
二、乙醇的基本性质乙醇,化学式C2H5OH,是一种醇类化合物。
以下是乙醇的一些基本性质:1. 物理性质:(1)无色液体,具有特殊的酒精气味;(2)沸点约为78℃,密度约为0.79 g/mL;(3)可与水混溶,与很多有机物互溶;2. 化学性质:(1)乙醇可以被氧化,生成醛、酸等产物;(2)乙醇可以被还原,生成乙烷;(3)乙醇可发生酯化反应,生成乙酸乙酯等酯类产物。
三、乙酸的基本性质乙酸,化学式CH3COOH,是一种有机酸。
以下是乙酸的一些基本性质:1. 物理性质:(1)无色液体,具有刺激性气味;(2)沸点约为118℃,密度约为1.05 g/mL;(3)可与水混溶,生成酸性溶液;2. 化学性质:(1)乙酸具有酸性,可以与碱反应生成乙酸盐;(2)乙酸可以与醇反应,生成酯类物质;(3)乙酸可以被氧化,生成二氧化碳和水。
四、乙醇和乙酸的相关反应1. 醇的氧化反应:醇可以被氧化为酮、醛或羧酸。
乙醇氧化的反应方程式如下:C2H5OH + [O] → CH3CHO + H2OC2H5OH + 2[O] → CH3COOH + H2O2. 酸酐的酯化反应:酸酐可以与醇发生酯化反应,生成酯。
乙酸酐与乙醇酯化的反应方程式如下:CH3COOC2H5 + C2H5OH → CH3COOC2H5 + H2O3. 酯的水解反应:酯可以被酸性、碱性水解为醇和酸盐。
乙酸乙酯水解的反应方程式如下:CH3COOC2H5 + H2O → CH3COOH + C2H5OHCH3COOC2H5 + NaOH → CH3COONa + C2H5OH五、乙醇和乙酸在生活中的应用乙醇和乙酸在日常生活中有广泛的应用,例如:1. 乙醇:(1)用作消毒剂,可用于伤口消毒;(2)制备香精、饮料等;(3)作为溶剂,用于印刷、染料等行业。
乙醇和乙酸反应方程式一、前言乙醇和乙酸是我们生活中常见的有机化合物,它们在生产和日常生活中都有着广泛的应用。
当这两种化合物发生反应时,会产生什么样的结果呢?本文将从反应方程式的角度探讨乙醇和乙酸反应的过程。
二、乙醇和乙酸的结构与性质1. 乙醇乙醇是一种无色透明液体,具有刺激性气味。
其化学式为C2H5OH,分子量为46.07g/mol。
它是一种单元醇,由一个碳原子、一个氧原子和一个氢原子组成。
在常温下,它可以溶于水和大多数有机溶剂。
2. 乙酸乙酸是一种无色透明液体,具有刺激性气味。
其化学式为CH3COOH,分子量为60.05g/mol。
它是一种羧酸,由一个碳原子、两个氧原子和三个氢原子组成。
在常温下,它可以溶于水和大多数有机溶剂。
三、乙醇和乙酸反应方程式1. 酯化反应当乙醇和乙酸发生酯化反应时,会生成乙酸乙酯和水。
该反应需要加热,且需要催化剂存在。
反应方程式:CH3COOH + C2H5OH → CH3COOC2H5 + H2O该反应的机理是:在催化剂的作用下,乙醇中的羟基(-OH)与乙酸中的羧基(-COOH)发生缩合反应,形成一个新的羧基酯键(-C(=O)-O-),同时释放出一个水分子。
2. 氧化反应当乙醇和乙酸发生氧化反应时,会生成乙醛、乙酸和水。
该反应需要氧气或氧化剂存在,并且需要加热。
反应方程式:2C2H5OH + O2 → 2CH3CHO + 2CH3COOH + H2O该反应的机理是:在加热和氧气或氧化剂的作用下,两个乙醇分子先被氧化成为两个乙醛分子和两个水分子;而后,两个乙醛分子再被氧化成为两个乙酸分子和一个水分子。
四、乙醇和乙酸反应的应用1. 酯化反应的应用酯化反应是一种重要的有机合成方法,可以用于制备香料、染料、塑料等。
例如,乙酸乙酯可以用作溶剂、涂料和人造丝等材料的原料。
2. 氧化反应的应用氧化反应也是一种重要的有机合成方法,可以用于制备醛、羧酸等。
例如,乙醛可以用作溶剂、防腐剂和农药等;而乙酸可以用作食品添加剂、医药中间体和涂料等。
高一乙醇乙酸知识点总结乙醇与乙酸是我们日常生活中常见的有机化合物之一,它们具有一定的重要性和应用价值。
在高一化学学习中,对于乙醇和乙酸的了解是非常重要的。
本文将对乙醇与乙酸的相关知识点进行总结,以帮助同学们更好地理解和掌握这两种有机化合物。
一、乙醇的性质与应用1. 乙醇的结构和化学式乙醇的结构式为CH3CH2OH,化学式为C2H5OH,由于其中含有羟基(OH)官能团,因此乙醇也可以被称为醇类有机物。
2. 乙醇的物理性质乙醇是一种无色、气味芳香的液体,在室温下易挥发,可与水混溶。
乙醇的密度约为0.79 g/cm³,沸点约为78.5℃。
3. 乙醇的化学性质乙醇是一种具有醇的特性的有机化合物,具有醇的通性。
例如,乙醇可以与酸发生酯化反应,与碱发生醇化反应。
此外,乙醇还可被氧化剂如酸性高锰酸钾氧化为乙醛或乙酸等化合物。
4. 乙醇的应用乙醇在工业、医药、化妆品等领域具有广泛的应用。
它可以作为溶剂、消毒剂和燃料等。
此外,乙醇还可以用于制备醋酸乙酯、氯仿等有机化合物。
二、乙酸的性质与应用1. 乙酸的结构和化学式乙酸的结构式为CH3COOH,化学式为C2H4O2,乙酸是一种含有羧基(COOH)官能团的有机化合物。
2. 乙酸的物理性质乙酸是一种具有刺激性气味的无色液体,密度约为 1.05 g/cm³,沸点约为118℃。
乙酸可与水混溶,但不能与非极性溶剂如石油醚混溶。
3. 乙酸的化学性质乙酸是一种弱酸,可与碱发生酸碱中和反应生成对应的盐和水。
乙酸也可以发生酯化反应,与醇类反应生成相应的酯。
4. 乙酸的应用乙酸广泛应用于化学工业、食品工业等领域。
它可以作为食品酸味剂的添加剂,也可以用于制备乙酸乙酯、乙酸纤维素等化合物。
此外,乙酸还可以用于制取醋酐、染料等。
三、乙醇与乙酸的相互转化1. 乙醇转化为乙酸乙醇经过氧化反应可以转化为乙醛,再进一步氧化则转化为乙酸。
常见的乙醇氧化剂有酸性高锰酸钾等。
2. 乙酸还原为乙醇乙酸在适当条件下可以被还原为乙醇。
乙醇、乙醛和乙酸的性质比较
乙醇、乙醛和乙酸是三种常见的有机化合物,它们具有不同的化学性质和物理性质。
下面是它们的一些性质比较:
1. 分子式:乙醇的分子式为C2H5OH,乙醛的分子式为CH3CHO,乙酸的分子式为
CH3COOH。
2. 结构:它们的分子结构都由碳、氢和氧原子组成。
乙醇分子中的羟基(-OH)使它具有醇类化合物的通性,乙醛分子中的醛基(-C=O)使它具有醛类化合物的通性,而乙酸分子中的羧基(-COOH)使它具有羧酸类化合物的通性。
3. 溶解性:它们在不同溶剂中的溶解性不同。
乙醇可以与水、醇、酯和醚等溶剂混溶,乙醛可以与水、醇和醚等溶剂混溶,而乙酸可以与水、醇和酯等溶剂混溶。
4. 化学性质:它们具有不同的化学性质。
乙醇可以与氧化剂反应生成乙醛,乙醛可以进一步氧化为乙酸。
乙醛还可以与还原剂反应还原为乙醇。
乙酸可以与碱反应生成盐,可以与醇反应生成酯,还可以与氨反应生成酰胺等。
5. 物理性质:它们的物理性质也不同。
乙醇在常温下是液体,具有特殊的气味和辛辣的味道,易燃,其蒸汽可以与空气形成爆炸性混合物。
乙醛在常温下是液体,具有刺激性气味,易挥发,其蒸汽可以与空气形成爆炸性混合物。
乙酸在常温下是固体,具有强烈的刺激性气味,易溶于水,其蒸汽可以与空气形成爆炸性混合物。
总之,乙醇、乙醛和乙酸具有不同的化学性质和物理性质,这是由于它们分子结构的不同和极性的差异导致的。
这些性质在化学、工业和日常生活中都有广泛的应用。
1、烃的衍生物:烃的衍生物是指烃分子里的氢原子被其他原子或原子团取代所生成的一系列新的有机化合物。
2、官能团:官能团是指决定化合物化学特性的原子或原子团. 常见的官能团有:卤素原子(—X)、羟基(—OH)、醛基(—CHO)、羧基(—COOH)、硝基(—NO2)、磺酸基(—SO3H)、氨基(—NH2)等。
C=C和C≡C也分别是烯烃和炔烃的官能团。
有机物的性质是由其官能团决定的,一种物质具有几种官能团,它就具有这几类物质的性质。
因此,掌握烃及衍生物中各类物质的性质,是解答多官能团物质性质的关键。
(一)乙醇1、乙醇的分子结构乙醇的分子式为C2H6O,结构式为:,结构简式为CH3CH2OH或C2H5OH,它的官能团是-OH(羟基),-OH决定乙醇的特殊性质,乙醇分子是极性分子。
2、乙醇的物理性质乙醇是无色透明而有特殊香味的液体,密度比水小,沸点为78.5 ℃,易挥发,乙醇的官能团-OH是亲水基团,能和水以任意比混溶,本身是良好的有机溶剂,能溶解多种有机物和无机物,正是由于乙醇能和水以任意比混溶,水中溶解的碘或溴不能用乙醇加以萃取。
含乙醇99.5%(质量分数)以上的酒精叫做无水酒精。
制取无水酒精时,通常需要把工业酒精跟新制的生石灰混合,加热蒸馏才能制得。
3、乙醇的化学性质乙醇在发生化学反应时,其分子中有几处化学键可以发生断裂,表现出不同的化学性质。
(1)与K、Ca、Na、Mg、Al等活泼金属反应时,a键断裂,发生置换反应2CH3CH2OH+2Na→2CH3CH2ONa +H2↑此反应比钠与水反应要缓和得多,说明乙醇羟基上的氢原子活泼性小于水分子中的氢原子,乙醇比水难电离,乙醇是非电解质,水是弱电解质。
(2)氧化反应①燃烧:乙醇燃烧时放出大量的热,常被用作酒精灯和内燃机的燃料。
燃烧消耗氧气的量与乙烯相同,燃烧生成二氧化碳和水的量与乙烷相同。
CH3CH2OH+3O2 2CO2+3H2O②催化氧化:乙醇的催化氧化,常用的催化剂是银或铜。
如果将光亮的铜丝放在酒精灯火焰上灼烧,然后再趁热插入乙醇中,将发现铜丝先由紫红色变为黑色,插入乙醇中后,又变为紫红色,同时在乙醇中生成乙醛,可闻到乙醛的刺激性气味。
如果与羟基相连接碳原子上没有氢原子,则不能发生催化氧化。
如(CH3)3COH,就不能发生催化氧化反应,而CH3OH可以发生催化氧化反应。
③乙醇能被酸性高锰酸钾溶液或酸性重铬酸钾氧化生成乙酸,使溶液褪色。
※(3)脱水反应①分子内脱水(消去反应):醇发生消去反应时,是羟基和与羟基相连接碳原子相邻的碳原子上氢原子一起结合成水脱去,如果与羟基相连接碳原子相邻的碳原子上无氢原子,则不能发生消去反应。
②分子间脱水(取代反应):该反应中,每两个乙醇分子脱去一个水分子,形成的化合物仍然是饱和的,因而该反应是取代反应而不是消去反应。
【归纳总结】乙醇的分子结构与化学性质的关系4、乙醇的制备(1)乙烯水化法:(2)发酵法:淀粉→葡萄糖→乙醇5、乙醇的主要用途乙醇有相当广泛的用途,是一种重要的有机化工原料,可用它制取乙酸、乙醚等。
乙醇还可用作燃料、制造饮料和香精。
它还是一种有机溶剂,用于溶解树脂、制造染料。
在医疗上常用75%(体积分数)的酒精作消毒剂。
(二)乙酸1、乙酸的分子结构乙酸的分子式为C2H4O2,结构简式为CH3COOH,官能团为羧基(—COOH)。
从结构上看,乙酸是羧基(—COOH)和甲基相连接而成的。
由于乙酸分子中羰基和羟基的相互影响,使羟基上的氢更活泼,在水溶液中能部分电离出氢离子,乙酸是一种典型的有机弱酸;羟基的存在也使羰基的加成反应相当困难,很难与氢气等发生加成反应。
2、乙酸的物理性质乙酸是无色、有强烈刺激性气味的液体,乙酸在温度低于它的熔点(16.6℃)时会变成冰状晶体,所以无水乙酸又叫冰醋酸。
乙醇易溶于水和有机溶剂。
3、乙酸的化学性质(1)弱酸性:CH3COOH在水溶液里部分电离产生H+,从而使乙酸具有酸的通性。
①乙酸能使紫色石蕊试液变红:CH3COOHCH3COO-+H+②乙酸可与活泼金属反应放出氢气:Zn+2CH3COOH=(CH3COO)2Zn +H2↑③与碱发生中和反应:Cu(OH)2+2CH3COOH=(CH3COO)2Cu +2H2O④与碱性氧化物反应:CuO+2CH3COOH=(CH3COO)2Cu + H2O⑤与某些盐反应:CaCO3+2CH3COOH=(CH3COO)2Ca +CO2↑+ H2O此反应证明乙酸的酸性强于碳酸,常见几种物质的酸性强弱顺序为:乙酸 >碳酸>苯酚>HCO3-(2)酯化反应:醇和酸相互作用生成酯和水的反应叫做酯化反应。
①酯化反应属于取代反应,酯化反应的反应机理是羧酸分子中羧基上的羟基跟醇分子中羟基上的氢原子结合生成水,其余部分相互结合成酯。
研究有机反应的过程通常采用同位素示踪原子法。
②饱和Na2CO3溶液液面上有透明的不溶于水的油状液体产生,并可以闻到香味,这种有香味的液体叫乙酸乙酯。
酯化反应的产物是酯,一般由有机酸与醇脱水而成。
③试剂的加入次序:先加乙醇,后加乙酸,再加浓H2SO4。
④长导管起冷凝回流的作用,导管口不能插入饱和Na2CO3溶液的液面下,防止倒吸。
⑤饱和Na2CO3溶液的作用:吸收挥发出的乙酸;溶解挥发出的乙醇;降低乙酸乙酯的溶解性。
⑥浓H2SO4的作用:催化剂和吸水剂。
4、乙酸的用途乙酸是一种重要的有机化工原料,用途极为广泛,可用于生产醋酸纤维、合成纤维(如维纶)、喷漆溶剂、香料、染料、医药以及农药等。
(三)酯1、结构式:(其中两个烃基R和R,可不一样,左边的烃基还可以是H)2、物理性质:低级酯是具有芳香气味的液体,密度比水小,难溶于水,易溶于有机溶剂。
3、酯的水解:【比较归纳】酯化反应与水解反应的比较:酯化水解反应关系酯化水解RCOOH+ROHRCOOR+H2O催化剂浓硫酸稀硫酸或NaOH溶液催化剂的其它作用吸水,提高CH3COOH和C2H5OH的转化率NaOH中和酯水解生成的CH3COOH,提高酯的水解率加热方式直接加热热水浴加热反应类型酯化反应,取代反应水解反应,取代反应【归纳总结】有机方程式书写(1)有机物用结构简式表示(原因:分子式相同的有机物不一定是同种物质)。
(2)标明反应必须的条件(原因:有机反应只有在一定条件下才能发生;反应条件不同,反应产物和反应类型均有可能不同)。
(3)要配平,不漏写其他生成物(原因:遵循质量守恒定律)。
(4)反应物和生成物连接要用“→”(原因:有机反应副反应多)。
【典型例题】例1. (2006上海,9)二甘醇可用作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。
二甘醇的结构简式是HO—CH2CH2—O—CH2CH2—OH。
下列有关二甘醇的叙述正确的是A. 不能发生消去反应B. 能发生取代反应C. 能溶于水,不溶于乙醇D. 符合通式CnH2nO3分析:由二甘醇的结构简式可以看出,分子中含有2个醇羟基,具有醇的性质,能发生取代反应和消去反应,又根据“相似相容”原理,它应该溶于水和乙醇,很明显组成不符合CnH2nO3,则答案选B。
答案:B例2. 下列关于乙酸的说法中正确的是()A. 乙酸是有刺激性气味的液体B. 乙酸分子中含有4个氢原子,它不是一元羧酸C. 乙酸在常温下能发生酯化反应D. 乙酸酸性较弱,不能使石蕊试液变红分析:乙酸是具有强烈刺激性气味的无色液体,尽管其分子中含有4个氢原子,但在水中只有羧基上的氢原子能发生部分电离,因此乙酸是一元酸。
乙酸的酸性较弱,但比碳酸的酸性强,它可使石蕊试液变红,乙酸在浓H2SO4存在下加热,可与醇类发生酯化反应,在常温下乙酸不能发生酯化反应,故本题答案为A。
答案:A例3. 白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成的实验是()①检验自来水中是否含氯离子②鉴别食盐和小苏打③蛋壳能否溶于酸④白酒中是否含甲醇A. ①②B. ①④C. ②③D. ③④分析:检验自来水中是否含氯离子需要硝酸银溶液和稀硝酸。
鉴别食盐和小苏打可利用NaHCO3能与酸反应放出气体而食盐不能。
蛋壳的成分是碳酸盐,能溶于酸并放出气体。
甲醇可用氧化为甲醛来检验。
上述所给物质中,食醋是酸,可用来检验②③。
]答案:C例4. 已知卤代烃在一定条件下既可发生水解,又可发生消去反应,现由2-溴丙烷为主要原料,制取1,2-丙二醇时,需要经过的反应是()A. 加成-消去-取代B. 消去―加成―取代C. 取代―消去―加成D. 取代―加成―消去分析:根据题意分析,卤代烃在一定条件下发生水解,就可以引入羟基,而在相邻的碳原子上分别引入一个羟基就需要首先在相邻的碳原子上分别引入一个卤素原子,这就需要得到烯烃,卤代烃发生消去反应就可以得到烯烃:答案:B例5. 下列说法正确的是()A. 能使溴水褪色的物质一定能和溴水发生加成反应B. 醇和酸作用,生成酯和水的反应叫酯化反应C. 乙醇脱水成醚、酯的水解、苯的硝化、皂化反应的实质都是取代反应D. 所有的醇都能被去氢氧化生成相应的醛或酮分析:A不对,苯酚使溴水褪色是和溴发生取代反应生成沉淀;B选项如果是醇和无氧酸(如氢卤酸)反应就不是酯化反应;D并不是所有的醇都能被去氢氧化,伯醇被催化去氢氧化生成相应的醛,仲醇被催化去氢氧化生成相应的酮,而叔醇不能被氧化。
答案:C例6. 已知实验室以乙醇为原料来制备乙酸乙酯时,经历了下面三步反应,已知反应①、反应②、反应③的转化率分别为a、b、c。
则由乙醇制乙酸乙酯时总的转化率为A. B. abc C. D. 2abc分析:本题考查对转化率概念的理解与运用。
由转化率求产物的量,要注意到反应所需的酸也来源于醇,因此,在计算醇转化为酯的总转化率时要考虑醇的上述消耗。
设有xmol乙醇,则可产生xamol乙醛,进而产生xabmol乙酸,另取xabmol乙醇与xabmol乙酸转化为酯,同时xabmol乙酸中也有xabcmol转化为酯,从源头上说,这些酸也是醇一步步氧化得来的。
故当有(x+xab)mol乙醇转化为乙酸乙酯时,共有2xabc乙醇发生了转化,转化率应为=。
答案:C例7. 维生素C的结构简式为:有关它的叙述错误的是A. 是一个环状的酯类化合物B. 易起氧化及加成反应C. 可以溶解于水D. 在碱性溶液中能稳定地存在分析:从维生素C的结构简式可以看出,其分子中有环状结构,且有,应属于环状酯类化合物,在碱性溶液中能水解;其分子式内有C==C双键,易起加成反应和氧化反应;其分子中有多个—OH,可溶于水。
答案:D例8. 苹果酸是一种常见的有机酸,其结构简式为:(1)在苹果酸中含有的官能团是(写名称):____________,_______________。