sjl-物质的分类、胶体
- 格式:ppt
- 大小:1.60 MB
- 文档页数:22


物质的分类知识总结
高一化学物质的分类知识总结(一)
1、掌握两种常见的分类方法:交叉分类法和树状分类法。
2、分散系及其分类:
(1)分散系组成:分散剂和分散质,按照分散质和分散剂所处的状态,分散系可以有9种组合方式。
(2)当分散剂为液体时,根据分散质粒子大小可以将分散系分为溶液、胶体、浊液。
3、胶体:
(1)常见胶体:Fe(OH)3胶体、Al(OH)3胶体、血液、豆浆、淀粉溶液、蛋白质溶液、有色玻璃、墨水等。
(2)胶体的特性:能产生丁达尔效应。
区别胶体与其他分散系常用方法丁达尔效应。
胶体与其他分散系的本质区别是分散质粒子大小。
(3)Fe(OH)3胶体的制备方法:将饱和FeCl3溶液滴入沸水中,继续加热至体系呈红褐色,停止加热,得Fe(OH)3胶体。
高一化学物质的分类知识总结(二)
一、物质的分类:
二.几种分散系的比较:
分散系溶液浊液胶体
分散质粒子的直径<1nm >100nm 1nm~100nm
分散质粒子
单个小分子
或离子巨大数目的
分子集合体
高分子或
多分子集合体
实例蔗糖溶液、NaCl溶
液
油水、石灰乳淀粉溶胶、AgI胶体
外观均一、透明不均一、不透明均一、透明稳定性稳定不稳定介稳定
能否透过滤纸能不能能
能否透过半透膜能不能不能
鉴别无丁达尔效应静置分层或沉淀丁达尔效应。

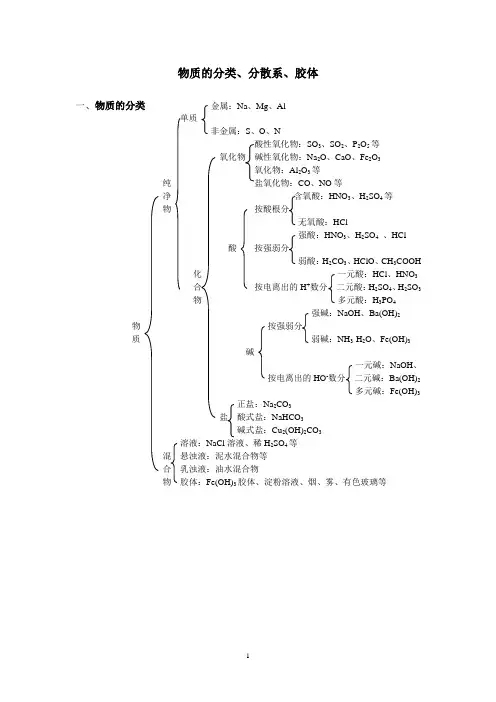
物质的分类、分散系、胶体一、物质的分类金属:Na、Mg、Al非金属:S、O、N酸性氧化物:SO3、SO2、P2O5等氧化物碱性氧化物:Na2O、CaO、Fe2O3氧化物:Al2O3等纯盐氧化物:CO、NO等净含氧酸:HNO3、H2SO4等物按酸根分无氧酸:HCl强酸:HNO3、H2SO4、HCl酸按强弱分弱酸:H2CO3、HClO、CH3COOH化一元酸:HCl、HNO3合按电离出的H+数分二元酸:H2SO4、H2SO3物多元酸:H3PO4强碱:NaOH、Ba(OH)2 物按强弱分质弱碱:NH3·H2O、Fe(OH)3碱一元碱:NaOH、按电离出的HO-数分二元碱:Ba(OH)2多元碱:Fe(OH)3正盐:Na2CO3盐酸式盐:NaHCO3碱式盐:Cu2(OH)2CO3溶液:NaCl溶液、稀H2SO4等混悬浊液:泥水混合物等合乳浊液:油水混合物物胶体:Fe(OH)3胶体、淀粉溶液、烟、雾、有色玻璃等二、分散系相关概念1、分散系:一种物质(或几种物质)以粒子形式分散到另一种物质里所形成的混合物,统称为分散系。
2、分散质:分散系中分散成粒子的物质。
3、分散剂:分散质分散在其中的物质。
4、分散系的分类:当分散剂是水或其他液体时,如果按照分散质粒子的大小来分类,可以把分散系分为:溶液、胶体和浊液。
分散质粒子直径小于1nm 的分散系叫溶液;分散质粒子直径在1~100nm (10-9~10-7m)之间的分散系称为胶体;分散质粒子直径大于100nm 的分散系叫做浊液。
⎢⎢⎢⎢⎢⎢⎢⎢⎣⎡⎩⎨⎧→→⎩⎨⎧→→→→⎥⎦⎤乳浊液悬浊液浊液胶气溶胶;液溶胶;固溶粒子胶体:分子胶体胶体溶液分散系分散剂分散质三、胶体1、胶体的定义:分散质粒子直径大小在1~100nm (10-9~10-7m)之间的分散系。
2、胶体的分类: ①根据分散质微粒组成的状况分类:如:3)(OH Fe 胶体胶粒是由许多3)(OH Fe 等小分子聚集一起形成的微粒,其直径在1~100nm (10-9~10-7m)之间,这样的胶体叫粒子胶体。




物质的分类(粘在教材P24—25)单质 金属单质。
如Na Mg Al Fe Hg非金属单质。
如H 2 N 2 O 2 F 2 Cl 2 He Br 2 I 2 S氢化物 非金属元素的气态氢化物(H 为+1价)。
如HCl H 2O H 2S NH 3 CH 4 金属元素的氢化物(H 为—1价)。
如NaH CaH 2纯 按 酸性氧化物(酸酐)——与水反应只生成酸、与碱反应生成盐和水。
非金属的氧化物组 金属的高价氧化物。
如CO 2 SO 2 SO 3 SiO 2 P 2O 5 Mn 2O 7 成 碱性氧化物(金属的低价氧化物——与水反应只生成碱、与酸反应生成盐和水)。
如 净 和 氧化物 Na 2O CaO MgO FeO Fe 2O 3 CuO性 两性氧化物(与强酸强碱都能反应生成盐和水)。
如Al 2O 3 (第三章学习) 质 不成盐氧化物(不能与酸、碱反应生成盐和水)。
如CO NO物 分 酸 强酸(都易溶于水、在水溶液中完全电离)。
如HCl H 2SO 4 HNO 3 HBr HI HClO 4 弱酸(在水溶液中少部分电离)。
如HF CH 3COOH H 2CO 3 H 2S H 2SiO 3 HClO(中强酸H 2SO 3H 3PO 4 也属于弱酸类)碱 强碱(活泼金属的氢氧化物,在水溶液中完全电离)。
如KOH Ca(OH)2 NaOH Ba(OH)2 化 弱碱(在水溶液中少部分电离)。
NH 3 H 2O M g (O H )2~AgOH(不活泼金属的氢氧化物) 正盐(由碱根离子和酸根离子组成)。
如NaCl Na 2SO 4 Na 2CO 3 Na 2SO 3 Na 2S Na 3PO 4 合 盐 酸式盐(由碱根离子和酸式根离子组成)。
如N a H S O 4 NaHCO 3 NaHSO 3 NaHS 碱式盐(由碱根离子和OH —、酸根离子组成,相当于由碱和盐组成)。
如Cu 2(OH)2CO 3物 复盐(由多种碱根离子和酸根离子组成,相当于由多种盐组成)。
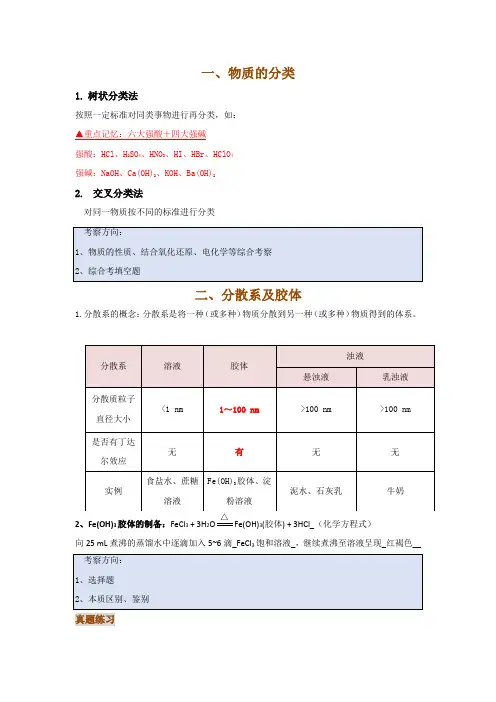
一、物质的分类1. 树状分类法按照一定标准对同类事物进行再分类,如: ▲重点记忆:六大强酸+四大强碱 强酸:HCl 、H 2SO 4、HNO 3、HI 、HBr 、HClO 4 强碱:NaOH 、Ca(OH)2、KOH 、Ba(OH)22. 交叉分类法对同一物质按不同的标准进行分类二、分散系及胶体1.分散系的概念:分散系是将一种(或多种)物质分散到另一种(或多种)物质得到的体系。
2、Fe(OH)3胶体的制备:FeCl 3 + 3H 2OFe(OH)3(胶体) + 3HCl_(化学方程式)向25 mL 煮沸的蒸馏水中逐滴加入5~6滴_FeCl 3饱和溶液_,继续煮沸至溶液呈现_红褐色__ 真题练习1、(2014年四川)下列物质分类正确的是()A.SO2、SiO2、CO均为酸性氧化物B.稀豆浆、硅酸、氯化铁溶液均为胶体C.烧碱、冰醋酸、四氯化碳均为电解质D.福尔马林、水玻璃、氨水均为混合物【答案】D【解析】CO是不成盐氧化物,不是酸性氧化物,A项错误;氯化铁溶液不是胶体,B项错误;四氯化碳是共价化合物,与水互不相溶,其在液态或水溶液条件下均不导电,属于非电解质,C项错误;福尔马林是质量分数为35%~40%的水溶液、水玻璃是指硅酸钠溶液、氨水是氨气的水溶液,均为混合物,D项正确。
2、(2019天津)下列离子方程式能用来解释相应实验现象的是()【答案】A【解析】本题考查化学实验现象分析及离子方程式正误判断,考查的核心素养是科学探究与创新意识、变化观念与平衡思想。
氢氧化镁悬浊液中存在沉淀溶解平衡Mg(OH)2Mg2++2OH,滴加氯化铵溶液,NH4+与OH结合生成NH3·H2O,Mg(OH)2的沉淀溶解平衡正向移动,离子方程式为Mg(OH)2+2NH4+Mg2++2NH3·H2O,A项正确;向沸水中滴加饱和氯化铁溶液,得到红褐色Fe(OH)3胶体而不是沉淀,B项错误;二氧化硫使酸性高锰酸钾溶液褪色,发生反应5SO2+2MnO4+2H2O5SO42+2Mn2++4H+,C项错误;氧化亚铁与稀硝酸发生氧化还原反应3FeO+10H++NO33Fe3++NO↑+5H2O,D项错误。