8分子式,电子式,结构简式,结构式
- 格式:doc
- 大小:30.00 KB
- 文档页数:1

8分子式电子式结构简式结构式分子式:分子式是用化学符号表示化合物中元素的种类和数目,如H2O表示水分子中含有2个氢原子和1个氧原子。
电子式:电子式是用化学符号和电子数目表示化合物中每个原子的电子排布,如氯气的电子式为Cl:2s^22p^6结构简式:结构简式是用化学式表示化合物的分子结构,如甲烷的结构简式为CH4,表示一个碳原子和四个氢原子通过共价键连接而成。
结构式:结构式是用化学符号和连接线表示化合物的分子结构,如乙醇的结构式为CH3CH2OH,表示一个乙基基团(CH3)和一个羟基(OH)连接在一个碳原子上。
以下是8个化合物的分子式、电子式、结构简式和结构式:1.水(H2O)分子式:H2O电子式:O:2s^22p^4结构简式:H2O结构式:H-O-H2.二氧化碳(CO2)分子式:CO2电子式:O:2s^22p^4,C:2s^22p^2结构简式:CO2结构式:O=C=O3.氯气(Cl2)分子式:Cl2电子式:Cl:3s^23p^5结构简式:Cl2结构式:Cl-Cl4.甲烷(CH4)分子式:CH4电子式:C:2s^22p^2,H:1s^1结构简式:CH4结构式:HH-C-HH5.乙醇(C2H5OH)分子式:C2H5OH电子式:C:2s^22p^2,H:1s^1,O:2s^22p^4结构简式:C2H5OH结构式:HHH-C-C-O-HH6.二氯甲烷(CH2Cl2)分子式:CH2Cl2电子式:C:2s^22p^2,H:1s^1,Cl:3s^23p^5结构简式:CH2Cl2结构式:ClHH-C-CCl7.硫酸(H2SO4)分子式:H2SO4电子式:H:1s^1,S:3s^23p^4,O:2s^22p^4结构简式:H2SO4结构式:OH-O-S-O-HO8.乙酸(CH3COOH)分子式:CH3COOH电子式:C:2s^22p^2,H:1s^1,O:2s^22p^4结构简式:CH3COOH结构式:HO/H-C-C=OO以上为8个化合物的分子式、电子式、结构简式和结构式,共计1208字。



分子式分子式是用元素符号表示物质(单质、化合物)分子的组成及相对分子质量的化学式。
有些物质确实由分子构成,在分子内原子间以共价键联结,而分子间以范德华力或氢键联结,这些物质就具有分子式。
如氧分子用O2 表示,氯化氢分子用HCl表示。
分子式不仅表示了物质的组成,更重要的,它能表示物质的一个分子及其成分、组成(分子中各元素原子的数目、分子量和各成分元素的重量比)。
所以分子式比最简式的含义广。
分子式和最简式不同,对化合物来说,它们的分子式是最简式的整数倍,或者说相对分子质量是最简式的整数倍。
仅当相对分子质量和最简式式量相同时,最简式才和分子式相同,这时最简式就是分子式。
当分子式相同时,也有可能不是一种物质,它们有可能是同分异构体。
例如氧的分子式是O2,表示1个氧分子由2个氧原子组成,分子量是31.9988。
又如乙酸的分子式是C2H4O2,表示1个乙酸分子由2个碳原子、4个氢原子和2个氧原子组成,分子量是60.05。
水分子的分子式为H2O,它表示1个水分子由2个氢原子和1个氧原子组成。
(图:分子式和结构式)分子式可示出物质的名称、相对分子质量、一个分子中所含元素的原子数目及元素质量比等。
结构式用元素符号和短线表示化合物(或单质)分子中原子的排列和结合方式的式子.如甲烷的分子结构式可以表示为:H∣H—C—H∣H结构式用—、=、≡分别表示1、2、3对共用电子;用→表示1对配位电子,箭头符号左方是提供孤对电子的一方,右方是具有空轨道、接受电子的一方。
结构式可以在一定程度上反映真正的分子结构和性质,但不能表示空间构型,如甲烷分子是正四面体,而结构式所示的碳原子和四个氢原子却都在同一平面上。
确定一个化合物的结构是一件相当艰巨而有意义的工作.测定有机化合物的方法有化学方法和物理方法.化学方法是把分子打成“碎片”,然后再从它们的结构去推测原来分子是如何由“碎片”拼凑起来的.这是人类用宏观的手段以窥测微观的分子世界.50年代前只用化学方法确定结构确实是较困难的.例如,很出名的麻醉药东莨菪碱,是由植物曼陀丹中分离出来的一种生物碱,早在1892年就分离得到,并且确定其分子式为C17H21O4N.但它的结构式直到1951年才肯定下来.按照现在水平来看,这个结构并不太复杂.近年来,应用现代物理方法如X衍射、各种光谱法、核磁共振谱和质谱等,能够准确、迅速地确定有机化合物的结构,大大丰富了鉴定有机化合物的手段,明显地提高了确定结构的水平.分子结构包括了分子的构造、构型和构象.构造是分子中原子成键的顺序和键性.以前叫做结构,根据国际纯粹和应用化学联合会的建议改为“构造”.表示化合物的化学式叫做构造式.由于有机化合物中存在着同分异构现象,因此一个分子式可能代表两种或两种以上具有不同结构的物质.在这种情况下,知道了某一物质的分子式,常常可利用该物质的特殊性质,通过定性或定量实验来确定其结构式.结构式不同而化学式相同不一定是同一种物质,其性质也往往不一样吗。




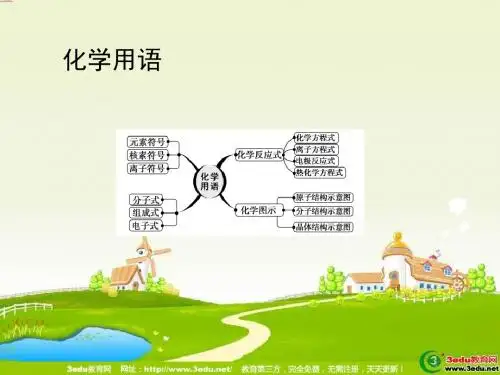
2014高考化学必考知识点:基本理论1、掌握一图(原子结构示意图)、五式(分子式、结构式、结构简式、电子式、最简式)、六方程(化学方程式、电离方程式、水解方程式、离子方程式、电极方程式、热化学方程式)的正确书写。
2、最简式相同的有机物:① CH:C2H2和C6H6② CH2:烯烃和环烷烃③ CH2O:甲醛、乙酸、甲酸甲酯④ CnH2nO:饱和一元醛(或饱和一元酮)与二倍于其碳原子数和饱和一元羧酸或酯;举一例:乙醛(C2H4O)与丁酸及其异构体(C4H8O2)3、一般原子的原子核是由质子和中子构成,但氕原子(1H)中无中子。
4、元素周期表中的每个周期不一定从金属元素开始,如第一周期是从氢元素开始。
5、ⅢB所含的元素种类最多。
碳元素形成的化合物种类最多,且ⅣA族中元素组成的晶体常常属于原子晶体,如金刚石、晶体硅、二氧化硅、碳化硅等。
6、质量数相同的原子,不一定属于同种元素的原子,如18O与18F、40K与40Ca7.ⅣA~ⅦA族中只有ⅦA族元素没有同素异形体,且其单质不能与氧气直接化合。
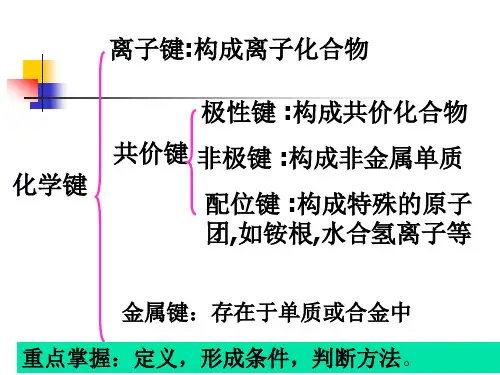
8、活泼金属与活泼非金属一般形成离子化合物,但AlCl3却是共价化合物(熔沸点很低,易升华,为双聚分子,所有原子都达到了最外层为8个电子的稳定结构)。
9、一般元素性质越活泼,其单质的性质也活泼,但N和P相反,因为N2形成叁键。
10、非金属元素之间一般形成共价化合物,但NH4Cl、NH4NO3等铵盐却是离子化合物。
11、离子化合物在一般条件下不存在单个分子,但在气态时却是以单个分子存在。
如NaCl。
12、含有非极性键的化合物不一定都是共价化合物,如Na2O2、FeS2、CaC2等是离子化合物。
13、单质分子不一定是非极性分子,如O3是极性分子。
14、一般氢化物中氢为+1价,但在金属氢化物中氢为-1价,如NaH、CaH2等。
15、非金属单质一般不导电,但石墨可以导电,硅是半导体。
16、非金属氧化物一般为酸性氧化物,但CO、NO等不是酸性氧化物,而属于不成盐氧化物。
什么是8电子结构。
10电子微粒。
这两个分别怎么判断什么是8电子结构。
10电子微粒。
这两个分别怎么判断8电子结构指的是最外层电子数为8的粒子,通常这种状态下的粒子是比较稳定的。
符合八电子结构的粒子主要有三类:①稀有气体分子。
如氖、氩、氪、氙、氡。
需要注意的是,氦虽然也是稀有气体,但是最外层只有两个电子。
②阳离子。
如钠离子、镁离子、氯离子等等。
③阴离子。
如氯离子、硫离子、氧离子等等。
10电子微粒则是指微粒的电子总数为10的微粒。
主要有:①一核:Ne、*N3-、O2-、F-、Na+、Mg2+、Al3+②二核:HF、OH-③三核:H2O、*NH2-④四核:NH3、H3O+⑤五核:CH4、NH4+这类物质容易在高考中的推断题中出现。
怎么判断8电子结构对于离子化合物,如NACL等,外层电子数等于本身电子数减化合价:如CL本身有7个电子,又夺取NA的一个电子,达到8电子结构。
NA本有1电子,被CL夺取,所以也有 8个(L层)对于共价化合物,电子是公用的,应用本身电子数+化学价的绝对值,如SO3种,S元素本有6个电子,又与O共用3乘以2等于6个,总共12个,所以不是8电子稳定结构。
希望你在做题中能慢慢体会这一点。
怎样判断8电子结构对于离子化合物,如NACL等,外层电子数等于本身电子数减化合价:如CL本身有7个电子,又夺取NA的一个电子,达到8电子结构。
NA本有1电子,被CL夺取,所以也有 8个(L层)对于共价化合物,电子是公用的,应用本身电子数+化学价的绝对值,如SO3种,S元素本有6个电子,又与O共用3乘以2等于6个,总共12个,所以不是8电子稳定结构。
某微粒电子结构为2 8 8失去2个电子变为原子是什么微粒电子结构为2 8 8,失去2个电子变为原子,说明该粒子是阴离子,是硫离子S2-,原子是S原子。
如何判断微粒中的每个原子是否都满足8电子结构?根据价电子数和成键的数目,价电子数加键数就是总共的电子数。
比如CO2,C的电子数就是最外层电子数4再加上四个键,也就是4+4=8.再比如H2O,O最外层是6,和H成两个键,6+2=8.这只是简单的,复杂的还有配合物的电子数演算法,那就不好说了。
有机化学总复习专题一:有机物的结构和同分异构体:(一)、有机物分子式、电子式、结构式、结构简式的正确书写:1、分子式的写法:碳-氢-氧-氮(其它元素符号)顺序。
2、电子式的写法:掌握7种常见有机物和4种基团:7种常见有机物:CH4、、C2H6、C2H4、、C2H2、CH3CH2OH、CH3CHO、CH3COOH。
4种常见基团:-CH3、-OH、-CHO、-COOH。
3、有机物结构式的写法:掌握8种常见有机物的结构式:甲烷、乙烷、乙烯、乙炔、乙醇、乙醛、乙酸、乙酸乙酯。
注意键的连接要准确,不要错位。
4、结构简式的写法:结构简式是结构式的简写,书写时要特别注意官能团的简写,烃基的合并。
要通过练习要能识别结构简式中各原子的连接顺序、方式、基团和官能团。
掌握8种常见有机物的结构简式:甲烷CH4、、乙烷C2H6、乙烯C2H4、、乙炔C2H2、乙醇CH3CH2OH、乙醛CH3CHO、乙酸CH3COOH、乙酸乙酯CH3COOCH2CH3。
(二)、同分异构体:要与同位素、同素异形体、同系物等概念区别,注意这四个“同”字概念的内涵和外延。
并能熟练地作出判断。
1、同分异构体的分类:碳链异构、位置异构、官能团异构。
2、同分异构体的写法:先同类后异类,主链由长到短、支链由整到散、位置由心到边。
3、烃卤代物的同分异构体的判断:找对称轴算氢原子种类,注意从对称轴看,物与像上的碳原子等同,同一碳原子上的氢原子等同。
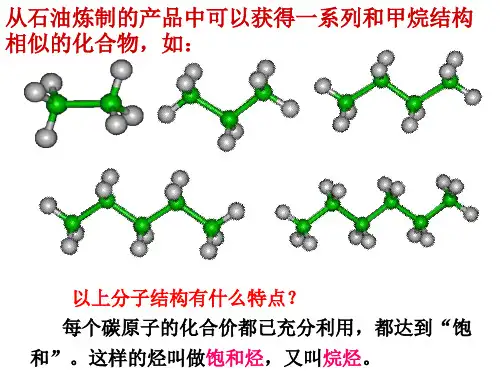
专题二:官能团的种类及其特征性质:(一)、烷烃:(1)通式:CnH2n+2,代表物CH4。
(2)主要性质:①、光照条件下跟卤素单质发生取代反应。
②、在空气中燃烧。
③、隔绝空气时高温分解。
(二)、烯烃:(1)通式:CnH2n,代表物CH2=CH2,官能团:(2)主要化学性质:①、跟卤素、氢气、卤化氢、水发生加成反应。
②、在空气中燃烧且能被酸性高锰酸钾溶液氧化。
③、加聚反应。
(三)、炔烃:(1)通式:CnH2n-2,代表物CH≡CH,官能团(2)主要化学性质:①、跟卤素、氢气、卤化氢、水发生加成反应。
电子式表示方法用电子式可以表示原子、离子、单质分子,也可表示共价化合物、离子化合物及其形成过程.电子式书写的注意事项:①无论何种微粒,其电子式都是由原子为基本单位组成的,不能出现角码甚至系数.②组成各种微粒的各个原子的电子式,必须力求均匀、对称.稳定的8电子结构通常表示为四对电子(一般为元素符号的上、下、左、右各一对电子).③电子式只能用于表示由主族元素形成的物质,不能表示由过渡元素形成的物质.电子式局限性较大,只能表述一小部分物质的结构.1)原子依据元素的原子最外层电子个数的多少,先用小黑点“•”(或“×”)等符号在元素符号上、下、左、右各表示出1个电子,多余的电子配对.例如:2)离子①阳离子:简单阳离子由于在形成过程中已失去最外层电子,所以其电子式就是其离子符号本身.例如:Na+K+Mg2+Ca2+Ba2+Al3+,复杂的阳离子(例如NH4+、H3O+等.)除应标出共用电子对、非共用电子对等外,还应加中括号,并在括号的右上方标出离子所带的电荷.②阴离子:无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷.例如:原子失去电子变成阳离子,原子得到电子变成阴离子.原子中,质子数=核电荷数=核外电子数3)共价型单质分子必须正确地表示出共用电子对数,并满足每个原子的稳定结构.例如:4)共价化合物共价化合物电子式的书写,基本与共价型单质分子相同,一般为正价者在前.对于不同价态的元素的原子,一般将化合价绝对值大的写在中间,绝对值小的写在周边.例如:5)离子化合物离子化合物电子式的书写,是将阴阳离子(阳离子在前,阴离子在后)拼在一起.对于不同价态的离子,也按其绝对值,遵照“大值在中间、小值在周边”的原则书写.例如:6)用电子式表示化合物的形成过程①共价化合物的形成过程示例:②离子化合物的形成过程示例:③NaOH属于例外,在它的化学式中,既包含了离子键也包含了共价键.但是由于其含有离子键,所以我们称像NaOH一类的两种键都包含的物质为离子化合物.【命题方向】本考点主要考察电子式的概念和原子、离子、分子及物质的表示方法,需要重点掌握.题型一:电子式的表示方法典例1:下列电子式或结构式错误的是()A.OH﹣的电子式B.NH4Br的电子式C.CCl4的电子式D.H2O的结构式H﹣O﹣H分析:根据原子的最外层电子数来分析电子式,并注意阴离子的电子式书写应用中括号和带电荷数,共价化合物不用中括号,将共用电子对用“﹣”表示即为结构式.解答:A、因氧原子最外层6个电子,氢原子最外层1个电子,则OH﹣的电子式为,故A正确;B、NH4Br为离子化合物,N原子最外层5个电子,Br原子最外层7个电子,则其电子式为,故B正确;C、CCl4为共价化合物,碳最外层4个电子,而Cl最外层7电子,中Cl的最外层电子数未标全,正确的形式应该是:,故C错误;D、水中有2对共用电子对,则H2O的结构式H﹣O﹣H,故D正确;故选C.点评:本题考查化学用语的使用,明确原子的最外层电子数及物质的类别、电子式的书写方法是解答本题的关键.题型二:用电子式表示化合物的形成过程典例2:下列用电子式表示的形成过程正确的是()A.B.C.D.分析:A、氯化氢是共价化合物;B、溴化钠是离子化合物;C、MgF2电子式中2个氟离子在镁离子两边;D、O原子和C原子通过共用电子对形成二氧化碳.解答:A、HCl为共价化合物,HCl电子式书写错误,故A错误;B、NaBr为离子化合物,NaBr电子式书写错误,故B错误;C、MgF2为离子化合物,镁离子与两个F﹣形成离子键,正确的形成过程为,故C错误;D、O原子和C原子通过共用电子对形成二氧化碳,所以其形成过程为,故D正确.故选D.点评:本题考查用电子式的形成过程,题目难度不大,注意相关基础知识的积累.【解题思路点拨】电子式分子式实验式结构式结构简式定义化学中常在元素符号周围用小黑点“.”或小叉“×”来表示元素原子的最外层电子.这种表示的物质的式子叫做电子式.分子式是用元素符号表示纯净物(单质、化合物)的分子的组成及相对分子质量的化学式.实验式又称最简式或经验式,是化学式中的一种.用元素符号表示化合物分子中各元素的原子个数比的最简关系式.结构式是表示用元素符号和短线表示化合物(或单质)分子中原子的排列和结合方式的式子.结构简式就是结构式的简单表达式(通常只适用于以分子形式存在的纯净物,如有机分子),应表现该物质中的官能团,只要把碳氢单键省略掉即可,碳碳单键、碳氯单键、碳和羟基的单键等大多数单键可以省略也可不省略,如,丙烷的结构简式为CH3CH2CH3,乙烯为CH2=CH2,四氯甲烷CCl4,乙醇CH3CH2OH等.举例H:C::C:H C2H4CH2CH2=CH2附注电子式只能用于表示由主族元素形成的物质,不能表示由过渡元素形成的物质.而化学式是用元素符号表示物质组成的式子.化学式是实验式、分子式、结构式、结构简式、电子式的统称.有机化合物中往往有不同的化合物具有相同的实验式.例如乙炔、苯的实验式均为CH,但乙炔的分子式是C2H2,苯的分子式是C6H6.表示有机化合物一般用结构简式,通常省去碳氢键,有时也省去碳碳单键,用折线表示.碳碳双键、三键、大多数环一定不能省略.碳氧双键可省略,比如甲醛HCHO.。
化学“五式”的比较电子式分子式实验式结构式结构简式定义化学中常在元素符号周围用小黑点“.”或小叉“×”来表示元素原子的最外层电子.这种表示的物质的式子叫做电子式.分子式是用元素符号表示纯净物(单质、化合物)的分子的组成及相对分子质量的化学式.实验式又称最简式或经验式,是化学式中的一种.用元素符号表示化合物分子中各元素的原子个数比的最简关系式.结构式是表示用元素符号和短线表示化合物(或单质)分子中原子的排列和结合方式的式子.结构简式就是结构式的简单表达式(通常只适用于以分子形式存在的纯净物,如有机分子),应表现该物质中的官能团,只要把碳氢单键省略掉即可,碳碳单键、碳氯单键、碳和羟基的单键等大多数单键可以省略也可不省略,如,丙烷的结构简式为CH3CH2CH3,乙烯为CH2=CH2,四氯甲烷CCl4,乙醇CH3CH2OH等.举例H:C::C:H C2H4CH2CH2=CH2附注电子式只能用于表示由主族元素形成的物质,不能表示由过渡元素形成的物质.而化学式是用元素符号表示物质组成的式子.化学式是实验式、分子式、结构式、结构简式、电子式的统称.有机化合物中往往有不同的化合物具有相同的实验式.例如乙炔、苯的实验式均为CH,但乙炔的分子式是C2H2,苯的分子式是C6H6.表示有机化合物一般用结构简式,通常省去碳氢键,有时也省去碳碳单键,用折线表示.碳碳双键、三键、大多数环一定不能省略.碳氧双键可省略,比如甲醛HCHO.第1页共1页。
专题8分子式,电子式,结构简式,结构式
1 甲烷的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
2乙烷的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
3丙烷的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
4丁烷的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
5乙烯的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
6丙烯的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
7乙炔的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
8苯的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
9甲苯的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
10乙醇的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
11甲醇的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
12乙醛的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
13甲醛的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
14乙酸的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
15甲酸的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
16苯酚的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
17尿素的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
18葡萄糖的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
19淀粉的分子式是_________ 电子式是_____ ,结构简式___ __ 结构式。
20甘氨酸的分子式是________ 电子式是____ ,结构简式___ __ 结构式。
21聚氯乙烯的分子式是_______ 电子式是____ ,结构简式___ __ 结构式。
电子式:1 原子:H O N Na Al
2离子:H+Na+Mg2+
Cl- O2-S2-
3共价化合物H2O HCl N2
4(中挎号)离子化合物(金属离子+铵根离子)Na Cl Ca Cl2
NaOH NH4Cl Na2O2。