华师大版 九年级上册 科学 第三节 用分解反应制氧气
- 格式:pptx
- 大小:1.11 MB
- 文档页数:24


九年级上册制取氧气知识点氧气是我们生活中不可或缺的重要气体之一,而了解如何制取氧气是非常有意义的。
在九年级上册化学课程中,我们将学习到一些制取氧气的常见方法和相关实验原理。
首先,让我们来了解一下最常见的制取氧气的方法之一——加热过氧化氢。
过氧化氢(H2O2)是一种常见的氧化还原剂,能够分解产生氧气和水。
该反应可以通过设置适当的实验装置来进行。
我们可以取一个小量的过氧化氢溶液放入一只试管中,然后使用酒精灯或火柴将其加热。
当加热过程中,溶液内会产生气泡,并且可以观察到一种明亮的火焰。
这是因为氧气在加热过程中被释放出来,并激发了气体周围的火焰。
然而,通过加热过氧化氢制取氧气的方法存在一些安全隐患,因为过氧化氢具有强氧化性和易燃性。
因此,在进行此实验时,我们应该格外小心,并请老师或者有经验的人员指导。
除了加热过氧化氢的方法,我们还可以通过分解过氧化锰酸钾来制取氧气。
过氧化锰酸钾(KMnO4)是一种黑紫色的结晶,也是一种常见的氧化剂。
在实验中,我们可以使用石棉网或火砖制成的搭架将过氧化锰酸钾放置在试管中,然后用烧瓶通过橡皮管送入硫酸。
由于过氧化锰酸钾的分解反应是吸热反应,所以我们需要使用酒精灯或火柴加热试管,以促进反应的进行。
随着反应的进行,试管内的过氧化锰酸钾逐渐变成棕色固体,同时氧气也被释放出来。
我们可以通过将一根带着点燃的火柴或火焰靠近试管口,观察到氧气能够让火焰重新燃烧,并发出明亮的火光。
了解这些制取氧气的实验方法有助于我们对化学反应的理解和实验操作的掌握。
在进行实验时,我们还需要注意实验装置的选择和安全操作。
同时,我们还可以进一步探索其他制取氧气的方法,如电解水或氯酸钾的分解等。
除了了解制取氧气的方法,我们还可以学习氧气的一些重要性质。
氧气是一种无色、无味、无味的气体,具有优良的可燃性和强氧化性。
它是维持生命的必需气体,参与了燃烧、呼吸等许多重要的生化过程。
同时,氧气也是许多化学工业生产和科学实验中不可或缺的物质。


第一章化学反应第一节(P2)一、质量守恒定律(1)定义:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,这个定律叫质量守恒定律。
(2) a.必须是真正参加反应的物质b.各物质的质量总和相等(3)质量守恒定律的解释宏观元素种类元素质量物质的总质量原子种类没有变化微观原子数目没有增减原子质量没有增减进行有关的计算应用推测一些物质的组成解释一些实验事实(3)化学反应前后一定不变的量:①原子种类②元素种类③原子数目④物质总质量用质量守恒定律解释下面两种现象:1、镁带在空气中燃烧后,生成物的质量比镁带的质量增加了,为什么2、煤燃烧后留下的煤灰的质量,比煤的质量减少了,为什么小练克碳与一定量的氧气恰好完全反应,生成二氧化碳22克,有______克氧气参加了反应。
二、化学方程式(1)定义:用化学式来表示化学反应的式子(2)化学方程式的书写原则:一是以客观事实为依据;二是要遵守质量守恒定律(3)书写化学方程式的方法和步骤写:写出反应物和生成物的分子式配:配平化学方程式等:将短线改为等号注:注明反应条件,生成物的状态(4)化学方程式表示的意义①表示反应物和生成物的种类②表示反应的条件③表示反应物、生成物间原子、分子个数比④表示反应物、生成物间的质量练习:试写出下列反应的化学方程式(1)硫在氧气中燃烧生成二氧化硫(2)磷在氧气中燃烧生成五氧化二磷(3)氢气与灼热的氧化铜反应生成铜和水三、化学方程式的配平1.最小公倍数法配平方法是:求出方程式两边相同原子前系数的最小公倍数,然后用该最小公倍数除以各自的原子个数,所得的值就是对应物质的系数。
2.用奇数配偶数法用这一方法配平的化学方程式的特点是:某元素在式子里出现的次数较多,且各端的原子总数是一奇一偶。
配平方法:选定该元素作为配平的起点,先把奇数变为最小的偶数(即乘以2),再确定其它化学式的系数。
3.观察法配平方法是:(1)通过观察,从化学式比较复杂的一种生成物推求出有关各反应物和生成物的系数。
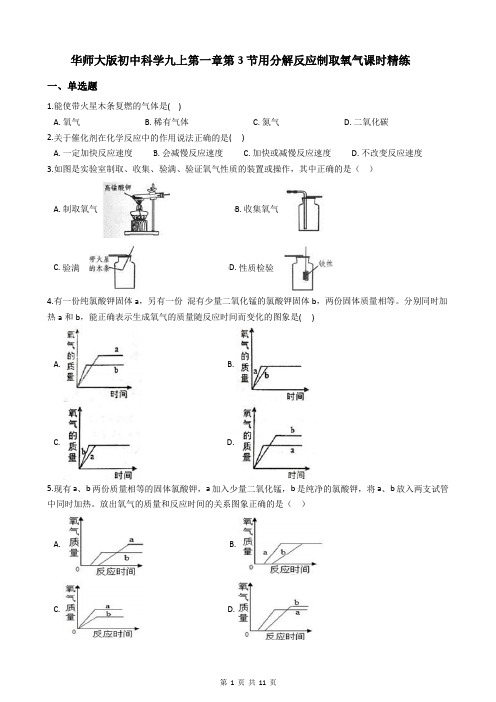
华师大版初中科学九上第一章第3节用分解反应制取氧气课时精练一、单选题1.能使带火星木条复燃的气体是( )A. 氧气B. 稀有气体C. 氮气D. 二氧化碳2.关于催化剂在化学反应中的作用说法正确的是( )A. 一定加快反应速度B. 会减慢反应速度C. 加快或减慢反应速度D. 不改变反应速度3.如图是实验室制取、收集、验满、验证氧气性质的装置或操作,其中正确的是()A. 制取氧气B. 收集氧气C. 验满D. 性质检验4.有一份纯氯酸钾固体a,另有一份混有少量二氧化锰的氯酸钾固体b,两份固体质量相等。
分别同时加热a和b,能正确表示生成氧气的质量随反应时间而变化的图象是( )A. B.C. D.5.现有a、b两份质量相等的固体氯酸钾,a加入少量二氧化锰,b是纯净的氯酸钾,将a、b放入两支试管中同时加热。
放出氧气的质量和反应时间的关系图象正确的是()A. B.C. D.6.某化学兴趣小组用如图所示的装置来制取干燥的氧气,并测定实验中生成的氧气体积。
装置气密性良好,图Ⅰ中的燃烧匙内装有二氧化锰,燃烧匙可以上下移动,干燥管内装有足量碱石灰(可以吸收水蒸气)。
下列说法正确的是()A. 将装置Ⅰ分别与装置Ⅱ、Ⅲ、Ⅳ、V连接,均能达到测定氧气体积的目的B. 若用装置V测量生成氧气的体积,集气瓶上方原有的空气会使测量结果偏大C. 若用装置Ⅳ收集氧气,可将带火星的木条放置在b处导管口验满D. 若用装置Ⅰ与装置V量组合测量生成氧气的体积,实验先连接装置Ⅰ和V,后将燃烧匙伸到液面以下7.小金需收集一瓶约混有四分之一体积空气的氧气,下列操作正确的是()A B C D集气瓶中灌的水集气瓶中灌的水导管伸入到集气瓶体积的处导管伸入到集气瓶体积的处A. AB. BC. CD. D8.如图所示,①为制取氧气的发生装置(气密性良好),其中的燃烧匙可以上下移动。
②和③为氧气的收集装置。
小金欲制取一瓶干燥的氧气,下列分析正确的是()A. 在①中,将MnO2浸入H2O2溶液,MnO2可分解产生氧气B. 若用装置②的方法收集氧气,需等到导管口气泡均匀并连续冒出时才可收集C. 若用装置③的方法收集氧气,可将带火星的木条放入瓶中进行验满D. 将装置①分别与装置②或③连接,均能达到实验目的9.科学实验要规范操作。

一、氧气的实验室制取(1)实验室制取氧气的原理、装置及主要步骤。
①原理:过氧化氢分解和高锰酸钾加热分解。
②实验步骤:发生装置和收集装置。
能说出装置中各仪器的名称和用途,注意各仪器的连接顺序、检验气密性的方法、收集方法(向上排空气法和排水法)和检验氧气的方法(能使带火星的木条复燃)。
了解工业上制氧的方法(分离空气法)。
③实验室加热分解高锰酸钾制取氧气为七个操作步骤,每一步骤用一个字缩记为:查、装、定、点、收、移、熄,可谐音串记作“制氧步骤一字记,茶庄定点收利息”。
(2)实验注意事项:1)加热高锰酸钾或氯酸钾制取氧气应注意:①试管口应略向下倾斜,防止生成的冷凝水倒流至热的试管底部,使试管炸裂;②用高锰酸钾制氧气应在试管口塞一团棉花,作用是以防加热时高锰酸钾粉末随气流进入导管,堵塞导管;③制取氧气时导管不能伸入试管过长,便于生成的气体能顺利导出;④长颈漏斗的下端管口应伸入液面以下,形成“液封”,防止生成的气体从长颈漏斗逸出;⑤用B装置制取气体的不足之处为不能随时控制反应的发生和停止(或不能控制反应的速率等合理即可) (写出1点即可);⑥用向上排空气法收集氧气时,导气管应伸入至集气瓶底部,目的是排尽集气瓶中的空气;⑦用排水法收集氧气时,当观察到导管口气泡连续、均匀冒出时,再开始收集气体;当观察到瓶口有大气泡冒出时,证明氧气已收集满;⑧采用固体加热型发生装置和排水法组合制取氧气时,实验结束时,一定要先将导管移出水面,再熄灭酒精灯,防止水槽中的水倒流至热的试管底部,使试管炸裂。
2)用过氧化氢制取氧气应注意:长颈漏斗的下端管口应伸入液面以下,以防止生成的气体从长颈漏斗逸出。
(3)举例说明催化剂和催化作用。
例如二氧化锰在氯酸钾和双氧水的分解中是催化剂,具有催化作用。
橡胶制品中常加入一些催化剂以减缓橡胶的老化速度。
【温馨提示】①催化剂有一变(改变化学反应速率)二不变(自身的质量和化学性质不变);②我们不能说二氧化锰是催化剂,而要说某一种物质在某个化学反应中是催化剂。
+6第一章化学反应第一节质量守恒定律1.质量守恒定律是指在化学反应中,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和2.质量守恒定律的微观解释:化学反应前后,原子的种类,数目,质量保持不变,只是原子进行了重新组合,所以化学反应前后各物质的质量总和必定相等一定改变:分子种类,物质种类,可能变:分子数目,一定不变:原子的种类,数目,质量,元素种类注意:质量守恒定律的理解要注意“化学变化”和“参加”这两个词。
首先,质量守恒定律只适用于化学变化,不适用于物理变化。
其次,之所以强调“参加”,是因为某物质未必全部参与反应。
如2g氢气和8g氧气反应只生成9g水,因为只有1g氢气参加反应3.化学方程式的书写注意事项:①配平(根据反应前原子的总数=反应后原子的总数)②反应条件“点燃”、“加热(或者用“Δ”)”、催化剂③只有生成物中有气体或者沉淀生成时,用“↑”、“↓”4.书写化学方程式,我们要遵循以下两条原则:(1)化学方程式必须以客观事实为依据(2)遵循质量守恒定律,反应前后各种原子的数目必须相等5.微观模型图:6.化合价口诀表7.常见的元素符号第二节化合反应和分解反应8.化合反应:字母表达式A+B→C (多变一)9.分解反应:字母表达式C→A+B (一变多)10.第三节用分解反应的方法制取氧气11.工业上制取氧气:空气冷冻分离法。
利用了液态氧和氮的沸点不同12.实验室制取氧气的化学方程式ClO32-氯酸根MnO4-高锰酸根MnO42-锰酸根催化剂是改变反应速度的物质,但在化学反应前后,质量和化学性质都不会变13.14.收集气体的实验装置图1 图2 图3图1排水法:适用于难溶于水的气体(例如O2,H2)图2 向上排空气法:适用于气体密度大于空气(例如O2,CO2)图3 向下排空气法:适用于气体密度小于空气(例如H2)密度大小可以用相对分子质量来比较,空气的相对分子质量为29,气体的相对分子质量大于29为密度大于空气,相对分子质量小于29为密度小于空气第四节用化学方程式的简单计算15.计算题的步骤:①设未知量为X②写出化学方程式,注意要配平③根据化学方程式写出有关物质的式量比,已知量,未知量④列比例式,求解⑤简明地写出答案16.已知量的确定:生成物①有气体或者沉淀生成,可以用气体或者沉淀作为已知量代入计算化学计算题已知量一般都是以生成的气体作为条件比较多17.18.19.常见的化学方程式+7第二章酸和碱第一节生活中的酸和碱1.2.PH<7呈酸性,PH值越小,酸性越强;PH=7呈中性;PH>7呈碱性,PH值越大,碱性越强。
新华师大版初中科学教材目录(最新校对准确版)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(新华师大版初中科学教材目录(最新校对准确版))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为新华师大版初中科学教材目录(最新校对准确版)的全部内容。
华师版初中科学教材目录七年级(上册)七年级(下册)走近科学1。
探索奇妙的自然界2。
什么是科学探究3。
建立健康信息档案4。
几个重要的科学概念第一章地球上的生物1。
艳丽多姿的生物2. 生物的基本特征第二章生物的主要类群1. 动物的主要类群2. 植物的主要类群3。
细菌和真菌4。
生物的分类第三章生物多样性1。
生物物种的多样性2。
同种生物的差异性3. 保护生物的多样性生物体的结构层次1. 生物体2。
细胞组织、器官和系统第五章地球1。
地球的形状和大小2. 地球仪和经纬网3. 地图和平面图第六章变化的地形1. 火山与地震2。
海陆的变迁3. 千姿百态的地形第七章地月系1。
地球的运动2。
昼夜与四季3. 月球与月相第八章星空世界1。
观天认星2. 太阳3。
太阳系4. 银河系与河外星系第一章水1. 地球上的水2. 水的三态变化3. 水是常用的溶剂4。
配置溶液5。
水的组成6. 水资源的利用和保护第二章空气1空气的存在2。
空气的成分3. 氧气4. 二氧化碳5. 保护大气圈第三章阳光1.太阳辐射能2. 阳光的传播3. 阳光的组成第四章土壤1。
土壤的组成与性状2. 土壤与植物3人类活动与土壤生态系统1。
种群和群落2. 生态系统生物圈动物和人的生殖与发育动物的生殖与发育2。
人的生殖与发育第七章植物和微生物的生殖与发育1. 绿色开花植物的有性生殖与发育2。
九年级化学制造氧气知识点氧气在化学中扮演着非常重要的角色,它是许多化学反应以及生物过程的必需物质。
在九年级的化学学习中,我们需要了解制造氧气的基本知识。
本文将介绍几种制造氧气的方法以及相关的化学原理。
一、通过分解过氧化氢制造氧气过氧化氢是一种常见的氢氧化合物,其化学式为H2O2。
通过催化剂的作用,过氧化氢可以分解成水和氧气。
化学反应的方程式如下:2H2O2 → 2H2O + O2这种方法制备氧气比较简单,只需要将过氧化氢注入反应瓶中,加入催化剂(例如二氧化锰),就能观察到氧气的产生。
但需要注意的是,过氧化氢是一种具有强氧化性的物质,在使用时要小心避免接触皮肤和眼睛。
二、通过电解水制造氧气电解水是另一种制造氧气的方法,它是利用电能将水分解成氢气和氧气。
化学反应的方程式如下:2H2O → 2H2 + O2在实验中,我们需要准备一个电解槽,将带有电解质(如盐或硫酸)的水注入至槽中,然后用电极通电。
正极(即阳极)会产生氧气,负极(即阴极)会产生氢气。
通过将导管引导到不同容器中,就可以分别收集到氧气和氢气。
三、通过过氧化钾和重铁盐制造氧气过氧化钾和重铁盐反应也可以制备氧气。
化学反应的方程式如下:2KClO3 + 2FeCl2 → 2KCl + 2FeCl3 + 3O2在实验中,我们需要先将过氧化钾和重铁盐混合,然后加热。
反应过程中会产生氧气气体,可以用来进行进一步的实验或观察。
四、通过高温分解金属氧化物制造氧气某些金属氧化物在高温下可以发生分解反应,生成氧气气体。
化学反应的方程式如下:2HgO → 2Hg + O2在实验中,我们需要将金属氧化物(如二氧化汞)加热,并烧结成固体,然后通过加热使其发生分解反应。
利用这种方法制造氧气时需要注意操作安全,避免接触高温器具以及对有毒物质的处理。
五、通过植物光合作用产生氧气在自然界中,氧气主要通过植物的光合作用产生。
光合作用是指植物利用阳光、水和二氧化碳产生氧气和葡萄糖的过程。