原料药中重金属残留检测 原料药中重金属残留测试
- 格式:doc
- 大小:28.04 KB
- 文档页数:4


天然提取物中重金属溶剂残留的检测作者:张欢罗忠国来源:《科学与财富》2015年第33期摘要:近年来,生物技术获得了很大的发展,多数产品都打着天然提取物的旗号在销售和使用。
但对于天然提取物而言,并没有想象的那么神奇。
从客观的角度来分析,天然提取物,是一种针对各类物质的提取,多数情况下是针对植物的提取。
提取物虽然是在天然环境形成的,但并非是完全清洁的,提取物中含有的其他物质相对较多,且在检测中不易察觉。
目前,很多地区的土地都受到了严重的污染,环境破坏严重。
针对天然提取物的重金属溶剂残留检测,是非常有必要的,日后应加强该方面的研究。
关键词:天然提取物;重金属;溶剂;残留重金属溶剂是对人体危害较大的一种溶剂,并且在检测中比较困难。
重金属溶剂会随着河流、土地等,不断的融入到植物当中,即便是某些天然提取物,其内部依然有可能含有大量的重金属溶剂,这对植物的加工和产品的销售,都是非常不利的。
为此,应针对天然提取物的检测进行重视,尤其是重金属溶剂的检测工作,必须选择有效的方法,实现高度精准的检测。
在此,本文主要对天然提取物中重金属溶剂残留的检测进行讨论。
一、概述近年来,天然提取物获得了很大的重视,并且在各个领域中均获得了较大的发展,其创造的经济效益和社会效益均是值得肯定的。
但在检测中发现,部分天然提取物中,含有一定数量的重金属溶剂,该物质所造成的恶劣影响非常严重。
从客观的角度来分析,重金属溶剂会对人体构成极大的威胁,如果持续的加大剂量,将导致较多的疾病和身体不适,最终危及生命。
从主观的角度来分析,盲目的相信天然提取物显然是不明智的,应针对天然提取物中的重金属溶剂,进行深入的检测分析,任何残留现象都将是极大的安全隐患。
在大环境中,土地的污染和水源的污染,都为重金属溶剂的残留提供了较多的路径,天然提取物的安全性也是有待深究的。
二、天然提取物中重金属溶剂残留的检测经过长时间的分析和研究,发现大多数的天然提取物中,其含有的重金属溶剂并不多,一般表现为残留现象。

化学原料药中元素杂质的风险评估吴洁;黄青兰【摘要】原料药中可能存在多个来源的元素杂质,由于元素杂质通常没有治疗作用,因而原料药生产中元素杂质含量应被控制在可接受的限度.国际人用药物注册技术协调会议(ICH)Q3D元素杂质指南,提出对于潜在存在于药物中的元素杂质需进行定性和定量分析评估,并基于进行风险评估以限制最低元素杂质含量.为响应ICH颁布的元素杂质指导原则,进一步控制原料药中元素杂质水平,现就原料药生产实际,通过对生产工艺及设备等因素可能导致的元素杂质进行评估,确定其风险以制定相应控制策略,从而有效保障药品质量.【期刊名称】《上海医药》【年(卷),期】2019(040)001【总页数】4页(P74-77)【关键词】元素杂质;风险评估;原料药;ICH_Q3D【作者】吴洁;黄青兰【作者单位】上海紫源制药有限公司上海 201108;上海紫源制药有限公司上海201108【正文语种】中文【中图分类】TQ460.72元素杂质主要是指药品生产或贮藏过程中生成、加入或无意引入的物质。
由于药品中元素杂质不能给病人提供任何治疗益处(个别药品除外),而且还可能引发不良反应,或可能对药品的稳定性、保质期产生不利影响,因而建立旨在减少存在于药物中的元素杂质,或者对允许可接受的元素杂质浓度范围进行分析评估尤为重要[1]。
2014年12月人用药品注册技术要求国际协调会(ⅠCH)更新关于金属杂质的指南,该指导原则对元素杂质进行了重新分类,监控的元素杂质种类增加至24种,包含了毒性较大的非金属元素如砷、汞、硒及各种常用的金属催化剂、重金属等,并于2015年9月更名为ⅠCH_Q3D元素杂质指导原则(Q3D Guideline for elements impurities)[2]。
自ⅠCH更新Q3D元素杂质指南后,欧洲药品管理局(EMA)和美国FDA相继更新了这一指南,与ⅠCH高度保持一致,由此可见控制的杂质种类已经从传统的重金属扩展到非金属元素,对元素杂质的监控越来越严格,范围也变宽。

IC P-M S法测定富马酸福莫特罗原料药中催化剂钯的残留量李春盈,张静,钟依雯,曾敏珊(广州市药品检验所,广东广州510160)摘要:目的建立富马酸福莫特罗中催化剂钯(P d)残留的检测方法。
方法通过直接溶解样品,以电感耦合等离子质谱法(1CP-MS)测定样品中钯的含量。
结果测定了3批富马酸福莫特罗中钯的含量。
ICP-MS条件经优化后,测得钯在2~50 浓度范围内相关系数为0.999 9(^1 = 6),线性关系良好,方法检测限为0.03 fxg.L_1,回收率在98.0%〜101.4%之间,ftSZ)为l.l%(n = 6)。
结论本方法操作简便、快捷、灵敏度高,适用于富马酸福莫特罗中钯残留量的检测。
关键词:电感耦合等离子质谱法;钯残留量;富马酸福莫特罗中图分类号:R917 文献标志码:A文章编号:1674-229X( 2020) 11-0767-02Doi : 10.12048/j.issn. 1674-229X.2020.11.009Determination of Catalyst Palladium Residue in Formoterol Fumarate Dihydrate Crude Product by ICP-MS LI Chunying, ZHANG Jing,ZHONG \iwen,ZENG Minshan( Giia/igz/low Institute of Drug Control, Guangzhou ^ Guangdong 5\0\60 y China)ABSTRACT : OBJECTIVE To establish a method for determinating the residual content of palladium which was used as a catalyst in drug substance of formoterol fumarate dihydrate. METHODS The samples were prepared through dissolving directly and analyzed by inductively coupled plasma mass spectrometry (ICP-MS). RESULTS The content of palladium residue in 3 batches of formoterol fumarate dihydratewere determined.Optimized by ICP-MS, the calibration curves of palladium were at good linear of the concentration range of 2-50 fxg • L 1 , with correlation coefficient (r) was 0.999 9 (n = 6).Detection limits of the method was 0.03 ixg'L-1. The recoveries were in the range of 98.0%-101.4%,and RSD was 1.1% (n = 6).CONCLUSION The method is highly sensitive, rapid and accuracy for determination of catalyst palladium residue in formoterol fumarate dihydrate crude product.KEY WORDS:ICP-MS;palladium residue;formoterol fumarate dihydrate富马酸福莫特罗最初是由日本山之内制药公司 开发的长效、高选择性p2受体激动剂,用于治疗支 气管哮喘,急性支气管炎或喘息性支气管炎等气道 阻塞性肺病[M]。

原料药中元素杂质的法规要求及控制方法张再奇元素杂质又称重金属,重金属原义指比重大于5的金属,元素杂质包括可能存在于原料、辅料或制剂中,来源于合成中催化剂残留、药品生产制备过程中引入或辅料中存在的、生产设备引入、或容器密闭系统引入。
某些元素杂质不仅对药品的稳定性、保质期产生不利影响,还可能因为潜在的毒性引发药物副反应。
因此欧盟、美国对杂质的控制越来越严格,对此项不断修订,中国在加入ICH后对此项检测应该也会向国际靠拢,因此了解法规对元素杂质的要求、建立有效的检测方法变得尤为重要。
一、各国法规变更史(1)EMA、EP关于元素杂质的修订EP最新版为9.0版,其中保留了2.4.8金属测试方法A-H;2.4.20章节金属催化剂和金属试剂残留检测;5.20金属催化剂或金属试剂残留。
但在9.3增补版(2018年1月1日实施)中5.20项下规定,元素杂质限度遵循ICH要求。
EMA对元素杂质的修订如下表1。
(2)ICH对元素杂质的修订历程ICH于2009年10月批准了Q3D,经多方讨论后,修订版本的Q3D step4于2014年12月16日生效,其中列出了24种元素杂质的三种给药途径的PDE 值,确定实施日期为:新上市许可为2016年6月生效,已上市品种为2017年12月生效。
(3)USP对元素杂质的修订历程FDA规定在2018年1月1日之后,针对USP药典品种,提交新的NDA、ANDA 应该符合USP<232>、<233>。
针对非USP药典品种,申请人提交新的NDA、ANDA时,应该遵循Q3D。
美国对元素杂质的规定与ICH规定在不同时期,内容不一致,但从2017年12月之后,USP对元素种类和限量均与ICH保持一致。
修订历程详见下表2。
(4)中国药典对重金属检测的修订中国药典对重金属检测的修订主要体现在表3中,名称仍然为重金属,方法仍采用比色法,2017年中国成为了ICH成员国,未来中国的药政监管将遵循ICH指南规定,元素杂质与国际接轨也是大势所趋。
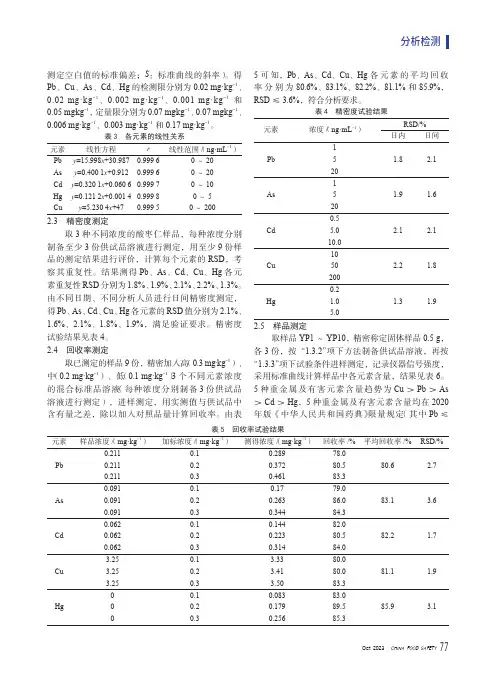
测定空白值的标准偏差;S:标准曲线的斜率)。
得Pb、Cu、As、Cd、Hg的检测限分别为0.02 mg·kg-1、0.02 mg·kg-1、0.002 mg·kg-1、0.001 mg·kg-1和0.05 mg·kg-1,定量限分别为0.07 mg·kg-1、0.07 mg·kg-1、0.006 mg·kg-1、0.003 mg·kg-1和0.17 mg·kg-1。
表3 各元素的线性关系元素线性方程r线性范围/(ng·mL-1)Pb y=15.998x+30.9870.999 60~20As y=0.400 1x+0.9120.999 60~20Cd y=0.320 1x+0.060 60.999 70~10Hg y=0.121 2x+0.001 40.999 80~5Cu y=5.230 4x+470.999 50~2002.3 精密度测定取3种不同浓度的酸枣仁样品,每种浓度分别制备至少3份供试品溶液进行测定,用至少9份样品的测定结果进行评价,计算每个元素的RSD,考察其重复性。
结果测得Pb、As、Cd、Cu、Hg各元素重复性RSD分别为1.8%、1.9%、2.1%、2.2%、1.3%。
由不同日期、不同分析人员进行日间精密度测定,得Pb、As、Cd、Cu、Hg各元素的RSD值分别为2.1%、1.6%、2.1%、1.8%、1.9%,满足验证要求。
精密度试验结果见表4。
2.4 回收率测定取已测定的样品9份,精密加入高(0.3 mg·kg-1)、中(0.2 mg·kg-1)、低(0.1 mg·kg-1)3个不同元素浓度的混合标准品溶液(每种浓度分别制备3份供试品溶液进行测定),进样测定,用实测值与供试品中含有量之差,除以加入对照品量计算回收率。
由表5可知,Pb、As、Cd、Cu、Hg各元素的平均回收率分别为80.6%、83.1%、82.2%、81.1%和85.9%,RSD≤3.6%,符合分析要求。

原子吸收分光光度法测定重金属残留铅、镉测定法(石墨炉法)供试品溶液制备:取供试品粗粉(过2号筛)0.5~1.0g,精密称定,置消化瓶中加硝酸-高氯酸(4:1)混合溶液10mL,混匀,瓶口加一小漏斗,浸泡过夜。
置消化炉上,加热消解,保持微沸,至棕色烟散尽后,加温继续加热直至白烟散尽,消解液呈无色或略带黄色,放冷,转入50mL量瓶中,用2%硝酸定容至刻度,摇匀,即的。
同法同时制备试剂空白溶液。
铜测定法(火焰法)供试品溶液制备同铅测定下供试品溶液制备。
砷测定法(氢化物法)供试品溶液制备:取供试品粗粉(过2号筛)0.5~1.0g,精密称定,置消化瓶中加硝酸-高氯酸(4:1)混合溶液10mL,混匀,瓶口加一小漏斗,浸泡过夜。
置消化炉上,加热消解,保持微沸,至棕色烟散尽后,加温继续加热直至白烟散尽,消解液呈无色或略带黄色,放冷,转入50mL量瓶中,用2%硝酸定容至刻度,摇匀,即的。
精密量取10mL,置25mL量瓶中,加25%碘化钾(临用前配置)1mL,摇匀,加10%抗坏血酸(临用前配置)1mL,摇匀,用20%盐酸定容,摇匀,密塞,置80度水浴中加热3min,取出放冷。
取适量吸入氢化物发生装置,测定吸收值。
同法同时制备试剂空白溶液。
汞测定法(冷吸收法)供试品溶液制备:取供试品粗粉(过2号筛)0.5~1.0g,精密称定,置消化瓶中加硝酸-高氯酸(4:1)混合溶液10mL,混匀,瓶口加一小漏斗,浸泡过夜。
置消化炉上,加热消解,保持微沸,至棕色烟散尽后,加温继续加热直至白烟散尽,消解液呈无色或略带黄色,放冷,加4%硫酸溶液适量、5%高锰酸钾溶液0.5mL,摇匀,滴加5%盐酸羟胺溶液至紫红色恰消失,转入25mL量瓶中,用4%硫酸定容至刻度,摇匀,即得。
同法同时制备试剂空白溶液。
注意事项:1、视实际消化情况称取供试品,一般是取1.0g,有些量多就称取少些比如菟丝子只能是0.5g,否则消化不完,有残渣。
因瓶壁上会沾有供试品,所以加硝酸-高氯酸(4:1)混合溶液时先冲洗瓶壁。

利伐沙班原料药中重金属镍残留量的检测方法与评价王宣江苏省淮安市食品药品检验所,淮安223001摘要目的:建立利伐沙班原料药中金属催化剂镍残留的两种测定方法,并对不同方法进行比较分析。
方法:方法一采用石墨炉原子吸收分光光度法;方法二采用电感耦合等离子体质谱法"结果:方法一在10〜100范围内线性良好,最低检出浓度为1.9方法检测限为0.2!g・gT,加标回收率平均为112%;方法二在0.5〜20!g・LT范围内线性良好,最低检出浓度为0.056!g・L%i,方法检测限为0.007^g-g%1,加标回收率平均为97.9%。
结论:6批样品的检验结果表明,两种方法对结果的测量无明显差异,但电感耦合等离子体质谱法具有分析速度快、检测限更低、灵敏度高以及可多种元素同时测定等优点,在重金属痕量分析检测方面更具优势。
关键词利伐沙班;金属催化剂;镍;电感耦合等离子体质谱法;石墨炉原子吸收分光光度法中图分类号R927.1文献标志码A文章编号1673-7806(2020)05-338-03利伐沙班(Rivaroxaban)化学名为5-氯(((5S)-2-氧代-3-(4-(3-氧代-4-吗啉基)苯基)-1,3-恶唑烷-5-基)甲基)-2-噻吩甲酰胺巴分子式为G9H27CIN3O5S,是一种口服的抗凝血药物,它通过高选择性直接抑制Xa因子达到抑制凝血酶产生和血栓形成的作用,与传统抗凝血药物相比,具有服用方便、起效迅速、安全性高等特点叫在利伐沙班合成中,用到雷尼鎳作为催化剂目,鎳及其盐类的毒性较低,但由于它本身具有生物化学活性,故能激活或抑制一系列的酶(精氨酸酶、羧化酶、酸性磷酸酶和脱羧酶)而发挥其毒性。
长期接触(如冶炼鎳、镀鎳等)、吸入或注射鎳化物,均有致癌作用。
欧洲药物评审组织(EMEA)将金属催化剂按风险级别分类管理,鎳作为第1类金属,规定注射用原料药中不得超过1!g-g"1[4]o药物中鎳含量的测定方法主要有火焰原子吸收法、石墨炉原子吸收法、电感耦合等离子体质谱法等%本研究采用微波消解法进行样品前处理,建立了石墨炉原子吸收法、电感耦合等离子体质谱法两种方法测定利伐沙班中残留的鎳,并作比较分析,为药物中痕量鎳的测定提供参考。

微波消解-电感耦合等离子体质谱(ICP-MS)法测定化学原料药中痕量钯含量李莉;赵桂莉【摘要】建立了微波消解-电感耦合等离子体质谱(ICP-MS)法测定酒石酸氢可酮原料药中痕量元素钯含量的方法.样品经过微波消解,在优化ICP-MS仪器工作参数后,对样品中的钯含量进行测定.结果表明,方法检出限为0.002 9 μg/mL,加标回收率在94.90%~103.4%,相对标准偏差小于3%.方法实现了对化学原料药中痕量钯的快速、简便、准确的检测.方法有望用于其它类似化学原料药中多种痕量元素的同时检测.【期刊名称】《中国无机分析化学》【年(卷),期】2016(006)001【总页数】4页(P6-9)【关键词】微波消解;ICP-MS;化学原料药;钯【作者】李莉;赵桂莉【作者单位】青海出入境检验检疫局综合技术中心,西宁810000;青海出入境检验检疫局综合技术中心,西宁810000【正文语种】中文【中图分类】O657.63;TH843药品安全是重大的民生和公共安全问题,事关人民群众身体健康和社会和谐稳定,因此国家在2012年伊始第一次发布了“国家药品安全“十二五”规划”,对包括化学药、原料药、中成药在内的各种药品提出了更高质量标准和检测需求。
但是在化学药合成过程中,过渡金属的复合物或金属盐类,通常作为催化剂和原料试剂使用,在大多数原料药的合成中,都需要使用金属催化剂,而原料药中的金属残留物会被进一步带入到药物制剂中,从而造成药品中金属杂质元素的残留。
杂质元素的限度检测对于药物安全至关重要,已经证明这些杂质元素是引起人体癌症,神经系统等疾病的诱因。
这些金属杂质不但对治疗作用无益,而且具有影响人类健康的潜在危险[1]。
基于药物安全性和质量控制的要求,必须对原料药中的金属催化剂或金属试剂残留量予以严格的控制。
金属钯具有选择性好、活性高等特点,它常作为一种催化剂在药物及其中间体的合成过程中得到广泛应用,但如果残留在药物中的钯含量过高,会对人体的重要脏器造成损害,如引发鼻炎、结膜炎等疾病[2]。

HPLC法测定肝素钠原料中EDTA―2Na的残留肝素钠是从猪小肠黏膜中提取精制的含有硫酸氨基葡聚糖的钠盐,属于不均一的多糖分子,通常分子量在3000~30000道尔顿,临床常作为注射剂使用。
肝素钠本身带负电荷,能干扰血凝过程的许多环节,其作用机制比较复杂,主要通过与抗凝血酶Ⅲ(AT-Ⅲ)结合,而增强后者对活化的Ⅱ、Ⅸ、Ⅹ、Ⅺ和Ⅻ凝血因子的抑制作用。
具体涉及阻止血小板凝集和破坏,妨碍凝血激活酶的形成;阻止凝血酶原变为凝血酶;抑制凝血酶,从而妨碍纤维蛋白原变成纤维蛋白。
肝素钠作为原料药,中国药典中明确规定了其重金属限度的检测,但由于其来源于动物组织提取,实际生产工艺中均要增加去除重金属的工艺。
目前多采用添加EDTA-2Na来螯合重金属,形成水溶物后,经分级沉淀步骤去除螯合物。
EDTA-2Na收载于FDA《非活性组分指南》,可用于非注射和注射给药制剂,会与人体内的钙离子形成螯合物,引起低血钙等症状。
由于肝素钠生产过程中使用EDTA-2Na去除重金属,所以在终产品中可能残留EDTA-2Na,对其进行检测有重要的意义。
1仪器与材料11仪器TG332A型分析天平(湘仪天平仪器设备有限公司);LC-15C 型高效液相色谱仪(日本岛津);LC-20AD型紫外检测器(日本岛津);1.2材料硫酸铜(分析纯,天津市永大化学试剂有限公司);EDTA-2Na (分析纯,天津市科密欧化学试剂有限公司);肝素钠(注射级,批号:HM120401、HM120402、HM120403,石家庄市协和药业有限公司)。
水为自制纯化水(二级反渗透法)。
2方法与结果2.1色谱条件色谱柱:十八烷基硅烷键合硅胶填料WondaSilC18(200mm×46mm×5μm);流动相:0025mol/l硫酸铜溶液(用稀硫酸调节pH至30);检测波长:254nm;流速:10ml/min;检测温度:室温;进样量:20μl。
2.2溶液的制备2.2.1空白溶液的制备精密量取004mol/l硫酸铜溶液10ml,置50ml 量瓶中,加水稀释至刻度,摇匀,即得。

中药口服液生产工艺检验方案中药口服液生产工艺检验方案一、引言中药口服液是一种常见的中药剂型,其生产工艺的质量检验至关重要。
本文将深入探讨中药口服液的生产工艺检验方案,包括其制备工艺、原料药检验、工艺参数检验、成品检验等多个方面。
通过对中药口服液生产工艺的全面检验,可以确保其质量的稳定性和安全性,提高产品的整体品质,满足患者的需求。
二、制备工艺检验制备工艺是中药口服液生产中至关重要的环节,其合理性和有效性直接影响着产品的质量。
在制备工艺检验中,应重点关注以下几个方面:1. 生产工艺流程:对中药口服液的生产工艺流程进行评估,确保各个步骤的顺序和条件合理,并排除可能存在的风险因素。
2. 溶媒选择和比例:选择适合的溶媒,并确定合理的药品与溶媒的比例,以确保药物能够均匀分散在溶媒中,达到良好的稳定性。
3. 温度控制:对于涉及温度的步骤,如煎煮、浓缩等,应对温度进行严格控制,以确保药物的活性成分在适宜温度下不受损失。
4. 药物质量检测:对每一批使用的药材进行质量检测,如外观、味道、湿度、挥发性物质等,确保药材符合标准要求。
三、原料药检验原料药检验是中药口服液生产中的重要一环,对原料药的质量进行检验,可以避免因原料药质量不合格而导致的产品质量问题。
在原料药检验中,应重点关注以下几个方面:1. 药材质量检测:对每一批使用的药材进行全面的质量检测,包括外观、气味、含水量、挥发性物质等指标。
2. 药材成分分析:通过对药材进行成分分析,确定其有效成分含量,以确保原料药的质量稳定性和一致性。
3. 农药和重金属残留检测:针对使用的草药,应对其中的农药残留和重金属含量进行检测,确保原料药的安全性。
四、工艺参数检验工艺参数是中药口服液生产的重要控制点,合理的工艺参数可以保证产品的稳定性和质量一致性。
在工艺参数检验中,应重点关注以下几个方面:1. 温度控制:对涉及温度的步骤,如煎煮、浓缩等,应进行温度的监控和控制,确保温度在合适的范围内。
目的: 建立重金属检查法标准操作规程范围: 本规范合用于重金属检查法检查职责: 质量控制部全体人员内容:1.简述重金属是指在规定实验条件下能与显色剂作用显色的金属杂质。
采用硫代乙酰胺试液或硫化钠试液作显色剂, 以铅的限量表达。
由于实验条件不同, 分为4种检查方法: 第一法合用于供试品不经有机破坏, 在酸性溶液中进行显色的重金属限度检查;第二法合用于供试品需灼烧破坏, 取炽灼残渣项下遗留的残渣, 经解决后在酸性溶液中进行显色的重金属限度检查;第三法用来检查能溶于碱而不溶于稀酸(或在稀酸中即生成沉淀)的药品中的重金属;第四法用微孔滤膜过滤, 使重金属硫化物沉淀富集成色斑, 用于有色溶液或重金属限度较低的品种。
检查时, 应根据药典品种项下规定的方法选用。
四种方法显示的结果均为微量重金属的硫化物微粒均匀混悬在溶液中所呈现的颜色;采用滤膜法可获得“色斑”;假如重金属离子浓度大, 加入显色剂后放置时间长, 就会有硫化物聚集下沉。
重金属硫化物生成的最佳PH值是3.0-3.5, 选用醋酸盐缓冲液(PH3.5)2.0ml调节PH较好, 显色剂硫代乙酰胺试液用量经实验也以2.0ML为佳, 显色时间一般为2分钟。
以10-20μg的Pb与显色剂所产生的颜色为最佳目视比色范围。
在规定实验条件下, 与硫代乙酰胺试液在弱酸条件下产生的硫化氢呈色的金属离子有银、铅、汞、铜、镉、铋、锑、锡、砷、锌、钴与镍等。
由于在药品生产过程中碰到铅的机会较多, 且铅易积蓄中毒, 故以铅作为重金属的代表, 用硝酸铅配制标准铅溶液。
2.仪器与用品2.1纳氏比色管50ml应选玻璃质量好、无色(特别管底)、配对、刻度标线高度一致的纳氏比色管。
2.2滤器见中国药典重金属检查法第四法附图, 由具有螺纹丝扣并能密封的上、下两部分以及垫圈、滤膜和辅助滤板组成。
2.2.1滤器上盖部分A的入口处应能与50ML注射器紧密联接, 滤器下部F的出口处能套上一合适橡皮管。
原料药中元素杂质的法规要求及控制方法张再奇元素杂质又称重金属,重金属原义指比重大于5的金属,元素杂质包括可能存在于原料、辅料或制剂中,来源于合成中催化剂残留、药品生产制备过程中引入或辅料中存在的、生产设备引入、或容器密闭系统引入。
某些元素杂质不仅对药品的稳定性、保质期产生不利影响,还可能因为潜在的毒性引发药物副反应。
因此欧盟、美国对杂质的控制越来越严格,对此项不断修订,中国在加入ICH后对此项检测应该也会向国际靠拢,因此了解法规对元素杂质的要求、建立有效的检测方法变得尤为重要。
一、各国法规变更史(1)EMA、EP关于元素杂质的修订EP最新版为9.0版,其中保留了2.4.8金属测试方法A-H;2.4.20章节金属催化剂和金属试剂残留检测;5.20金属催化剂或金属试剂残留。
但在9.3增补版(2018年1月1日实施)中5.20项下规定,元素杂质限度遵循ICH要求。
EMA对元素杂质的修订如下表1。
(2)ICH对元素杂质的修订历程ICH于2009年10月批准了Q3D,经多方讨论后,修订版本的Q3D step4于2014年12月16日生效,其中列出了24种元素杂质的三种给药途径的PDE 值,确定实施日期为:新上市许可为2016年6月生效,已上市品种为2017年12月生效。
(3)USP对元素杂质的修订历程FDA规定在2018年1月1日之后,针对USP药典品种,提交新的NDA、ANDA 应该符合USP<232>、<233>。
针对非USP药典品种,申请人提交新的NDA、ANDA时,应该遵循Q3D。
美国对元素杂质的规定与ICH规定在不同时期,内容不一致,但从2017年12月之后,USP对元素种类和限量均与ICH保持一致。
修订历程详见下表2。
(4)中国药典对重金属检测的修订中国药典对重金属检测的修订主要体现在表3中,名称仍然为重金属,方法仍采用比色法,2017年中国成为了ICH成员国,未来中国的药政监管将遵循ICH指南规定,元素杂质与国际接轨也是大势所趋。
烟用材料中铬、镍、砷、硒、镉、烟用材料中铬镍砷硒镉汞、铅含量的测定电感耦合等离子体质谱法国家烟草质量监督检验中心家烟草质量监督检验中心October 20, 2011O t b202011内容纲要重金属毒性及研究意义检测方法及原理设备和试剂样品处理样品检测结果计算与表述回收率和检出限重金属毒性铬:六价铬对人体有害,能使人体血液中某些蛋白质沉淀,引起贫血、铬六价铬对人体有害能使人体液中某蛋白质沉淀引起贫肾炎和神经炎等镍:人体生命元素,但过量会引起炎症、神经衰弱、癌症、系统紊乱、致突变等砷:砒霜的成分之一,剧毒,会致人迅速死亡,长期少量接触引起慢性中毒,有致癌性硒:摄入过多引起脱发、脱甲、四肢麻木、头昏眼花、食欲不振、皮疹、皮痒、消化不良,急性中毒引起死亡镉:导致高血压引起心脑血管疾病破坏骨骼和肝肾引起肾衰竭镉:导致高血压,引起心脑血管疾病,破坏骨骼和肝肾,引起肾衰竭汞:食入后直接沉入肝脏、对大脑、神经和视力破坏极大 铅:进入人体内很难排出,直接伤害脑细胞,特别是胎儿的神经系统,造成智力低下研究意义烟草制品的成分披露和管制中,包括7种元素(铬、镍、砷、硒、镉、汞、铅)。
有害元素(铬、镍、砷、硒、镉、汞、铅)对人们的影响不仅仅直接来源于烟草烟叶、烟气中,还间接来源于培植的土仅直接来源于烟草烟叶烟气中还间接来源于培植的土壤和用于加工包装的卷烟材料(烟用接装纸原纸、烟用接装纸、烟用内衬纸、框架纸、卷烟纸、滤棒成形纸、烟用纸、烟用内衬纸、框架纸、卷烟纸、滤棒成形纸、烟用二醋酸纤维素丝束及其滤棒、烟用聚丙烯纤维丝束及其滤棒、烟用三乙酸甘油酯、烟用水基胶、热熔胶等)。
目前仅烟用接装纸和接装纸原纸有行业标准方法(硒元素除外),烟用三乙酸甘油脂和热熔胶对个别元素有限量要求,缺乏统的检测方法。
求,缺乏统一的检测方法。
检测方法及原理检测方法微波消解-电感耦合等离子体质谱法(ICP-MS)原理试样经消解后转移定容,在选定的仪器参数下,在线加入内标,用电感耦合等离子体质谱仪测定;以质荷强度与元素浓度的定关系测定样品溶液质荷比强度与元素浓度的定量关系,测定样品溶液中元素浓度,分别计算得出样品中铬、镍、砷、硒、镉、汞和铅的含量。
烟用材料中铬、镍、砷、硒、镉、烟用材料中铬镍砷硒镉汞、铅含量的测定电感耦合等离子体质谱法国家烟草质量监督检验中心家烟草质量监督检验中心October 20, 2011O t b202011内容纲要重金属毒性及研究意义检测方法及原理设备和试剂样品处理样品检测结果计算与表述回收率和检出限重金属毒性铬:六价铬对人体有害,能使人体血液中某些蛋白质沉淀,引起贫血、铬六价铬对人体有害能使人体液中某蛋白质沉淀引起贫肾炎和神经炎等镍:人体生命元素,但过量会引起炎症、神经衰弱、癌症、系统紊乱、致突变等砷:砒霜的成分之一,剧毒,会致人迅速死亡,长期少量接触引起慢性中毒,有致癌性硒:摄入过多引起脱发、脱甲、四肢麻木、头昏眼花、食欲不振、皮疹、皮痒、消化不良,急性中毒引起死亡镉:导致高血压引起心脑血管疾病破坏骨骼和肝肾引起肾衰竭镉:导致高血压,引起心脑血管疾病,破坏骨骼和肝肾,引起肾衰竭汞:食入后直接沉入肝脏、对大脑、神经和视力破坏极大 铅:进入人体内很难排出,直接伤害脑细胞,特别是胎儿的神经系统,造成智力低下研究意义烟草制品的成分披露和管制中,包括7种元素(铬、镍、砷、硒、镉、汞、铅)。
有害元素(铬、镍、砷、硒、镉、汞、铅)对人们的影响不仅仅直接来源于烟草烟叶、烟气中,还间接来源于培植的土仅直接来源于烟草烟叶烟气中还间接来源于培植的土壤和用于加工包装的卷烟材料(烟用接装纸原纸、烟用接装纸、烟用内衬纸、框架纸、卷烟纸、滤棒成形纸、烟用纸、烟用内衬纸、框架纸、卷烟纸、滤棒成形纸、烟用二醋酸纤维素丝束及其滤棒、烟用聚丙烯纤维丝束及其滤棒、烟用三乙酸甘油酯、烟用水基胶、热熔胶等)。
目前仅烟用接装纸和接装纸原纸有行业标准方法(硒元素除外),烟用三乙酸甘油脂和热熔胶对个别元素有限量要求,缺乏统的检测方法。
求,缺乏统一的检测方法。
检测方法及原理检测方法微波消解-电感耦合等离子体质谱法(ICP-MS)原理试样经消解后转移定容,在选定的仪器参数下,在线加入内标,用电感耦合等离子体质谱仪测定;以质荷强度与元素浓度的定关系测定样品溶液质荷比强度与元素浓度的定量关系,测定样品溶液中元素浓度,分别计算得出样品中铬、镍、砷、硒、镉、汞和铅的含量。
ICP-OES法快速检测药品中催化剂残留的14种重金属元素张玲帆;王艳萍;刘鑫;陶卫;张磊;张文清【摘要】采用有机溶剂二甲基亚砜和水(4∶1)的混合溶剂溶解药物样品,建立了电感耦合等离子体发射光谱法(ICP - OES)直接检测药物产品中金属催化剂残留的方法.在优化实验条件下,该法能快速检测欧洲药物评审委员会(EMEA)颁布指南中的14种重金属元素;方法检出限均小于0.30 mg/kg,加标回收率在90%~115%之间;对不同前处理方法的数据结果进行了对比.实验结果表明,该法操作简单、快速、准确度高,适合大批量药物产品中多元素的快速检测.%An inductively coupled plasma optical emission spectrometric (ICP - OES) method was developed for the determination of metallic impurities in pharmaceutical ingredients. The samples were directly dissolved with organic mixed solvent (DMSO :H2O =4 : 1). The conditions of instrument were optimized, and the 14 metal elements listed in EMEA guidance could be rapidly analyzed by the method. The detection limits were less than 0. 30 mg/kg, and the recoveries of the 14 metal elements ranged from 90% to 115% . The data was compared with those obtained from the different treatment methods. The results showed that the method, with the advantages of simplicity, easy operation and high accuracy, was suitable for the quick determination of multi-elements in large quantities of samples.【期刊名称】《分析测试学报》【年(卷),期】2012(031)004【总页数】5页(P475-479)【关键词】ICP-OES;二甲基亚砜;金属催化剂;药物;检测;重金属【作者】张玲帆;王艳萍;刘鑫;陶卫;张磊;张文清【作者单位】华东理工大学化学与分子工程学院,上海200237;安捷伦科技有限公司生命科学与化学分析部,上海200233;华东理工大学化学与分子工程学院,上海200237;华东理工大学化学与分子工程学院,上海200237;华东理工大学化学与分子工程学院,上海200237;华东理工大学化学与分子工程学院,上海200237【正文语种】中文【中图分类】O657.3;TS207.51在有机化学合成反应中,不同的金属,特别是过渡金属的复合物或金属盐类,通常作为催化剂或原料试剂使用,而大多数具有药物活性的药品或药剂的合成都需要加入金属催化剂或原料试剂,因此造成了药品中金属元素的残留,而这类残留通常是以金属元素在原材料中的存在形式或其衍生物形式存在于药品中。
原料药中重金属残留检测原料药中重金属残留测试
一、仪器及试剂
1、仪器:
电感藕合等离子质谱(ICP-MS,美国THERMO iCAP Q);WX-8000微波消解仪(上海屹尧仪器科技发展有限公司);Dura series超纯水处理系统。
2、试剂:
65%-68%优级纯硝酸(国药集团);超纯水(Dura series超纯水处理系统);各元素元素标准溶液(国家有色金属及电子材料分析测试中心,1000 μg/mL)。
3、标准溶液的配置:
吸取各元素元素标准溶液,用5 % HNO3将标准溶液稀释成20 mg/L的储备液,取20 mg/L的储备液再次稀释为200 µg/L、400 µg/L的储备液,取200 µg/L、400 µg/L储备液适量依次配制成0 µg/L、8 µg/L、16 µg/L、24 µg/L、32 µg/L、48 µg/L、64 µg/L的系列标准溶液,摇匀待用。
二、样品分析方法
1、前处理方法:
称取0.5mL样品至聚四氟乙烯消解罐中(精确至0.1 mg),加入5 mL硝酸。
静置,反应结束后,盖盖密封,放入微波消解仪,消解程序见表1。
步骤温度(℃)保温时间(min)
1 100 3
2 140 3
3 160 3
4 180 3
5 190 15
表1:消解程序
待温度冷却至50℃以下后,取出消解罐放入通风橱中,打开消解罐,用超纯水润洗,转移至50 mL容量瓶中,至少润洗3~4次,用超纯水稀释定容至刻度,待测。
空白对照同法处理。
2、仪器工作参数
载气流量(L/min)0.98 积分时间(ms)500
三、方法学验证
1、专属性检测
向样品溶液中使用移液枪移取50μL的100ng/mL的标准中间液,按照消解程序消解定容至50mL。
同时准备一份空白溶液,进样后对比分析。
要求专属性良好,其他元素对各元素元素检测无干扰。
2、系统适用性
根据制备溶液步骤制备溶液,在测试溶液前后各测量加标浓度为1.0 ng/mL的样品加标,前后两次的漂移不得超过20%。
3、线性关系和检出限、定量限
将系列标准溶液分别进样分析,得到各元素的线性方程和相关系数,要求线性关系良好。
取空白对照溶液进行测试,连续进样10次,以空白对照溶液测定值的3倍标准偏差除以相应元素标准曲线的斜率计算该方法的检出限。
4、重复性
取6份样品于微波消解罐中,按照上述过程消解,定容50mL,使用仪器读数,计算各元素元素的偏差。
测得RSD值均不得大于5%。
5、中间精密度
连续三天取1份样品于微波消解罐中,按照上述过程消解,定容50mL,使用仪器读数,计算各元素元素的偏差。
测得RSD值均不得大于5%。
6、加标回收率
取6份样品于微波消解罐中,使用移液枪取0.5 mL的1000ng/mL的标准溶液于微波消解罐中,按照上述过程消解,定容50mL,使用仪器读数,计算各元素元素的偏差。
加标回收率均要求在80%-120%之间,测得RSD值均不得大于5%。
科标技术分析中心简称“科标技术”,是青岛科标(检测)研究院旗下的专业分析研发品牌,由科标技术研发中心(青岛)有限公司独立运营。
科标技术依托科标检测品牌旗下的技术、设备、人员、平台等优势资源,地处化工行业产学研示范基地,可利用资源包括气相色谱质谱联用仪、液相色谱仪、ICP-OES等200余台/套先进的研发分析配套设备、5000平方米的实验室,保证分析的精度,为客户提供一站式的分析技术服务和整套解决方案。
科标技术作为“科标检测”品牌重点投资建设的专业研发品牌,可共享科标检测品牌旗下的优势团队资源。
专业研发团队150余人,其中教授(高级工程师、研究员)共9人,研究生以上学历共90余人,专业实验人员60余人。
科标品牌的发展得到了国家、省、市的大力支持与认可,是国家化工行业产学研示范基地分析研发板块支撑单位、科技部中小企业公共分析检测与科研创新资源共享服务平台、青岛市技术转移服务机构、青岛市名牌单位、青岛市“专、精、特、新”计划单位。
科标技术专业提供生物、环境、药品、精细化工、能源、材料等领域分析研发技术服务,专业解决国内外企业、高校院所、科研机构的分析方法开发与优化、课题外包、项目攻关等服务,致力于为客户提供最专业的分析研发解决方案,支撑科技进步,成为社会尊重、客户信赖的研究型分析研发机构。
科标技术始终引领分析研发行业的科学化、标准化发展,秉承“敢为人先、开拓创新、同心协力、勇承重载”的科标精神,以服务赢得信任,以品质铸就辉煌。
科标技术——“让研发更简单”。