第十三章有机合成基础_有机化学及实验
- 格式:ppt
- 大小:856.50 KB
- 文档页数:49

有机合成基础知识嘿,朋友们!今天咱来聊聊有机合成基础知识,这可真是个有趣又神奇的领域啊!你想想看,就好像我们是一群神奇的魔法师,能把各种不同的原子和分子组合在一起,创造出全新的化合物。
这多有意思呀!有机合成就像是搭积木,只不过我们用的不是木头积木,而是那些小小的原子。
我们要知道每个原子的脾气和特点,知道它们喜欢和谁在一起,不喜欢和谁在一起。
比如说碳原子,那可是有机世界的大明星,它特别喜欢和其他原子手牵手,组成各种各样的结构。
再说说反应条件吧,这就像是给我们的魔法施加合适的咒语。
温度啦、压力啦、催化剂啦,这些都能决定我们的魔法能不能成功。
有时候就差那么一点点条件不对,整个实验就可能失败。
这是不是跟我们做饭有点像?火候掌握不好,菜的味道就不一样啦。
还有那些反应类型,加成反应、取代反应、消除反应等等,每一种都有它独特的魅力。
加成反应就像是给分子加上一些新的装饰,让它变得更漂亮;取代反应呢,则像是给分子换一身新衣服,让它有了新的模样。
在有机合成的世界里,我们要时刻保持警惕,因为稍有不慎就可能出岔子。
就像走在一条小路上,得小心翼翼地避开那些陷阱和绊脚石。
但别害怕失败呀,失败是成功之母嘛!每次失败都是一次学习的机会,让我们能变得更厉害。
有机合成可不只是在实验室里玩玩哦,它和我们的生活息息相关呢!我们吃的药、用的化妆品、穿的衣服,很多都是通过有机合成得来的。
没有有机合成,我们的生活可就没那么丰富多彩啦!你说,有机合成是不是超级神奇?它就像一个充满奥秘的宝藏,等着我们去探索和发现。
让我们一起在这个神奇的世界里尽情遨游吧,说不定哪天我们也能创造出一个伟大的化合物呢!总之,有机合成基础知识是打开有机世界大门的钥匙,掌握了它,我们就能在有机的海洋里畅游啦!原创不易,请尊重原创,谢谢!。








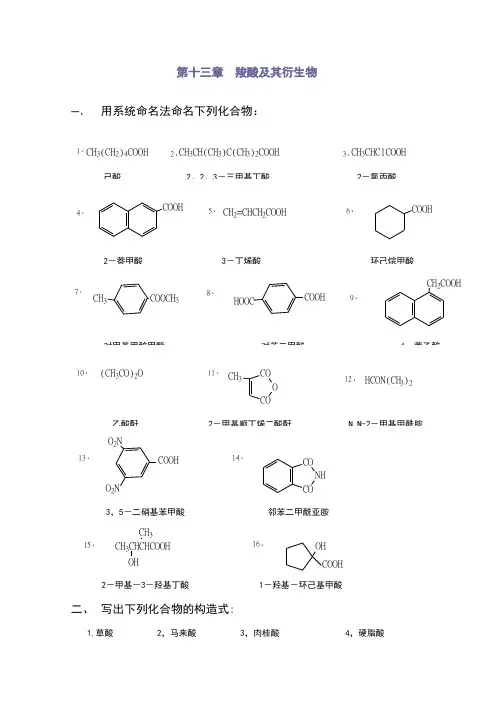
第十三章 羧酸及其衍生物一、 用系统命名法命名下列化合物:1.CH 3(CH 2)4COOH2.CH 3CH(CH 3)C(CH 3)2COOH3.CH 3CHClCOOH4.COOH5.CH 2=CHCH 2COOH6.COOH7.CH 3COOCH 38.HOOCCOOH9.CH 2COOH10.(CH 3CO)2O11.COO CO CH 312.HCON(CH 3)213.COOHO 2NO 2N14.CO NH3,5-二硝基苯甲酸 邻苯二甲酰亚胺15.CH 3CHCHCOOH CH 3OH16.OH COOH2-甲基-3-羟基丁酸 1-羟基-环己基甲酸二、 写出下列化合物的构造式:1.草酸 2,马来酸 3,肉桂酸 4,硬脂酸HOOCCOOHC C H H COOH COOHCH=CHCOOHCH 3(CH 2)16COOH5.α-甲基丙烯酸甲酯 6,邻苯二甲酸酐 7,乙酰苯胺 8,过氧化苯甲酰胺CH 2=C CH 3COOCH 3CO O CONHCOCH3CO C O OO NHC O H 2NCOOC 2H 5CNH C NHO OH 2N CNH 2NHCOO COnCH 2CH O C OCH 3[]n三、写出分子式为C 5H 6O 4的不饱和二元酸的所有异构体(包括顺反异构)的结构式,并指出那些容易生成酸酐:解:有三种异构体:2-戊烯-1,5-二酸;2-甲基-顺丁烯二酸;2-甲基-反丁烯二酸。
其中2-甲基-顺丁烯二酸易于生成酸酐。
CC H COOHCOOH C C H COOHCH 3HOOCCH 3HOOC CH=CHCH 2COOH2-戊烯-1,5-二酸; 2-甲基-顺丁烯二酸; 2-甲基-反丁烯二酸四、比较下列各组化合物的酸性强度:1,醋酸, 丙二酸, 草酸, 苯酚, 甲酸CH 3COOH ,HOOCCOOH HOOCCH 2COOH ,,OH ,HCOOHHOOCCOOHHOOCCH 2COOHHCOOHOHCH 3COOH>>>>2.C 6H 5OH ,CH 3COOH ,F 3CCOOH ,ClCH 2COOH ,C 2H 5OHF 3CCOOHClCH 2COOH CH 3COOH C 6H 5OHC 2H 5OH>>>>3.NO 2COOHCOOHNO 2COOHOHOHNO 2COOHCOOH NO 2COOH OHOH>>>>五、用化学方法区别下列化合物:1.乙醇,乙醛,乙酸2.甲酸,乙酸,丙二酸3.草酸,马来酸,丁二酸4,COOHCOOHCH 2OHOH2-羟基苯甲酸 苯甲酸 苯甲醇5.乙酰氯,乙酸酐,氯乙烷六、写出异丁酸和下列试剂作用的主要产物:1.Br 2/PCH 3CH 3CHCOOH Br /PCH 3CCOOH BrCH 32.LiAlH 4/H 2OCH 3CHCOOH CH 3LiAlH /H 2OCH 3CH 3CHCH 2OH 3.SOCl 2CH 3CH 3CHCOOH2CH 3CH 3CHCOCl4.(CH 3CO)2O/CH 3CH 3CHCOOH (CH 3CO)2O/CH 3CHCO)2CH 3(O +CH 3COOH5.PBr 3CH 3CH 3CHCOOH PBr (CH 3)2CHCOBr6.CH 3CH 2OH/H 2SO 4CH 3CH 3CHCOOH CH 3CH 2OH/H 2SO 4(CH 3)2CHCOOC 2H 57.NH 3/CH 3CH 3CHCOOHNH/(CH 3)2CHCONH 2七、分离下列混合物:CH 3CH 2COCH 2CH 3,CH 3CH 2CH 2CHO ,CH 3CH 2CH 2CH 2OH ,CH 3CH 2CH 2COOHCH 3CH 2CH 2COOH CH 3CH 2CH 2CH 2OH CH 3CH 2CH 2CHO CH 3CH 2COCH 2CH 3NaOHaqCH 2CH 2COONaCH 3CH 2CH 2COOHCH 3CH 2CH 2CH 2OH CH 3CH 2CH 2CHO CH 3CH 2COCH 2CH 3CH 3CH 2CH 2CHSO 3NaOHH +,H OCH 3CH 2CH 2CHOCH 3CH 2COCH 2CH 3NH 23NHOHCH 3CH 2CCH 2CH 3NNHOHHClCH 3CH 2COCH 2CH 3CH 3CH 2CH 2CH 2OH八、写出下列化合物加热后生成的主要产物:1, 1,2-甲基-2-羟基丙酸2, 2,β-羟基丁酸3, 3,β-甲基-γ-羟基戊酸 4, 4,δ-羟基戊酸5, 5,乙二酸九、完成下列各反应式(写出主要产物或主要试剂)1.CH 3CH 2CN (A)H 2O,H +CH 3CH 2COOHCH 3CH 2COCl(B)SOCl2(G)H 2,Pd/BaSO 4CH 3CH 2CHO2CONH 2P 2O 5(C)NH 3NaOBr,NaOH CH 3CH 2NH 22.C=O1.C 2H 5MgBr 2H 3O OH C 2H 5PBr 31.Mg,(C H )2O 2CO 2,H 3OC 2H 5COOH3.ClC ClO2NH 3H 2NC NH 2OH 2N CNH 2OH 2NC ONHC NH 2O4.C=O24OH CNH O +OH COOHOO OC O C十、完成下列转变:1.CH 3CH 2COOH CH 3CH 2CH 2COOHCH 3CH 2COOH CH 3CH 2CH 2OHPBr CH 3CH 2CH 2BrCH 3CH 2CH 2CN H O +CH 3CH 2CH 2COOH2.CH 3CH 2CH 2COH CH 3CH 2COOHCH 3CH 2CH 2COOH 2CH 3CH 2CHCOOHCl-OHCH 3CH 2CHCOOHOHKMnO ,H +CH 3CH 2COOH3.2CH 2COOHCH 2COOHC=CH 2+HBrROORCH 2Br25)OCH 2MgBr122,H 3O4.CH 3COCH 2CH 2CBr(CH 3)2CH 3COCH 2CH 2C(CH 3)2COOHCH 3COCH 2CH 2CBr(CH 3)222+CH 3CCH 2CH 2CBr(CH 3)2O OMg,(C 2H 5)OOOCH 3C CH 3CH 2CH 2CMgBrCH 3122.H 3OCH 3COCH 2CH 2C(CH 3)2COOH十一、试写出下列反应的主要产物:6.(R )-2-溴丙酸 + (S)-2-丁醇 H +/⊿C 2H 5HCH 3OO CBr H CH 3H +HCH 3OHCH 3CH 2+CH 3H COOHBr7.CH 3CH 2COONa+CH 3CH 2CH 2COClCH 3CH 2CH 2CO O CCH 2CHCH 3O 8.CH 2CH 2C CO O+2C 2H 5OHC 2H 5OC O CH 2CH 2COC 2H 5O9.CH 3CONH 2+NaOBr-OHCH 3NH 210.CNCONH 2+P 2O 5十二、预测下列化合物在碱性条件下水解反应的速度顺序。
化学,应用化学,化工,制药类各专业有机化学及实验教学大纲(试用)讲课学时:80 学时;实验学时:64学时大连理工大学化工学院化学系有机化学教研室2 0 0 9 年7 月有机化学教学大纲本大纲参考教育部化学与化工学科教学指导委员会于2006年拟订的化学专业《化学教学基本要求》制订。
讲课学时80。
章次目录第1章结构与性能概论4学时第10章醛酮醌6学时第2章分类及命名5学时第11章羧酸及其衍生物5学时第3章同分异构现象5学时第12章有机含氮化合物6学时第4章结构的表征 4 学时第13章杂环化合物5学时第5章饱和烃4学时第14章糖3学时第6章不饱和烃7学时第15章氨基酸蛋白质核酸2学时第7章芳香烃5学时第16章生物碱类脂萜及甾族化合物0学时第7章卤代烃6学时第17章有机合成基础4学时第9章醇酚醚5学时第18章绿色有机合成2学时教材:高占先主编有机化学第二版(国家精品教材—2008年)高等教育出版社2007年第1章结构与性能概论(4节4学时)纲目注释1.1 有机化合物和有机化学1 有机化合物与有机化学讲述定义,一般特性2 有机化学发展史讲述定义,发展史,有机化学与其它学科、国民经济关系1.2 分子结构1 学习方法2构造及构造式路易斯式、短线式、缩简式、键线式3共价键的形成甲键理论(杂化轨道,单、双、三键),分子轨道理论4 共价键的基本属性键长、键角、键能、键的极性、键的极化性5共振论简介简介共振论概念、用途,共振结构式书写规则,6 键的极性在链上的传递------诱导效应给电子基、拉电子基及其相对强度1.3 反应、试剂与反应控制1 有机反应中共价键断裂方式与反应类型反应过程共价键电子得失,均裂、异裂,共价键形成2 有机反应中间体的概念碳正离子、碳负离子、碳自由基的活泼性、构型3 试剂的分类亲电试剂、亲核试剂及其相对强度,亲电与亲核的相对性1.4 酸碱的概念和反应溶剂1酸碱理论共轭酸碱对,强度,酸碱的相对强度包括lewis酸碱与亲电、亲核试剂的关系2 溶剂的分类与溶剂化作用以界电常数、是否能形成氢键分类溶剂化作用,对化学反应的影响第2章分类及命名(5节5学时)2.1 分类方法和命名方法重点以碳架、官能团分类1 分类方法2 命名用介词8个介词的用法,基的命名,正、异、新,伯、仲、叔、季用法3普通命名法重点是普通命名法4俗名和简称2.2系统命名法重点三个规则2.3 烃的命名重点脂肪饱和链烃命名1开链烃命名,2 环烃命名,2.4烃衍生物的命名官能团做取代基、在链端、中间、任意位置四类1 烃衍生物命名(卤烃、硝基烃、氨基烃),2烃衍生物命名(含氧化合物),2.5 混合官能团化合物的命名运用三个规则第3章同分异构现象(5节5学时)3.1 构造异构和构象异构现象1 构造异构碳链异构、官能团位置异构、官能团异构、互变异构2链烷烃的构象重点乙烷、丁烷的构象3小环烷烃的结构及不稳定性重点环己烷、取代环己烷的构象3.2 几何异构现象1含双键化合物的几何异构顺/反、E/Z标记方法2含碳环化合物的顺反异构顺/反标记方法3.3 含手性中心化合物的对映异构现象1分子的手性与旋光性,手性概念、旋广度、比旋光度2手性分子的判断与表示,三种方法,重点费歇尔式,R/S、D/L标记3含两个手性碳分子异构现象,4含多个手性碳分子异构现象,3.4 非手性中心化合物的对映异构现象和构象对映体异构现象1含手型轴和手型面分子异构现象,1,2-丙二烯类,螺苯类2环状手性化合物,3.5 化合物的旋光性与对映体的拆分及合成1外消旋体的拆分分子结构决定旋光性重点化学拆分2不对称合成的概念第4章结构的表征(4节4学时)4.1 研究结构的基本程序4.2 红外光谱鉴定官能团4.3 核磁共振谱鉴定相邻碳原子及其相连的氢原子数目4.4 紫外光谱和质谱鉴定共轭体系、确定分子结构及相当分子质量第5章饱和烃(3节4学时)5.1 结构及链烷烃的物理性质给出各种骨架烷烃包括特殊的立方烷1同系列概念,同系列概念;2烷烃的物理性质,正构烷烃的物理常数变化规律5.2 烷烃的化学性质1 烷烃卤代反应氯代反应机理,卤代反应规律,碳自由基稳定性规律2卤代反应机理3 氧化反应4 裂解及异构反应5.3 环烷烃的性质1小环烃加成反应,不对称取代小环烷烃加成反应规律2环烷烃的氧化反应,3稠环烷烃及饱和烃来源。
第十三章现代有机化学和高分子化学的发展人类利用有机化合物最初来自生物有机体,除了从天然产物提取一些有机物质外,进而还通过农产品的综合利用,生产某些有机制品。
例如用粮食、薯类发酵制酒精就是一个例子。
其后,煤又成为有机化学工业原料的重要来源。
因为随着钢铁工业的发展,炼焦工业随着兴起,从炼焦副产物煤焦油可以提取多种芳烃,于是在十九世纪中叶,煤焦油化学便发展起来,关于这一时期的有机化学,我们已在第九章中作了介绍。
焦炭进而又可以做成电石,二十世纪初,因为电力工业有了大发展并日益强大,于是又崛起了电石化学。
在现代有机化学工业中,电石是一种非常重要的原料。
早在1839年,美国人黑尔(Hare)曾将氰化汞与石灰混合,用电弧加热,所得产物遇水时产生出一种气体,这便是最早获得的电石和乙炔。
1862年,维勒将碳和锌钙合金一起加热,也制得了电石,并鉴定了电石遇水所产生的气体就是乙炔。
1892年,美国人威尔逊(T.L.Willson,1860——1915)发明了以廉价的石灰和煤为原料在电炉中加热制取电石的方法,美国并于1895年建立了世界上第一个电石工厂。
工业制造电石要在高温电炉中进行,这就需要有相当雄厚的电力资源。
十九世纪末,电力工业发展到一个新水平,从而使电石工业有了兴起与迅速发展的可能。
在电石工业发展的初期,电石仅用于制取照明用的乙炔。
以后虽出现一些电石和乙炔的新用途,例如电石可用来制造碳氮化钙,进而制造氨肥;乙炔的高温火焰可用于切割、焊接金属等,但应用仍有限,因此,美国在电石生产工业化后的初期,电石生产曾一度过剩。
到本世纪二十年代,随着合成氨工业出现,虽然用电石生产化肥的方法也逐渐被淘汰了,但这时由于人们已探索到乙炔可以制造醋酸、乙醇等多种基本化工原料,并实现了工业化,这样电石——乙炔的原料路线便开始形成,电石化学成了有机合成工业的基础之一,随之也出现了电石工业的大发展。
乙炔是一种性质活泼、分子结构简单的化合物。