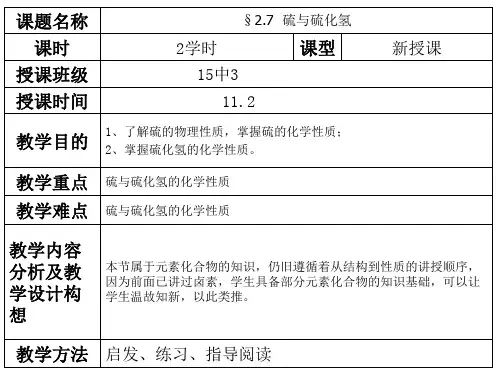
《硫、硫化氢》.
- 格式:pdf
- 大小:74.64 KB
- 文档页数:6

硫化氢中硫的杂化方式嘿,朋友们!今天咱们来聊聊硫化氢里硫的杂化方式,这就像是一场超级有趣的微观魔法秀呢。
你可以把硫原子想象成一个超级魔法师,在硫化氢这个小世界里要施展独特的魔法。
这个硫原子原本的电子结构啊,就像是它带着一群调皮的小电子精灵。
当它要进行杂化的时候,就像是魔法师要把这些小电子精灵重新排列组合,准备一场盛大的演出。
通常呢,硫在硫化氢里采用的是sp3杂化。
这sp3杂化啊,就像是硫原子给自己打造了四个魔法棒。
每个魔法棒都有独特的功能,就像四个性格迥异但又相互配合的小助手。
这四个杂化轨道就像四个伸向不同方向的小触手。
如果把硫化氢分子比作一个小房子,那这四个触手就像支撑小房子的柱子,稳稳地固定着整个分子结构。
其中两个触手抓住了氢原子这个小不点,就像两只大手抓住了两个小气球,让它们不能乱跑。
你看,硫原子从原本比较单一的电子状态变成sp3杂化,就像一个人原本穿着普通的衣服,突然换上了一身超级酷炫的四件套装备,而且每个装备都有特殊的用途。
这四个杂化轨道可不是随便长的,它们按照一定的角度伸展,就像精心设计的卫星天线,朝着最合理的方向接收或者发射信号,在硫化氢分子里就是合理地安排化学键的方向。
要是把未杂化的硫原子比作一个手忙脚乱的小厨师,不知道怎么摆放食材(电子),那杂化后的硫原子就是一个井井有条的大厨,把食材(电子)整整齐齐地放在四个盘子(杂化轨道)里,准备烹饪出硫化氢这个“菜肴”。
再夸张一点说,这个杂化过程就像孙悟空的七十二变。
硫原子原本普普通通的样子,一下子变成了拥有四个特殊能力(杂化轨道)的新模样。
而且这四个能力是如此的协调,就像一个完美的小团队,共同维持着硫化氢分子的稳定。
如果把硫化氢分子比作一艘小船,那sp3杂化后的硫原子就是船的核心引擎和船桨控制器,通过它那四个杂化轨道,稳定地推动着小船在微观的化学海洋里航行,让硫化氢分子有着自己独特的性质和存在方式。
这就是硫化氢中硫的杂化方式啦,是不是超级有趣呢?感觉就像在微观世界里看了一场精彩绝伦的魔法表演,每一个细节都充满了惊喜。

硫化氢和硫反应方程式
H2S和硫(S)之间的化学反应是:
2H2S(g) + 3O2(g) → 2SO2(g) + 2H2O(ℓ)
硫化氢(H2S)是一种常见的有毒有害气体,即硫化氢分子,含有一个硫原子和两个氢原子。
H2S是一种可燃气体,可以通过燃烧反应获得能量。
H2S反应与硫发生如下反应:
H2S + O2 → SO2 + H2O
在这种反应中,H2S的一个原子结合与一个氧原子,一个氢原子分解为一个水分子。
结果产生了硫酸二氧化(SO2)分子以及水汽(H2O)分子。
反应的化学方程式如下:
2H2S(g) + 3O2(g) → 2SO2(g) + 2H2O(ℓ)
上述化学反应可以进一步分解为多个基本反应,其结果如下:
H2S(g) + 2 O2(g) → S(s) + 2 H2O(ℓ)
S(s) + 2 O2(g) → SO2(g)
有趣的是,在上述反应中,硫颗粒在反应过程中会转变为硫酸二氧化(SO2)分子。
因此,当硫化氢(H2S)与空气中混合氧发生燃烧反应时,会产生二氧化硫(SO2)气体。
在实际应用中,H2S反应和硫反应在工业生产中起着十分重要的作用。
比如,其中的2H2S(硫化氢)反应可以用于生产硫酸,而SO2反应可以用于生产各种酸性物质。
因此,这两种反应在很多工业应用中发挥着重要作用。



5.1从黑火药到酸雨(1)知识要点一、硫1.自然界中硫的存在:含量低(硫元素在地壳中含量0.05%),分布广游离态——火山口附近化合态——芒硝、石膏、硫铁矿、黄铜矿等含硫化合物,生物体内蛋白质中2.硫的物理性质淡黄色固体,不溶于水,微溶于酒精,易溶于CS2。
可利用硫易溶于CS2的特点分离或除去硫,如可用CS2洗涤沾有硫粉的试管。
3.化学性质硫是比较活泼的非金属元素。
硫的原子结构示意图:,S原子最外层有6个电子,能得到2个电子成为-2价的硫,最高正价为+6价,此外硫的常见化合价还有+4价等。
硫单质中硫为0价,在化学反应中,其化合价既能降低又能升高,因此硫既能作氧化剂又能作还原剂。
(1)与金属反应S作氧化剂,与钠、铝、铁、铜、汞等金属单质都能反应,S被还原为S。
具有可变价态的金属(如铁、铜)只能被硫氧化到较低价态。
①2Na + S→Na2S,常温下研磨即可剧烈反应。
②Fe + S Δ→ FeS,加热条件下反应。
停止加热后,混合物仍保持红热状态(说明反应放热),生成黑褐色固体硫化亚铁。
③2Cu + S Δ→ Cu2S,Cu在S蒸气中燃烧,生成黑色固体硫化亚铜。
④Hg + S → HgS,实验室可利用此反应处理洒落的汞滴。
(2)与非金属反应①与氢气,硫作氧化剂H2 + S Δ→H2S②与氧气,硫作还原剂S + O2点燃→SO2硫在空气中燃烧产生微弱的淡蓝色火焰,在纯氧中燃烧产生明亮的蓝紫色火焰。
在点燃条件下,即使O2过量反应产物也是SO2,S和O2单质间化合产物不能写成SO3。
(3)黑火药反应该反应中,S和KNO3为氧化剂,C为还原剂。
二、硫化氢无色,有臭鸡蛋气味有毒气体,比空气重(标准状况下密度ρ=3422.4=1.52g/L),能溶于水,水溶液为氢硫酸。
1.化学性质硫化氢气体具还原性,具体表现为能在O2中燃烧,能被Cl2、SO2等氧化,能使酸性高锰酸钾褪色等。
0-2(1)可燃性→2SO2 + 2H2O氧气充足时,硫化氢气体完全燃烧:2H2S + 3O2点燃→2S↓ + 2H2O氧气不足时,硫化氢气体不完全燃烧:2H2S + O2点燃(2)与SO2反应2H2S + SO2→ 3S↓ + 2H2OH2S与SO2在集气瓶内混合后,可在瓶壁观察到有水珠和淡黄色粉末出现。

硫化氢中硫元素的化合价
硫化氢(H2S)是一种十分毒性的无色气体,其中的硫元素的化合价是-2。
1、硫化物的定义
硫化物指由二价或三价硫原子与其他种子元素组合而成的物质。
其中
最常见的是氯化铝硫化物,其次是亚硫酸钠、硫酸锌和硫酸铅等硫化物。
2、硫化氢的结构
硫化氢的分子结构由一个硫原子和两个氢原子组成,二者的化学键长
度为99.2pm。
由于硫原子比氢原子具有更大的电负性,硫化氢的分子
中存在着静电交互作用,硫原子极性程度要大于氢原子,由此硫的化
合价也可表示为负2。
3、硫化氢的性质
硫化氢是一种无色、有毒的气体,它味道非常刺激,其闻起来有烫伤
鼻腔的感觉和酸涩味,可引起急性中毒。
硫化氢沸点为42.1摄氏度,
能很容易与其他气体混合而不会析出液体,但其与水反应会产生极具
危害性的氰化钠。
4、硫化氢的用途
硫化氢是人类合成的重要物质,它的实际应用在石油和煤炭化工等方
面有着广泛的用途。
它可作为一种有效的纤维和塑料碳化剂;也可做为机械制造业粗磨剂、焊料熔剂之用;可以作为冶炼钢铁、镍和铬等贵金属的重要原料;另外它也作为溶剂,制作皮革、制造合成橡胶、制药、消毒药物、颜料等;还作为溶剂替代物。

5.1 从黑火药到酸雨(1)知识重点一、硫1.自然界中硫的存在:含量低(硫元素在地壳中含量0.05%),散布广游离态——火山口邻近化合态——芒硝、石膏、硫铁矿、黄铜矿等含硫化合物,生物体内蛋白质中2.硫的物理性质淡黄色固体,不溶于水,微溶于酒精,易溶于CS2。
可利用硫易溶于 CS2的特色分别或除掉硫,如可用 2CS 清洗沾有硫粉的试管。
3.化学性质硫是比较开朗的非金属元素。
硫的原子构造表示图:,S 原子最外层有 6 个电子,能获得 2 个电子成为 -2 价的硫,最高正价为+6 价,别的硫的常有化合价还有+4 价等。
硫单质中硫为 0 价,在化学反响中,其化合价既能降低又能高升,所以硫既能作氧化剂又能作复原剂。
(1)与金属反响0 -2S 作氧化剂,与钠、铝、铁、铜、汞等金属单质都能反响,S 被复原为 S。
拥有可变价态的金属(如铁、铜)只好被硫氧化到较廉价态。
①2Na + S Na2 S,常温下研磨即可强烈反响。
②Fe + S → FeS,加热条件下反响。
停止加热后,混淆物仍保持红热状态(说明反响放热),生成黑褐色固体硫化亚铁。
③2Cu + S → Cu2S, Cu 在 S 蒸气中焚烧,生成黑色固体硫化亚铜。
④Hg + SHgS,实验室可利用此反响办理洒落的汞滴。
(2)与非金属反响① 与氢气,硫作氧化剂H 2+ S →2 H S② 与氧气,硫作复原剂S+O2 点燃SO2 →硫在空气中焚烧产生轻微的淡蓝色火焰,在纯氧中焚烧产生光亮的蓝紫色火焰。
在点燃条件下,即便 O2过度反响产物也是SO2,S 和 O2单质间化合产物不可以写成 SO3。
(3)黑火药反响该反响中, S 和 KNO 3为氧化剂, C 为复原剂。
二、硫化氢无色,有臭鸡蛋气味有毒气体,比空气重(标准状况下密度ρ= 3422.4),能溶于水,水溶液为氢硫酸。
1.化学性质硫化氢气体具复原性,详细表现为能在 O2中焚烧,能被 Cl 2、SO2等氧化,能使酸性高锰酸钾退色等。

硫化氢硫磺分子量
硫化氢
硫化氢(H2S)是一种有毒气体,化学式为H2S。
由于它有一种特殊的臭味,常常被称为“臭鸡蛋气味”,这种臭味可以在非常低的浓度下就被人类嗅觉感知。
硫化氢是一种非
常有毒的气体,可以导致中毒,甚至死亡。
硫化氢的分子量为34.08g/mol。
硫化氢是一种极其不稳定的化学物质,容易被氧化为硫酸,并与许多金属形成硫化物。
硫化氢是一种无色、有毒、易燃的气体,具有强烈的刺
鼻气味,被广泛用于工业和化学实验中。
硫化氢的制备方法有几种。
其中一种方法是通过加热硫化铁和酸来制备硫化氢。
另一
种方法是通过反应氢气和硫来制备硫化氢。
硫磺
硫磺是一种化学物质,化学式为S8。
它是一种黄色晶体化合物,拥有明显的硫磺味道。
硫磺分子量为256.52g/mol。
硫磺具有一系列重要的化学性质和用途,同时也被广泛应用
于医药、农业、化学和矿业等领域。
硫磺的制备方法有多种。
其中一种方法是通过在高温下将纯硫磺加热到熔点(115°C)以上,然后将熔融硫磺喷入冷却器中,冷凝成细颗粒硫磺。
另一种方法是将硫化氢气体与
氧气反应,生成二氧化硫和硫磺。
硫磺具有独特的物理和化学性质。
硫磺可以溶解于有机溶剂中,但不能溶解于水。
硫
磺在低温下易形成聚硫,而在高温下则易发生氧化反应。
此外,硫磺还具有很强的极性和
良好的稳定性。
其用途广泛,包括在农业中用作杀虫剂、在医学中用作皮肤治疗剂和火药
催化剂、在化学中用作染料和荧光染料等。

硫化氢(H2S)与硫(S)硫元素常见的化合价有(由低到高排序):____________________________。
一、硫化氢(H2S)1.H2S的物理性质:_________色、____________气味的气体,有毒,能溶于水(1:2.6),H2S的水溶液显_________性(填“酸”或“碱”)。
2. H2S的化学性质:(1)弱酸性:________________________,________________________。
(2)不稳定性(受热易分解):________________________。
(3)强还原性:________________________,________________________;________________________,________________________,________________________。
3.H2S实验室制法:(1)实验原理:______________________________。
(2)发生装置:与制取CO2的相同,可以用启普发生器。
(3)干燥装置:选___________作为干燥剂,不可用浓H2SO4,因为________________________。
(4)收集装置:用_____________法收集。
(5)尾气处理装置:常使用_________溶液,也可用_________溶液。
相关化学反应为:________________________,________________________。
(6)H2S的检验:可用____________溶液或____________试纸。
相关化学反应为:________________________,________________________。
二、硫(S)1.硫元素的存在形态:(1)游离态:天然硫,俗称__________,存在于火山口附近或地壳岩层里。

硫化氢中硫的杂化方式
《硫化氢中硫的杂化方式》
嘿,今天咱就来说说硫化氢中硫的杂化方式。
你们知道吗,就像我上次去菜市场买菜,看到那些各种各样的蔬菜摆在一起。
那场景就好像硫原子周围的那些电子轨道似的。
咱就说硫原子啊,它就像是菜市场里的那个中心摊位,周围的轨道就是那些来来往往的人。
硫原子为了更好地和其他原子结合呀,就开始进行杂化啦。
就好像菜市场里的摊主为了招呼更多的顾客,会摆出各种吸引人的姿态。
它会把自己的轨道重新组合,变得更适合和氢原子结合。
这就好比摊主调整自己的摊位布局,让顾客更容易挑选商品。
这种杂化方式可神奇了,让硫化氢有了它独特的性质。
哎呀呀,这硫化氢中硫的杂化方式啊,还真挺有意思的,就像我在菜市场的那次经历一样让人印象深刻呢!下次再看到硫化氢,我肯定就会想起那个热闹的菜市场啦。
哈哈!。
硫化氢和硫的相互转化硫化氢和硫是两种重要的化学物质,在工业生产和日常生活中都有广泛应用。
硫化氢是一种具有刺激性气味的有毒气体,常用于制造硫酸、硫醇等化学品,同时也是一种重要的燃料。
硫是一种非金属元素,常用于制造硫酸、硫酸盐等化学品,同时也是一种重要的矿物资源。
硫化氢和硫之间可以相互转化,这种转化涉及到多种化学反应和过程。
本文将从硫化氢和硫的基本性质、相互转化的反应机理、应用等方面进行讨论。
一、硫化氢和硫的基本性质硫化氢,化学式H2S,是一种无色有臭味的气体。
其密度为1.363 g/L,熔点为-82.9℃,沸点为-60.3℃。
硫化氢是一种弱酸性物质,在水中可以形成硫酸根离子HS-和H+,同时也可以和金属形成硫化物。
硫,化学符号为S,是一种非金属元素。
硫的物理性质与硫化氢有很大差别,硫为黄色脆性固体,密度为2.07 g/cm3,熔点为115.21℃,沸点为444.6℃。
硫在常温下不溶于水,但可以溶于二硫化碳、苯等有机溶剂。
二、硫化氢和硫的相互转化的反应机理硫化氢和硫之间可以通过多种化学反应进行相互转化。
下面将分别介绍这些反应的机理。
1.硫化氢氧化生成硫硫化氢在空气中可以被氧化生成硫。
这种反应是一种氧化还原反应,反应式为:2H2S + 3O2 → 2H2O + 2SO2在反应中,硫化氢被氧化成为二氧化硫,同时放出大量的热量。
这种反应可以用于制备硫和硫酸。
2.硫还原生成硫化氢硫可以还原成为硫化氢。
这种反应也是一种氧化还原反应,反应式为:S + 2H2 → H2S在反应中,硫被还原成为硫化氢,同时消耗了氢气。
这种反应可以用于制备硫化氢。
3.硫化物酸解生成硫化氢硫化物可以被酸解生成硫化氢。
这种反应是一种酸碱反应,反应式为:M2S + 2HCl → 2MH + H2S在反应中,硫化物被酸分解成为硫化氢,同时生成盐和水。
这种反应可以用于检测硫化物的存在。
4.硫化氢加氧生成硫和水硫化氢可以加氧生成硫和水。
这种反应也是一种氧化还原反应,反应式为:2H2S + O2 → 2S + 2H2O在反应中,硫化氢被氧化成为硫和水,同时放出大量的热量。
《 S 和 H2S 》基础过关【基础知识】1、S的颜色要记清,同时归纳常见黄色物质。
2、S的溶解性质要记清,同时对比碘单质。
3、S的化学性质⑴.S和金属单质的反应,一般来说,我们会注意到生成____价化合物,但是会忽视硫在化合物中的化合价。
所以此处会有两种考查方式。
⑵.S和非金属单质的反应,注意产物是SO2还是SO3?⑶.S和酸的反应应注意酸必须具有__________,会书写S和浓硫酸、浓硝酸反应的方程式。
⑷.S和碱的反应,注意类比其他非金属单质的歧化反应及对比归中反应。
4、S的制备,掌握实验室制备就行了。
5、H2S 的物理性质,注意它的气味__________,__________(能或不能)算作刺激性气味,常见的刺激性气味有______、_______、_____、_____、_____、______(已学的2种,未学的4种)。
6、H2S 的化学性质⑴.能从结构和化合价进行分析,推出其可能的性质,而不是去强记。
⑵.H2S 的酸性,这一点要类比CO2,常见的考查方式有两种:①.离子方程式对产物的考查②.和碱反应后产物可能性分析⑶.H2S 的还原性,这一点非常重要,它联系着氧化还原反应的知识,包括常见的氧化剂,强的、弱的。
包括氧化还原后化合价的变化规律,相邻化合价规律和稳定化合价规律。
常见的氧化剂:SO2,FeCl3,H2O2,I2水,溴水,O2,氯水,浓硫酸,浓硝酸等常见的考查方式有与O2反应,与SO2反应,离子反应方程式,变形反应式,硫化物的保存等。
⑷.H2S 还可能有氧化性和不稳定性,在此不做讲解。
7、H2S的制备:⑴.原理分析⑵.原料⑶.装置⑷.收集和检验。
硫化氢硫磺分子量
硫化氢和硫磺是两种常见的硫化物,它们的分子量分别为34g/mol和256g/mol。
硫化氢分子由一个硫原子和两个氢原子组成,是一种具有刺激性气味的无色气体。
它广泛应用于化学工业和生物学研究中。
硫化氢是一种有毒气体,对人体和环境都有危害,因此必须谨慎使用。
硫磺是一种黄色固体,常用于制造硫酸和其他化学品。
它也被用于制造火药和医药领域。
硫磺具有抗菌、杀虫和防腐等作用,因此被广泛应用于农业和医药领域。
硫化氢和硫磺都是重要的化学物质,它们的分子量分别为34g/mol和256g/mol。
它们在不同领域有着广泛的应用,但也需要注意安全使用。
硫化氢生成硫单质的化学方程式化学方程式,2 H2S → 2 H2 + S.
硫化氢(H2S)是一种有毒气体,它可以通过化学反应生成硫单
质(S)和氢气(H2)。
这个化学反应的方程式是2 H2S → 2 H2 + S。
这个反应是一个重要的化学反应,它在工业和实验室中都有广泛
的应用。
硫化氢生成硫单质的化学反应是一个分解反应。
在这个反应中,硫化氢分解成了硫单质和氢气。
这个反应通常在高温下进行,通常
是在500°C以上的温度下进行。
在这个温度下,硫化氢分子会分解
成硫单质和氢气。
这个反应在工业上有很多应用,其中一个重要的应用是在硫的
生产中。
硫是一种重要的化工原料,它被用于制造硫酸、硫酸盐和
其他化工产品。
硫化氢生成硫单质的反应是硫的生产过程中的一个
重要步骤。
此外,这个反应也在实验室中有一些应用。
它可以用于制备硫
单质和氢气。
硫单质在实验室中被用于制备一些化合物,而氢气则
可以用于一些实验室反应中。
总的来说,硫化氢生成硫单质的化学反应是一个重要的化学反应,它在工业和实验室中都有广泛的应用。
这个反应的发现和应用对化学工业和实验室化学都有着重要的意义。