高三化学卤代烃+醇消去、取代反应
- 格式:ppt
- 大小:3.80 MB
- 文档页数:9

卤代烃的消去反应有哪些规律?与水解反应有哪些区别?
卤代烃的化学性质较活泼,这是由于卤原子(官能团)的作用所致。
卤原子结合电子的能力比碳原子强,当它与碳原子形成碳卤键时,共用电子对偏向卤原子,故碳卤键的极性较强,在其他试剂作用下,碳卤键很容易断裂而发生化学反应。
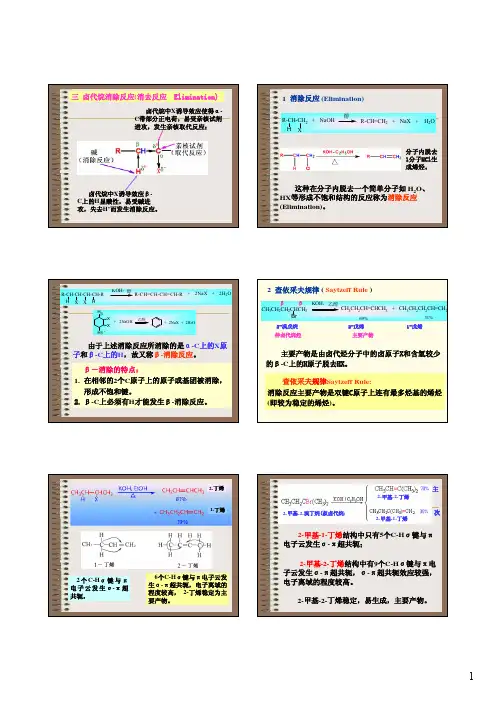
1.消去反应
(1)消去反应的实质:从分子中相邻的两个碳原子上脱去一个卤化氢分子,从而形成不饱和化合物。
例如: CH 3CH 2Cl :
+NaOH ――→醇
△NaCl +CH 2===CH↑+H 2O
(2)卤代烃的消去反应规律
①没有邻位碳原子的卤代烃不能发生消去反应,如CH 3Br 。
②有邻位碳原子,但邻位碳原子上不存在氢原子的卤代烃也不能发生消去反应。
例如:。
③有两个相邻碳原子,且碳原子上均带有氢原子时,发生消去反应可能生成不同的产物。
例如:
CH 3—CH===CH —CH 3+NaCl +H 2O
(3)二元卤代烃发生消去反应时要比一元卤代烃困难些。
有些二元卤代烃发生消去反应后可在有机物中引入三键。
例如:CH 3—CH 2—CHCl 2+2NaOH ――→醇
△CH 3—C≡CH +2NaCl +2H 2O[
2.消去反应与水解反应的比较
消去反应可在碳链上引入碳碳双键或碳碳三键。
(2)与—X相连碳原子的邻位碳上有氢原子的卤代烃才能发生消去反应,否则不能发生消去反应。



.
精品 卤代烃的取代反应
卤代烃中卤原子易被其它基团取代,所以是有机合成中的重要是间体之一,常用R —Br ,碘代烃因价格高而较少使用。
⑴羟基取代
⑵烷氧基取代 R —X + R ’ONa → ROR ’ + NaX
⑶氰基取代 R —X +NaCN → RCN + NaX
这一反应是有机合成中增长碳链的方法之一。
生成时RCN 在H +或OH —催化作用下生成
RCOOH ,碱性条件下还原可生成RCH 2NH 2。
⑷氨基取代 R —X + NH 3(过量) → RNH 2 + HX
此反应若卤代烃过量则还可生成R 2NH 或R 3N 。
注:上述反应特点:①为负离子如OH —、CN —,②有孤对电子的分子如NH 3,它们进攻RX
的
X C δδ:-+,的带正电部分,叫做亲核试剂,这种取代反应叫亲核取代,用SN 表示。
通式为X
R δδ:-++Z :(亲核试剂)→ R :Z + X —。
⑸与AgNO 3醇溶液生成卤化银沉淀
RX + AgNO 3
R O
NO 2+ ⑹卤素置换
RCl(RBr)+NaI 丙酮RI
如有侵权请联系告知删除,感谢你们的配合!。

三、消去反应1.概念:有机物在适当的条件下,从一个分子中脱去一个小分子(如水、HX 等),生成不饱和(双键或三键)化合物的反应。
如:实验室制乙烯。
2.能发生消去反应的物质:醇、卤代烃;能发生消去反应的官能团有:醇羟基、卤素原子。
(1)卤代烃消去HX在卤代烃的消去反应中,碱是反应物,醇是提供反应环境的溶剂,因为生成的乙烯能溶于醇中,同时反应物中的碱能与HBr 发生反应,使反应不断向生成乙烯的方向移动。
对于2-溴丁烷来说,发生取代反应时,生成含取代基较多的烯烃,这样的烯烃对称性好,分子比较稳定。
也就是说主要从含氢原子较少的碳原子上消去氢原子。
在醇的消去反应中,浓硫酸既起催化剂的作用,又起脱水剂的作用,也能促进反应不断的向生成乙烯的方向进行。
(2)醇消去H 2O :CH 3CH 2OHC170/浓硫酸CH 2=CH2+H 2O3.反应机理:相邻消去发生消去反应,必须是与羟基或卤素原子直接相连的碳原子的邻位碳上必须有氢原子,否则不能发生消去反应。
如CH 3OH ,没有邻位碳原子,不能发生消去反应。
加成反应和消去反应是对立统一的关系:饱和化合物通过消去反应,生成不饱和的化合物,腾出空位子,再通过加成反应,引入所需要的官能团。
四、聚合反应聚合反应是指小分子互相作用生成高分子的反应。
聚合反应包括加聚和缩聚反应。
1.加聚反应:由不饱和的单体加成聚合成高分子化合物的反应。
反应是通过单体的自聚或共聚完成的。
加聚反应的复习可通过类比、概括,层层深入,寻求反应规律的方法复习。
发生加聚反应的官能团是碳碳双键:加聚反应的实质是:加成反应。
加聚反应的反应机理是:碳碳双键断裂后,小分子彼此拉起手来,形成高分子化合物。
Ⅰ.单烯烃的加聚CH 2 HBrNaOH 醇溶液CH 2 CH 2+ HBrCH 2(1)乙烯的加聚:(2)氯乙烯的加聚:(3)丙烯的加聚:(4)2-丁烯的加聚:小结:烯烃加聚的基本规律:Ⅱ.二烯烃的加聚二烯烃单体自聚时,单体的两个双键同时打开,单体之间直接连接形成含有一个新双键的链节而成为高分子化合物。

卤代烃亲核取代和消除反应机理亲核取代反应历程卤代烃的亲核取代反应是⼀类重要反应,由于这类反应可⽤于各种官能团的转变,在有机合成中具有⼴泛的⽤途,因此,对其反应历程的研究也就⽐较重要。
在亲核取代反应中,研究最多的是卤代烃的⽔解,在反应的动⼒学、⽴体化学,以及卤代物的结构,溶剂等对反应速率的影响等都有不少的资料。
根据化学动⼒学的研究及许多实验表明,卤代烃的亲核取代反应是按两种历程进⾏的,即双分⼦亲核取代反应(S N 2反应)和单分⼦亲核取代反应(S N 1反应)。
⼀、双分⼦亲核取代反应(S N 2反应)实验证明:伯卤代烃的⽔解反应为S N 2历程。
RCH 2Br+OH -→RCH 2OH+Br -,v =k [RCH 2Br]·[OH -],v 为⽔解速率,k 为⽔解常数。
因为RCH 2Br 的⽔解速率与RCH 2Br 和OH -的浓度有关,所以叫做双分⼦亲核取代反应(S N 2反应)。
1.S N 2反应机理:亲核试剂(Nu -)从离去基团(L)的背⾯进攻中⼼碳原⼦。
当亲核试剂与中⼼碳原⼦之间逐渐成键时,离去基团与中⼼碳原⼦之间的键逐渐断裂,新键的形成和旧键的断裂是同步进⾏的协同过程,其反应过程如下所⽰。
反应物(sp 3) 过渡态(sp 2)产物(sp 3) 2.S N 2反应的能量变化,可⽤反应进程-势能曲线图表⽰如下:S N 2反应进程中的能量变化3.S N 2反应的⽴体化学:背⾯进攻和构型翻转。
(1)背⾯进攻反应:在S N 2反应中,亲核试剂Nu -可以从离去基团的同⼀边或离去基团的背⾯进攻中⼼碳原⼦(C δ+)。
若从离去基团的同⼀边进攻,则亲核试剂与带负电荷的离去基团(L δ-)之间,除空间障碍外,还因同种电荷相互排斥使反应活化能升⾼,不利于反应的进⾏。
若从离去基团的背⾯进攻,则反应活化能较低,容易形成相对较稳定的过渡态,反应易于进⾏。
(2)构型翻转:在S N 2反应中,中⼼碳原⼦由反应底物时的sp 3杂化转变为过渡态时的sp 2杂化,这时亲核试剂与离去基团分布在中⼼碳原⼦的两边,且与中⼼碳原⼦处在同⼀直线上,中⼼碳原CδδNu C + L -δδNu C + L δδNu C + L -Nu⼦与它上⾯的其他三个基团处于同⼀平⾯内。

卤代烃发生消去反应和水解反应的条件卤代烃是具有卤素取代基的烃类化合物,常见的有氯代烷和溴代烷等。
在实验室和工业生产中,卤代烃发生消去反应和水解反应是比较常见的反应。
下面介绍一下这两种反应的条件。
1. 消去反应的条件
消去反应是指卤代烃中的卤素取代基与邻接碳原子所连接的氢原子发生取代反应,生成烯烃或炔烃等不饱和化合物。
消去反应的条件如下:
温度:在适当的温度下进行,一般在100-200℃之间。
催化剂:消去反应需要催化剂的存在,常用的催化剂有碱金属氢氧化物、碳酸钾、碳酸钠等。
碱性条件:消去反应需要碱性条件,常用的碱有氢氧化钠、氢氧化钾、氢氧化钙等。
邻原子基团的影响:邻基团对消去反应有很大的影响,如果邻接原子上有较强的吸电子基团(如羰基、酮基、醇基等),则消去反应的速率会显著降低。
2. 水解反应的条件
水解反应是指卤代烃中的卤素取代基与水反应,水解成相应的醇或酸。
水解反应的条件如下:
温度:在高温下进行水解反应,一般需要加热到100℃以上。
催化剂:水解反应需要酸性或碱性催化剂的存在,常用的酸催化剂有硫酸、盐酸等,常用的碱催化剂有氢氧化钠、氢氧化钾等。
水的用量:水解反应需要适量的水参与反应,过量或不足都会影响反应的进行。
原料的结构:卤代烃的结构对水解反应也有很大的影响,一般来说,碳-卤键越长,水解反应的速率越慢。
同时,邻接原子上的基团也会影响水解反应的速率。

有机化学基础知识点整理卤代烃的亲电取代反应有机化学基础知识点整理:卤代烃的亲电取代反应一、简介有机化学是研究含有碳元素的化合物的科学,而卤代烃是其中一类常见的有机化合物。
卤代烃中的卤素原子与碳原子之间的键易于断裂,从而发生亲电取代反应。
本文将对卤代烃的亲电取代反应进行整理并介绍其基础知识点。
二、卤代烃的亲电取代反应分类卤代烃的亲电取代反应可以分为以下几类:1. 氢取代反应:亲电物质取代卤素原子,生成取代产物。
2. 亲电物质取代相邻的碳原子,生成加成产物。
3. 分子内环化反应:亲电取代反应发生在同一分子内部,形成环状产物。
4. 分子间亲电取代反应:亲电取代反应发生在不同分子之间,生成新的分子。
三、取代机理与影响因素1. SN2机制:双触电子亲胺取代反应。
在这类反应中,亲电物质与卤代烃同时与碳原子接近,卤素离子与亲核离子发生竞争性反应,生成取代产物。
取代反应速率受到亲电物质浓度、反应物浓度和立体阻隔等因素的影响。
2. SN1机制:单触电子亲胺取代反应。
在这类反应中,卤素原子首先离去,生成稳定的阳离子中间体,然后再与亲核物质发生反应,生成产物。
取代反应速率主要受到离去基团的稳定性和反应物浓度的影响。
3. E2机制:β消除取代反应。
在这类反应中,卤素原子和氢原子同时离去,生成双键结构。
取代反应速率受到碱度、侧链位阻等因素的影响。
4. E1机制:分步β消除取代反应。
在这类反应中,卤素原子首先离去,生成稳定的阳离子中间体,然后发生负离子消除,生成双键结构。
取代反应速率主要受到离去基团的稳定性和反应物浓度的影响。
四、亲电取代反应的应用亲电取代反应广泛应用于有机合成中,常用于生成各类有机化合物。
例如:1. 烷基化反应:通过亲电取代反应,将卤代烃与碱金属反应,生成相应的烷烃化合物。
2. 醇的合成:通过亲电取代反应,将卤代烃与醇反应,生成醇化合物。
3. 酯的合成:通过亲电取代反应,将卤代烃与酸反应,生成酯化合物。
4. 脂肪酸的合成:通过亲电取代反应,将卤代烃与碱金属反应,生成相应的脂肪酸化合物。
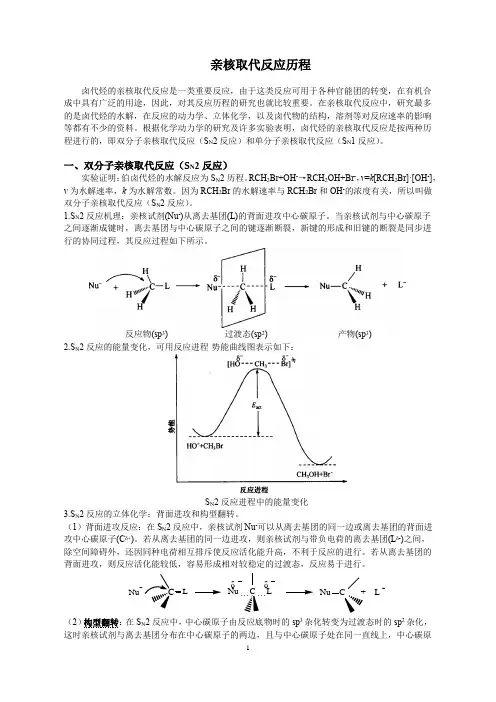
亲核取代反应历程卤代烃的亲核取代反应是一类重要反应,由于这类反应可用于各种官能团的转变,在有机合成中具有广泛的用途,因此,对其反应历程的研究也就比较重要。
在亲核取代反应中,研究最多的是卤代烃的水解,在反应的动力学、立体化学,以及卤代物的结构,溶剂等对反应速率的影响等都有不少的资料。
根据化学动力学的研究及许多实验表明,卤代烃的亲核取代反应是按两种历程进行的,即双分子亲核取代反应(S N 2反应)和单分子亲核取代反应(S N 1反应)。
一、双分子亲核取代反应(S N 2反应)实验证明:伯卤代烃的水解反应为S N 2历程。
RCH 2Br+OH -→RCH 2OH+Br -,v =k [RCH 2Br]·[OH -],v 为水解速率,k 为水解常数。
因为RCH 2Br 的水解速率与RCH 2Br 和OH -的浓度有关,所以叫做 双分子亲核取代反应(S N 2反应)。
1.S N 2反应机理:亲核试剂(Nu -)从离去基团(L)的背面进攻中心碳原子。
当亲核试剂与中心碳原子之间逐渐成键时,离去基团与中心碳原子之间的键逐渐断裂,新键的形成和旧键的断裂是同步进行的协同过程,其反应过程如下所示。
反应物(sp 3) 过渡态(sp 2)产物(sp 3) 2.S N 2反应的能量变化,可用反应进程-势能曲线图表示如下:S N 2反应进程中的能量变化3.S N 2反应的立体化学:背面进攻和构型翻转。
(1)背面进攻反应:在S N 2反应中,亲核试剂Nu -可以从离去基团的同一边或离去基团的背面进攻中心碳原子(C δ+)。
若从离去基团的同一边进攻,则亲核试剂与带负电荷的离去基团(L δ-)之间,除空间障碍外,还因同种电荷相互排斥使反应活化能升高,不利于反应的进行。
若从离去基团的背面进攻,则反应活化能较低,容易形成相对较稳定的过渡态,反应易于进行。
(2)构型翻转:在S N 2反应中,中心碳原子由反应底物时的sp 3杂化转变为过渡态时的sp 2杂化,这时亲核试剂与离去基团分布在中心碳原子的两边,且与中心碳原子处在同一直线上,中心碳原CδδNu C + L -δδNu C + L δδNu C + L -Nu子与它上面的其他三个基团处于同一平面内。

卤代烃的化学性质受官能团卤素原子(—X)的影响,卤代烃的化学性质比烷烃的活泼,既能发生消去反应,又能发生水解反应(取代反应)。
1.卤代烃的水解反应(取代反应)(1)条件:NaOH水溶液、加热。
(2)本质:水分子中的—OH取代了卤代烃中的—X。
R—X+NaOH R—OH+NaXR—CHX—CH2X+2NaOH R—CH(OH)—CH2OH+2NaX教材延伸(1)卤代烃的水解反应可用于制取醇,如CH3Cl+NaOH CH3OH+NaCl(制一元醇)、(制二元醇)、(制芳香醇)。
(2)卤代烃发生水解反应时量的关系:R—X~NaX~AgX↓,即1 mol一卤代烃通过反应可得到1 mol AgX(X=Cl、Br、I)沉淀,常利用此关系来定量测定卤代烃中卤素原子的含量。
2.卤代烃的消去反应(1)条件:强碱的醇溶液、加热。
(2)本质:从有机物分子中相邻的两个碳原子上脱去一分子的HX生成含不饱和键的烃。
(3)卤代烃发生消去反应的规律①与卤素原子相连的碳原子没有邻位碳原子的卤代烃不能发生消去反应,如CH3Cl。
②与卤素原子相连的碳原子有邻位碳原子,但邻位碳原子上无氢原子的卤代烃也不能发生消去反应,如。
③与卤素原子相连的碳原子有两个相邻的碳原子且相邻碳原子上均有氢原子(氢原子不等效)时,发生消去反应可生成不同的产物,如(或CH3—CH=CH—CH3↑)+NaBr+H2O。
名师提醒(1)发生消去反应必须具备的结构条件是分子中有β—H。
如中没有β-H,就不能发生消去反应(与X相连的C叫α-C,与α-C相邻的C叫β-C;α-C上连接的H叫α-H,β-C上连接的H叫β-H)。
(2)由于苯环的特殊结构(很稳定),卤代苯(如)不能发生消去反应。
(3)发生消去反应的有机产物有三种:(4)欲增加有机物分子中某些官能团(如—X、—OH等)的数目,可以先由原料发生消去反应生成含不饱和键的有机物,再由含不饱和键的有机物与卤素单质发生加成反应生成多卤代物,多卤代物还可继续发生水解反应以增加—OH的数目。
卤代烃的消去反应方程式卤代烃是一类有机化合物,其分子中含有卤素,如氯、溴或碘。
在化学反应中,卤代烃可以通过消去反应转变为双键或三键的烯烃或炔烃。
消去反应可以是通过碱性条件下的β-消去反应或通过烯烃的环化消去反应来实现。
下面将详细介绍这两种消去反应的方程式和机理。
1.β-消去反应β-消去反应通过碱性条件下的消去反应将卤代烃转化为烯烃。
具体来说,卤代烃分子中的卤素离子会被碱离子替代,然后产生一个双键。
这种反应的步骤和机理如下:步骤1:碱性条件下,碱离子会与卤代烃中的卤素离子发生取代反应,生成相应的含碱金属离子的中间体。
RX+MOH→ROM+HX步骤2:中间体在碱性条件下会发生脱水反应,从而产生双键。
ROM→R=CH2+MOH总的反应方程式为:RX+MOH→R=CH2+HX+MOH例如,对于溴代丁烷和水合钠碱性条件下的β-消去反应,反应方程式和机理为:CH3CH2CH2CH2Br+NaOH→CH2=CHCH2CH3+NaBr+H2O2.环化消去反应环化消去反应是指通过碱性条件下的消去反应将卤代烃转化为炔烃或环状烯烃。
具体来说,卤代烃中的卤素离子会被碱离子替代,并形成一个环。
这种反应的步骤和机理如下:步骤1:碱性条件下,碱离子与卤代烃中的卤素离子发生取代反应,生成相应的中间体。
RX+MOH→ROM+HX步骤2:中间体中的取代位点会被相邻的碳上的质子攻击,形成一个环状的质子酸中间体。
ROM+CH3C-CH2→CH3C=CH2+ROH总的反应方程式为:RX+MOH→CH3C=CH2+HX+ROH例如,甲基溴和氢氧化钠碱性条件下的环化消去反应,反应方程式和机理为:CH3Br+NaOH→CH2=C=CH2+H Br+NaOH卤代烃的消去反应具有重要的应用意义。
它可以用于合成烯烃和炔烃,这些化合物在有机合成中具有重要的地位。
要实现消去反应,通常需要在碱性条件下进行,例如使用氢氧化钠或氢氧化钾作为反应的碱。
此外,消去反应还需要适当的反应温度和反应时间来实现高效的转化。
有机化学四大反应类型有机化学四大反应类型是有机化学中最基本且重要的四种反应类型,分别是取代反应、消除反应、加成反应和重排反应。
本文将详细介绍这四种反应类型的定义、机理和应用。
一、取代反应取代反应是指一个原子、基团或官能团被另一个原子、基团或官能团所取代的反应。
这种反应常见于醇、酸、醛、酮等有机化合物中,通常涉及到亲核试剂和电子受体之间的反应。
取代反应的机理可以分为亲核取代和电子受体取代两种。
亲核取代反应中,亲核试剂攻击电子亏损的反应物,形成碳正离子中间体,并最终生成新的化合物。
常见的亲核试剂有氢氧根离子、卤素离子、氨基离子等。
电子受体取代反应中,电子富集的反应物攻击亲电子试剂,形成碳负离子中间体,并最终生成新的化合物。
常见的亲电子试剂有卤代烃、烯烃、芳香族化合物等。
二、消除反应消除反应是指有机化合物中发生键的断裂,生成双键或三键的过程。
消除反应通常涉及到酸碱催化剂和高温条件。
消除反应的机理可以分为β消除和α消除两种。
β消除反应中,发生消除的反应物中的β碳和邻位原子之间的键被断裂,生成双键。
β消除反应常见于醇、酮、酯等化合物中。
α消除反应中,发生消除的反应物中的α碳和邻位原子之间的键被断裂,生成双键或三键。
α消除反应常见于醇、酸、醛等化合物中。
三、加成反应加成反应是指两个或多个反应物中的原子或基团结合在一起,生成一个新的化合物。
加成反应通常涉及到亲电试剂和亲核试剂之间的反应。
加成反应的机理可以分为亲电加成和亲核加成两种。
亲电加成反应中,亲电试剂攻击亲核试剂,生成一个带正电荷的中间体,并最终生成新的化合物。
常见的亲电试剂有卤代烃、烯烃、芳香族化合物等;常见的亲核试剂有氢氧根离子、卤素离子、氨基离子等。
亲核加成反应中,亲核试剂攻击亲电试剂,生成一个带负电荷的中间体,并最终生成新的化合物。
常见的亲电试剂有卤代烃、酰卤、酸酐等;常见的亲核试剂有氢氧根离子、氨基离子、醇等。
四、重排反应重排反应是指有机化合物中的原子或基团在分子内或分子间发生位置变化的反应。