高考必考:高中化学常见离子检验汇总
- 格式:doc
- 大小:95.50 KB
- 文档页数:4

高中化学离子检验(全)高中化学离子检验H+的检验使用试剂:石蕊试液,Na2CO3溶液或pH试纸。
操作步骤和反应现象:将含有H+的溶液取出放入试管中,滴加Na2CO3溶液,会产生气泡。
将溶液用玻璃棒蘸取少量滴到蓝色石蕊试纸或pH试纸上,会呈现红色。
离子方程式:2H++CO32- CO2↑+H2O。
Na+、K+的检验使用试剂:XXX、HCl。
操作步骤和反应现象:取含钠离子的溶液,用烧过的铂丝蘸溶液或固体少许在酒精灯焰上灼烧,观察会出现黄色火焰。
用蘸HCl溶液烧铂丝进行清洗,直到看不出黄色为止,再取K+盐或其溶液在酒精灯焰上灼烧,透过钴玻璃片观察会出现紫色火焰。
NH4+的检验使用试剂:浓HCl、NaOH溶液、红色石蕊试纸。
操作步骤和反应现象:取含NH4+的盐或溶液加入浓NaOH溶液后加热,会产生气体,接触湿润红色石蕊试纸会变蓝。
或者用玻璃棒蘸上浓HCl挨近上述气体时冒大量白烟。
离子方程式或化学方程式:NH4++OH- NH3↑+H2O,NH3+H2O NH3•H2O,NH3+HCl NH4Cl。
Mg2+检验使用试剂:NaOH溶液。
操作步骤和反应现象:将含Mg2+的溶液中加入NaOH溶液,会生成白色不溶于过量NaOH的沉淀。
离子方程式:Mg2++2OH- Mg(OH)2↓。
Al3+的检验使用试剂:NaOH溶液,HCl溶液。
操作步骤和反应现象:在含有Al3+的溶液中滴加少量NaOH溶液,会产生白色絮状沉淀。
过量NaOH溶液沉淀会溶解,白色状沉淀也会溶于盐酸。
离子方程式:Al3++3OH-Al(OH)3↓,Al(OH)3+OH- AlO2-+2H2O,Al(OH)3+3H+Al3++3H2O。
Cu2+的检验使用试剂:NaOH溶液,NH3•H2O。
操作步骤和反应现象:取含Cu2+的蓝色溶液加入NaOH 溶液,会生成蓝色的沉淀。
再加NH3•H2O振荡,会呈现深蓝色溶液。
离子方程式:Cu2++2OH- Cu(OH)2↓,Cu(OH)2+4NH3 Cu(NH3)4(OH)2.Fe2+的检验使用试剂:NaOH溶液。
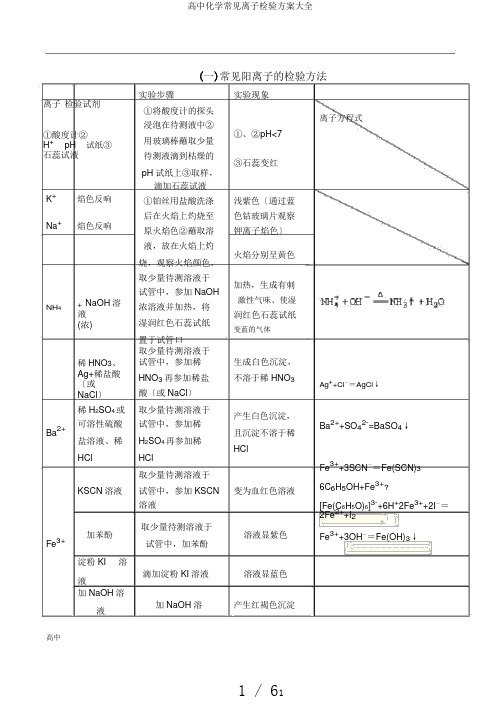
(一)常见阳离子的检验方法离子 检验试剂①酸度计② H +pH试纸③ 石蕊试液 K +焰色反响Na+焰色反响实验步骤实验现象①将酸度计的探头浸泡在待测液中② ①、②pH<7 用玻璃棒蘸取少量待测液滴到枯燥的 ③石蕊变红pH 试纸上③取样,滴加石蕊试液①铂丝用盐酸洗涤 浅紫色〔通过蓝后在火焰上灼烧至 色钴玻璃片观察原火焰色②蘸取溶 钾离子焰色〕液,放在火焰上灼 火焰分别呈黄色烧,观察火焰颜色。
取少量待测溶液于 加热,生成有刺试管中,参加NaOH离子方程式NH 4+ NaOH 溶液(浓)激性气味、使湿浓溶液并加热,将 润红色石蕊试纸湿润红色石蕊试纸 变蓝的气体置于试管口取少量待测溶液于稀HNO 3、Ag+稀盐酸〔或NaCl 〕试管中,参加稀生成白色沉淀, HNO 3再参加稀盐 不溶于稀HNO 3酸〔或NaCl 〕Ag ++Cl -=AgCl ↓稀H 2SO 4或 取少量待测溶液于 产生白色沉淀,可溶性硫酸 试管中,参加稀 Ba2+且沉淀不溶于稀盐溶液、稀 H 2SO 4再参加稀HClHClHCl取少量待测溶液于KSCN 溶液试管中,参加KSCN 变为血红色溶液溶液加苯酚取少量待测溶液于 溶液显紫色Fe3+试管中,加苯酚淀粉KI 溶溶液显蓝色液 滴加淀粉KI 溶液加NaOH 溶产生红褐色沉淀液加NaOH 溶Ba 2++SO 42-=BaSO 4↓ Fe 3++3SCN -=Fe(SCN)36C 6H 5OH+Fe 3+?[Fe(C 6H 5O)6]3-+6H +2Fe 3++2I -=2Fe 2++I 2Fe 3++3OH -=Fe(OH)3↓高中离子检验试剂KSCN溶液,新制的氯水NaOH溶液Fe2+③酸性高锰酸钾〔无其它复原性物质〕④铁氰化钾K3[Fe(CN)6]Al3+NaOH溶液2+Cu NaOH溶液Mg2+NaOH溶液实验步骤取少量待测溶液于试管中,参加KSCN溶液,新制的氯水取少量待测溶液于试管中,参加NaOH溶液并露置在空气中取少量待测溶液于试管中,参加酸性高锰酸钾溶液取少量待测溶液于试管中,参加铁氰化钾溶液取少量待测溶液于试管中,逐滴参加NaOH溶液至过量取少量待测溶液于试管中,参加NaOH溶液取少量待测溶液于试管中,参加NaOH溶液实验现象参加KSCN溶液不显红色,参加少量新制的氯水后,立即显红色。

【最新整理,下载后即可编辑】(一)常见阳离子的检验方法
2Fe2++ Cl
2Fe3++
2
2Cl-
Fe3++3SCN-=
Fe(SCN)
3
即显红色。
-+8H+
5Fe2+ + MnO
4
5Fe3+ +Mn2++4 H
O
2
(二)常见阴离子的检验方法
【最新整理,下载后即可编辑】 注意:
1.若SO 42-与Cl-同时检验,需注意检验顺序。
应先用Ba(NO 3)2溶液将SO 42-检出,并滤去BaSO 4,然后再用AgNO 3检验Cl-。
2.检验SO 32-的试剂中,只能用盐酸,不能用稀硝酸。
因为稀硝酸能把SO 32-氧化成SO 42-。
3.若Ag +和Ba 2+同时检验,也需注意检验顺序,应先用盐酸将Ag +检验出并滤去沉淀,然后再用稀硫酸检验Ba 2+。
4.若Ag +和Ba 2+同时检验,也需注意检验顺序,应先用盐酸将Ag +检验出
5.若CO 32-和HCO 3-同时检验,应先用足量的BaCl 2溶液将CO 32-检出,静置,取上层清夜用Ba(OH)2或Ca(OH)2检出HCO 3-。

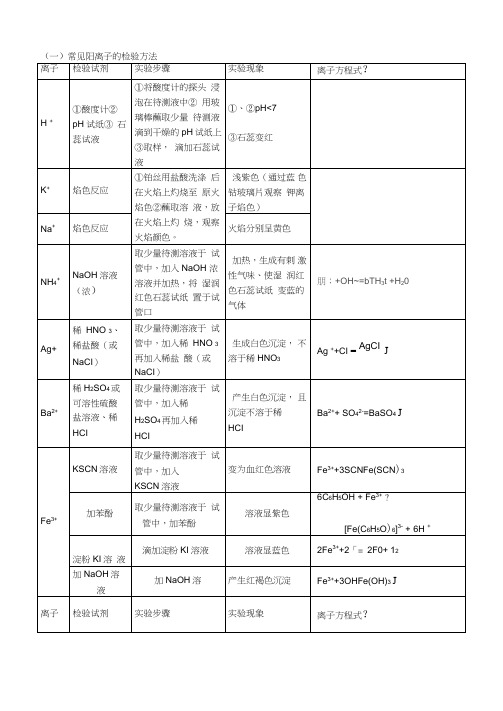
(一)常见阳离子的检验方法离子检验试剂实验步骤实验现象离子方程式Fe2+①KSCN溶液,新制的氯水取少量待测溶液于试管中,加入KSCN溶液,新制的氯水加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色.2Fe2+ + Cl22Fe3+ + 2Cl-Fe3++3SCN-=Fe(SCN)3②NaOH溶液取少量待测溶液于试管中,加入NaOH溶液并露置在空气中开始时生成白色沉淀,迅速变成灰绿色,最后变成红褐色沉淀.Fe2++2OH - =Fe(OH)2↓4Fe(OH)2十O2+2H2O=4Fe(OH)3③酸性高锰酸钾(无其它还原性物质)取少量待测溶液于试管中,加入酸性高锰酸钾溶液加入酸性高锰酸钾溶液紫色褪去5Fe2+ + MnO4-+8H+5Fe3+ +Mn2++4 H2O④铁氰化钾K3[Fe(CN)6]取少量待测溶液于试管中,加入铁氰化钾溶液产生蓝色沉淀3 Fe2++2[Fe(CN)6] 3- ═Fe2 [Fe(CN)6] 3↓Al3+NaOH溶液取少量待测溶液于试管中,逐滴加入NaOH溶液至过量加入适量NaOH溶液后生成白色沉淀,该沉淀溶于过量NaOH溶液中Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+ 2H2OCu2+NaOH溶液取少量待测溶液于试管中,加入NaOH溶液加入适量NaOH溶液后生成蓝色沉淀Cu2++2OH-=Cu(OH)2↓Mg2+NaOH溶液取少量待测溶液于试管中,加入NaOH溶液加入适量NaOH溶液后生成白色沉淀,该沉淀不溶于过量NaOH溶液中Mg2++2OH-=Mg(OH)2↓(仅用于鉴别Mg2+和Al3+)(二)常见阴离子的检验方法离子检验试剂实验步骤实验现象离子方程式注意:1.若SO42-与Cl-同时检验,需注意检验顺序.应先用Ba(NO3)2溶液将SO42-检出,并滤去BaSO4,然后再用AgNO3检验Cl-.2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸.因为稀硝酸能把SO32-氧化成SO42-.3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+.4.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出5.若CO32-和HCO3-同时检验,应先用足量的BaCl2溶液将CO32-检出,静置,取上层清夜用Ba(OH)2或Ca(OH)2检出HCO3-。
黑龙江省林口林业局助考辅导中心
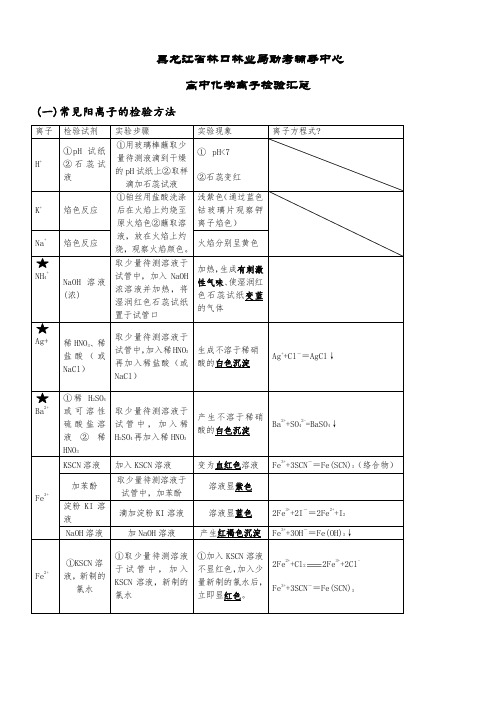
高中化学离子检验汇总(一)常见阳离子的检验方法
2
注意:
1.若SO 42-与Cl-同时检验,需注意检验顺序。
应先用Ba(NO 3)2溶液将SO 42-检出,并滤去BaSO 4,然后再用AgNO 3检验Cl-。
2.检验SO 32-的试剂中,只能用盐酸,不能用稀硝酸。
因为稀硝酸能把SO 32-氧化成SO 42-。
3.若Ag +和Ba 2+同时检验,也需注意检验顺序,应先用盐酸将Ag +检验出并滤去沉淀,然后再用稀硫酸检验Ba 2+。
4.若Ag +和Ba 2+同时检验,也需注意检验顺序,应先用盐酸将Ag +检验出
5.若CO 32-和HCO 3-同时检验,应先用足量的BaCl 2溶液将CO 32-检出,静置,取上层清夜用Ba(OH)2或Ca(OH)2检出HCO 3-。
高中化学中常见离子检验方法总结高中化学中常见离子检验方法总结一、常见阴离子的检验1.阴离子的初步检验①与稀H2SO4作用,试液中加入稀H2SO4并加热,有气泡产生,可能有CO32-、SO32-、S2-、NO2-或CN-存在,再根据气体的特性不同,再进行判断。
②与BaCl2的作用。
试液中加入BaCl2溶液,生成白色沉淀,可能有SO42-、SO32-、PO43-、S2O32-根据沉淀性质不同进行检验。
③与AgNO3HNO3作用。
试液中加入AgNO3再加入稀HNO3若为白色沉淀为Cl-黄色沉淀可能有I-、Br-和CN-存在,若有黄色沉淀很快变橙、褐色,最后变为黑色,表示有S2O32-存在,Ag2S 为黑色沉淀。
④氧化性阴离子的检验试液用H2SO4酸化后,加入KI溶液和淀粉指示剂,若溶液变蓝,说明有NO2-存在。
⑤还原性阴离子检验a、强还原性阴离子与I2的试验,试液用H2SO4酸化后,加含0.1%KI的I2-淀粉溶液,若其蓝色褪去,可能有SO32-、C2O42-、S2O32-、S2-和CN-等离子存在。
b、还原性阴离子与KMnO4的试验,试液用H2SO4酸化后,加入0.03%KMnO4溶液,若能褪色,可能有SO32-、S2O32-、S2-、C2O42-、Br-、I-、NO2-等离子。
2.个别鉴定反应⑴SO42-加入BaCl2溶液生成BaSO4白色沉淀,该沉淀不溶于稀HCl或稀HNO3Ba2SO42-===BaSO4↓⑵SO32-a、加入BaCl2溶液生成BaSO3白色沉淀,加入稀HCl,沉淀溶解并放出有刺激性气味的气体SO2Ba2SO32-===BaSO3↓BaSO32H===Ba2H2O SO2↑b、加入少量I2-淀粉溶液,蓝色褪去SO32-I2H2O===SO42-2I-2H⑶Cl-加入AgNO3生成AgCl白色沉淀,该沉淀不溶于稀HNO3或稀HCl,但溶于浓NH3·H2OAgCl2NH3·H2O===[Ag(NH3)2]Cl-2H2O⑷Br-a、加入AgNO3生成淡黄色AgBr沉淀,该沉淀不溶于HCl或HNO3中,微溶于浓NH3·H2O。
高中常见离子检验方法高中常见离子检验方法主要包括酸碱中性离子检验、金属离子检验和非金属离子检验等。
下面将从这三个方面逐一介绍。
一、酸碱中性离子检验1. 酸碱中性离子的灼烧法:将待检物质灼烧,观察它的灼烧现象来判断其离子成分。
如钠离子的存在可以通过灼烧后火花变亮、扑灭的现象来判定。
2. 酸碱指示剂法:通过将待检物质与酸碱指示剂反应,观察颜色的变化来判断其离子成分。
如酚酞指示剂在酸性溶液中呈现红色,在碱性溶液中呈现无色。
3. 气体的放出法:通过加热待检物质,观察有无气体产生来判断其离子成分。
如将一些金属碳酸盐加热,可以释放出二氧化碳气体,从而判定其中含有碳酸根离子。
二、金属离子检验1. 阳离子的碳酸盐沉淀法:通过加入碳酸盐试剂,观察是否产生沉淀来判断钙、镁、锌等金属离子的存在。
如加入碳酸钠试剂,若产生白色沉淀,则说明存在钙离子。
2. K2CrO4沉淀法:通过加入铬酸钾试剂,观察是否产生沉淀来判断铁、铜、银等金属离子的存在。
如加入铬酸钾试剂,若产生红棕色沉淀,则说明存在铁离子。
3. Na2S沉淀法:通过加入硫化钠试剂,观察是否产生沉淀来判断铅、汞、铅等金属离子的存在。
如加入硫化钠试剂,若产生黑色沉淀,则说明存在铅离子。
三、非金属离子检验1. 阴离子的沉淀法:通过加入适当的反应剂,观察是否产生沉淀来判断氯离子、碳酸根离子等的存在。
如加入银离子试剂,在存在氯离子的溶液中产生白色沉淀。
2. 离子溶液的颜色法:一些离子溶液具有显色性,可以通过颜色变化来判断其离子成分。
如硫酸铜溶液是蓝色的、硫酸钴溶液是红色的,可以通过观察其颜色来判断其中是否含有铜离子和钴离子。
3. 离子溶液的电导率法:通过测量离子溶液的电导率来判断其离子成分。
一般来说,含有离子的溶液的电导率较高,可以通过测定电导率的大小来判断其离子是否存在。
以上是高中中化学常见的离子检验方法。
通过这些方法,可以对样品中的离子成分进行准确的判断和分析,帮助搞懂化学中的一些问题。
高考必考:高中化学常见离子检验汇总
(一)常见阳离子的检验方法
离子 检验试剂 实验步骤 ①将酸度计的探头浸泡 ①酸度计②pH 在待测液中②用玻璃棒 H+ 试纸③石蕊试 蘸取少量待测液滴到干 液 燥的 pH 试纸上③取样, 滴加石蕊试液 浅紫色(通过蓝色钴 玻璃片观察钾离子焰 色) 火焰分别呈黄色 ③石蕊变红 、②pH<7 实验现象 离子方程式
K+
焰色反应
①铂丝用盐酸洗涤后在 火焰上灼烧至原火焰色 ②蘸取溶液,放在火焰
Na+
焰色反应
上灼烧, 观察火焰颜色。
取少量待测溶液于试管 NH4+ NaOH 溶液(浓) 中, 加入 NaOH 浓溶液并 加热,将湿润红色石蕊 试纸置于试管口 取少量待测溶液于试管 中, 加入稀 HNO3 再加入 稀盐酸(或 NaCl)
加热,生成有刺激性 气味、使湿润红色石 蕊试纸变蓝的气体
Ag+
稀 HNO3、稀盐 酸(或 NaCl)
生成白色沉淀,不溶 于稀 HNO3
Ag++Cl-=AgCl↓
①稀 H2SO4 或 取少量待测溶液于试管 Ba2+ 可溶性硫酸盐 中,加入稀 H2SO4 再加 溶液②稀 HNO3 入稀 HNO3 取少量待测溶液于试管 中,加入 KSCN 溶液 取少量待测溶液于试管 中,加苯酚 滴加淀粉 KI 溶液 加 NaOH 溶 实验步骤
产生白色沉淀,且沉 淀不溶于稀 HNO3
Ba2++ SO42-=BaSO4↓
KSCN 溶液
变为血红色溶液
Fe3++3SCN-=Fe(SCN)3
Fe3+
加苯酚
溶液显紫色
淀粉 KI 溶液 加 NaOH 溶液 离子 检验试剂
溶液显蓝色 产生红褐色沉淀 实验现象
2Fe3++2I-=2Fe2++ I2 Fe3++3OH-=Fe(OH)3↓ 离子方程式
①KSCN 溶液, ①取少量待测溶液于试 ①加入 KSCN 溶液不 第 1 页 共 4 页
2Fe2+ + Cl22Fe3+ + 2Cl-
Fe2+
新制的氯水 管中,加入 KSCN 溶液, 显红色,加入少量新 新制的氯水 制的氯水后,立即显 红色。
②开始时生成白色 ②取少量待测溶液于试 Fe(OH)2 沉淀,迅速 ②加 NaOH 溶液 管中, 加入 NaOH 溶液并 变成灰绿色,最后变 露置在空气中 成红褐色 Fe(OH)3 沉 淀。
③(无其它还 原性物质如 SO32-)酸性高 锰酸钾
Fe3++3SCN-=Fe(SCN)3
Fe2++2OH — =Fe(OH)2↓ 4Fe(OH)2 十 O2+2H2O=4Fe(OH)3
取少量待测溶液于试管 中,加入酸性高锰酸钾 溶液
加入酸性高锰酸钾溶 液紫色褪去
取少量待测溶液于试管 Al3+ NaOH 溶液 中, 逐滴加入 NaOH 溶液 至过量
加入适量 NaOH 溶液 后生成白色沉淀,该 沉淀溶于过量 NaOH 溶液中 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+ 2H2O
Cu2+
NaOH 溶液
取少量待测溶液于试管 加入适量 NaOH 溶液 中,加入 NaOH 溶液 后生成蓝色沉淀
Cu++2OH-=Cu(OH)2↓
(二)常见阴离子的检验方法
离子 检验试剂 实验步骤 ①将酸度计的探头浸 ①酸度计②pH 试 OH纸③酚酞或石蕊 试液 泡在待测液中②用玻 璃棒蘸取少量待测液 滴到干燥的 pH 试纸上 ③酚酞变红或石蕊 变蓝 ③取样,滴加石蕊试 液 取少量待测溶液于试 1.加入 BaCl2 溶液 沉 ①BaCl2 溶液、 管中,加入 BaCl2 溶 后生成白色沉淀, 稀 盐酸 CO32②稀盐酸、 液再向沉淀中加入稀 淀溶于稀盐酸, 并放 盐酸。
出无色无味气体 Ba2++ CO32-=BaCO3↓ BaCO3+2H+=Ba2++CO2↑+H2O ②pH>7 实验现象 离子方程式
取少量待测溶液于试 2.加入稀盐酸后放
CO32-+2H+=H2O+CO2↑ Ca2++2OH-+CO2=CaCO3↓+H2O
通 Ca(OH)2 溶液 管中,加入稀盐酸后 出无色无味气体, 放出的气体通入使澄 入澄清的 Ca(OH)2
第 2 页 共 4 页
清的 Ca(OH)2 溶液 取少量待测溶液于试 SO42BaCl2 溶液、 稀硝 管中,加入 BaCl2 溶 酸或稀盐酸 液再向沉淀中加入稀 盐酸。
取少量待测溶液于试 ①稀盐酸、品红 管中,加入稀盐酸后 溶液 SO32放出的气体通入品红 溶液
溶液变浑浊
生成不溶于稀硝酸 或稀盐酸的白色沉 淀 Ba2++ SO42-=BaSO4↓
加入稀盐酸后放出 的气体使品红溶液 褪色 SO32-+2H+=H2O+SO2↑
取少量待测溶液于试 加入 BaCl2 溶液后 ②BaCl2 溶液、 管中,加入 BaCl2 溶 生成白色沉淀, 稀 沉淀 盐酸 液再向沉淀中加入稀 溶于稀盐酸, 并放出 盐酸。
离子 检验试剂 实验步骤 刺激性气味的气体 实验现象 生成不溶于稀硝酸 或稀盐酸的白色沉 淀 取少量待测溶液于试 Br- AgNO3 溶液、 稀硝 酸或稀盐酸 管中,加入 AgNO3 溶 生成不溶于稀硝酸 液,再向沉淀中加入 或稀盐酸的浅黄色 稀盐酸。
沉淀 ①生成不溶于稀硝 酸的黄色沉淀 取少量待测溶液于试 ②滴入新制 Cl2, 振 管中,加入新制氯水,荡后再滴入淀粉溶 再加入淀粉溶液 取少量待测溶液于试 HCl、淀粉-KI ClO管中,加入 HCl 溶液, 淀粉-KI 溶液变蓝 然后加入淀粉-KI 溶 液 取少量待测溶液于试 HCl、石蕊 管中,加入 HCl 溶液,石蕊先变红后褪色 然后加入石蕊试液 液,变蓝 Ag++Br-=AgBr↓ Ag++Cl-=AgCl↓ 离子方程式 SO32-+2H+=H2O+SO2↑
Cl-
AgNO3 溶液、 稀硝 酸或稀盐酸
①AgNO3 溶液、 稀 硝酸 I- ②新制氯水,淀 粉溶液
Ag++I-=AgI↓
Ag++I-=AgI↓ 2I-+Cl2=I2+2ClI2 遇淀粉变蓝
注意:
第 3 页 共 4 页
1. SO42-与 Cl-同时检验, 若 需注意检验顺序。
应先用 Ba(NO3)2 溶液将 SO42检出,并滤去 BaSO4,然后再用 AgNO3 检验 Cl-。
2. 检验 SO32-的试剂中, 只能用盐酸, 不能用稀硝酸。
因为稀硝酸能把 SO32氧化成 SO42-。
3.若 Ag+和 Ba2+同时检验,也需注意检验顺序,应先用盐酸将 Ag+检验出 并滤去沉淀,然后再用稀硫酸检验 Ba2+。
4.若 Ag+和 Ba2+同时检验,也需注意检验顺序,应先用盐酸将 Ag+检验出 5.若 CO32-和 HCO3-同时检验,应先用足量的 BaCl2 溶液将 CO32-检出,静 置,取上层清夜用 Ba(OH)2 或 Ca(OH)2 检出 HCO3-
第 4 页 共 4 页
。