第二章 色谱法拆分DL-氨基酸
- 格式:pdf
- 大小:185.30 KB
- 文档页数:16

研究论文L 2异亮氨酸聚合物手性配体交换固定相的制备及对DL 2氨基酸的拆分马桂娟a 龚波林a,b 3 阎 超b(a 宁夏大学能源化工重点实验室 银川750021;b 上海通微分析技术有限公司 上海201203)摘 要 单分散亲水交联聚甲基丙烯酸环氧丙酯2甲基丙烯酸乙二醇双酯树脂(P G MA /E D MA )和手性配体L 2异亮氨酸反应,再与铜离子进行配位,得到一种新型的L 2异亮氨酸聚合物键合高效手性配体交换固定相。
在流动相为012mol/L Na Ac +011mmol/L Cu (Ac )2水溶液和检测波长为254n m 条件下,固定相拆分了12种DL 2氨基酸对映体,分离因子在1123~2133之间。
详细考察了流动相pH 、流速及柱温等色谱条件对DL 2氨基酸对映体拆分的影响,并探讨了拆分过程热力学。
结果表明,以单分散亲水性聚合物为基质的新型手性配体交换色谱固定相制备简单、操作方便、成本低廉,柱性能稳定。
在配体交换模式下,固定相对12种DL 2氨基酸对映体进行了良好的拆分。
关键词 手性配体交换色谱固定相,单分散树脂,L 2异亮氨酸,DL 2氨基酸,对映体分离中图分类号:O658 文献标识码:A 文章编号:100020518(2009)022*******2008201219收稿,2008204209修回科技部国际合作重点项目(2006DF A33690)、教育部新世纪优秀人才支持计划(NCET 20420986)和上海市博士后科研基金(06R214202)资助项目通讯联系人:龚波林,博士,教授;E 2mail:gongbl@nxu .edu .cn;研究方向:色谱固定相的制备及应用在DL 2氨基酸对映体的色谱拆分方法中,高效配体交换色谱法(ligand 2exchange chr omat ography,LEC )具有样品毋需衍生,对映体选择性高,且色谱柱再生容易等优点,是最佳的色谱拆分方法之一[1~3]。


合成苏氨酸的研究(ⅴ)—dl—别苏氨酸的
光学拆分
光学拆分法是目前用于合成dl-苏氨酸的最主要技术,它可将混合物中的两种成分分离纯净,因此被广泛应用于化学及制药行业、饮料等行业。
首先,原料苏氨酸溶于甲醇或其他有机溶剂中,然后对其加入氢氧化钠溶液,在以合适的pH值维持控制下,由于手性催化剂的作用,混合物中的“d”和“l”两种形式,在结晶过程中分离出来,利用微滤法可筛出dl-苏氨酸的晶体。
接着,可将其用室温90~95℃水浴蒸馏,经过分离柱分两次蒸馏得到纯度较高的dl-苏氨酸分子,并将其再次干燥,即可获得纯度较高的dl-苏氨酸产品。
dl-苏氨酸过去常用熔融分离法分离获得,由于该法只能处理高纯度(>99%)的混合物,并且操作过程费力耗时,所以不太适用于大量分离合成。
而光学拆分法的优点是简便快速,且不受手性制剂品质的控制,能够精确控制目标组分的浓度,适合大量分离合成。
因此,用光学拆分分离法合成dl-苏氨酸在医药、制药行业已得到越来越多的应用,它是一种行之有效的方法,能有效提高制药行业的生产效率,为人类健康和安全提供了有力的保障。



纸色谱法分离氨基酸实验报告氨基酸的分离鉴定纸层析法【实验目的】1.学习氨基酸纸层析法的基本原理2.掌握氨基酸纸层析的操作技术【实验原理】纸层析法(paper chromatography)是生物化学上分离、鉴定氨基酸混合物的常用技术,可用于蛋白质的氨基酸成分的定性鉴定和定量测定;也是定性或定量测定多肽、核酸碱基、糖、有机酸、维生素、抗菌素等物质的一种分离分析工具。
纸层析法是用滤纸作为惰性支持物的分配层析法,其中滤纸纤维素上吸附的水是固定相,展层用的有机溶溶剂是流动相。
在层析时,将样品点在距滤纸一端约2,3cm的某一处,该点称为原点;然后在密闭容器中层析溶剂沿滤纸的一个方向进行展层,这样混合氨基酸在两相中不断分配,由于分配系数(Kd)不同,结果它们分布在滤纸的不同位置上。
物质被分离后在纸层析图谱上的位置可用比移值(rate of flow, Rf)来表示。
所谓Rf,是指在纸层析中,从原点至氨基酸停留点(又称为层析点)中心的距离(X)与原点至溶剂前沿的距离(Y)的比值:在一定条件下某种物质的Rf值是常数。
Rf值的大小与物质的结构、性质、溶剂系统、温度、湿度、层析滤纸的型号和质量等因素有关。
【器材与试剂】(一)器材1.层析缸2.点样毛细管3.小烧杯4.培养皿5.量筒6.喷雾器7.吹风机(或烘箱)8.层析滤纸(新华一号)9.直尺及铅笔(二) 试剂1. 扩展剂(水饱和的正丁醇和乙酸混合液)将正丁醇和乙酸以体积比4?1在分液漏斗中进行混合,所得混合液再按体积比5?3与蒸馏水混合;充分振荡,静置后分层,放出下层水层,漏斗内即为扩展剂。
2. 氨基酸溶液0.5%赖氨酸、脯氨酸、亮氨酸以及它们的混合液(各组份均为0.5%)。
?3. 显色剂0.1%水合茚三酮正丁醇溶液。
【实验步骤】1.准备滤纸取层析滤纸(长22?、宽14?)一张,在纸的一端距边缘2,3?处用铅笔划一条直线,在此直线上每间隔3?作一记号,如右图所示。
2.点样用毛细管将各氨基酸样品分别点在这4个位置上,干后重复点样2,3次。

氨基酰化酶的固定化和柱色谱法拆分氨基酸消旋体氨基酰化酶是一种常用的分子生物学工具,它可以将氨基酸转换成氨基酰基化产物。
氨基酰化酶有几种不同的催化反应,如烯丙基化、酰胺基化和醛基化。
它们通过在氨基酸上形成氨基酰基而使它们易于沉淀。
此外,氨基酰化酶也可以用来将氨基酸消旋体拆分成单糖基构型,以便进行后续的生物学研究。
氨基酰化酶的固定化是一种用于将氨基酸消旋体拆分成单糖基构型的技术。
该方法通过将氨基酰化酶固定在一种支持性材料上,如聚合物或金属等,从而实现氨基酰化反应。
这样可以有效地阻止氨基酰化反应物的移动,从而提高氨基酰化酶的活性和稳定性,从而提高消旋体的拆分效率。
柱色谱法是另一种常用的处理氨基酸消旋体的技术,它是一种仪器分析方法,用于检测和分析溶液中的物质。
柱色谱法的原理是利用柱色谱仪中的柱、柱色谱仪和检测器之间的相互作用来对溶液进行检测。
柱色谱仪中的柱是由一种溶剂混合物(通常是由含有氯代烃和醇类组成的混合溶剂)固定在一种吸附性材料上的管。
柱色谱仪利用柱上的溶剂混合物的分子层析作用,将溶液中的物质拆分成不同的组分,并在不同的位置上检测到它们。
当用柱色谱法拆分氨基酸消旋体时,首先要将氨基酰化酶固定在支持性材料上,然后将氨基酸消旋体加入氨基酰化酶中,再将固定化的氨基酰化酶和氨基酸消旋体混合液加入柱色谱仪中。
柱色谱仪会通过分子层析作用将溶液中的消旋体拆分成单糖基构型,并在不同的位置上检测到它们,随后经过计算机处理,可以得到拆分氨基酸消旋体的结果。
以上就是氨基酰化酶的固定化和柱色谱法拆分氨基酸消旋体的详细说明。
氨基酰化酶的固定化是一种用于将氨基酸消旋体拆分成单糖基构型的技术,而柱色谱法是一种仪器分析方法,用于检测和分析溶液中的物质,可以有效地将溶液中的消旋体拆分成单糖基构型,从而为后续的生物学研究提供了支持。

氨基酸的分离(纸层析法)一、实验原理1、层析法又称色谱法,是一种物理的分离方法。
利用混合物中各组分物理化学性质的差异(如吸附力、分子形状及大小、分子亲和力、分配系数等),使各组分以不同程度分布在固定相和流动相两相中,并使各组分以不同速度移动,从而得到有效的分离。
操作方式:纸层析、薄层层析、柱层析等分离机理:分配层析、吸附层析、离子交换层析、凝胶层析、亲和层析等2、纸层析法是用滤纸作为惰性支持物的分配层析法,展层溶剂由有机溶剂和水组成。
滤纸纤维上的羟基具有亲水性,在滤纸上水就被吸附在纤维素的纤维之间形成固定相。
当有机溶剂(流动相)沿纸流动经过层析点时,层析法上溶质就在水相和有机相之间不断进行分配。
由于溶质就在水相和有机相之间不断进行分配。
由于溶质中各组分的分配系数不同,移动速率也不同,因而可以彼此分开。
物质被分离后在滤纸上的移动速率用值表示:只要条件(如温度、展层溶剂的组成)不变,值是常数,故可根据值作定性依据。
氨基酸无色,利用茚三酮反应,可将氨基酸层析点显色作定性、定量用。
二、实验器材标准氨基酸溶液、滤纸、层析缸、保鲜膜、剪刀、毛细管、电吹风。
三、实验试剂1、酸相溶剂:V[正丁醇(A.R)]:V[88%甲酸]:V[水]=15:3:22、显色贮备液:V(0.4mol/L茚三酮-异丙醇):V(甲酸):V(水)=20:1:5四、实验操作1、点样量取30mL层析溶剂、1mL显色贮备液于层析缸中,混匀密闭,静置。
戴好手套,在桌上铺好一层保鲜膜。
取一张干净滤纸,将其剪彩为18cm*14cm。
在纸的一端距边缘2cm处用铅笔轻轻划一条直线,在此直线上等距离分出几个点作为点样原点。
用毛细管将标准氨基酸和未知样品分别点在点样点上,每次点样后用电吹风冷风吹干再点下一次,点样点直径不超过5mm。
2、层析与显色将滤纸卷成圆筒形,用钉书针固定成圆筒状,纸的两边不能接触。
将滤纸垂直放入盛有展层剂的层析缸中,迅速盖紧层析缸盖(点样点的一端朝下,展层剂液面需低于点样线1cm左右)。


氨基酸纸色谱实验报告氨基酸纸色谱实验报告引言:氨基酸是构成蛋白质的基本组成单元,对于研究生物学和化学领域具有重要意义。
氨基酸的分离和鉴定是研究蛋白质结构和功能的关键步骤之一。
本实验旨在通过纸色谱法对氨基酸进行分离和鉴定,探究不同氨基酸在纸上的迁移率和色谱图谱。
实验材料与方法:实验所需材料包括氨基酸样品、滤纸、色谱槽、色谱溶液等。
首先,将滤纸剪成适当大小,然后将氨基酸样品溶解于色谱溶液中。
接下来,将滤纸浸泡于色谱溶液中,待其吸满后,将其放入色谱槽中。
在槽的一侧加入适量色谱溶液,使其与滤纸保持湿润。
将色谱槽放置在恒温水浴中,保持适当的温度。
观察滤纸上氨基酸的迁移情况,并记录下来。
实验结果与讨论:在实验中,我们选择了若干种常见的氨基酸作为样品,并进行了纸色谱分离实验。
通过观察滤纸上的迁移情况,我们得到了不同氨基酸的迁移率和色谱图谱。
首先,我们观察到不同氨基酸在纸上的迁移速率是不同的。
一般来说,极性较强的氨基酸会更容易迁移,而极性较弱的氨基酸则迁移较慢。
这是因为在纸上,极性较强的氨基酸与纸的极性较强的部分有更强的相互作用力,因此更容易被吸附和迁移。
而极性较弱的氨基酸则与纸的极性较弱的部分的相互作用力较小,因此迁移较慢。
其次,我们观察到不同氨基酸在纸上的迁移距离也不同。
迁移距离与氨基酸的分子量和极性有关。
一般来说,分子量较大的氨基酸迁移距离较短,而分子量较小的氨基酸迁移距离较长。
这是因为分子量较大的氨基酸在纸上的扩散速度较慢,因此迁移距离较短。
而分子量较小的氨基酸则扩散速度较快,因此迁移距离较长。
最后,我们观察到不同氨基酸在纸上的色谱图谱也不同。
色谱图谱反映了不同氨基酸在纸上的分离程度和迁移速率。
通过比较色谱图谱,我们可以判断氨基酸之间的相对含量和纯度。
例如,如果一个氨基酸的色谱图谱上只有一个峰,说明该氨基酸非常纯净;而如果一个氨基酸的色谱图谱上有多个峰,说明该氨基酸可能存在杂质或同分异构体。
结论:通过本实验,我们成功地利用纸色谱法对氨基酸进行了分离和鉴定。
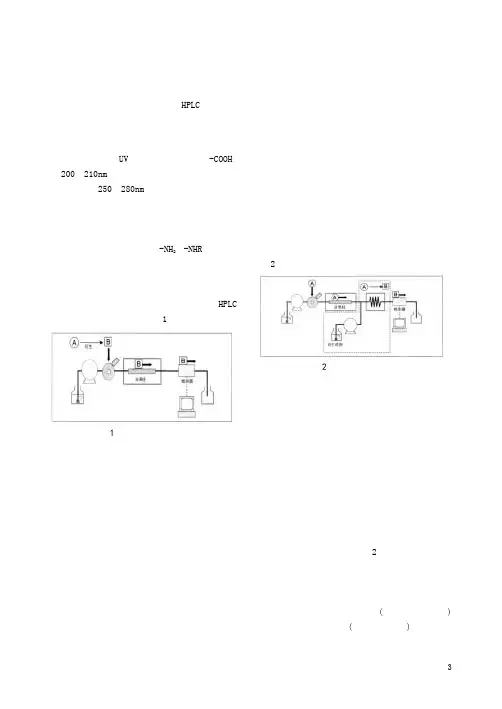
氨基酸的分析法健康食品繁荣兴旺中受人注目的是「氨基酸」,对该物质分析最常用的是HPLC。
本篇以检测法为中心谈谈氨基酸分析法。
■检测法的种类氨基酸进行UV检测只能利用羧基(-COOH)在200~210nm处的吸收。
一部分具有苯环的氨基酸也可在250~280nm检测,但是,一般在原形物质进行高灵敏度、良好选择性的分析比较困难。
因此,很早以来就使用衍生法,利用许多氨基酸构造中存在的氨基(-NH2,-NHR),使用与该集团可进行选择性反应的衍生试剂。
■柱前反应衍生法进样前进行氨基酸衍生,衍生物使用HPLC 进行分离、检测的方法。
图1表示它的流程。
图1 柱前反应衍生法这种方法的优点如下。
・反应系统小,试剂用量少。
・可使用高价格的试剂,低背景,可提高灵敏度。
・即使检测出未反应试剂,但经柱分离,也不会影响检测。
而它的缺点是,由于试样和衍生试剂直接混合,反应效率容易受试样基体(共存成分和溶剂等)的影响。
因此可以说,柱前反应衍生法是局限在某种程度的试样种类上适用于以高灵敏度分析为目的的方法。
具有代表性的氨基酸分析用柱前反应衍生试剂有邻苯二甲醛、异硫氰酸苯脂、荧光胺、氯化丹酰等。
反应操作各不相同,有的在室温下只须混合即可快速反应,有的在反应中必须加热,还有的反应后必须净化等。
衍生物的分离,多用反相色谱法。
为了快速并且提高分离性能,利用条件设定顺序可作到非常高效率的分析。
■柱后反应衍生法柱后反应衍生法是在柱分离氨基酸后,将衍生试剂输入、混合后进行反应,最后导入检测器。
图2是它的流程图。
图2 柱后反应衍生法本方法的主要优点如下・由于反应可自动化,定量性、重现性优异。
・由于反应前试样成分在柱中分离,不容易受基体的影响,可适用于广大范围的试样。
它的缺点是不易高灵敏度检测,且由于反应试剂连续输送,试剂消耗量大。
因此,可以说,柱后反应衍生法,一旦反应系统最佳化即可适用于宽范围的试样,是定量优越的常规分析方法。
柱后反应衍生法由于反应试剂连续流入检测器,受到未反应试剂不能检测的限制,可使用的试剂种类有限。
实验二圆形滤纸色谱法分离氨基酸一、原理用各种标准氨基酸的混合物和几种未知氨基酸在相同条件下的同一张圆形滤纸上进行层析。
层析后滤纸上的氨基酸用茚三酮显色剂显色得到纸色谱和各种标准及未知氨基酸的Rf值,将未知氨基酸的Rf值与各种标准氨基酸的Rf值相对照,以达到离、鉴定氨基酸的目的。
必须注意手指印含有一定量的氨基酸,故不能用手直接接触分析用的滤纸和滤纸条,要用镊子钳夹滤纸边。
二、仪器和试剂1.圆形滤纸(直径15厘米)、滤纸条(2x1 厘米)2.毛细玻管3.培养皿( 直径 l1-12 厘米 )4.电吹风机5.喷雾器6.镊子、剪刀、圆规、直尺、铅笔7.标准氨基酸溶液:0.1%丙氨酸水溶液,0.1% 精氨酸水溶液,0.1% 亮氨酸水溶液(加微量NaOH 使之溶解)8.层析溶剂:正丁醇:醋酸:乙醇:水 =4:1:1:2(V/V) 混合后的上清液。
9.0.1%茚三酮溶液:0.1克茚三酮溶于100毫升95%乙醇中。
10.待测氨基酸样品:丙氨酸、精氨酸、亮氨酸混合溶解(每种氨基酸的浓度均为0.1%) 。
三、操作:1.滤纸的处理取圆形滤纸一张以滤纸中心为圆心,用圆规画半径为1厘米的圆,在圆心处用打孔器打一个小孔。
用铅笔过圆心将滤纸分成4等份,并在滤纸边缘上分别标上丙、精、亮、混字样。
2.点样在圆规画的圆周上每一等份的中点(即原点) 用干净毛细玻管小心点上0.1%丙氨酸、 0.1%精氨酸、0.1%亮氨酸和混合氨基酸样品,点样直径约为2毫米,不宜过大,并把滤纸放在空气中晾干。
3.层析将滤纸条卷成圆筒(如灯芯),插入滤纸小孔,注意吻合紧密,勿使滤纸芯突出纸面,下端刚好接触培养皿底为宜。
用吸量管吸取层析溶剂5-10 毫升加入干燥、洁净的培养皿中,勿使溶剂沾到培养皿的边沿上,将点好样品的滤纸平放在培养皿上,纸芯浸入层析溶剂中, 并迅速用同样大小的培养皿严密覆盖在上面。
此时可见溶剂沿纸芯上升到圆形滤纸上,然后向滤纸四周徐徐扩散。
氨基酸的纸色谱分离一、目的要求1、了解纸色谱的基本原理;2、学习用纸色谱分离氨基酸的一般操作。
二、基本原理在平面上进行分离的一种色谱方法纸色谱,主要包括纸色谱法和薄层色谱法。
纸色谱是一种分配色谱,以滤纸作载体。
滤纸是由纤维素组成,纤维素上有多个—OH,能吸附水(一般纤维能吸附20%~25%水份),作为固定相,与水不相混溶的有机溶剂作为流动相。
当样品点在滤纸一端,放在一密闭器中,让流动相通过毛细管作用从滤纸一端,经过点样点流向另一端,样品中溶质在固定相水、流动相有机溶剂中进行分配,因样品中不同溶质在两相中分配系数不同,容易溶于流动相中而难溶于水中的组份,随流动相往前移动速度快些,而易溶于固定相,难溶于流动相的组份,随流动相向前移动速度慢些,从而达到将不同组份分离的目的。
也可用测定R f值方法对不同组分进行鉴定。
纸色谱常用作多官能团或极性较大的化合物,如糖类、酯类、生手碱、氨基酸的分离。
它因为设备简单、试剂用量少、便于保存,而为实验室常用方法。
纸色谱的操作方分为滤纸和展开剂的选择、点样、展开、显色和结果处理(测量R f值)五个部分。
三、仪器、药品仪器:圆形滤纸(直径125mm)、培养皿一套、毛细管、电吹风、剪刀、直尺、铅笔、边长约2.5cm的普通滤纸。
药品:标准液(1%亮氨酸/乙醇溶液、1%赖氨酸/乙醇溶液),样品混合液(含亮氨酸、赖氨酸的乙醇溶液),0.1%茚三酮乙醇溶液,展开剂(正丁醇∶冰乙酸∶水=4∶1∶5,在分液漏斗中充分混合,静止分层,取上层作展开剂)。
四、实验步骤1、点样取16cm×6cm的中速色谱纸在距离底边2cm处用铅笔划起始线,在其电线上分别点上标准品(亮氨酸、赖氨酸)及混合样品溶样(样点间距1cm),点样直径控制2mm~4mm,然后将其晾干。
注意: 滤纸的选择与处理(1)滤纸要求质地均匀、平整、边沿整齐、无折痕、有一定机械强度;(2)滤纸纸质要求纯度高、无杂质,无明显萤光斑点,以免与色谱斑点相混淆;(3)滤纸纤维松紧要适宜,过紧则展开太慢,过松则斑点扩散。
氨基酸的离子交换柱色谱分离【实验目的】1.掌握离子交换树脂分离氨基酸的基本原理;2.掌握离子交换柱层析法的基本操作;3.掌握氨基酸和茚三酮显色反应机理及洗脱曲线的绘制。
【实验原理】1.离子交换层析原理离子交换层析是一种用离子交换树脂做支持剂的层析法.离子交换树脂是具有酸性或碱性基团的人工合成聚苯乙烯和苯二乙烯等不溶性高分子化合物.树脂一般都制成球形的颗粒.阳离子交换树脂含有的酸性基团如磺酸基(一S03H),磷酸基(一P03H),亚磷酸基(一PO2H),羧基(一COOH),酚羟基(一OH)等,可解离出H离子,当溶液中含有其他阳离子时,例如在酸性环境中的氨基酸阳离子,它们可以和H 离子发生交换而"结合"在树脂上本实验采用磺酸型阳子交换树脂(732型)分离酸性氨基酸(天冬氨酸Asp pI=2.97)和碱性氨基酸(赖氨酸Lys pI=9.74)的混合液。
在pH5.3条件下,由于pH低于Lys的pI值,Lys可解离成阳离子,吸附在树脂上;又由于pH高于Asp的pI值,则Asp可解离为阴离子,不能被树脂吸附而直接流出色谱柱。
在pH12条件下,因pH高于Lys的pI值,Lys又解离为阴离子从树脂上被交换下来,这样通过改变洗脱液的pH值可使它们被分别洗脱而达到分离的目的。
2.茚三酮反应机理在弱酸条件下(pH5-7),蛋白质或氨基酸与茚三酮共热,可生成蓝紫色缩合物。
此反应为一切蛋白质和α—氨基酸所共有(亚氨基酸如脯氨酸和羟脯氨酸产生黄色化合物)。
含有氨基的其他化合物亦可发生此反应。
该反应颜色产物在570nm处有最大吸收峰。
【仪器与试剂】1.仪器:层析柱(20cmX1cm);铁架台;恒流泵;部分收集器;分光光度计;移液枪;恒温水浴锅;试管玻璃棒烧杯等常用器材。
2.试剂:A.732型阳离子交换树脂B.2mol/L氢氧化钠溶液1mol/L氢氧化钠溶液0.01mol/L氢氧化钠溶液C.2mol/L盐酸溶液D.混合氢基酸溶液:天冬氨酸、赖氨酸均配制成2 mg/mL的柠檬酸缓冲液溶液。
第二章 色谱法拆分D/L-氨基酸2.1 氨基酸手性拆分概述早在二十世纪初食品添加剂10重现性最低检测限等参数值还需要和生物样品中dopa的回收方法有效的衔接考虑到样品量大光不稳定性化合物)和经济实用等因素因为D-NNA的体内手性转化现象得到了证实且相关的CEC手性分析方法也较为成熟[36]±¾Ñо¿ÔÚ¿¼²ì¶à°Íת°±Ã¸µÄÒÖÖƼÁ¿¨±È¶à°ÍµÄµ×ÎïÑ¡ÔñÐÔʱ¾ßÌåÊÇÒò´Ë2.2手性配体交换法概述手性配体交换法(ligand-exchange´ÓÄÇÒÔºó³ÉΪ·ÖÀëÊÖÐÔ°±»ùËáµÄÓÐÁ¦¹¤¾ßËûÓÃ×é°±Ëá-Cu2+以及阿斯巴甜-Cu2+成功的实现了多种丹酰化氨基酸的手性分离[42]Ëüͨ³£Ö¸Á½À໯ºÏÎï-环糊精比如L-Pro°¢Ë¾°ÍÌðÇ°Ò»ÀàµÄÖ÷Òª½á¹¹ÊÇÓÉ6-8个呋喃糖通过因为每个呋喃糖上都有5个手性碳原子可以和氨基酸的对映异构体进行手性识别从而使对应异构体被拆分不过两者的具体分离机制还是不同的它主要是通过在流动相中添加L-氨基酸和螯合剂比如Cu2+等金属离子D/L氨基酸衍生物)与之形成螯合化的非对应异构体物这对形成的非对应异构体因为存在疏水性的差异保留时间)就不同11动态的解离-螯合过程中实现了氨基酸手性异构体的分离[42, 43]ÊÖÐÔÅäÌå½»»»·¨µÄ·ÖÀëÔ-ÀíÕýÊÇ»ùÓÚÕâ¶Ô·Ç¶ÔÓ¦Òì¹¹ÌåµÄÊèË®ÐÔ²îÒìÔÚÊÖÐÔÒì¹¹ÌåµÄ²ð·ÖÉϾݲé¶ÔD/L-Ala D/L-甲硫氨酸实现了手性对照对D/L-Ser此外事实上也可以广泛的应用于基于毛细管电泳的分析方法LE-MEKC比如手性选择性差异不显著有了更多的解决途径使用LE-MEKCp D/L-酪氨酸和o p 氟-D/L-Phe 可以同时对o共12种单体实现同时分离[45]³ýÁËÒÇÆ÷Ó²¼þÌõ¼þÒÔ´ïµ½ÀíÏëµÄ·ÖÀëЧ¹û½ðÊôÀë×ÓÁ÷¶¯ÏàpH值流动相离子强度1LE-LC 中的常用的金属离子有Cu2+, Ni2+, Co2+等在色谱柱中有效分离其它离子形成的络合物稳定性相对较差122Á÷¶¯Ï಻ͬµÄpH 值会改变金属离子的平衡状态非极性氨基酸的分离度通常会随着pH 值的升高而升高由于过低的pH 值环境中而使分离度下降因而通常是实际情况中选用pH5.0~6.0 之间洗脱的先后顺序也可能会发生改变 有机改性剂甲醇降低有机流动相中的有机溶剂会促进溶质和吸附剂之间的疏水作用4Àë×ÓÇ¿¶È²»½ö»áÓ°ÏìÒì¹¹ÌåµÄ±£Áôʱ¼ä5²»Í¬µÄÑ¡ÔñÌåÒòÓëÒì¹¹ÌåÐγÉÂçºÏÎïµÄÎȶ¨ÐÔ²»Í¬½ÏΪ³£ÓõÄÓÐL-脯氨酸N,N-双甲基-L-苯丙氨酸在众多基于手性配体交换的分析方法中手性固定相法(CSP)虽然灵敏但是手性柱价格昂贵生命周期短柱前衍生化方法虽然常以荧光检测器提高灵敏度也比CSP便宜操作步骤相对繁琐不利于热不稳定性化合物的定量分析结果的重现性更好它本身的优点是适用范围广操作方便总之因此我课题中的dopa手性分离也采用LE-LCËüÒ²Óв»¿ÉºöÊÓµÄȱµã1mM-5mM Cu2+介入流动相导致检测器的检测背景显著升高在分离某些极性的螯合化三重化合物的过程中有机改性13剂比如甲醇然而2.3 L/D-dopa的手性分离方法关于D-dopa的动物药效学研究资料显示而且药效较L-dopa有时滞D-dopa虽然是其药效的源头而是以D-dopa为底物我们推测这个物质可能就是由D-dopa转化生成的L-dopa×îÖ±¹Û×îÎÞи¿É»÷µÄÊֶξÍÊÇÈκη½·¨Ñ§µÄ½¨Á¢ÄǾÍÊÇ·ÖÎö·½·¨ÒªÊʺÏÑо¿¶ÔÏóµÄÀí»¯ÐÔÖʽ«¶à°ÍµÄÀí»¯ÐÔÖÊÏêÊöÈçÏÂÔÚ1mM盐酸溶液中的最佳吸收值在280nmË®ÖеÄÈܽâ¶ÈΪ1.5mg/ml ÂÈ·ÂÈÝÒ×±»¿ÕÆøÖеÄÑõÑõ»¯²¢ËæÖ®±äºÚ其实在体内的代谢也是非常活跃的dopa主要被儿茶酚胺-O-甲基转移酶(COMT)代谢为3-O-甲基多巴多巴胺进一步迅速的被单胺氧化酶氧化脱氨形成3DOPAC)HVA)[48]×óÐýdopa的人体药代动力学数据显示脑脊液中的浓度则仅相当于10-20%相应的目前常用的分析方法是采用离子对色谱法原理在于被测组分离子与离子对试剂离子形成中性的离子对化合物后从而使流动相中各组分的分离因子改善通常是采用C18反相柱在磷酸盐或柠檬酸缓冲体系中添加离子对试剂辛基磺14酸钠乙腈采用电化学检测器进行分离分析[50, 51, 52, 53]±È³£¹æµÄ×ÏÍâ¼ì²âÆ÷ÖÁÉÙÒª¸ß2-3个数量级该方法不仅可以对L-dopa 的体内代谢浓度进行检测4-二羟基苯乙酸(DOPAC)去甲肾上腺素(norepinephrine,NE)È»¶øÆä´ÎʹÓ÷ÑÓðº¹óÑ°ÕÒеķ½·¨ÅäÖÃ×ÏÍâ¼ì²âÆ÷µÄLE-LC方法就是一个可以实现D/L-dopa 分离分析的方案采用LE-LCÒÔ3 mM Cu2+为络合金属离子添加到去离子水中这两个非对映异构体螯合物在疏水性上的差异即从而实现手性分离日本岛津LC-2010C高效液相仪4.6mm上海通微分析技术有限公司)2.3.2药物和主要试剂L/D-dopa(Sigma乙腈(Fisher, 美国)其余试剂均为国产优质纯250 ~300 g2.3.4大鼠肾匀浆制备大鼠断头处死取双肾3置于冰预冷的100mM15Tris-HCl缓冲液(pH 8.2)中再用匀浆器按1000 r pm/min的转速匀浆数分钟吸上清存放于-202.3.5样品处理由100 l空白肾匀浆和100 l Tris-HCl缓冲液组成的样品2缓慢滴加0.6M高氯酸避光静置15分钟后下20,000×g 离心15分钟2.3.6方法学考察2.3.6.1 D/L多巴的手性分离取100 ìl D-dopa(1mg/ml, 溶于0.01M盐酸)和100 ìl肾匀浆至1.5ml 离心管立刻按2.3.5所示方法处理后进行高效液相分析5同法处理同法处理空白对照组以等体积的50mM Tris-HCl代替dopa的标准溶液102040并用100mM Tris再按2.3.5中的方法处理样品以L-dopa峰面积对匀浆中L-dopa的浓度进行线性回归2.3.6.3 方法回收率取空白匀浆100 l数份25并用Tris制成终浓度为25按2.3.5中方法除蛋白计算方法回收率162.3.6.4 提取回收率另取相应浓度的标准液直接进样得到提取回收率172.3.6.5 精密度取空白肾匀浆100 l数份制成浓度为12.5 g/ml按样品处理方法处理后计算精密度(RSD)ÅäÖÆ0.003MCu2+-0.006M L-Phe的去离子水溶液0.22 ìm滤膜过滤并超声脱气10分钟;以1%乙腈和99%的上述溶液实行等度洗脱280nm0.5ml/ml;柱温D/L-dopa的分离度Rs两个对映异构体可以实现基线分离图1出峰位置不受蛋白杂峰的干扰18Fig. 1 Typical chromatograph of drug free kidney homogenate (A); unequal concentration of D/L-dopa recovered from kidney homogenate (B); L-dopa recovered (C); D-dopa recovered (D). Mobile phase consisted of 1 mM Cu (II)-3 mM L-phenylalanine in aqueous solution containing 0.01% trifluoroacetic acid and 1% CAN. The flow rate was 0.5 ml/min and the column temperature was at 20µÃ»Ø¹é·½³ÌY = 9675.3X–46371R2 =0.9947 3时0.015 mM表2 方法回收率2.70103.474.0195.604.3198.152.3.8.4绝对回收率L-dopa按本文描述方法提取时中又称提取回收率6.88%4.12%3.21%192.3.8.5 精密度低高浓度组的精密度分别为8.49%2.3.9讨论生物样品如血浆1980年代常用的方法是固相萃取法(Solid Phase Extract简单来说以便样品中的待检物质如dopa等吸附于具有强表面自由能的三氧化铝表面达到回收的目的高速离心得到的上清直接检测[54, 56, 57]ËäȻǰÕߵľø¶Ô»ØÊÕÂʽϸß(80-90%)[55, 59, 56]¼´ÑùÆ·´¦Àí·½·¨¼òµ¥ÊʺϴóÅúÁ¿µÄÑùÆ·´¦ÀíºóÕߵľø¶Ô»ØÊÕÂÊËäÈ»ÉÔµÍ但是也基本满足药代动力学的回收率要求[57]Ïà¶ÔÎó²îÉпÉÎÒÃDzÉÓøßÂÈËáÖ±½Ó³ýµ°°×µÄ·½·¨À´´¦ÀíÉúÎïÑùÆ·¸ßÂÈËáÊÇÒ»ÖÖµäÐ͵ÄÀë×Ó¶ÔÊÔ¼Á由于流动相的PH呈中性在非极性固定相中的溶解度增大此外我们选用的柱温是20预试验数据表明故而添加1%的乙腈以增加流动相的非极性另一方面随PH升高紫外吸收背景过高可能影响检测的灵敏度弥补温度降低对峰型的影响我们参照Husain等分离D/L-dopa标准品的方法[58]³É¹¦µØ½¨Á¢ÁËHPLC上应用手性配体交换法分离定量20生物样品中D/L-dopa 的方法2.4L/D-硝基精氨酸的手性分离方法通过对硝基精氨酸体内手性转化的研究动物实验中D-NNA表现出来的类L-NNA的升压效应正是源于D-NNA在体内的生物学手性转化这些定性定量的研究进展都是基于HPLC的色谱方法首创了基于手性配体交换法来分离分析D/L-NNA 的毛细管电色谱方法[36]Êǽ«¹Ì¶¨ÏàÌî³äÓÚëϸ¹ÜÖùÄÚ»òÍ¿²¼ÒÔµçÉøÁ÷»òµçÉøÁ÷½áºÏѹÁ¦Á÷Íƶ¯Á÷¶¯Ïà¸ÅÀ¨µÄÀ´ËµÒò´ËÒ²¼¯ºÏÁËÕâÁ½ÖÖ·ÖÎö·½·¨µÄÓŵã¾ßÓиßЧ¾-¼ÃµÈÌصãÐí¶àÑо¿ÕßÔÚ·ÖÀëÀíÂÛËûÃǵľ-Ñé±íÃ÷¸ßËÙ·ÖÀë´øµçºÉµÄÐý¹âÒì¹¹Ìå[58]ÊǼ«¾ßDZÁ¦µÄÊÖÐÔ·ÖÀë·½·¨C18 反相毛细管柱上海通微分析技术有限公司2.4.2药物和主要试剂D-NNA(Bachem Bioscience, 美国)甲醇(Fisher, 美国)其余试剂均为国产优质纯212.4.3样品处理空白对照组加入用100mM Tris-HCl 补足体积至200 ìläöÎлìÔȺó离心15 min ÓÃÀëÐÄŨËõÒǻӸÉÈܼÁ¸ÃÑùÆ·ÒºÔÙ¾-12,000rpm离心10分钟后取上清进行CEC分析精密量取100 ìl 空白肾匀浆用100mM Tris-HCl 补足体积至200 ìl37700rpmÔÙ°´ÉÏÊö·½·¨´¦ÀíÑùÆ·ºó½øÐÐCEC分析包括两个PU2080 plus 输送泵, 10 nl 进样环, UV-20全波长紫外检测器和Trisep-2000GV 高压模块检测波长280 nm含有2 mM Aspartame5%甲醇2.4.5D-NNA手性转化的典型图谱A2223B图2 大鼠肾匀浆中D/L-NNA手性转化的典型图谱Fig. 2 Typical CEC chromatograph of rat kidney homogenate blank (A); 1.8mM D-NNA incubated in rat kidney homogenate (B). CEC conditionsÓ¦ÓÃÊÖÐÔÁ÷¶¯ÏàºÍ·´ÏàÖù°´2.4.3中的方法图2且血浆组分无干扰2.4.6讨论该实验采用CEC仪器在不加电渗流的情况下即24可有效的实施对生物样品中D/L-NNA的手性分离和定量省去了电极缓冲液的配制步骤从实验结果分析[20, 36]±ê×¼ÇúÏßÏà¹ØϵÊý¿É´ï0.99 以上此外检测样品量和流动相用量少等突出优点25。