产品开发流程各个阶段输出文件
- 格式:doc
- 大小:100.50 KB
- 文档页数:5

医疗器械设计和开发各阶段的输出文件医疗器械设计和开发的各个阶段需要进行输入和输出文件的开发。
以下是一些输出文件的清单,但需要结合本公司产品及开发流程进行具体的开发。
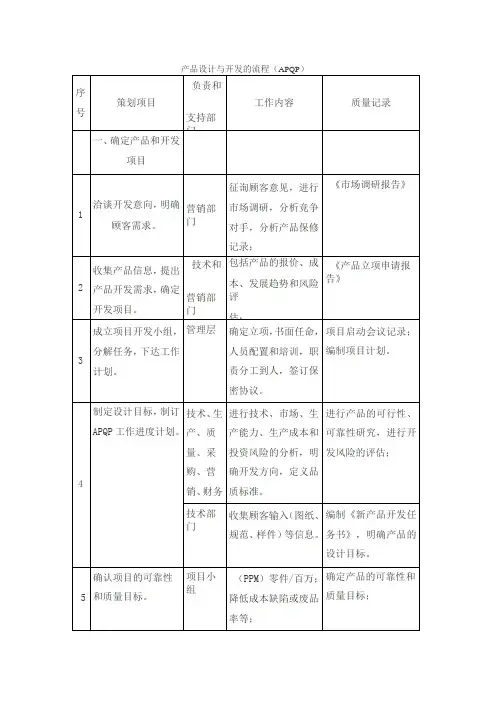
1、医疗器械设计与开发输入1)产品设计与开发策划/计划:设计开发的人员与职责、时间、各个阶段的输入与输出、各个阶段的工作内容与目标、资源需求。
需要明确评审、验证和确认等活动的安排。
这些活动对产品质量有着极为重要的影响。
产品设计可开发策划中的计划安排应分级分层进行描述。
设计和开发策划,应承继《产品实现策划》《项目可行性报告》或《项目任务书》的内容,并保持一致。
2)产品综述:需要清楚描述产品预期用途、功能、性能、管理类别、结构组成、规格型号、主要材料、标签、包装、灭菌方式、有效期等信息。
也需要清晰描述性能指标如何验证,以及制造过程的环境要求、设备、工装的需求,可以列一个清单,画出工艺流程图。
同时做好工艺布局图。
3)风险分析:需要进行风险管理,制定风险管理计划、风险的识别、分析、评价,制定风险控制措施。
可以列一个《安全有效基本要求清单》,在以后的开发活动中按照清单去进行开发。
风险管理是贯穿整个设计和开发过程的,也贯穿了产品生命周期的。
4)适用的法律法规/标准:需要列出一个详尽的清单,并对标准和法规中的适用的条款及要求进行识别,并转换成设计的要求。
5)产品包需求:包括了产品的可制造性、可测试性、可维护性、可靠性(故障率)、可用性(人机工程的要求)、价格/成本。
其中可制造性即生产转换的要求,也就是最终可批量生产的要求。
6)在市场调查的基础上,需对顾客的要求进行优先级排序,并将其转换成产品的语言,即功能、性能和特征。
顾客的要求不能直接作为输入使用。
7)产品技术规范的范围包括产品技术要求、使用说明、包装、标签、标记、可追溯性、效期、安全性、有效性、可生产性、极限/公差、电磁兼容、毒性/生物相容性等要求。
2、医疗器械设计与开发输出1)产品图纸包括总装图、部件图、零件图、原理图、工艺图、运动状态图、包装与标签图。
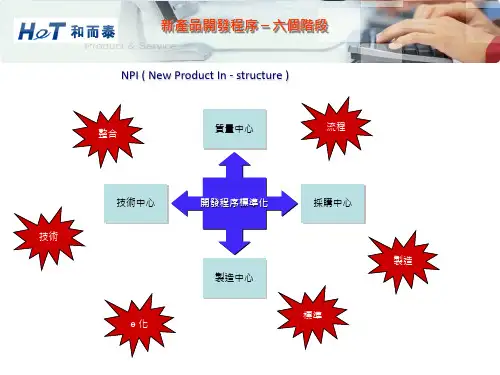



项目产品研发各阶段质量控制输出文件一、需求分析阶段:在需求分析阶段,主要的质量控制输出文件包括:1.需求规格说明书:详细描述了产品的功能需求和性能需求,确保需求的准确性和完整性。
2.用户故事:用于描述用户的需求和期望,帮助团队理解用户的需求,并在设计和开发过程中以用户为中心。
3.用例图:描述系统的功能和用户角色之间的交互,帮助团队理解用户需求并设计相应的功能。
4.需求跟踪矩阵:用于跟踪需求的实现情况,确保在后续设计和开发过程中不丢失任何重要的需求。
二、设计阶段:在设计阶段,主要的质量控制输出文件包括:1.系统架构设计文档:描述整个系统的结构和组件之间的关系,确保系统的可靠性和可扩展性。
2.详细设计文档:描述系统各个模块的设计细节,包括算法、数据结构、接口等,确保设计的合理性和可实现性。
3.数据库设计文档:描述数据库的结构和关系,确保数据库的一致性和有效性。
4.接口设计文档:描述系统和外部系统之间的接口规范,确保系统的互操作性和扩展性。
三、开发阶段:在开发阶段,主要的质量控制输出文件包括:1.编码规范:规定了团队成员在编码过程中的要求和规范,确保代码的可读性和可维护性。
2.单元测试用例和测试报告:用于对代码进行单元测试,确保每个单元的正确性和可靠性。
3.集成测试用例和测试报告:用于对系统进行集成测试,确保不同模块之间的协调性和兼容性。
4.代码审查记录:记录代码审查过程中的问题和建议,确保代码的质量和可靠性。
四、测试阶段:在测试阶段,主要的质量控制输出文件包括:1.测试计划和测试报告:规划测试策略和测试范围,并记录测试过程和结果,确保产品质量的可控性和可追溯性。
2.缺陷报告:记录测试过程中发现的缺陷和问题,确保缺陷得到及时修复和验证。
3.用户反馈记录:记录用户对产品的反馈和意见,确保产品的用户体验和满意度。
五、发布阶段:在发布阶段,主要的质量控制输出文件包括:1.上线计划:规划产品的上线时间和方式,确保产品的平稳过渡和用户的无缝体验。

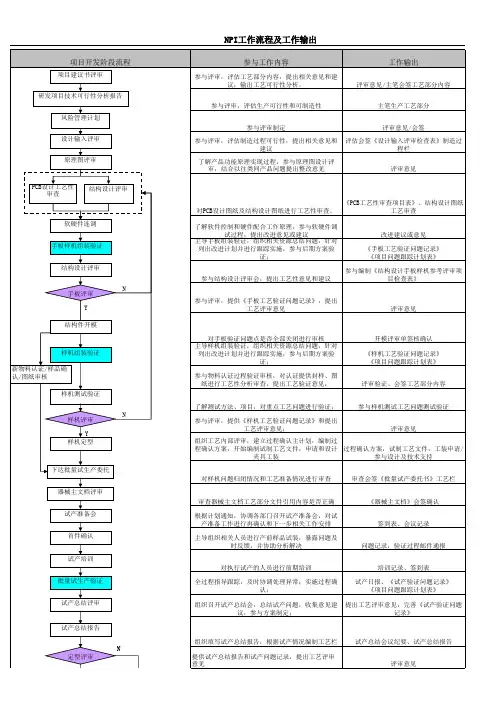
研发阶段输出文件及评审规定编制/日期审核/日期批准/日期1.目的确保产品研发的顺利进行,确保产品研发的品质。
2.范围本程序文件适用于深圳市创智成科技股份有限公司产品的研发整个过程。
3.定义EVT:Engineering Verification Test 工程验证测试DVT:Design Verification Test 设计验证测试PVT:Process Verification Test 制程验证测试4.权责4.1 产品经理:完成《产品策划书》、《产品规格书》、《产品配置需求表》和《Key Parts List》,参与立项会议;项目经理:完成《Team member list》、《项目开发schedule》,维护《Key Parts list》,并将各DQA监控关键文档,编入《项目开发schedule》以控制进度,主导组织各评审会议。
4.2 DQA(设计品质保证工程师):完成《产品质量保证大纲》,对各评审过程监督负责,确保按照既定的评审流程和评审要素(checklist)进行评审,并审计结果是否正确输出。
4.3 ID工程师:完成《ID设计图纸》、《ID效果图》、《产品工艺说明书》(材质、外观工艺)及有关资料,参加相关评审。
4.4包装工程师:完成《包材设计图》及有关资料。
4.5电子/电源工程师:完成《电子/电源总体设计方案》、《原理图》、《原理图检查表》(新平台首次设计时适用)、《HW To SW interface》、《电子备料BOM》、《电子生产BOM》、《生产注意事项》、《湿敏元件清单》、《电子调试报告》(部门报告,含功能、功耗及电源部分报告)、《Power Sequence测试报告》、《电源SI测试报告》、《适配器/电池单体测试报告》、《信号测试报告》(Option)及有关资料,参加相关评审。
4.6软件工程师:完成《软件设计总体方案》、《BIOS/EC SPEC》、BIOS/EC/Image等软件及有关技术资料,参加相关评审。
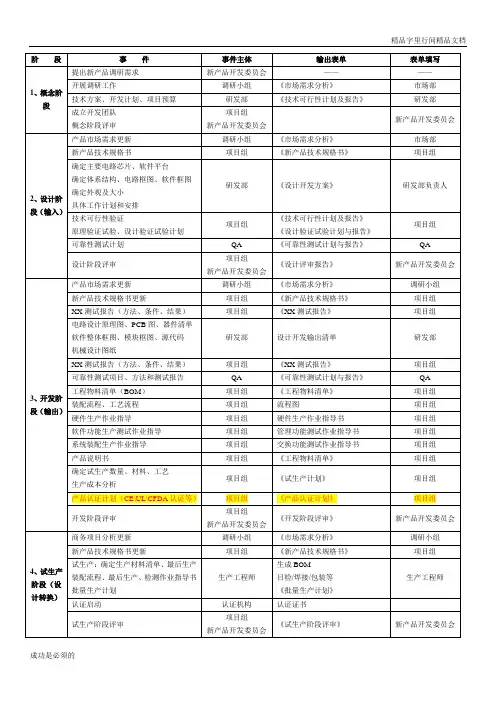
产品开发流程各个阶段输出文件阶段事件:新产品调研需求提出后,新产品开发委员会成立调研小组,开始调研工作。
事件主体:新产品开发委员会、调研小组、研发部、项目组。
输出表单:市场需求分析表单(Form 1-01)、技术可行性报告表单(Form 1-02)、概念阶段评审表单(Form 1-03)、新产品技术规格书表单(Form 2-01)。
表单填写:调研小组、研发部、新产品开发委员会、项目组。
概念阶段:成立开发团队,确定概念阶段技术方案、开发计划和项目预算,更新产品市场需求,确定主要电路芯片、软件平台、体系结构、电路框图、软件框图、外观及大小,制定具体工作计划和安排,进行技术可行性验证(FVT)。
设计阶段:进行原理验证试验计划(EVT plan)、设计验证试验计划(DVT plan)、可靠性测试计划,更新产品市场需求和新产品技术规格书,撰写EVT测试报告、电路设计原理图、PCB 图、器件清单、软件整体框图、模块框图、源代码、机械设计图纸、DVT测试报告、可靠性测试项目、方法和测试报告、工程物料清单(BOM)。
QA:进行设计阶段评审,填写技术可行性验证报告表单(Form 2-03)、工程验证试验计划表单(Form 2-04)、设计验证试验计划表单(Form 2-05)、可靠性测试计划表单(Form 2-06)、设计阶段评审表单(Form 2-07)。
生产阶段:QA进行流程图、硬件生产作业指导书、管理功能测试作业指导书、交换功能测试作业指导书、工程物料清单表单(Form 3-05)、试生产计划表单(Form 3-06)、强制认证计划表单(Form 3-07)的制定,进行开发阶段评审表单(Form 3-008)的填写。
最终输出:市场需求分析表单(Form 1-01)、技术可行性报告表单(Form 1-02)、概念阶段评审表单(Form 1-03)、新产品技术规格书表单(Form 2-01)、技术可行性验证报告表单(Form 2-03)、工程验证试验计划表单(Form 2-04)、设计验证试验计划表单(Form 2-05)、可靠性测试计划表单(Form 2-06)、设计阶段评审表单(Form 2-07)、EVT测试报告、DVT测试报告、可靠性测试报告、工程物料清单表单(Form 3-04)、试生产计划表单(Form 3-06)、强制认证计划表单(Form 3-07)、开发阶段评审表单(Form 3-008)、流程图、硬件生产作业指导书、管理功能测试作业指导书、交换功能测试作业指导书。
新产品开发流程程序文件一、前期准备阶段1.明确产品研发目标:对于新产品的开发,需要明确产品的研发目标和市场需求,例如产品定位、目标群体、市场竞争等方面。
2.市场调研:进行市场调研,了解目标市场的需求和竞争情况,通过用户反馈、竞争对手的产品分析等形成报告。
3.需求分析:根据市场调研的结果,进行需求分析,明确新产品的功能、特点和技术要求,形成产品需求文档。
4.初步设计:根据产品需求文档,进行初步设计,包括产品外观设计、结构设计、电路设计等方面,形成初步设计文档。
5.技术评估:对初步设计进行技术评估,确定可行性和技术难点,并提出解决方案,形成技术评估报告。
二、详细设计阶段1.详细设计:根据初步设计和技术评估报告,进行详细设计,包括产品结构详图、电路原理图、软件算法等方面,形成详细设计文档。
2.材料选型:根据详细设计文档,选择合适的材料和零部件,进行材料选型和供应商选择,并形成材料选型报告。
3.技术验证:对详细设计进行技术验证,包括模拟仿真测试、实物样品制作和测试等方面,确保设计方案的可行性和稳定性。
4.原型制作:根据详细设计和技术验证结果,进行产品原型的制作和调试,形成产品原型。
5.性能测试:对产品原型进行功能性能测试,包括质量检测、电性能测试、环境试验等方面,评估产品是否符合设计要求。
三、小批量制造阶段1.工艺开发:根据产品设计和性能测试结果,进行工艺开发,包括生产工艺流程、工装夹具制作等方面,确定生产流程。
2.供应链搭建:建立合作关系并进行供应链搭建,包括原材料采购、外包加工、物流运输等方面,确保生产所需资源供应。
3.小批量试制:根据工艺开发和供应链搭建结果,进行小批量试制,验证生产流程和工艺可行性。
4.品质控制:对试制产品进行品质控制,包括质量检测、性能测试、环境试验等方面,确保产品符合设计要求。
5.用户反馈:对试制产品进行用户反馈收集,了解产品的优缺点和改进方向,并进行改进调整。
四、量产阶段1.生产准备:根据小批量试制结果,进行生产准备,包括设备投入、员工培训等方面,为正式量产做好准备。
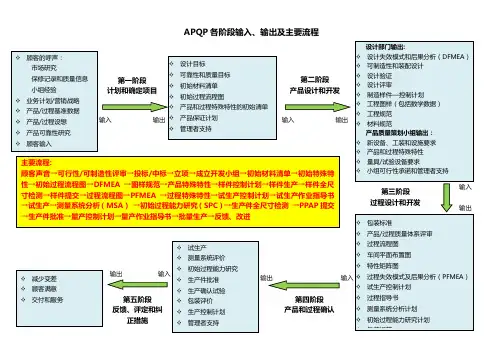
PPAP和APQP各阶段输出清单(附全套表单下载)做零部件的朋友都很清楚,需要给顾客提交⼀个叫PPAP的东西,我们做STA/SQE的朋友也都很熟悉,需要给每个零部件签署PSW这么⼀个玩意⼉,天啦,⼀般的⾏外⼈看的是⼀头雾⽔,好懵啊。
其实⼤家有所不知,PPAP可以称得上是零件的宝典,它包含了许多零件的秘密,你没有说明书,你就打不开这些秘密哦,今天闪亮君就给⼤家详解⼀下打开PPAP这个宝典的密钥。
⼀.PPAP的前世今⽣PPAP(Production Part Approval Process)中⽂全称为⽣产件批准程序,是IATF 16949的五⼤⼯具之⼀,AIAG的《PPAP⽣产件批准程序⼿册》是做⽣产件批准的国际通⽤指导⽂件,⽬前最新版为第四版,我们通常所说的PPAP我们通常认为有⼴义和狭义之分,⼴义的PPAP是指在新品开发,⽣产条件变更等完成之前进⾏重要APQP要素的审核并运⾏,简称PPAP运⾏审核;⽽狭义的PPAP就是我们最熟悉的PPAP⽂件包的提交了。
PSW (Part Submission Warrant)中⽂全称为零部件提交保证书,PSW是PPAP⽂件包的提交⽂件之⼀,同时也是APQP最终收尾,盖棺定论的重要⽂件,是供应商向顾客证明已经具备了能够向顾客提供持续满⾜顾客要求产品能⼒(哇喔,真的好拗⼝)的担保书,国际惯例认为PSW的签署完毕表明了顾客认可零部件可以批量供货。
⼆、 PPAP基本概念1. PPAP⽬的(1)⽤来确定供应商是否已经正确理解了顾客⼯程设计记录和规范的所有要求;(2)在执⾏所要求的⽣产节拍条件下的实际⽣产过程中,具有持续满⾜这些要求的能⼒。
2. PPAP应⽤对象适⽤于散装材料、⽣产材料、⽣产件或服务件组织的内部和外部现场。
对于散装材料,不要求PPAP,除⾮经授权的顾客代表规定。
3. PPAP适⽤范围关于什么情形下需提交PPAP恐怕是我们很多合作伙伴⾮常迷糊的事情,那闪亮君就和⼤家⼀起重温⼀下适⽤范围,加深印象吧。