复习专题导学粗盐提纯
- 格式:doc
- 大小:515.00 KB
- 文档页数:4


高考粗盐提纯知识点高考粗盐提纯是化学中一个重要的知识点,也是高考考查的重点之一。
本文将介绍高考粗盐提纯的相关知识点,以帮助考生更好地理解和掌握这一内容。
一、粗盐提纯的原理粗盐提纯是通过化学反应和物理方法将粗盐中的杂质去除,获得纯度较高的盐。
其原理主要涉及溶解、结晶和过滤等基本的化学操作。
1. 溶解:将粗盐溶解在适量的水中,形成盐水。
2. 过滤:通过过滤操作,将盐水中的固体杂质(如泥沙、悬浮物等)分离出来,得到澄清的盐水。
3. 结晶:利用盐水的饱和溶解度特性,在加热的条件下,使溶液中的盐逐渐结晶成晶体。
4. 分离:将结晶体与溶剂(水)进行分离,得到纯净的盐晶体。
二、常用的粗盐提纯方法1. 单纯结晶法:将盐水置于容器中,提高温度,经过结晶过程得到纯净的盐晶体。
这种方法适用于溶解度随温度升高而增加的物质。
2. 双水系结晶法:将盐水分次加热浓缩,得到饱和盐水。
然后在较低温度下结晶出纯净的盐晶体。
这种方法适用于溶解度随温度升高而减小的物质。
3. 活性炭吸附法:将盐水通过活性炭层过滤,活性炭可以吸附掉一部分杂质,使盐水得到净化。
这种方法适用于颜色较深的粗盐提纯。
4. 沉淀法:通过加入沉淀剂,使盐水中的杂质生成沉淀,然后通过过滤、洗涤等操作分离出纯净的盐晶体。
这种方法适用于含有金属离子等重金属杂质的粗盐提纯。
三、注意事项和解题技巧在掌握了粗盐提纯的基本原理和方法后,我们还需要注意以下几点:1. 注意操作细节:在进行实际操作时,需要掌握好温度、溶液浓度、沉淀剂的添加量等关键参数,以保证提纯效果。
2. 控制反应条件:在进行粗盐提纯时,需要根据具体情况来选择合适的操作条件,如温度、溶剂选择等,以保证反应的进行和选择性。
3. 解题技巧:在应用题中考察粗盐提纯时,需要灵活运用所学知识,综合运用化学反应、溶解度规律、过滤分离等相关概念,进行问题的分析和解决。
总结:高考粗盐提纯是考查化学知识的一个重要环节,需要考生对该知识点进行深入理解和掌握。




粗盐提纯知识点总结一、粗盐的提纯目的1.提高盐的纯度粗盐中含有各种杂质,如泥沙、有机物、金属离子等,需要通过提纯过程将这些杂质除去,以提高盐的纯度。
2.去除水分粗盐中含有大量水分,需要去除水分,以提高盐的质量和稳定性。
3.改善颗粒结构粗盐颗粒结构不均匀,经过提纯处理后,可以改善盐的颗粒结构,使得盐更加均匀细腻。
4.达到食品级标准通过提纯处理,可以使粗盐达到食品级标准,符合食品卫生安全要求。
二、粗盐的提纯方法1.溶解结晶法溶解结晶法是最常用的盐提纯方法之一。
将粗盐溶解于水中,然后通过蒸发结晶的方式,使盐结晶析出,经过过滤、干燥等步骤,最终得到纯净的盐产品。
2.蒸发法蒸发法是通过将粗盐溶解于水中,然后通过自然蒸发或加热蒸发的方式,使盐结晶析出,最终得到纯净的盐产品。
3.离子交换法离子交换法是通过将粗盐溶解于水中,然后利用离子交换树脂吸附盐中的杂质离子,最终得到纯净的盐产品。
4.电解法电解法是利用电解设备,将粗盐溶解于水中,然后通过电解的方式使盐中的杂质离子沉积在电极上,最终得到纯净的盐产品。
5.膜分离法膜分离法是利用特殊的膜技术,将粗盐溶液通过膜分离设备,将盐中的杂质和水分分离出去,最终得到纯净的盐产品。
6.气固法气固法是将粗盐在高温下蒸发,然后通过气态分离的方式,将盐中的杂质和水分排除,最终得到纯净的盐产品。
以上这些方法可以单独使用,也可以组合使用,根据不同的盐矿资源和生产工艺,选择适合的提纯方法,以获得高品质的盐产品。
三、粗盐提纯过程1.粗盐的净化将粗盐进行洗涤、过滤等步骤,去除掉盐中的泥沙、有机物等杂质,使盐变得更加干净。
2.溶解将净化后的粗盐溶解于水中,形成盐水溶液。
3.蒸发结晶将盐水溶液进行蒸发结晶,使盐结晶析出。
4.分离和干燥通过离心、过滤等手段,将盐结晶和溶液分离开来,然后对盐结晶进行干燥处理,最终得到干净纯净的盐产品。
本文对粗盐提纯的目的、方法和过程进行了详细的介绍,希望能够帮助读者更加全面地了解盐的提纯过程。

粗盐提纯专题练 姓名:______________1.从海水中提取的粗盐,除了NaCl 外,还可能含有少量的Ca 2+、Mg 2+、CO 32﹣和SO 42﹣,为了进一步检测成分,将其配置成溶液.一份中加入氢氧化钠,无明显的白色沉淀生成;一份加入氯化钡,也有明显的白色沉淀生成;加入盐酸溶液,有气泡冒出.下列说法正确的是( B )A .一定含有Mg 2+B . 一定含有CO 32﹣C .一定含有SO 42﹣D .一定含有Ca2+2.为了除去粗盐(主要成分为NaCl )样品中含有少量的氯化镁和硫酸钠杂质,某学生根据氯碱工业中精制食盐水的基本原理,运用所学知识设计了如下图所示的①至⑤步除杂方案:请根据上述除杂方案,回答下列问题:①沉淀甲是 Mg (OH )2 ;沉淀乙是____________;沉淀丙是_________________;滤液C 中的溶质是 NaCl 、NaOH 、BaCl 2 ;操作⑤中加入过量盐酸的作用是 除去滤液D 中的NaOH 和Na 2CO 3 . 中NaCl 的质量比原样品中NaCl 的质量 增大 (填增大、不变或减小);若在操作②中改为加过量的KOH 溶液,固体丁中可能含有的杂质是 KCl .3.海水是取之不尽、用之不竭的资源宝库.请围绕科学利用海水资源,填写表格:用海水“晒盐”的方法得到的粗盐中,除NaCl 外,还含有MgCl 2、CaCl 2、Na 2SO 4等杂质.将此粗盐提纯的部分实验方案如下:A 溶液:NaOH 溶液;B 溶液:BaCl 2溶液C 溶液:Na 2CO 3溶液;D 溶液:HCl 溶液(1)溶液甲中有什么溶质:________________________;溶液乙中有什么溶质:___________________________; 溶液丙中有什么溶质:___________________________; 溶液丙加盐酸能否一步到位转化为NaCl 溶液________; (2)为了简化实验步骤,可以在第_______步进行过滤。
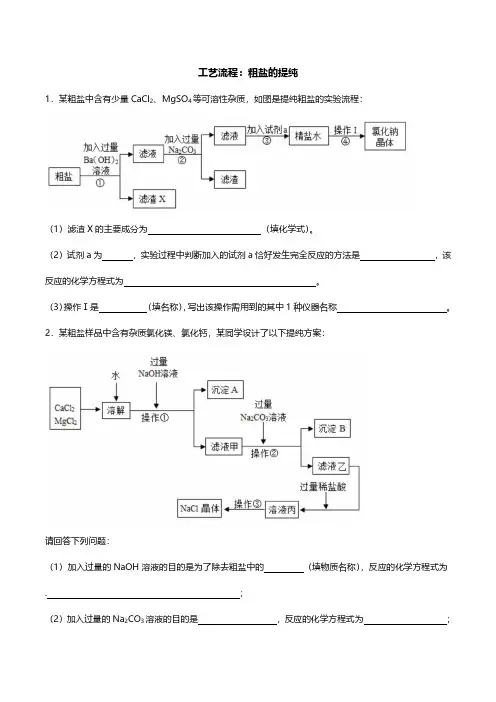
工艺流程:粗盐的提纯1.某粗盐中含有少量CaCl2、MgSO4等可溶性杂质,如图是提纯粗盐的实验流程:(1)滤渣X的主要成分为(填化学式)。
(2)试剂a为,实验过程中判断加入的试剂a恰好发生完全反应的方法是,该反应的化学方程式为。
(3)操作Ⅰ是(填名称),写出该操作需用到的其中1种仪器名称。
2.某粗盐样品中含有杂质氯化镁、氯化钙,某同学设计了以下提纯方案:请回答下列问题:(1)加入过量的NaOH溶液的目的是为了除去粗盐中的(填物质名称),反应的化学方程式为.;(2)加入过量的Na2CO3溶液的目的是,反应的化学方程式为;(3)滤液乙中含有的溶质有;向滤液乙中加入过量盐酸后,发生中和反应的化学方程式为;(4)操作③的名称为,在该操作中,需要用到的仪器有三脚架、酒精灯、玻璃棒、和;(5)经上述提纯后得到的氯化钠比原来样品中的氯化钠的质量是(填“增多”、“减少”或“不变”)。
3.蒸发海水得到的粗盐中除含NaCl外,还含有MgCl2、CaCl2、Na2SO4及泥沙等杂质,以下是将粗盐进行提纯的实验步骤。
①步骤②玻璃棒的作用是。
②写出加入NaOH发生反应的化学方程式。
③加入过量Na2CO3溶液的目的是,溶液B中含有的溶质有。
小明取上述制得的精盐5g配制成溶液,向其中加硝酸银溶液100g,恰好完全反应,过滤得到沉淀11.48g。
试计算精盐中氯化钠的质量分数。
4.粗盐中含有MgCl2、CaCl2等杂质,工业提纯粗盐的工艺流程如图所示:(1)Ca(OH)2俗称:,其溶液的pH(选填“>”“<”或“=”)7.步骤①反应的化学方程式为。
(2)步骤③操作a的名称是。
步骤④加入适量盐酸的目的是除去滤液中的和。
(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有。
(4)将精盐水制成食盐晶体的方法是。
5.某粗盐样品除含有不溶性固体杂质外,还含有少量的氯化镁、氯化钙、硫酸钠,某化学兴趣小组开展如下探究活动:探究一:除去粗盐中不溶性杂质探究二:从滤液1中提取氯化钠固体(1)探究一中的操作Ⅰ是,探究二中的蒸发结晶操作中玻璃棒的作用为:。



人教版初中化学复习课:粗盐的提纯探究实验说课稿实验目的本实验旨在通过对粗盐的提纯实验,让学生了解盐的提纯方法以及晶体的结构特征,培养学生的实践操作能力和观察分析能力。
实验材料与器材•粗盐•滤纸•瓷杯•铁夹•酒精灯•准胶体硅胶实验原理盐是由钠离子和氯离子组成的化合物,而粗盐中含有杂质如沙子、泥土、微粒等。
本实验将通过溶解、过滤和结晶三个步骤对粗盐进行提纯。
溶解:将粗盐加入瓷杯中,加入适量蒸馏水并充分搅拌,使盐溶解于水中。
过滤:使用滤纸将溶解后的盐水过滤,滤去其中的杂质颗粒。
此时得到的滤液为盐溶液。
结晶:将盐溶液倒入干净的瓷杯中,放在安全闪点下加热,使水分慢慢蒸发,直到结晶生成。
准胶体硅胶的作用是吸附溶液中的微粒杂质,起到加快盐溶液的过滤速度和提高盐的提纯效果。
实验步骤1. 准备工作•检查实验器材,确保清洁无损。
•准备足够的粗盐、滤纸、瓷杯、铁夹、酒精灯和准胶体硅胶。
2. 溶解•在瓷杯中加入适量的蒸馏水。
•加入适量的粗盐,并使用玻璃棒充分搅拌,直至盐溶解。
3. 过滤•将滤纸折叠成合适的形状,放入漏斗中。
•将漏斗放在干净的瓷杯中,倒入盐溶液。
•观察盐溶液慢慢渗透过滤纸,杂质颗粒留在滤纸上。
4. 结晶•将过滤后的盐溶液倒入干净的瓷杯中。
•使用铁夹将瓷杯固定在安全闪点下方的酒精灯上,加热盐溶液。
•观察盐溶液慢慢蒸发,直到结晶生成,形成纯净的盐。
实验结果与分析经过溶解、过滤和结晶三个步骤,从粗盐中成功提纯得到纯净的盐。
通过观察实验结果,学生可以观察到结晶的形状和颜色,并初步了解晶体的结构特征。
实验注意事项•实验过程需要小心操作,避免烧伤和触摸热的容器。
•加热时要注意安全,避免火灾事故。
•操作过程需要耐心和细心,确保实验结果准确。
思考题目1.为什么在溶解时需要充分搅拌?2.为什么过滤后的溶液一定要加热才能得到结晶?3.除了准胶体硅胶,还有哪些方法可以提高盐的提纯效果?实验延伸利用提纯后的盐,可以进行进一步的实验,例如制作食盐溶液以及利用盐溶液进行酸碱中和反应等。
初中粗盐提纯知识点
1. 粗盐是从海水或盐矿中提取出来的,其中含有杂质和水分。
为了得到纯净的食用盐,需要进行提纯处理。
2. 初步提纯:将粗盐溶解在水中,使用过滤纸或滤网过滤掉大颗粒的杂质。
这一步骤能使盐溶液变清(不含可见杂质),但仍含有微小的悬浮物。
3. 蒸发结晶:将过滤后的盐溶液放入容器中,通过加热使其蒸发,因为盐的溶点比水低,所以水会先蒸发,而盐则会逐渐结晶。
4. 结晶分离:当盐溶液完全蒸发,只剩下结晶的盐时,将其取出,并用纸巾或棉布吸干其表面的水分。
5. 粉碎:将得到的盐结晶放入研钵中,用研钵和杵搅碾并细磨,使其变成粉末状。
6. 储存:将粉末状的食用盐放入干燥的容器中,避免湿气进入,以保持其纯净和干燥。
需要注意的是,这只是针对初中阶段学习的粗盐提纯的简要知识点,实际操作可能还涉及其他因素和步骤。
具体操作时,请务必根据教师或其他专业人士的指导进行操作。
《中国医院管理》第39卷第9期(总第458期)2019年9月医院评价Yiyuan pingjia 5所三级医院患者出院流程及护理满意度调查与分析*李禹慧①梁立波②霍洪波①张桥③摘要目的通过调查黑龙江省5所三级医院共975名住院患者的住院满意度,了解患者对出院流程及护理工作的满意度及其影响因素,以提高患者就医体验。
方法采用问卷调查的方法收集数据,数据分析方法为统计描述和多元线性回归分析。
结果住院患者对出院流程和对护理工作的总体满意度得分分别为(4.54±0.54)分和(4.71±0.45)分;患者是否首次住院是出院流程和对护理工作总体满意度的共同影响因素,其回归系数分别为-0.1564和-0.0656。
结论三级医院需进一步优化出院流程,加强对患者的护理健康宣教,同时做好双向转诊工作,以提高患者满意度。
关键词出院流程护理工作患者满意度多元线性回归中图分类号R197.323.2文献标志码B文章编号1001-5329(2019)09-0065-03Investigation and Analysis of Discharge Process and Nursing Work of Patients in5Tertiary Hospitals/LI Yu-hui,LIANG Li-bo,HUO Hong-bo,et al.//Chinese Hospital Management,2019,39(9):65-67 Abstract Objective Through the investigation of975inpatients in5tertiary hospitals in Heilongjiang Province,the satis⁃faction of patients with discharge process,nursing work and its influencing factors were understood,to improve patients’medical experience.Methods Data were collected by questionnaire survey,and the data analysis method was statistical de⁃scription and multiple linear regression.Results The scores of discharging process and overall satisfaction with nursing work of inpatients were(4.54±0.54)and(4.71±0.45),respectively.Whether the patients were first hospitalized was the com⁃mon factor affecting the discharging process and overall satisfaction with nursing work.The regression coefficients wereβ= -0.1564andβ=-0.0656,respectively.Conclusion Tertiary hospitals need to further optimize the discharge process,strengthen health education for patients,and do a good job of“two-way referral”to improve patient satisfaction.Key words discharge process,nursing work,patient satisfaction,multiple linear regressionFirst-author’s address Harbin Medical University Cancer Hospital,Harbin,Heilongjiang,150081,China患者满意度是指患者在医院接受医疗服务的满意程度,也是患者对医疗服务的直接体验和亲身体会[1]。
粗盐提纯导学案一、引言粗盐是指未经处理的天然盐,通常含有杂质和其他无用的物质。
为了提高盐的品质和纯度,人们常常需要对粗盐进行提纯处理。
本文将介绍粗盐提纯的导学案,旨在帮助读者了解粗盐提纯的基本知识和步骤。
二、什么是粗盐提纯粗盐是从盐矿中开采出来的天然盐,它通常含有一些与盐无关的杂质,例如石灰石、泥土、杂质颗粒等。
这些杂质不仅影响了盐的纯度和品质,还可能对人体健康产生一定的影响。
粗盐提纯是指通过一系列的物理和化学处理,将粗盐中的杂质去除,提高盐的纯度和品质的过程。
常见的粗盐提纯方法包括洗涤、溶解、过滤和结晶等步骤。
三、粗盐提纯的步骤1. 洗涤首先,将粗盐倒入容器中,用清水充分洗涤。
洗涤的目的是去除表面的泥土和其他无关物质。
2. 溶解洗涤后的粗盐放入溶解器中,加入适量的水,充分搅拌使其溶解。
溶解的目的是将粗盐溶解在水中,使杂质与盐溶液分离。
3. 过滤溶解后的盐水通过一系列过滤器进行过滤,去除溶解后的杂质颗粒和悬浮物。
过滤的目的是将溶解后的盐水中的固体颗粒分离出来。
4. 结晶过滤后的盐水放入结晶器中,等待其自然结晶。
在结晶过程中,盐分子重新排列,结晶出纯净的盐晶。
结晶的目的是将溶液中的盐从水中析出,得到纯净的盐。
5. 干燥获得的盐晶经过结晶器排出,需要进行干燥以去除余留的水分。
干燥可以通过自然晾晒或使用加热设备进行。
6. 包装干燥后的盐晶通过包装设备进行包装,以保持其纯度和品质。
包装的目的是将提纯后的盐进行合适的包装,方便储存和使用。
四、粗盐提纯的意义粗盐提纯的过程可以有效地去除盐中的杂质,提高盐的纯度和品质。
纯净的食用盐对人体健康有益,而含有杂质的盐可能对人体产生负面影响。
此外,粗盐提纯还有利于盐的保存和运输。
纯净的盐不易结块,有利于长期储存和运输。
粗盐提纯的过程还可以减少对环境的污染。
通过去除盐中的杂质,可以减少盐水对环境的污染,保护周围的自然环境。
五、结语粗盐提纯是去除盐中杂质、提高盐的纯度和品质的过程。
第11讲_粗盐提纯及复分解反应知识图谱粗盐的提纯知识精讲一.粗盐的初步提纯实验1.实验目的(1)除去粗盐中难溶性杂质的实验过程。
(2)掌握溶解、过滤、蒸发、回收实验的操作技能。
2.实验用品(1)粗盐(含难溶性杂质)、蒸馏水;(2)托盘天平(含砝码)纸片、钥匙、烧杯、量筒、胶头滴管、玻璃棒、铁架台(带铁圈)滤纸、酒精灯、蒸发皿、坩锅钳、石棉网、火柴、剪刀等。
3.实验过程(1)溶解用托盘天平称取5g左右粗盐,并用量筒量取10ml蒸馏水,将粗盐和蒸馏水转移到烧杯中,并用玻璃棒搅拌,使粗盐充分溶解。
(2)过滤制作过滤器,并进行过滤。
若滤液仍然浑浊,则需重新过滤。
(3)蒸发将过滤后所得的溶液转移到蒸发皿中,将蒸发皿放在铁架台的铁圈上,用酒精灯加热,同时用玻璃棒搅拌滤液,待蒸发皿中出现较多固体时,停止加热,利用余热将滤液蒸干。
(4)回收注:问题讨论解析在易错点后二.过滤时要注意事项1.一贴:指滤纸要紧贴漏斗壁,一般在将滤纸贴在漏斗壁时先用水润湿并挤出气泡,因为如果有气泡会影响过滤速度。
2.二低:(1)滤纸的边缘要稍低于漏斗的边缘。
(2)在整个过滤过程中还要始终注意到滤液的液面要低于滤纸的边缘。
否则的话,被过滤的液体会从滤纸与漏斗之间的间隙流下,直接流到漏斗下边的接受器中,这样未经过滤的液体与滤液混在一起,而使滤液浑浊,没有达到过滤的目的。
3.三靠:(1)待过滤的液体倒入漏斗中时,盛有待过滤液体的烧杯的烧杯嘴要靠在倾斜的玻璃棒上(玻璃棒引流)。
(2)指玻璃棒下端要靠在三层滤纸一边(三层滤纸一边比一层滤纸那边厚,三层滤纸那边不易被弄破)。
(3)指漏斗的颈部要紧靠接收滤液的接受器的内壁。
一.考点:掌握粗盐提纯的步骤和实验仪器使用1.实验步骤:溶解、过滤、蒸发、回收。
2.实验仪器3.当水接近全部蒸发时熄灭酒精灯,停止加热,利用余热使剩余水分蒸发。
4.粗盐中由于含有氯化镁、氯化钙等杂质,易吸收空气中的水分而潮解;无水氯化钙可用作干燥剂。
复习专题导学粗盐的提纯一粗盐中难溶性杂质的去除问题聚焦:1.粗盐是如何获得的?粗盐中含有哪些物质?2.如何去除粗盐中难溶性杂质?3.过滤的目的是什么?举出你所了解的过滤操作。
一.教材过关(P87实验活动8)欲除去粗盐中难溶性杂质并计算所制精盐的产率实验流程如下:A基础题:过滤的注意事项:“一贴”:_____________________________;“两低”:(1)________________________________,(2)___________________________________。
“三靠”(1)___________________________________,(2)___________________________________。
(3)___________________________________。
1.除去粗盐中难溶性杂质的实验中,各步使用玻璃棒的作用是:溶解______________________________;过滤_____________________;蒸发______________________________________________________。
2.若经过两次过滤,滤液仍浑浊,可能原因是:(1)___________________________________,(2)___________________________________。
3.加热蒸发过程中,_______________________时,停止加热。
4.所得精盐是否为纯净物,为什么?__________________________________________。
5.海水晒盐、盐井水或盐湖水煮盐,获得粗食盐,都是采用______结晶方法,不采用______结晶方法。
依据是____________________________________。
6.本实验利用了食盐的哪些性质?_________________________________________________________。
7.若某班按照图示实验流程进行分组实验,定量实验的结果是:有两组同学得出粗盐的产率与其他组的实验结果有明显的差异。
试分析可能的原因:(1)粗盐的产率明显偏小。
_____________________________________;(2)粗盐的产率明显偏大。
_________________________________。
B提高题:1.俗话说“靠山吃山,靠水吃水”。
我国西北部有许多内陆盐碱湖,湖水中有大量的NaCl、Na2CO3,当地人“夏晒盐(食盐晶体)冬捞碱(纯碱晶体)”。
根据图示的溶解度曲线,联系所学知识说明:(1)“冬天捞纯碱”的道理________________________________________________________________ ____________________________;(2)“夏天晒食盐”的道理________________________________________________________________ ____________________________。
二.粗盐中可溶性杂质的去除问题聚焦:1.考虑粗盐的来源,设计实验验证并除去氯化钠溶液中混有的可溶性杂质(如氯化镁、氯化钙等)?2.海水蒸发所得食盐固体中常含有氯化镁、氯化钙等可溶性杂质,工业上常用饱和食盐水浸泡除去杂质,其原理是什么?【初高中链接】(人教版高中化学必修一绪言)粗盐的提纯:用海水、盐井水、盐湖水直接制盐,其中含有较多的杂质,如不溶性的泥沙,可溶性的CaCl2、MgCl2以及一些硫酸盐等。
用所学的方法进行(1)思考:你认为通过上述操作得到的是比较纯的氯化钠吗?可能还有什么杂质没有除去?用什么方法可以检验它们呢?(2)一些可溶性物质在水溶液中以离子的形式存在。
如氯化钠在水溶液中以Na+和Cl-的形式存在。
我们可以通过检验溶液中的离子来确定某些物质的成分。
请问如何利用化学方法来检验上述方法得到的氯化钠中是否含有SO42-?(3)如何设计实验检验自来水和蒸馏水中是否含有Cl-?一.基础题:检验:1.检验氯化钠溶液中是否含有CaCl2,可以加入___________;检验氯化钠溶液中是否含有MgCl2, 可以加入___________;2.检验氯化钠溶液中是否含有CaCl2、MgCl2,可以依次加入_____________、______________.除杂(理论除杂):1.除去氯化钠溶液中含有的CaCl2,可以加入适量__________________;除去氯化钠溶液中是否含有的MgCl2, 可以加入适量__________________;除去氯化钠溶液中含有的Na2SO4,可以加入适量__________________;2.除去氯化钠溶液中是否含有的CaCl2、MgCl2,可以依次加入适量_____________、______________. 除去氯化钠溶液中是否含有的CaCl2、MgCl、、Na2SO4,可以依次加入适量_____________、_______ _______.实际除杂:实际除杂时,常常加入适当过量的除杂试剂,使沉淀反应完全。
(注:《无机化学》《分析化学》“沉淀的溶解平衡”及“影响溶解度的因素”:适当过量,利用同离子效应,使沉淀的溶解度减小;过量太多,由于盐效应或配位效应,会导致沉淀的溶解度增大)【深度思考】上述除杂问题,若按实际除杂,分别采用这样的实验方法?二【巩固提高】1.如何除去氯化钠固体中混有的CaCl2、MgCl2等杂质,得到纯净干燥的氯化钠晶体?实验步骤:①溶解,②滴加稍过量的A溶液,③滴加稍过量的B溶液,④过滤,⑤向滤液中滴加稍过量的C溶液,⑥蒸发结晶,得到氯化钠晶体。
请回答:(1)写出化学式:A___________,B__________,C____________。
(2)滴加稍过量的A溶液的目的是______________________________________;滴加稍过量的B溶液的目的是______________________________________。
(3)第⑤步发生了两个反应的化学方程式分别是:________________________________; ______________________________________。
(4)第⑥步所得氯化钠晶体是否混有杂质,为什么?____________________________________________________。
2.如果要除去粗盐中含有的可溶性杂质CaCl2、MgCl2以及一些硫酸盐,按照下表顺序,应加入什么试思考:加入你选择的试剂除掉杂质后,有没有引入其他离子?想一想可以用什么方法再把它们除去?3.通过以上学习,你认为如何除去氯化钠溶液中含有的NaOH 和Na2CO3?中考直通车1.(2012年天津第26.题8分)某粗盐样品中含有杂质氯化镁、氯化钙。
某同学设计了以下提纯方案:请回答下列问题:(1)方案中加入过量试剂a若为氢氧化钠溶液,则其目的是为了除去粗盐中的;(2)在过滤操作中,除用到带铁圈的铁架台、烧杯、玻璃棒外,还需要用到的仪器是; (3)滤液B中所含有的溶质为;(4)向滤液B滴加稀盐酸的过程中,当观察到溶液中的现象为时,应停止滴加,如果滴加的稀盐酸过量,对最后得到的精盐晶体的成分(填“有”或“没有”)影响。
(5)操作c的名称为。
(6)工业上用电解饱和食盐水的方法可制取氢氧化钠、氢气和氯气,写出该反应的化学方程式。
2.(2014•菏泽第14题5分)粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).某班同学在粗盐提纯实验中,为把少量可溶性杂质CaCl2,MgCl2一并除去,将教材中实验方案修改设计如下,请据此回答问题:(1)实验操作A的名称是________,该操作的目的是________________.(2)写出步骤③中发生反应的主要化学方程式________________________________;步骤⑥的作用是________________________________.(3)小刚同学认为该方案实际得到的氯化钠可能比粗盐中含有的氯化钠要多,请你为他找出理由:________________________________________.3.(2014漳州)某氯化钠样品中含有硫酸钠、氯化镁、氯化钙等杂质,设计如下过程除去杂质:步骤Ⅰ:加足量的水溶解.步骤Ⅱ:依次加入过量的氯化钡溶液、过量的氢氧化钠溶液、过量的X溶液,充分反应后过滤.步骤Ⅲ:加入足量的稀盐酸.根据上述过程回答下列问题:(1)步骤Ⅰ需要用到的玻璃仪器是和.(2)步骤Ⅱ中加入氯化钡溶液时,发生反应的化学方程式是;物质X是溶液.(3)步骤Ⅱ得到的固体中主要含有的物质是.步骤Ⅱ中可以用过量的溶液(填一种物质)代替氯化钡和氢氧化钠两种溶液,也可以达到相同实验目的(4)步骤Ⅲ加入足量稀盐酸的目的是;步骤Ⅳ的实验操作名称是.4.(2013年山西17).化学小组同学为鉴定某工厂排出的无色污水成分,他们查阅工厂的有关资料后,推测出污水中可能含有HCl、Na2SO4、NaOH、Na2CO3中的一种或几种物质,同学们取污水进行了探究:(已知Na2SO4溶液呈中性)(1)测污水的pH:取一张pH试纸,放在玻璃片上________________________,读数为pH=2,由此可知:污水中一定有_____________,可能有Na2SO4。
(2)检验Na2SO4是否存在:甲同学在一支试管中取少量污水,向试管中滴加少量的_______________溶液,振荡,产生了白色沉淀,反应的化学方程式为____________________,证明污水中有Na2SO4存在。
乙同学用物理方法也得到了同样的结论,他的实验操作及实验现象是_____________________________。
通过探究,同学们确定了污水的成分。
为使排放的污水中不含酸或碱,可向污水中加过量的________________________。
5.(2008广东)用如图所示的简易净水器处理河水,下面对该净水器分析正确的是()A.能杀菌消毒B.能把硬水变为软水C.能得到纯净水D.活性炭主要起吸附杂质的作用【收获与体会】1.通过对粗盐的提纯的深入学习,你一定对复分解反应在实际生产中的应用有了新的认识,请简要总结分享。
2.除杂的一般原则是什么?(不增不减、简便环保)3.常用的除杂方法有哪些?4.用离子共存的微观角度,可快速准确分析酸碱盐的反应问题。