郑州大学无机化学复试题2012
- 格式:doc
- 大小:7.10 MB
- 文档页数:6


第一题、单项选择题(每题1分,5道题共5分)
1、导致外消旋酒石酸无旋光性的原因是
A、分子内无手性碳
B、分子内含一个对称面
C、分子内含一个手性碳
D、存在等量的左旋体和右旋体
2、2-甲基-5-氯-3-己烯的立体异构体的数目是
A、6
B、4
C、8
D、10
3、下列哪一个化合物是内消旋化合物
A、(2S,3S)-2,3-二氯丁烷
B、(2S,4R)-2,3-二氯丁烷
C、顺-1,3-二氯环丁烷
D、顺-1,2-二氯环丁烷
4、下列类型化合物只有哪一种具有旋光性
A、非手性分子
B、内消旋化合物
C、外消旋体
D、单一的对映体
5、化合物的旋光方向与其构型的关系,下列哪一种叙述是正确的
A、无直接对应关系
B、R-构型为右旋
C、S-构型号为左旋
D、R-构型为左旋
第三题、判断题(每题1分,5道题共5分)
1、含手性碳原子的化合物都具有旋光性
正确错误
2、Fischer投影式中的手性碳原子上所连原子或基团,两两交换偶数次后,构型不变。
正确错误
3、某分子中含有3个手性碳,则一定含有6个立体异构体,即3对对映异构体。
正确错误
4、分子若含有对称面或对称中心,则此分子没有手性。
正确错误
5、Fischer投影式中的竖键代表朝向纸平面后方的键;连于手性碳上的横键,代表朝向纸平面前方的键。
正确错误。


郑州大学676普通化学无机化学929有机化学2015年2016年考研真题答案解析经验专业:无机化学、分析化学、有机化学、物理化学、药物化学、药物分析学、化学生物学(2016年新增专业)专业课考试科目:③676普通化学(指无机化学)④929有机化学主要推荐参考书目:1、《无机化学》(第三版上、下册)武汉大学、吉林大学、南开大学宋天佑等编高等教育出版社(上册2009年9月第二版,下册2010年4月第二版)2、《基础有机化学》(第四版上、下册)邢其毅、裴伟伟等编,高等教育出版社(2010年11月第三版)其他补充参考书目:《大学化学》,傅献彩主编,高等教育出版社,1999;《普通化学原理》第二版,华彤文等著,北京大学出版社,1993;《元素无机化学》,蔡少华、黄坤耀、张玉容编著,中山大学出版社,1998;《基础元素化学》第1 版,黄佩丽、田荷珍编著,北京师范大学出版社,1994。
适用科目:专业:070301★▲无机化学、070302★▲分析化学、070303☆★▲有机化学、070304★物理化学、078001★药物化学、078004药物分析学、0703Z1化学生物学(2016年新增专业)说明:1、以上专业从2014考研开始改革为初试考试科目完全一样;2、以上专业2015考研再次变动考研科目,初试考的仍然都一样;3、☆表示该专业为国家级重点学科,▲表示该专业是省重点学科,★表示该专业有博士点。
※专业课初试考试科目:③普通化学(考试内容涉及参考教材中无机化学、物理化学和分析化学)④有机化学内容详情郑州大学资料包括了以下几个部分内容:Part 1 - 考试重难点:1、郑州大学有机化学考试大纲2、郑州大学有机化学导师授课教案3、郑州大学有机化学考研基础知识点总结4、郑州大学有机化学式汇总5、郑州大学有机化学复习题集6、郑州大学有机化学考研重难点讲解7、郑州大学考研有机化学高分考生手写笔记8、郑州大学考研无机化学专业课考研辅导讲义9、郑州大学考研《有机化学学习指导》(郑大王敏灿老师编写内部复习资料★★★★★)10、有机化学郑大期末试题5份含答11、无机化学和分析化学郑大期末试题集(部分缺答案)12、《基础有机化学》(第三版上、下册)邢其毅考研班辅导视频Part 2- 郑州大学历年考研真题与部分答案:汇编郑州大学考研专业课考试科目的无机化学2005-2014.2016.2017年+有机化学2005-2017年考研真题,并配备无机化学2005-2012年+有机化学2005-2011年真题答案,方便考生检查自身的掌握情况及不足之处,并借此巩固记忆加深理解,培养应试技巧与解题能力。
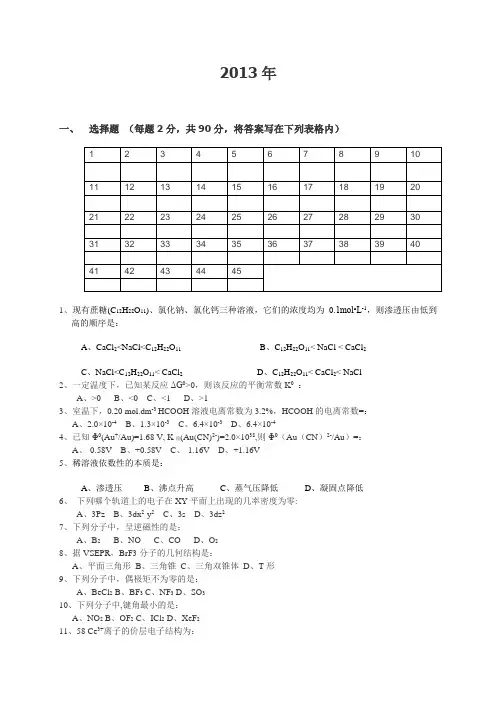
2013年一、选择题(每题2分,共90分,将答案写在下列表格内)1、现有蔗糖(C12H22O11)、氯化钠、氯化钙三种溶液,它们的浓度均为0.1mol•L-1,则渗透压由低到高的顺序是:A、CaCl2<NaCl<C12H22O11B、C12H22O11< NaCl < CaCl2C、NaCl<C12H22O11< CaCl2D、C12H22O11< CaCl2< NaCl2、一定温度下,已知某反应ΔG0>0,则该反应的平衡常数K0:A、>0B、<0C、<1D、>13、室温下,0.20 mol.dm-3 HCOOH溶液电离常数为3.2%,HCOOH的电离常数=:A、2.0×10-4B、1.3×10-3C、6.4×10-3D、6.4×10-44、已知Φ0(Au+/Au)=1.68 V, K稳(Au(CN)2-)=2.0×1038,则Φ0(Au(CN)2-/Au)=:A、-0.58VB、+0.58VC、-1.16VD、+1.16V5、稀溶液依数性的本质是:A、渗透压B、沸点升高C、蒸气压降低D、凝固点降低6、下列哪个轨道上的电子在XY平面上出现的几率密度为零:A、3PzB、3dx2-y2C、3sD、3dz27、下列分子中,呈逆磁性的是:A、B2B、NOC、COD、O28、据VSEPR,BrF3分子的几何结构是:A、平面三角形B、三角锥C、三角双锥体D、T形9、下列分子中,偶极矩不为零的是:A、BeCl2B、BF3C、NF3D、SO310、下列分子中,键角最小的是:A、NO2B、OF2C、ICl2D、XeF211、58 Ce3+离子的价层电子结构为:A 、4f 2B 、4f 05d 1C 、4f 1D 、6s 112、金属钾晶体为体心立方结构,在单位晶胞中钾原子的个数是:A 、2B 、4C 、6D 、913、晶体场稳定化能正确的大小顺序是:A 、[Mn(H 2O)6]2+ <[Fe(CN)6]3-<[Fe(H 2O)6]3+<[Ru(CN)6]3-B 、[Fe(H 2O)6]3+<[Mn(H 2O)6]2+<[Ru(CN)6]3-<[Fe(CN)6]3-C 、[Fe(CN)6]3-<[Fe(H 2O)6]3+<Mn(H 2O)6]2+<[Ru(CN)6]3-D 、[Mn(H 2O)6]2+<[Fe(H 2O)6]3+<[Fe(CN)6]3-<[Ru(CN)6]3-14、下列配合物中,磁矩最小的是:A 、[Cr(H 2O)6]2+B 、[Fe(CN)6]3-C 、[Co(H 2O)6]2+D 、[Co(NH 3)6]3+15、下列同浓度含氧酸中,氧化性最强的是:A 、HBrO 4B 、HClO 4C 、HBrO 3D 、H 5IO 616. 要使溶液的凝固点降低1K ,必须向100ml 水中加入多少mol CaCl 2?假定所得到的溶液为理想溶液,水的K F =1.86K ⋅kg ⋅mol -1:A . 0.018B . 0.027C . 0.054D . 0.5417. 在298K ,下列反应中∆r H өm 与∆r G ө m 最接近的是( )A . CCl 4(l )+2H 2O (g )=CO 2(g )+4HCl (g )B . CaO (s )+CO 2(g )=CaCO 3(s )C . Cu 2+(aq )+Zn (s )= Cu (s )+Zn 2+(aq )D . 2Na (s )+2H +(aq )+2H 2O (l )=2Na +(aq )+2OH -(aq )+H 2(g )18. 下列叙述中正确的是:A . 非基元反应是由若干基元反应组成的B . 当速率表达式中各物质的浓度的指数等于反应方程式中其化学式前的系数时,此反应必为基元反应C . 反应级数等于反应物在反应方程式中的系数和D . 反应速率一定随反应物浓度升高而升高19. 下列原子中,第一电子亲合能最大的是:A . NB . OC . PD . S20. 下面的说法,哪个是正确的?:A . 如果原子在基态没有未成对电子,则不能形成共价键B . 分子的几何构型只取决于中心原子的杂化轨道数目C . sp 2杂化轨道是由某个原子的1s 和2p 轨道杂化而成的D . 轨道杂化只发生在原子形成分子的过程中21. 下列哪个分子中至少有二个不同长度的键:A . CO 2B . SO 3C . XeF 4D . PCl 522. 为避免配制的SnCl 2溶液中Sn 4+积累,最好的方法是:A . 加入Sn 粒B . 加入Fe 屑C . 加入HClD . 均可23. 在H 2S 水溶液中,下面哪个关系是正确的?:A . c (H +)=2c (S 2-)B . c (H +)=c (HS -)C . c (H +)>c (H 2S )D . c (HS -)>c (S 2-)24. 已知H 3PO 4的pK өa 1=2.12,pK ө a 2=7.20,pK ө a 3=12.36,则0.10 mol ⋅dm -3Na 2HPO 4溶液的pH 值约为: A . 4.7 B . 7.3 C . 9.8 D . 10.125. 碳酸钙在下列哪一种溶液中有最大的溶解度?:A. 纯水B. 0.10mol⋅dm-3NaClC. 0.10mol⋅dm-3Na2CO3D. 0.10mol⋅dm-3CaCl226.在配合物中,关于中心离子的配位数,下面说法错误的是:A. 配体的负电荷增加时,配体与中心离子作用力加大,因此配位数增加B. 中心离子半径越大,一般而言周围可容纳更多的配体,因此配位数增加C. 配体半径越大,中心离子周围可容纳的配体数目越小,因此配位数降低D. 温度升高时,配位数一般会下降27.下列分子中,S采取sp2杂化的是:A. SOCl2B. SO2C. SO2Cl2D. H2S28.以下关于各对配合物稳定性的判断,不正确的是:A. [Fe(CN)6]3- >[Fe(SCN)6]3-B. [HgCl4]2- >[HgI4]2-C. [AlF6]3- >[AlBr6]3-D. [Cu(NH3)4]2+ >[Zn(NH3)4]2+29.下列叙述中错误的是:A. 自然界中只存在单质氧而没有单质硫B. 氧既有正氧化态的化合物,又有负氧化态的化合物C. 由H和18O组成的水叫做重氧水D. O2和O3为同素异形体30.实验室中制取少量HBr所采用的方法是:A. 红磷与Br2混合后滴加H2OB. KBr固体与浓H2SO4作用C. 红磷与H2O混合后滴加Br2D. Br2在水中歧化反应31.下列含氧酸的氧化性递变不正确的是:A. HClO4>H2SO4>H3PO4B. HBrO4>HClO4>H5IO6C. HClO>HClO3>HClO4D. HBrO3>HClO3>HIO3的是:32.下列物质在酸性溶液中,能将Mn2+氧化成MnO–4A. Cl2B. HClO3C. H5IO6D. H2O233.下列化合物属于缺电子化合物的是:A. BCl3B. H[BF4]C. B2O3d. Na[Al(OH)4]34.下列各对物质中,中心原子的轨道杂化类型不同的是:D. CF4与SF4A. CH4与SiCl4B. H3O+与PH3C. GeH4与NH+435.下列氧化物中,氧化性最强的是:A. Cr2O3B. B2O3C. As2O3D. Pb2O336.下列物质加热分解可得到NO2的是:A. LiNO3B. NaNO3C. KNO3D. NH4NO337.下列分子中,属于极性分子的是:A. SnCl2B. BCl3C. CCl4D. PCl538.制备NO气体,下面的方法中最好的是:A. 向酸化的NaNO2溶液中滴加KI溶液B. 向酸化的KI溶液中滴加NaNO2溶液C. 用Zn粒与2mol⋅dm-3硝酸反应D. 向双氧水中滴加NaNO2溶液39.Zn比Cu活泼的主要原因是:A. Zn2+的水合热比Cu2+大得多B. Zn的I1+I2比Cu小得多C. Zn的气化热明显比Cu小D. Zn2+半径比Cu2+大40.某金属离子在八面体弱场中磁矩为4.90BM,在八面体强场中磁矩不为零,则该离子可能是:A. Ti2+B. Cr2+C. Fe2+D. Mn2+41.下列新制备的沉淀在空气中放置,颜色不变化的是:A. Mn(OH)2B. Fe(OH)2C. Co(OH)2D. Ni(OH)242.常温下以液态形式存在的是:A. CoCl2B. AlCl3C. TiCl4D. PCl543.FeCl3溶液遇KSCN溶液变红,下面各试剂中,不能使红色褪去的是:A. Fe粉B. SnCl2C. CoCl2D. NH4F44.下列金属单质中,耐碱能力最强的是:A. CuB. CrC. NiD. Pt45.下列水合晶体中,加热脱水时不生成碱式盐的是:A. CoCl2⋅6H2OB. NiCl2⋅6H2OC.MgCl2⋅6H2OD. CuCl2⋅2H2O二、填空题(共25分)1、某温度下,N2(g)+3H2(g)=2NH3(g),△r Hm0<0。

郑州⼤学《⽆机化学》在线测试《⽆机化学》第03章在线测试《⽆机化学》第03章在线测试剩余时间:54:59答题须知:1、本卷满分20分。
2、答完题后,请⼀定要单击下⾯的“交卷”按钮交卷,否则⽆法记录本试卷的成绩。
3、在交卷之前,不要刷新本⽹页,否则你的答题结果将会被清空。
第⼀题、单项选择题(每题1分,5道题共5分)1、在⼀定条件下,⼀可逆反应其正反应的平衡常数与逆反应的平衡常数关系是A、它们总是相等B、它们的和等于1C、它们的积等于1D、它们没有关系2、已知HF(g)的标准⽣成热ΔfHmΘ= -565 kJ?mol-1,则反应H2(g)+F2(g)=2HF(g)的ΔrHmΘ为A、565 kJ?mol-1B、-565 kJ?mol-1C、1130 kJ?mol-1D、-1130 kJ?mol-13、下列反应及其平衡常数H2 (g)+S(s)=H2S(g) K1Θ; K2Θ,则反应的平衡常数KΘ是A、K1Θ+K2ΘB、K1Θ- K2ΘC、K1Θ×K2ΘD、K1Θ÷K2Θ4、已知某化学反应是吸热反应,欲使此化学反应的速率常数k和标准平衡常数Kθ都增加,则反应的条件是A、恒温下,增加反应物浓度B、升⾼温度C、恒温下,加催化剂D、恒温下,改变总压⼒5、反应 2NO2(g)(红棕⾊)==N2O4(g)(⽆⾊) ΔrHm<0 达平衡后,将体系的温度降低,则混合⽓体颜⾊A、变浅B、变深C、不变D、⽆法判断第⼆题、多项选择题(每题2分,5道题共10分)1、下列关系式中正确的是A、H=U+PVB、ΔU(体系)+ ΔU(环境)=0C、ΔG=ΔH-TΔSD、ΔG(正反应)×ΔG(逆反应)=1第三题、判断题(每题1分,5道题共5分)1、系统经历⼀个循环,⽆论多少步骤,只要回到初始状态,其热⼒学能和焓的变化量均为零正确错误2、⼄烷裂解⽣成⼄烯:C2H6 (g) C2H4 (g) + H2 (g) 。
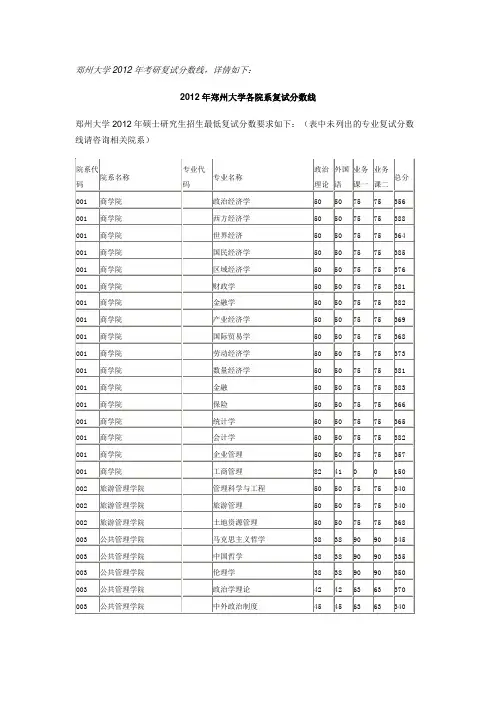
2010年第一部分:理论知识(共100分)1.Zn可以将HAsO2还原为As,但一般不用这种方法制备单质As,原因是一、填空题:(每空1分,共10分)___________________________________2.金属Na和K可保存在煤油中,但Li不行,原因是____________________________3.根据晶体场理论,在八面体弱场中,中心离子d电子数为__________时,CFSE最大=_________4.某一元酸HA溶液的pH=4,同浓度的NaA溶液pH=9,则HA的Kөa5.Cr3+、Mn2+、Fe2+、Fe3+、Co2+、Ni2+中,溶于过量氨水的是_______________________6.Ga3+与F−形成的配离子是__________,与Cl−形成的配离子是_______________7.Na2SO3受热分解产物为___________________________________8.TlCl和TlCl3中比较稳定的是__________,Ga和In中熔点较高的是__________二、单选题:(每题1分,共20分)1.某金属离子在八面体弱场中磁矩为4.90BM,在八面体强场中磁矩不为零,则该离子可能是A. Ti2+B. Cr2+C. Fe2+D. Mn2+2.下列离子水合时,放出能量最少的是:A. Li+B. Na+C. K+D. Ba2+3.以下物质在气态时,结构与众不同的是:A. AlCl3B. FeCl3C. AuCl3D. GaCl34.下列物质中碱性最强的是:A. NH3B. PH3C. H2OD. H2Se5.下列水合晶体中,加热时得到正盐的是:A. MgCl2⋅6H2OB. NiCl2⋅6H2OC. CoCl2⋅6H2OD. CuCl2⋅2H2O6.形成强的酸性X−H键,X应满足:A. 原子小且电负性也小B. 原子小而电负性大C. 原子大而电负性小D. 原子大且电负性也大7.下列氮化物最稳定的是A. Li3NB. Na3NC. K3ND. Ba3N28.下列各组化合物加热时分解产物类型不同的一组是:A. NaNO3、KNO3B. LiNO3、NaNO3C. LiNO3、Mg(NO3)2D. Mg(NO3)2、Cu(NO3)29.下列化合物中,溶解度最大的是:A. LiFB. NaClO4C. KClO4D. K2PtCl410.下列气态分子中,偶极矩不为0的是:A. BCl3B. SiCl4C. PCl5D. SnCl211.1mol下列物质充分溶于1dm3水中,生成的溶液中H+浓度最大的是:A. B2O3B. P4O10C. N2O4D. SO312.熔点分别为102°C和104°C的固体粉末按物质的量1:1混合均匀(未发生化学反应),混合物的熔点应为:A. 低于102°CB. 等于102°CC. 102 ~104°C之间D. 高于104°C13.下列金属中,与HNO3作用产物氧化数最高的是:A. CdB. InC. SnD. Bi14.下列含氧酸中,氧化性最强的是:A. HMnO4B. HClO4C. HBrO4D. H5IO615.pH=3的某一元酸溶液与pH=11的NaOH溶液等体积混合,混合液的pH不可能为:A. 5B. 7C. 9 (此题没有D选项)16.下列硫化物中,不能用HCl溶解的是:A. SnS2B. Sb2S3C. CdSD. As2S317.从海水中提取溴时,海水的酸碱性必须控制在哪个范围:A. 酸性B. 碱性C. 中性D. 无所谓18.下列含氧酸中酸性最强的是:A. H3PO3B. H3BO3C. H2SiO3D. HClO19.实验室中熔化NaOH,应选用哪种坩埚:A. 石英坩埚B. 刚玉坩埚C. 铂坩埚D. 镍坩埚20.常温下以液态形式存在的是:A. HgCl2B. LaCl3C. SnCl4D. AsCl5三、判断题:(每题1分,共10分)1.除了少量不活泼金属和稀有气体外,其它元素与O2化合生成氧化物都是放热的2.对于同族金属元素,如果从上到下金属活泼性降低,则相应氢氧化物碱性也降低3.卤素含氧酸的热稳定性随卤素氧化数增加而提高。
这是因为随着卤素氧化数增加,结合氧原子数增加,增加了含氧酸根的对称性4.用氨水处理HgCl2可以得到[Hg(NH3)4]2+配离子5.卤化硅都能水解,生成硅酸和相应卤化氢6.为防止锡盐水解,可加酸使溶液呈酸性。
若已生成沉淀,也可加酸溶解7.化合物ACl2成直线形,则元素A进行sp杂化8.向CuSO4溶液中滴加KI,可得棕色的CuI沉淀9.Fe3+能够氧化I−,而[Fe(CN)6]3−不能氧化I−,这个实验事实说明,[Fe(CN)6]3−的稳定常数小于[Fe(CN)6]4−的稳定常数10.只用AgNO3,不能区分NaCl、Na2S、K2CrO4、Na2S2O3和Na2HPO4五种物质四、简答题:(每题5分,共30分)1.为何Si-Si键能(222kJ·mol-1)小于C-C键能(346kJ·mol-1),而Si-O键能(452kJ·mol-1)却大于C-O键能(358kJ·mol-1)?2.已知Cu、Ag、Au的I1分别为746、731和890kJ·mol-1,请解释这种随着周期数增加,I1先减后增的现象。
3.以前实验室常用K2Cr2O7和浓H2SO4配制“铬酸洗液”,用于洗去玻璃器皿上难以去除的油污,这是依据什么原理?由于Cr(VI)有剧毒,有人建议用KMnO4代替K2Cr2O7,是否可行?4.溶液中含有Cr3+、Al3+、Zn2+、Cu2+,如何将它们分离开?5.C3H6N6(三聚氰胺)已是家喻户晓的物质了,请根据以下描述,绘制其结构示意图(1) 全部H 都只与N 相连; (2) 所有C 都是sp 2杂化;(3) 分子呈环状,具有高度对称性,也非常稳定。
6. 液态的BrF 5和AsF 5都是不良的电导液,但是它们混合后导电性大为增强。
试解释之。
五、计算题:(每题15分,共30分) 1. 已知Cl 的部分元素电位图,请(1) 计算图中未知电位(2) 根据数据推算HClO 的K өa2. 在生命系统中,酶在很多化学反应中扮演重要角色。
许多酶的催化反应的反应速率可以表示为:v = A [S ]B + [S ],其中A 和B 是常数,S 为反应物。
据推测,这些催化反应可用如下的机理描述:E + Sk 1k ESk 2E + P ,其中E 为酶,其浓度一般远低于反应物S ,P 为最终产物,第二步反应的逆反应可忽略。
请证明,反应机理与反应速率公式吻合,并导出A 和B 的表达式。
第二部分:实验技能(共100分)一、填空题(每空2分)1. 实验室中常用离子交换法制备纯水。
主要过程是待处理水流经(1)树脂柱后,使水中(2)等离子除去。
再经过(3)树脂柱后,使水中(4)等离子除去。
为提高柱子的交换能力及效果,常使用(5)混合交换柱。
φө A /V HClO1.63 Cl 2 Cl - 1.50φө B /V ClO− 0.41 Cl 2 Cl -2.下图为实验化学中常常使用的一些玻璃仪器的示意图。
请写出图中以字母标示的仪器对应的中文规范名称。
A. (6);B. (7);C. (8);D. (9);E. (10);F. (11);G. (12);H.(13)。
3.实验室乙醚往往含有少量过氧化物,蒸馏时应事先除去,否则蒸至末段时有爆炸危险。
其检验方法使用(14)溶液,现象为加入试剂后水相呈(15)色,若有过氧化物存在,可用新配制的(16)溶液除去。
4.重结晶的滤集晶体步骤中常需用新鲜溶剂洗去晶粒表面粘附的母液。
正确的洗涤方法是先(17),再加入少量新鲜溶剂,小心地用刮匙将晶体(18),使溶剂浸润全部晶体,然后(19)。
5.可见分光光度计的常用光源是(20),吸收池材料为(21);紫外分光光度计的常用光源是(22),吸收池材料为(23)。
6.标定EDTA溶液时,若控制pH=5,常选用(24)为金属离子指示剂;若控制pH=10,常选用(25)为金属离子指示剂。
二.简答题(每题10分,共20分。
请尽可能简要回答)1.蒸馏时为什么蒸馏烧瓶中所盛液体的量既不超过其容积的2/3,也不少于1/3?2.分析在普通蒸馏或减压蒸馏中,可用磁力搅拌代替沸石或毛细管的理由。
三.综合题(30分。
请尽可能按要求回答)含硫酸根离子样品的常量分析一般采用基于硫酸钡沉淀的重量法。
某生在对天然芒硝矿物样品的分析中,深感重量法的繁琐与低效率。
经过初步考虑,他提出了基于以下反应和过程的氧化还原容量法,来测定芒硝矿可溶性组分中的硫酸根含量:将样品溶液与草酸钡固体在pH6~9于353~363K下共搅拌,完成沉淀转化BaC 2O 4+SO 4=BaSO 4+C 2O 4=K=812。
过滤除去沉淀,滤液用标准高锰酸钾溶液滴定:2MnO 4-+5C 2O 4=+16H +10CO 2+2Mn 2++8H 2O根据标准高锰酸钾溶液浓度和消耗体积,计算样品中硫酸根含量。
这个方案将重量法测定硫酸根的繁琐程度大大化简。
请你依据上述背景材料并结合你掌握的知识原理,回答下面的问题(注:这些问题之间不存在关联关系,应分别回答):①该生的上述方案是否可行?请说明原因。
②如果上述方案可行,在其按该方案第一次实施的同时,还需要安排什么实验? ③如果上述方案可行,则请列出实施该方案所需要的试剂、材料和仪器条件,并分别注明它们的规格(浓度)、型号。