郑州大学2006年攻读硕士学位研究生入学试题无机化学 B卷答案
- 格式:pdf
- 大小:246.95 KB
- 文档页数:5

北京科技大学成人教育学院2007—2008学年第二学期《无机化学》试题B卷一、填空题:(每空1分,共30分)1、频率越高,活化分子数,反应。
2、H2(g)+I2(g)=2HI(g),Kθ=50.3(713k).某状态下,p氢气=p碘=5.379×105pa,p碘化氢=62.59×105pa.则自发进行的方向是______________,原因是________________。
2、2NH3(g)=N2(g)+3H2(g).298k,△rHθm=+92.22kj·mol-1,△rSθm=+198.53j·mol-1·k-1,则标准状态下,NH3(g)自发分解的温度是_________________。
3、系统命名[CoCl(NH3)3(H2O)2]Cl2为,三羟基.水.乙二胺合铬(Ⅲ)的化学式为。
4、已知基元反应2NO2=2NO+O2,则其速率方式为v= ,反应级数为。
5、当J<Kθsp时,沉淀从溶液中;当J>Kθsp时,平衡移动,沉淀无析出;J=Kθsp时,为饱和溶液,溶液中的离子和沉淀处于状态。
6、自然界中硬度最大的单质是_______________;熔点最高的金属元素是____________.7、往KI和足量KCIO3组成的混合溶液中逐滴加入稀H2SO4,可观察到的现象是_____________。
8、根据"碰撞理论”,反应速率取决于以下3个因素:、_和。
9、在水溶液中,HCIO4与HNO3的酸强度比较,是________,水被称为__________; 在液体CH3COOH中,HCIO4与HNO3的酸强度比较,是_________,,故液态CH3COOH被称为。
10、已知反应1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)2)3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)3)Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)则反应feo(s)+co(g)=fe(s)+co2(g)的恒压反应热计算公式是=____________,其值=___________。
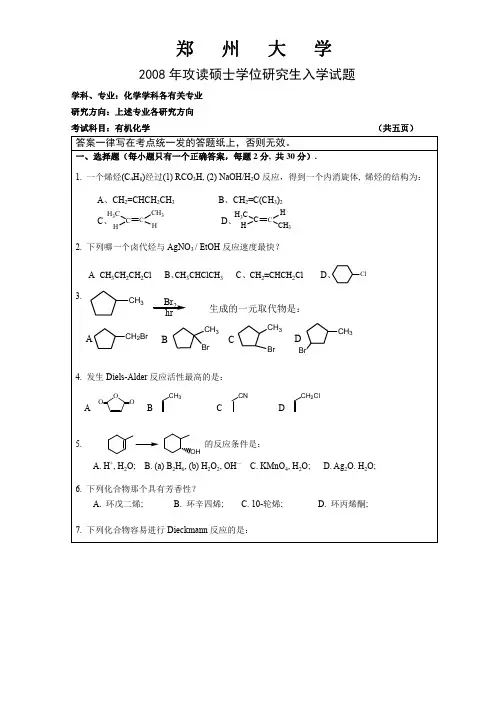


五、如图所示的Cu-Sn二元相图中, 在水平线I、II、VI、V、X上各发生什么三相平衡反应
写出相应的反应式 (5分)
:
四相平衡包共晶反应区应是什么形状? 它的上下方分别与几个三相区相在四相区的上方和下方是否还与两相区或单相区相连? 为什么?
三元相图中的四相平衡共晶反应区和包晶反应区都是三角形, 请说出这两种四相平衡反从液相成分点和相邻相区的情况作比较).
在下图所示的三元相图投影图中会发生什么样的四相平衡反应? 写出反应式
组成这个三元系的三个二元系中分别发生什么样的三相平衡反应?
III点代表的成分在室温下的平衡组织.(15分)
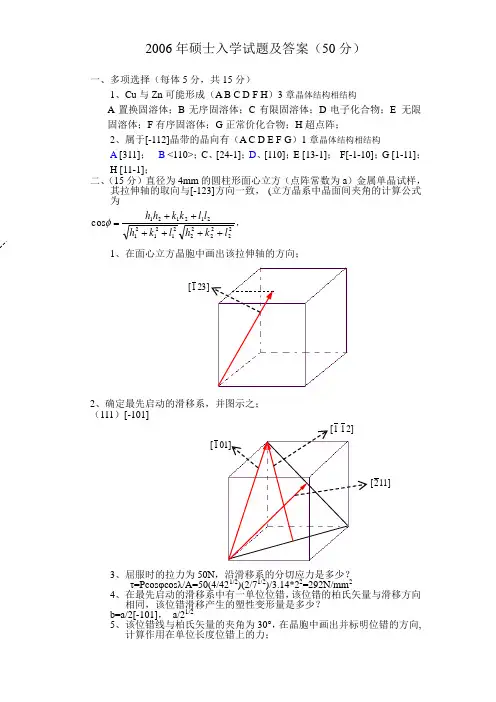
九、假定某面心立方晶体(点阵常数为a)中的活动滑移系为]011)[111(,
、给出引起滑移的单位位错的柏氏矢量,加以说明;
、若引起此滑移的为刃型位错,指明位错线方向及其移动方向;
、若引起此滑移的为螺型位错,指明位错线方向及其移动方向。
(10分)十、铜是工业上常用的一种金属材料,具有导电率高和耐腐蚀性好等优点,但是纯铜的强度较低,经常难以满足要求,根据你所学的知识,提出几种强化铜合金的方法,并说明其强化十一、将经过大量冷塑性变形(例如为70%)的纯铜长棒的一端浸入冰水中,另一端加热至接近熔点的高温(例如0.9T m ),过程持续进行一小时,然后试样完全冷却,试作沿棒长度的硬度分布曲线(示意图),并作简要说明。
(8分)
]101[a 能否与肖克莱不全位错]211[a 相结合形成弗兰克不全位错,若能,写。


郑州大学2005至2006学年第一学期化工原理I期末考试试题B 2005-2006学年第一学期化工原理(I)课程试题(B卷)题号一二三四五六七总分分数合分人:复查人:分数评卷人一、填空题:(每空 1分,共23分)1、因次分析法的依据是。
2、右图示为某塔设备的液封装置,进塔气体压力为80mmHg(表压),为保证正常操作,水封高度h= 。
3、某流体在直管中作层流流动,在流速不变的情况下,管长、管径同时增加一倍,其阻力损失为原来的倍。
4、当喉径与孔径相同时,文丘里流量计的孔流系数C v比孔板流量计的孔流系数C o,文丘里流量计的能量损失比孔板流量计的(大、小)。
5、离心泵的工作点是曲线与曲线的交点。
6、为除去液体中混杂的固体颗粒,在化工生产中可以采用、、等方法(列举三种方法)。
7、间歇过滤机的生产能力可写为Q=V/∑t,∑t表示一个操作循环所需的,∑t等于一个操作循环中,、和项之和。
8、大容积的饱和沸腾传热可分为、和三个阶段,而工业生产中常在阶段操作。
9、管内湍流传热,流体内温度梯度最大的部分是在,原因是。
10、采用多效蒸发器所获得的高的蒸汽经济性是以为代价,因为、。
分数评卷人二、选择题:(每题 2分,共 16 分)1、在完全湍流(阻力平方区)时,粗糙管的摩擦系数λ数值()。
A 与光滑管一样B 只取决于ReC 只取决于相对粗糙度D 与粗糙度无关2、一敞口容器,底部有一进水管(如图示)。
容器内水面保持恒定,管内水流动的速度头为0.5 m水柱。
水由水管进入容器,则2点的表压p2=()水柱。
A 2.0mB 1.5mC 1.0mD 0.75m3、离心泵的调节阀开大时,则()。
A吸入管路的阻力损失不变B泵出口的压强减小C泵入口处真空度减小D泵工作点的扬程升高4、床层的平均空隙率与床层的平均自由截面积在以下条件下相等()。
A颗粒粒度均匀B沿整个横截面上自由截面均匀C沿整个床层高度各截面的自由截面均匀D颗粒的比表面积均匀5、提高回转真空过滤机的转速,其他条件都保持不变时,过滤机的生产能力()。

2006年硕士学位研究生入学考试试题共2页第1页考试科目:微生物学(食品)A一、名词解释(30分)1、菌落2、生长因子3、质粒4、拮抗5、半抗原6、ELISA7、BOD58、Ames试验9、巴斯德效应10、营养缺陷型二、图解题(20分)1、烈性噬菌体与温和性噬菌体的生活史2、营养物质进入细胞的四种运输方式3、暗修复4、大肠杆菌在含有葡萄糖和乳糖的肉汤培养液中的生长曲线三、填空题(20分,答案写在答题纸上)1、影响革兰氏染色结果的因素有、、,革兰氏阳性菌的颜色是色。
2、培养基中大量元素的一般功能为、、、。
3、化能异养微生物在以有机物为基质的生物氧化中,以为最终电子受体时称为无氧呼吸;以为最终电子受体时称为发酵。
共2页第2页4、影响微生物生长的延滞期的因素有、、、。
5、影响微生物耐热力的因素有、、、。
6、平板菌落计数的cfu意指,有效数字有位。
四、是非题(以“+”、“-”表示,共15分,答案写在答题纸上)()1、水中所含的大肠菌群数,等于所含的大肠杆菌数和产气肠细菌数之和。
()2、同一原料的两种样品含菌量分别为10的8次方cfu/ml与10的10次方cfu/ml,在相同温度杀菌所需杀菌时间相同。
()3、饱和氯化钠溶液中不可能有微生物存在。
()4、葡萄糖可作为所有微生物的碳源。
()5、乳酸链球菌素(Nisin)可以抑制革兰氏阴性菌的生长。
五、问答题(75分)1、下述微生物的生态环境如何?设想如何分离它们?(15分)嗜热菌,嗜盐菌,高渗酵母菌,芽孢菌,光合细菌,金黄色葡萄球菌。
2、在食品添加剂和酶制剂中,有相当一部分是来源于微生物的代谢产物,如何使微生物合成比自身需求量更多的产物?举例说明。
(15分)3、检测食品中的大肠菌群指标的意义是什么?通常采用什么方法?现有一种采用革兰氏阳性厌氧菌制成的益生菌活菌产品,该菌可发酵乳糖产酸产气,且能耐受高浓度的胆汁盐,试设计一种检测该产品中的大肠菌群数的方法。
(15分)4、在防止食品腐败变质中,是否可以使用抗生素?为什么?如果使用,所使用的抗生素应具有什么特性?(15分)5、什么是D值?什么是Z值?试以公式说明Z值和D值的关系,并证明该式。

]011[]211[]112[2006年硕士入学试题及答案(50分)一、多项选择(每体5分,共15分)1、Cu 与Zn 可能形成(A B C D F H )3章晶体结构相结构A 置换固溶体;B 无序固溶体;C 有限固溶体;D 电子化合物;E 无限固溶体;F 有序固溶体;G 正常价化合物;H 超点阵;2、属于[-112]晶带的晶向有(A C D E F G )1章晶体结构相结构A [311];B <110>;C 、[24-1];D 、[110];E [13-1]; F[-1-10];G [1-11]; H [11-1];二、(15分)直径为4mm 的圆柱形面心立方(点阵常数为a )金属单晶试样,其拉伸轴的取向与[-123]方向一致, (立方晶系中晶面间夹角的计算公式为222222212121212121cos l k h l k h l l k k h h ++++++=φ,1、在面心立方晶胞中画出该拉伸轴的方向;2、确定最先启动的滑移系,并图示之;(111)[-101]3、屈服时的拉力为50N ,沿滑移系的分切应力是多少?τ=Pcos φcos λ/A=50(4/421/2)(2/71/2)/3.14*22=292N/mm 2 4、在最先启动的滑移系中有一单位位错,该位错的柏氏矢量与滑移方向相同,该位错滑移产生的塑性变形量是多少?b=a/2[-101], a/21/25、该位错线与柏氏矢量的夹角为30°,在晶胞中画出并标明位错的方向,计算作用在单位长度位错上的力; ]231[[11-2]或[-211],f=τb=292*a/21/2四、(8分)相图计算含碳3%的铁碳合金按亚稳定系统冷却到室温后组织中珠光体、二次渗碳体和莱氏体的相对百分含量。
答:在1148℃稍下,莱氏体的相对百分含量=(3-2.11)/(4.3-2.11)*100%=40.6% 含碳2.11%的奥氏体含量=100%-40.6%=59.4%冷到室温后莱氏体变为室温莱氏体,其相对百分含量不变, 奥氏体分解为二次渗碳体与珠光体.二次渗碳体在 2.11%铁碳合金中的含量=(2.11-0.77)/(6.69-0.77)*100%=22.7%所以二次渗碳体的含量=59.4%*22.7%=13.5%珠光体的含量=59.4%-13.5%=45.9%。

2006级普通化学课程试题(B 卷)合分人: 一、填空题:(每空1分,共20分)1. 体系对环境做功,则W _____0,体系从环境吸收热量,则Q _____0。
(填大于或小于)。
2. 热力学中,体系可分为__________、__________、__________三类,而研究对象主要是_______体系。
3. 基元反应2A +B →C 的反应速率方程式v =_____________________。
4. 波函数ψ是描述_____________数学函数式,它和__________是同义词,|ψ|2的物理意义是__________,_________为其形象化表示。
5. 原子序数为24的元素,其原子核外电子排布式为_________________________,未成对电子数为__________。
6. PCl 3(∠ClPCl =101°)中心原子的杂化方式是____________,该分子中有_________个σ键。
7. 根据分子轨道理论,分子轨道是由________________线性组合而成,分子中的电子是在____________中运动,而不属于某个原子。
8. [Co (OH )(C 2O 4)(H 2O )2]的命名是_______________________。
9. 五氰·一羰基合铁(Ⅱ)配离子的化学式是_____________________;二氯化亚硝酸根·三氨·二水合钴(Ⅲ)的化学式是______________________。
1.下列纯态物质中,哪种单质的标准摩尔生成焓等于零?A. 金刚石B. O3C. Hg(g)D. Br2(l)2.自发进行的化学反应,其必要条件是A. ∆S<0B. ∆H<0C. ∆H<T∆SD. ∆G>03.反应N2(g)+O2(g)=2NO(g)的∆r Hөm>0,下列变化中,不影响平衡状态的是A. 升高温度B. 加大N2分压C. 延长反应时间D. 通入O24.反应速率随着温度升高而加快的主要理由是A. 高温下分子碰撞更加频繁B. 反应物分子所产生的压力随温度升高而增大C. 活化能随温度升高而减小D. 高能分子的百分数随温度升高而增加5.为防止配制的SnCl2溶液中Sn2+被氧化,最好的方法是A. 加入Sn粒B. 加入Fe屑C. 通入H2D. 均可6.反应Cu+2Ag+=Cu2++2Ag和½Cu+Ag+=½Cu2++Ag的Eө和∆r Gөm相比A. 分别相等B. Eө不等,∆r Gөm相等C. 分别都不相等D. Eө相等,∆r Gөm不等7.在H2S水溶液中,下面关系是正确的?A. c(H+)=2c(S2-)B. c(H+)=c(HS-)C. c(H+)>c(H2S)D. c(HS-)>c(S2-)8.下面说法不正确...的是A. 在水溶液中能电离的物质都能达到电离平衡B. 同离子效应可以使溶液的pH值增大,也可以使pH值减小C. 盐的水溶液pH=7,表明该盐不发生水解D. 稀释HOAC溶液,解离常数不变,而解离度变大9.已知Kөa (HF)=6.3⨯10-4,Kөa(HCN)=6.2⨯10-10,Kөa(HOAc)=1.76⨯10-5。
