电导法测定弱电解质的电离常数
- 格式:ppt
- 大小:175.50 KB
- 文档页数:15


实验一电导法测定弱电解质的电离平衡常数实验目的:通过电导法测定弱电解质的电离平衡常数,探究电导法测定电离平衡常数的原理和操作方法。
实验原理:弱电解质的电离平衡常数K为:K=α²C/(1-α) (其中,α表示电离度,C表示弱电解质的浓度)。
由于弱电解质的电离度很小,可以近似认为它的电离度是常数。
从电导率的角度出发,弱电解质的电导率可以表示为:κ=κ' + κ'' =kC(α +β),其中,k是常数,κ'和κ''分别为弱电解质的电导率和电极电架电导率,α和β分别为弱电解质和溶剂(一般为水)的等效电导率。
通常实验中只能测量到总电导率,但是可以通过电导率对浓度和电离度的关系进行分析,进而计算出弱电解质的K值。
实验步骤:1.将所需量的KCl、NaCl和HCl等指定量的不同浓度的溶液加入电导池中。
在每次测量前,用去离子水清洗电导池。
2.打开电导计电源开关,选择对应的测量范围,将电导池放入电导计的电极架内。
3.读取电导计显示的电导率值,将其记到实验记录表中。
4.根据所加入的某一种量浓度的水溶液电离平衡常数的已知值,计算α和K值。
将计算结果记录到实验记录表中。
5.重复以上步骤,测定其他浓度水溶液的电导率和计算α和K值。
6.将α和K值以绘制α和C的曲线等形式呈现。
通过分析α和C的曲线,确定弱电解质的电离平衡常数K。
实验注意事项:1.电导池在使用前需清洗,以保证测量结果的准确性。
2.一定要记录所有测量数据,保证测量结果的可重复性。
3.将实验结果以图表等形式呈现,进行分析和论证。
实验结果:所得结果表明,电导法测定弱电解质的电离平衡常数是可靠准确的。
通过实验,还可以得到弱电解质电离度与浓度的变化规律,进一步了解了电解质溶液中的离子平衡关系。

电导法测定弱电解质的电离常数1 电导法测定弱电解质的电离常数姓名:侯芳利班级:化学2班学号:20105051243一、实验目的1.掌握电桥法测量电导的原理和方法;2.测定电解质溶液的当量电导,并计算弱电解质的电离常数。
二、实验原理θAB型(HAc)弱电解质在溶液中电离达到平衡时,电离常数K与浓度c、电离度α有如下关系:θθ2 K= (c/c )* α/(1-α) ( 1)θ在一定温度下K是一个常数,因此可以通过测定醋酸在不同浓度下的电离θ度,代入(1)式计算得到K值。
醋酸溶液的电离度可用电导法来测定。
电导的物理意义是:当导体两端的电势差为1伏特时所通过的电流强度。
亦即电导,电流强度/电势差。
因此电导是电阻的倒数,在电导池中,电导的大小与两极之间的距离l成反比,与电极的面积A成比。
A kG=(,) l2k称为电导率或比电导,即l为1m,A为1m时溶液的电导,因此电导这个值与电导池的结构无关。
电解质溶液的电导率不仅与温度有关,而且还与溶液的浓度有关,因此通常用摩尔电导率这个量值来衡量电解质溶液的导电本领。
摩尔电导率的定义如下:含有1摩尔电解质的溶液,全部置于相距为1m的两个电极之间,这时所具有的电导称为摩尔电导率,摩尔电导率与电导率之间有如下的关系:Λm=k/c-3式中c为溶液中物质的量浓度,单位为mol?m。
c,*m,11c,,,,,2,,K(,)mmm1电桥法是测定电阻的常用方法。
它的原理如图所示。
,是高频(1000Hz)交流电源,,,是均匀且带有刻度的滑线变阻(全长1000)。
G为示波器,R为可,变电阻。
调节电阻R或移动触电D,可使,D两点间点位等于零,因此,,间没, 有电流。
R、R、R均可直接由仪器上读出,由此可计算出R。
12,,RRSX, RR12RRS1R, XR2三、仪器和药品电桥装置、电导电极(1支)、移液管(5 ml 2支)、移液管(10 ml 2支)、移液管(25 ml 2支)、恒温槽(1套)、容量瓶(50ml 5支)、试管(2.2cm*15cm 2支)KCl(化学纯);KCl 0.0100M溶液;HAc(化学纯);HAc 0.01000M溶液;NaCl (化学纯);NaCl 0.0100M溶液;电导水。
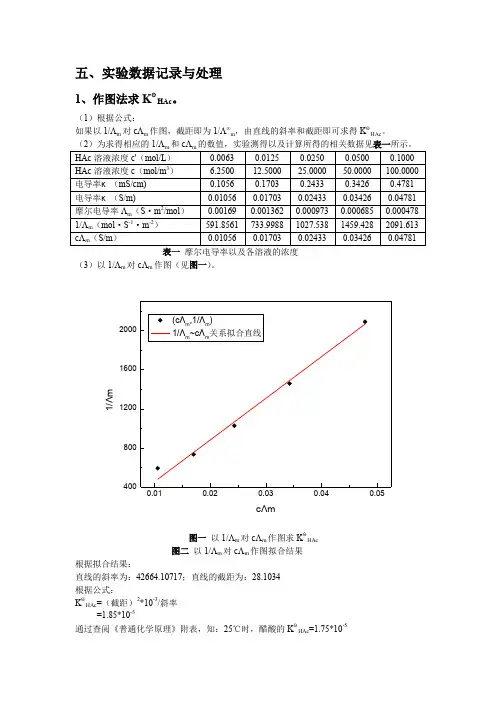
五、实验数据记录与处理1、作图法求K ΘHAc 。
(1)根据公式:如果以1/Λm 对cΛm 作图,截距即为1/Λ∞m ,由直线的斜率和截距即可求得K ΘHAc 。
表一 摩尔电导率以及各溶液的浓度 (3)以1/Λm 对cΛm 作图(见图一)。
1/ΛmcΛm图一 以1/Λm 对cΛm 作图求K ΘHAc 图二 以1/Λm 对cΛm 作图拟合结果 根据拟合结果:直线的斜率为:42664.10717;直线的截距为:28.1034 根据公式: K ΘHAc =(截距)2*10-3/斜率 =1.85*10-5通过查阅《普通化学原理》附表,知:25℃时,醋酸的K ΘHAc =1.75*10-5相对误差:5.71%2、求醋酸的电离度α。
根据弱电解质的电离度与摩尔电导率的关系: 求出五组不同浓度的醋酸溶液的电离度,见表二。
其中25℃下的Λ∞由表三得到。
表二 醋酸溶液的电离度 表三 不同温度下无限稀释的醋酸溶液的摩尔电导率(10S ·m /mol )3、计算法求K ΘHAc根据公式:通过计算的方法求得K Θ,与作图法以及标准值比较,相关数据见表四。
表四 计算的方法求得K HAc根据计算的结果,只有c/16的K ΘHAc 与其他数据相差较大,这与通过作图拟合时的数据一致,通过图一中对无根数据的拟合,可以看出也是c/16的数据点偏离拟合直线比较多,应该是实验误差所致。
4、对第一次实验数据的处理以及处理结果。
注:本次实验我们小组测量了两次,原因是第一次实验测量的数据通过拟合直线虽然斜率是可靠的,但是其截距是负值,这与直线方程的截距物理意义不符合,通过询问前面几组的数据,我们发现用右侧仪器的小组数据都出现了这样一个问题,因此我们决定用另外一个仪器第二次测量。
表五 第一次测量的实验数据及相关计算数值(2)作图法求KΘHAc1/ΛmcΛm图三 第一次实验数据以1/Λm 对cΛm 作图求K ΘHAc 图四 第一次实验数据以1/Λm 对cΛm 作图拟合结果 根据拟合结果:直线的斜率为:36293.42452;直线的截距为:-266.69365 根据公式:因为截距为负值无法加入计算,因此用表三中25℃时的摩尔电导率代入计算:求得K ΘHAc =(1/0.03908)2/斜率=1.80*10-5通过查阅《普通化学原理》附表,知:25℃时,醋酸的K ΘHAc =1.75*10-5 相对误差:2.86%。



实验二 电导法测定弱电解质的电离常数一、实验目的1. 掌握电导测量的原理和方法。
2. 学会使用 DDS-11A 型电导率仪,测定弱电解质电离平衡常数的方法。
二、实验原理AB 型(如HAc )弱电解质在溶液中的电离达到平衡时,HAc= H + + Ac - c(1-αc )cαccαc其电离平衡常数(K c )与浓度(c )、电离度(αc )之间有如下的关系:cc cc K αα-=12(1)在一定温度下K c 是常数,因此可以通过测定AB 型弱电解质在不同浓度时的αc ,代入上式就可以求出K c 。
醋酸溶液的电离度可用电导法测定,溶液的电导用电导率仪测定。
测定溶液的电导,要将被测溶液注入电导池中,如图1所示。
图1 浸入式电导池若两电极间距离为l ,电极的面积为A ,则溶液电导G 为:G=КA/1式中:К为电导率。
电解质溶液的电导率不仅与温度有关,还与溶液的浓度有关。
因此常用摩尔电导m λ来衡量电解质溶液的导电能力。
m λ与К之间的关系为:m λ=10-3К/c式中m λ的单位是S·m 2·mol -1,К的单位为S·m -1,c 的单位为mol·dm -3。
对于弱电解质,电离度αc 等于浓度为c 时的摩尔电导(m λ)和溶液在无限稀释时的摩尔电导(∞m λ )之比,即:∞=mmc λλα (2)将式(2)代入式(1):)(2m m m m cc c K λλλλ-=∞∞ cm κλ=∞∞-⋅=m c m c K cK λκλκ2)(以κ对κc 作图应为一直线,其斜率为2)(∞m c K λ ,截距为)(∞m c K λ ,根据斜率和截距可算出 K c 和∞m λ 。
三、仪器及试剂仪器:恒温装置 1套,DDS-11A 型电导率仪,电导电极,移液管(25 ml 、5 ml 和 1 ml 各 1支),容量瓶(50 ml 5只),250 ml 烧杯1只,洗耳球1只。

实验二 电导法测定弱电解质的电离常数一、目的要求1.了解溶液的电导,电导率和摩尔电导率的基本概念。
2.学时用电导法测定醋酸的电离平衡常数。
3.掌握电导率仪的使用方法。
二、实验关键1.浓度和温度是影响电导的主要因素,故移液管和容量瓶必须清洗干净,浓度配制要准确;测定电导时电极必须与待测溶液同时一起恒温。
2.测电导水的电导时,铂黑电极要用电导水(去离子水)充分冲洗干净,测定中电极不可互换。
三.实验原理电解质溶液是靠正,负离子的迁移来传递电流。
而弱电解质溶液中,只有已电离部分才能承担传递电量的任务。
在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为∞Λm ,而且可用离子极限摩尔电导率相加而得:∞-∞+∞Λ+Λ=Λ , , m m m∞+Λ , m 和∞-Λ , m 分别为无限稀释时的离子电导。
对乙酸在25℃时,∞Λm =349.82+409=390.8 S ·cm 2·mol -1。
一定浓度下的摩尔电导率m Λ与无限稀释的溶液中的摩尔电导率∞Λm 是有差别的。
这是由两个因素造成,一是电解质溶液的不完全离解,二是离子间存在着相互作用力。
所以m Λ通常称为表观摩尔电导率。
根据电离学说,弱电解质的电离度α随溶液的稀释而增大,当浓度c →0时,电离度α→1。
因此在一定温度下,随着溶液浓度的降低,电离度增加,离子数目增加,摩尔电导增加。
在无限稀释的溶液中α→1,m Λ→∞Λm ,故α=∞ΛΛmm 根据电离平衡理论,当醋酸在溶液中达到电离平衡时,其电离常数K 与初始浓度C 及电离度α在电离达到平衡时有如下关系:αα-=12C K 将α=∞ΛΛmm 代入上式,得到 )(2m m m m C K Λ-ΛΛΛ=∞∞ 在一定温度下,由实验测得不同浓度下的m Λ值,由上式可得C m Λ=K ∞Λm 2mΛ1-K ∞Λm 以C m Λ对mΛ1作图得一直线,其斜率为K ∞Λm 2 ,截距为K ∞Λm 。

实验二 电导法测定弱电解质的电离常数一、实验目的1. 掌握电导测量的原理和方法。
2. 学会使用 DDS-11A 型电导率仪,测定弱电解质电离平衡常数的方法。
二、实验原理AB 型(如HAc )弱电解质在溶液中的电离达到平衡时,HAc= H + + Ac - c(1-αc )cαccαc其电离平衡常数(K c )与浓度(c )、电离度(αc )之间有如下的关系:cc cc K αα-=12(1)在一定温度下K c 是常数,因此可以通过测定AB 型弱电解质在不同浓度时的αc ,代入上式就可以求出K c 。
醋酸溶液的电离度可用电导法测定,溶液的电导用电导率仪测定。
测定溶液的电导,要将被测溶液注入电导池中,如图1所示。
图1 浸入式电导池若两电极间距离为l ,电极的面积为A ,则溶液电导G 为:G=КA/1式中:К为电导率。
电解质溶液的电导率不仅与温度有关,还与溶液的浓度有关。
因此常用摩尔电导m λ来衡量电解质溶液的导电能力。
m λ与К之间的关系为:m λ=10-3К/c式中m λ的单位是S·m 2·mol -1,К的单位为S·m -1,c 的单位为mol·dm -3。
对于弱电解质,电离度αc 等于浓度为c 时的摩尔电导(m λ)和溶液在无限稀释时的摩尔电导(∞m λ )之比,即:∞=mmc λλα (2)将式(2)代入式(1):)(2m m m m cc c K λλλλ-=∞∞ cm κλ=∞∞-⋅=m c m c K cK λκλκ2)(以κ对κc 作图应为一直线,其斜率为2)(∞m c K λ ,截距为)(∞m c K λ ,根据斜率和截距可算出 K c 和∞m λ 。
三、仪器及试剂仪器:恒温装置 1套,DDS-11A 型电导率仪,电导电极,移液管(25 ml 、5 ml 和 1 ml 各 1支),容量瓶(50 ml 5只),250 ml 烧杯1只,洗耳球1只。

实验四、电导法测定弱电解质的电离平衡常数1. 实验原理电解质溶液的电导率直接受到溶液中电离物种数目的影响。
弱电解质在水中溶解时,只有一部分分子电离,形成正离子和负离子,其它大部分分子不电离,形成未电离的分子。
其电离反应式可表示为:HA ↔ H+ + A-电离度α用来描述电离的程度,定义为分子中电离出的分子数与总分子数之比,即α = (数量浓度C_A-C_H+)/(数量浓度C_A) ×100%电离度α远小于1,根据电荷平衡原理可知,溶液中H+离子浓度与A-离子浓度相等,即C_H+=C_A-αC_A由于电导率υ与电离物种数成正比,可用电导率推算出弱电解质的电离度α,进而计算出电离平衡常数K。
考虑到氢离子的极性较大,对电导率的影响较大,可采用酸度远小于pH 7的甲酸钠溶液作为载体,同时用玻璃电极进行测量,其中甲酸钠是一种正常盐,不会影响弱电解质的电离平衡,且在化学实验室易得。
实验中测量甲酸钠和弱电解质混合溶液的电导率,从而计算出弱电解质的电离度α,再由α计算K。
2. 实验仪器、试剂和材料(1)仪器:电导仪、电极(包括导电电极和比较电极)、玻璃刻度试管。
(2)试剂:硝酸钾(KNO3)、甲酸钠(NaHCOO)、氯化亚铁(FeCl2)、氯化亚锡(SnCl2)。
(3)材料:去离子水。
3. 实验操作(1)测定甲酸钠溶液的电导率:1)取一个清洁干燥的50mL玻璃容器,称取2 g甲酸钠粉末,用少量去离子水加热溶解,再稀释至刻度线。
2)将电导仪用去离子水冲洗干净,测量该溶液的电导率υ,记录实验数据。
(2)测定弱电解质(C5H5N)的电导率及电离度α:2)将电极插入腐蚀液中并用去离子水冲洗干净,插入干净的电极涂上润湿剂,放入容器中。
4)根据弱电解质的计算公式算出该弱电解质的电离度α。
α = (υ - υ0)/(kυ0) ×100%其中,υ0为甲酸钠溶液的电导率,k为弱电解质的摩尔浓度,该值可由载体溶液的浓度、测量容器体积和弱电解质的摩尔质量计算出来。

电导法测定醋酸电离常数一、实验目得1、了解溶液电导、电导率与摩尔电导率得概念;2、测量电解质溶液得摩尔电导率,并计算弱电解质溶液得电离常数。
二、实验原理电解质溶液就是靠正、负离子得迁移来传递电流。
而弱电解质溶液中,只有已电离部分才能承担传递电量得任务。
在无限稀释得溶液中可以认为电解质已全部电离,此时溶液得摩尔电导率为Λ∞m,而且可用离子极限摩尔电导率相加而得。
一定浓度下得摩尔电导率Λm与无限稀释得溶液中摩尔电导率Λ∞m就是有差别得。
这由两个因素造成,一就是电解质溶液得不完全离解,二就是离子间存在着相互作用力。
所以,Λm通常称为表观摩尔电导率。
Λm/Λ∞m=α(U++ U-)/(U+∞+ U-∞)若U+= U-,,U+∞=U-∞则Λm/Λ∞m=α式中α为电离度。
AB型弱电解质在溶液中电离达到平衡时,电离平衡常数K aө,起始浓度C0,电离度α有以下关系: AB A+ + B-起始浓度mol/L: C00 0平衡浓度mol/L: C0·(1-α) αC0 αC0K cө=[c(A+)/cө][c(B-)/cө]/[c(AB)/cө]=C0α2/(1-α)=C0Λ2/[cөΛ∞m(Λ∞m-Λm)]m根据离子独立定律,Λ∞m可以从离子得无限稀释得摩尔电导率计算出来。
Λm可以从电导率得测定求得,然后求出K aө。
Λm C0/cө =Λ∞m2K cө/Λm-Λ∞m K cө通过Λm C0/cө~1/Λm作图,由直线斜率=Λ∞m2K cө,可求出K cө。
三、仪器与试剂DDS-11A(T)型电导率仪1台;恒温槽1套;0、1000mol/L醋酸溶液。
四、实验步骤1、调整恒温槽温度为25℃±0、3℃。
2、用洗净、烘干得义形管1支,加入20、00mL得0、1000mol/L醋酸溶液,测其电导率。
3、用吸取醋酸得移液管从电导池中吸出10、00mL醋酸溶液弃去,用另一支移液管取10、00mL电导水注入电导池,混合均匀,温度恒定后,测其电导率,如此操作,共稀释4次。
实验十一电导法测定弱电解质的电离常数和难溶盐的溶解度Ⅰ、电导法测定弱电解质的电离常数一、实验目的1.掌握电导法测定弱电解质电离常数的原理。
2.掌握用电导率仪测定醋酸电离常数K的方法。
HAc3.通过实验了解溶液的电导(L)、摩尔电导率(λ)、弱电解质的电离度(α)、电离常数(K)等概念及它们之间的关系。
4.学会使用DDS-1lA型电导率仪。
二、实验原理弱电解质如醋酸,在一般浓度范围内,只有部分电离。
因此有如下电离平衡:+- Ac + H HAc =起始浓度 C 0 0平衡浓度C(1-α) CαCα-+的平衡状态下AcH及α各为HAc、α为电离度,故C(1-α)、C其中C为醋酸的起始浓度,的浓度。
如果溶液是理想的,在一定温度下,可由质量作用定律得到电离常数(K)为:HAc(1)根据电离学说,弱电解质的α随溶液的稀释而增加,当溶液无限稀释时,α→1,即弱电解质趋近于全部电离。
当温度一定时,弱电解质溶液在各种不同浓度时,。
只与在该浓度时所生成的离子数有关,因此可通过测量在该浓度所生成的离子数有关的物理量,如pH值、电导率等来测定α。
本实验是通过测量不同浓度时溶液的电导率来计算α和K值。
1-(欧姆)或S((欧姆),所以电导的单位为Ω西门电导,即电阻的倒数,电阻的单位是Ω成反比,和导体的截面积(A)l)成正比。
)。
对于金属导体,电导(L)的数值和导体的长度(子(2)其中l/A为常数,定义为Q;Lo称为电导率或比电导,其物理意义是长l为lm,截面积A2-1/m或S/m的导体的电导,所以它的单位可以写成Ω。
对于每种金属导体,为lm温度一定,电导率(Lo)是一定的,因此可以用它来衡量金属导体的导电能力。
但是,对于电解质溶液,其导电机制是靠正、负离子的迁移来完成的。
它的电导率,不仅与温度有关,而且与该电解质溶液的浓度有关,所以若用电导率L。
来衡量电解质溶液的导电能力就不合适了。
这样,就提出了摩尔电导率λ的概念。
它的定义是:含有lmol电解质的溶液,全部置于相距为单位距离(SI单位用lm)的两个平行电极之间,该溶液的电导称为摩尔电导率(λ)。
实验四电导法测定弱电解质的电离常数一、实验目的1. 学会用电导法测定醋酸的电离平衡常数;2. 熟悉电导池、电导池常数、溶液电导(或电导率)等相关基本概念;3. 掌握电桥法测量溶液电导的实验方法和技术。
二、实验原理 根据Arrhenius(阿累尼乌斯)的电离理论,弱电解质与强电解质不同,它在溶液中仅部分解离,离子和未解离的分子之间存在着动态平衡。
如醋酸水溶液中,设c为醋酸的原始浓度,αc为解离度,其解离平衡为:式中电导率κ的单位是S·m-1,为测量的电导电极两极片间的间距,A为电极片的截面积,对于一个固定的电导池,l和A都是定值,故比值 l/A 为一常数,称为电池常数Kcell。
所以有 κ=Kcell/R (6) 根据以上关系,只要我们在指定温度下测得不同浓度下的电导率κ(用电导率仪)或溶液的电阻(用1000Hz交流电下的惠斯通电桥测),就可以计算出摩尔电导率∧m,再根据式(3),即可计算出解离常数K来。
本实验我们采用测溶液电阻的方法,先用已知电导率的KCl标准溶液测出那个条件下的特征电阻值RS,算出Kcell;然后使用同一电导池测定待测乙酸溶液的电阻Rx,最后就可以得到解离常数K 因此,实验中必须考虑的是,在增大交流电频率以防极化的同时,还要尽量消除相位差对电桥平衡的影响。
比较好的办法是,选择1000Hz的交流频率,尽可能使电流通过电导池里的溶液电阻而不是寄生电容Cx,从而使电导池上的电压降的相位移动较小,而不至于影响测量精度。
三、仪器和试剂仪器:XD-7型低频信号发生器1台,ZX56型电阻箱1台,SJ8001型示波器1台,恒温水浴1套,260型铂电导电极(镀铂黑)1支,带支管试管4支,25ml移液管1支,容量瓶2只(50ml),小烧杯,洗瓶,导线若干。
试剂:0.01000mol/L KCl溶液,0.1mol/L 左右的HAc溶液(准确浓度c 标于瓶签)。
四、实验步骤1. 调节恒温水浴温度为25.00±0.1℃2. c/2和c/4浓度HAc溶液的配制:用移液管移取25.00ml真实浓度为c(标于瓶签上)的HAc溶液,注入50ml容量瓶中,然后加蒸馏水至刻度并摇匀即成,其真实浓度分别为原溶液浓度的1/2。
电导法测定弱电解质的电离常数实验步骤1.调节恒温水浴温度为25.00±0.1℃首先打开恒温水浴开关,按“回差”键将回差设为0.1。
然后按“”键,使十位数字开始闪动,按“▲”键为增加,按“▼”键为减少,将十位设为“2”;接着再按“”键,使个位数字开始闪动,同上面方法,将个位设为“5”,其余各键均为“0”,再按“”键,使“工作”指示灯亮。
打开加热器开关,先置于强档,当温度与所设温度只差2℃(即23℃)时,将加热器置于弱档。
将水搅拌开关打开置于弱档。
恒温。
2.0.05mol/l和0.025mol/l浓度的醋酸溶液的配制用移液管移取25.00ml0.1mol/l浓度的醋酸溶液,注入50 ml容量瓶中,然后加蒸馏水至满刻度并摇匀即成,其浓度即为原溶液浓度的1/2,即0.05mol/l。
然后用刚配好的0.05mol/l醋酸溶液采取同样方法配制0.025mol/l浓度的醋酸溶液。
3.交流电桥线路的连接(已连好)按图用导线连接电桥线路,低频信号发生器输出频率为1000Hz,滑动变阻器触头置于50Ω处,接通各自电源,观察示波器屏幕,如果出现稳定的正弦波形,说明接线正确,仪器工作状态正常。
4.电导池常数的测定4.1 将电导电极和试管用蒸馏水洗净,然后用少量0.01mol/l的KCl溶液洗3次。
在试管中加入1/4~1/3容积的KCl溶液,插入电导电极,此时液面超过电极铂片1~2厘米。
将试管置于恒温水浴中恒温10分钟以上。
4. 2 将电阻箱的所有档位旋至0处,然后从最大档位(×1000)开始调节,每旋转一格,观察示波器屏幕上的正弦曲线的波幅变化,调至波幅最小为止。
依次调节下一个档位(×100,×10,×1),最终使得屏幕上波幅最小,尽量形成一条直线,这时可认为电桥达到平衡状态,将电阻箱各档位的读数相加,即为电阻箱阻值。
注意:如果从0开始调节某档位旋钮,发现正弦曲线波幅一直增大,说明前一档位调节过大,应将前一档位的数字减少一个,再回头调节该档位。
电导法测定弱电解质的电离平衡常数及数据处理
1. 实验仪器:电导仪、电极、分析天平、pH计等。
2. 实验操作:将一定摩尔浓度的弱电解质(例如醋酸钠)溶于适量纯水中,用pH计或者指示剂调节pH值。
然后,将电导仪的电极分别放入溶液中,测量电导率(记作G)。
接下来,向溶液中加入少量强电解质(例如氯化钠),观察电导率是否有所变化。
如果电导率变化较大,则说明弱电解质降解,需要重新调整pH值。
反之,则可以认为加入的强电解质对电解质平衡产生的影响较小,可以用来计算电离平衡常数。
3. 数据处理:根据碳酸钙-二氧化碳平衡反应:
CaCO3 = Ca2+ + CO32-
可以写出电离平衡式:
因为水的电导率与浓度存在一定的关系,所以需要进行校正。
设纯水电导率为G0,弱电解质溶液电导率为G,摩尔浓度为c,则有:
G = G0 + (u+c)V(G°m+G°mκc)
其中,u代表无限稀释电离度、V代表摩尔体积、κ代表电离度、G°m代表摩尔电导等。
通过实验测定的G、c和G0,可以计算出无限稀释电离度和摩尔电导,从而根据电离平衡式计算得到电离常数。
4. 结果分析:根据实验数据计算得到的电离平衡常数可以用于评估所测定的电解质的强度。
通常情况下,电离平衡常数越大,电解质的强度就越弱。
如果实验数据与理论计算值存在较大偏差,则说明实验设计有误或者实验条件不满足,需要重新进行实验。
总之,电导法是一种简便可靠的测定弱电解质电离平衡常数的方法,可以广泛应用于化学、生物等领域。
电导法测定弱电解质的电离常数Ⅰ、目的要求 一、用电导法测定弱电解质醋酸在水溶液中的解离平衡常数Kc ;二、巩固溶液电导的基本概念及其熟悉DDS-307型电导率仪的使用 Ⅱ、仪器与试剂Ⅲ、实验原理醋酸在水溶液中呈下列平衡:HAc = H + + Ac -c(1-α) c α c α式中c 为醋酸浓度;α为电离度,则电离平衡常数Kc 为:定温下,Kc 为常数,通过测定不同浓度下的电离度就可求得平衡常数Kc 值。
醋酸溶液的电离度可用电导法测定。
溶液的电导用电导率仪测定。
测定溶液的电导,要将被测溶液注入电导池中,如图1-1所示图1 浸入式电导池若两电极间距离为l ,电极的面积为A ,则溶液电导G 为: G =式中: 为电导率。
电解质溶液的电导率不仅与温度有关,还与溶液的浓度有关。
溶液的电导率κ按 ⎪⎭⎫ ⎝⎛==A l G ρκ1式计算。
对电导池而言,⎪⎭⎫ ⎝⎛A l 称为电导池常数,可将一精确已知电导率值的标准溶液(通常用KCl 溶液)充入待用电导池中,在指定温度下测定其电导率,然后按照⎪⎭⎫ ⎝⎛==A l G ρκ1算出电导池常数⎪⎭⎫ ⎝⎛A l 值。
对于弱电解质来说,无限稀释时的摩尔电导率∞Λm 反映了该电解质全部电离且没有相互作用时的电导能力,而一定浓度下的m Λ反应的是部分电离且离子间存在一定相互作用时的电导能力。
如果弱电解质德电离度比较小,电离产生出的离子浓度较低,使离子间作用力可以忽略不计,那么m Λ与∞Λm 的差别就可以近似看成是由部分离子与全部电离产生的离子数目不同所致,所以弱电解值的电离度可表示为:а=m Λ/∞Λm若电解质为MA 型,电解质的浓度为c ,那么电离平衡常数αα-=12c Kc 若已知该电解质溶液的物质的量浓度,则依照式c m /κ=Λ即可求出摩尔电导率m Λ值。
再根据奥斯特瓦尔德(Ostwald )稀释定律。
()m m m m c Kc Λ-ΛΛΛ=∞∞2实验证明,弱电解质的电离度а越小,该式越精确。