利用化学方程式的简单计算典型例题
- 格式:doc
- 大小:45.50 KB
- 文档页数:4
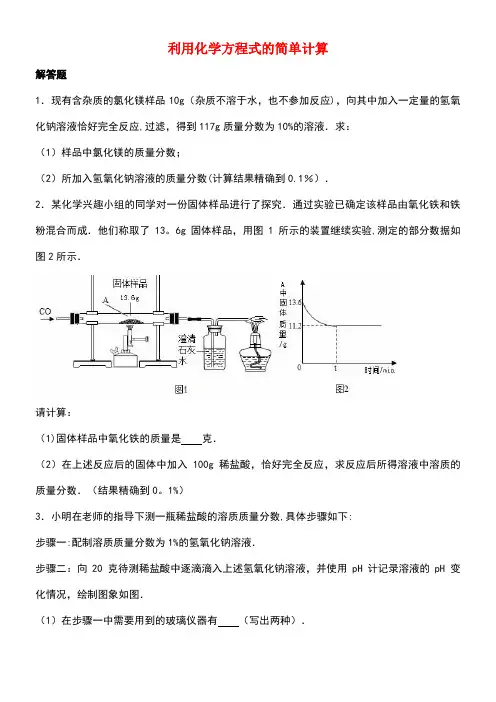
利用化学方程式的简单计算解答题1.现有含杂质的氯化镁样品10g(杂质不溶于水,也不参加反应),向其中加入一定量的氢氧化钠溶液恰好完全反应,过滤,得到117g质量分数为10%的溶液.求:(1)样品中氯化镁的质量分数;(2)所加入氢氧化钠溶液的质量分数(计算结果精确到0.1%).2.某化学兴趣小组的同学对一份固体样品进行了探究.通过实验已确定该样品由氧化铁和铁粉混合而成.他们称取了13。
6g固体样品,用图1所示的装置继续实验,测定的部分数据如图2所示.请计算:(1)固体样品中氧化铁的质量是克.(2)在上述反应后的固体中加入100g稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数.(结果精确到0。
1%)3.小明在老师的指导下测一瓶稀盐酸的溶质质量分数,具体步骤如下:步骤一:配制溶质质量分数为1%的氢氧化钠溶液.步骤二:向20 克待测稀盐酸中逐滴滴入上述氢氧化钠溶液,并使用pH计记录溶液的pH 变化情况,绘制图象如图.(1)在步骤一中需要用到的玻璃仪器有(写出两种).(2)已知发生反应的化学方程式为:NaOH+HCl=NaCl+H2O,请结合图,计算该稀盐酸的溶质质量分数.(结果精确到0.01%)(3)在往稀盐酸中逐渐滴入氢氧化钠溶液的过程中,当溶液的pH达到2时,溶液中的溶质有.(用化学式表示)4.实验室用溶质质量分数为5%的过氧化氢溶液与二氧化锰混合制取氧气.若要制取1。
6g氧气,理论上需要该过氧化氢溶液的质量是多少?(请写出计算过程)5.乙醇俗称酒精,可用作医用消毒,也常作燃料.其完全燃烧的化学方程式可表示为:C2H6O+3O22CO2+3H2O.(1)23g乙醇完全燃烧需消耗多少克氧气?(2)乙醇不完全燃烧会产生一氧化碳,某实验测得反应前后各物质的质量如下表:物质乙醇氧气二氧化碳水一氧化碳反应前质量(g) 4.68.8000反应后质量(g)00 6.65。
4a①表中a的值为.②该实验发生反应的化学方程式为:4C2H6O+11O2 CO2+ H2O+ CO.6.黄铜是由铜、锌组成的合金.为测定某种黄铜中锌的含量,取43.4g这种黄铜和质量分数为19.6%的硫酸溶液100g恰好完全反应,将未反应的铜过滤后得到112.6g溶液.试计算(计算结果保留1位小数)(1)合金中锌的质量分数;(2)反应后所得溶液中溶质的质量分数.7.在回收家电废品时,发现一种含铜和锌的合金.某化学兴趣小组的同学在测定样品中铜的含量时,取该样品25g放入烧杯中,向其中加入105g稀盐酸,恰好完全反应.反应后烧杯中剩余物的总质量为129.8g.请计算:(1)反应产生氢气的质量是g.(2)求样品中铜的质量分数.(写出计算过程)8.盐水选种是我国古代劳动人民发明的一种巧妙的挑选种子的方法.农业生产上常用质量分数15%﹣﹣20%的氯化钠溶液来选种.为了测定某氯化钠溶液是否符合要求,取该溶液70g,加入一定溶质质量分数的AgNO3溶液100g,恰好完全反应【已知:氯化钠溶液和硝酸银溶液反应生成氯化银(AgCl)沉淀和硝酸钠】.过滤分离出沉淀的质量为28。

利用化学方程式的计算一、质量比的计算1.丁酸乙酯(C6H12O2)是无色、具有菠萝香味的液体, 常用作食品、饮料的调香剂。
下列正确的()A.丁酸乙酯是由20个原子构成的B.丁酸乙酯中碳元素的质量分数为27.6%C.丁酸乙酯中碳、氢、氧元素的质量比为18: 3: 8D.一个丁酸乙酯分子中, 碳、氢、氧原子的个数比为3:6:22.电解水得到氢气和氧气的质量比为()A.4: 8B.1: 8C.2: 1D.1: 163.磷在氧气中燃烧生成五氧化二磷的化学反应方程式中磷、氧气、五氧化二磷的质量比是()A.31: 16: 142B.4: 5: 2C.124: 160: 284D.31: 32: 71解析: 体会求物质中各元素质量比和化学方程式中求各物质质量比的区别。
二、“相同质量”的计算4.相同质量的下列各种物质, 经完全分解后, 制得氧气质量最多的是()A.HgOB.KMnO4C.H2OD.H2O25、相同质量的下列物质分别在氧气中完全燃烧, 消耗氧气最多的是()A.CB.H2C.FeD.P解析:设相同质量的各物质质量为1g, 方便计算。
三、过量问题6.4g碳在8g氧气中充分燃烧后, 生成二氧化碳的质量是()A.22gB.44gC.11gD.12g7、16克H2与196克 O2充分反应, 求生成水的质量。
第次以后, 生成氧化镁的质量不再增加。
为什么会出现这种情况?解析: 两个已知量, 莫急于代入计算, 需先判断哪个物质过量有剩余, 应用充分反应的量代入计算。
四、反应前后固体质量减少9、15g氯酸钾和二氧化锰的混合物, 充分加热后剩余10.2g固体物质, 则原混合物中二氧化锰的质量为()A.10.2gB.2.75gC.4.8gD.10g10、实验室用加热10g高锰酸钾的方法制取氧气, 实验完毕, 剩余固体为9.2g, 通过计算确定9.2g固体物质中含有那些物质?它们的质量各是多少?11.为测定某石灰石样品中碳酸钙的含量, 取样品10.0g于烧杯中加入稀盐酸50.0g, 恰好完全反应(杂质不反应), 反应后烧杯中物质的总质量为56.7g。

利用化学方程式的简单计算典型例题例1:(南通市中考)密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:下列说法正确的是( )A.物质C一定是化合物,物质D可能是单质B.反应后密闭容器中A的质量为19.7gC.反应过程中,物质B与物质D变化的质量比为87∶36D.若物质A与物质C的相对分子质量之比为197∶158,则反应中A与C的化学计量数之比为l∶2解读由题中所给的数据可知:C反应后质量没有了,说明是反应物,而B、D反应后质量都增加了,说明是生成物,C反应掉 31.6g,B、D共生成的质量只有11.9g,说明A也生成物,且生成的质量为19.7g,则该反应为分解反应,C一定是化合物,A、B、D可能是化合物,也可能是单质;然后由质量比、相对分子质量比求化学计量数比。
答案:AD例2:(北京市中考)甲醇(CH3OH)是一种有毒、有酒的气味的可燃性液体。
甲醇在氧气中不完全燃烧可发生如下反应:8CH3OH + nO2mCO2 + 2CO + 16H2O。
若反应生成3.6g水,请计算:(1)m值是(2)参加反应的氧气质量是多少克?(写出规范计算步骤)解读此题要求运用质量守恒定律,去确定化学计量数。
质量守恒定律不仅体现在宏观上总质量相等、元素的质量相等,还体现在微观上原子个数相等。
根据碳原子数反应前后相等,8=m+2 ,m=6 ;反应前后氧原子个数为8+2n=6×2+2+16 ,n=11 ,然后根据化学方程式,由生成3.6g水,求参加反应的氧气的质量。
答案:(1)6(2) 8+2n=6×2+2+16 n=11设参加反应的氧气质量为X 8CH 3OH + 11O 26CO 2 + 2CO + 16H 2O11×32 16×18 x 3.6ggx6.318163211=⨯⨯ x=4.4g答:参加反应的氧气为4.4g 。
例3:(江西省中考)化学兴趣小组为了测定某钢铁厂生铁样品中铁的质量分数,在实验室将5.8g 生铁样品放入烧杯中,加入50g 稀硫酸恰好完全反应(杂质不参加反应),反应后称得烧杯中剩余物质的总质量为55.6g 。

化学方程式的计算典型例题1.实验室用3.7 g锌跟足量的盐酸反应,可制氢气和氯化锌各多少克?2.对于反应:X2+3Y2=2Z,可根据质量守恒定律推知下列说法一定错误的是()A.若X2的式量为m,Y2相对分子质量为n,则Z的相对分子质量为(m+3n)B.若m g X2和n g Y2恰好完全反应,则生成(m+n) g ZC.若m g X2完全反应生成n g Z,则同时消耗(m-n) g Y2D. Z的化学式为XY23.反应:A+3B=2C,若7 g A和一定量B完全反应生成8.5 g C,则A、B、C的相对分子质量之比为( )A. 14∶3∶7B. 28∶2∶17C. 1∶3∶2D. 无法确定4.将金属镁和氢氧化镁的混合物在空气中灼烧,混合物的质量在冷却后没有变化,求原混合物中镁元素的质量分数。
[已知:Mg(OH)2MgO+H2O]5.在反应A+2B=C+2D中,已知C和D的相对分子质量之比为22∶9,当6.4 g B与一定量A完全反应,生成3.6 g D,则此反应中A与B的相对分子质量之比是()A. 1∶4B. 4∶1C. 1∶2D. 2∶16.与足量稀硫酸完全反应,制取W g氢气,需消耗金属由多到少的顺序是()A. Mg>Fe>Al>ZnB. Fe>Al>Mg>ZnC. Zn>Fe>Mg>AlD. Al>Fe>Zn>Mg7.把干燥纯净的氯酸钾和二氧化锰的混合物3.45 g装入大试管中,加热制取氧气,待反应完全后,将试管冷却,得到2.49 g固体物质。
计算制得氧气多少克?2.49 g固体物质中含有什么物质?各多少克?8.加热条件下,使足量H2与铜和氧化铁的混合物18.8 g充分反应,冷却后,称量剩余物质的质量为14 g。
求剩余物中铜元素的质量分数。
1. 分析:在化学反应中,反应物与生成物之间的质量比是成正比关系,因此,利用正比例关系,根据化学方程式和已知的一种反应物(或生成物)的质量,可求生成物(或反应物)的质量。


化学方程式的简单计算在化学学科中,方程式是非常重要的概念,涉及到化学反应的基本过程。
化学方程式可以理解为化学反应过程的表达式,它表明了反应中各成分的摩尔比例和化学反应的程度。
化学方程式的表示有一定的规范,一般来说,它包括两部分:反应物和产物。
反应物通常写在左边,而产物则写在右边。
方程式中以箭头表示反应方向,箭头左侧表示反应物,箭头右侧表示产物。
然而,化学方程式的表达并不是简单的写出来,还需要进行一些简单计算。
以下是一些化学方程式的计算例子。
例1:氢气和氧气反应生成水的化学方程式是:H2 + O2 → H2O其中,H2和O2是反应物,H2O是产物。
根据方程式,可知一摩尔的H2和O2可以反应生成一摩尔的H2O。
问题: 20克的H2和20克的O2,可以反应生成多少克的H2O?解答:首先将质量转化为摩尔数。
根据元素的相对原子质量,可以计算出一摩尔的H2的质量为2g,一摩尔的O2的质量为32g。
因此,20克的H2相当于10摩尔,20克的O2相当于0.625摩尔。
根据化学方程式,可知一摩尔的H2可以生成一摩尔的H2O,因此10摩尔的H2可以生成10摩尔的H2O。
而一摩尔的O2可以生成一摩尔的H2O,因此0.625摩尔的O2可以生成0.625摩尔的H2O。
因此,总共可以生成10.625摩尔的H2O,相当于10.625 × (2+16) = 202.5克的H2O。
总结:在化学方程式的计算过程中,需要将质量转化为摩尔数,根据方程式中摩尔比例的关系,计算出反应物可以生成的产物的摩尔数,最后将摩尔数转化为质量即可。
例2:燃烧20克甲烷(CH4)需要多少克氧气(O2)才能完全燃烧?解答:首先可以写出甲烷燃烧的化学方程式:CH4 + 2O2 → CO2 + 2H2O其中,CH4是反应物,O2是反应物,CO2和H2O是产物。
根据化学方程式中的比例关系,一摩尔CH4需要两摩尔O2才能完全燃烧。
因此,20克的CH4相当于0.5摩尔。

第五单元课题3 利用化学方程式的简单计算测试题1.在反应X+2Y====R+2M中,当1.6 g X与Y完全反应后,生成4.4 g R,且反应生成的R和M的质量之比为11∶9,则在此反应中Y和M的质量之比为()A.23∶9 B.16∶9 C.32∶9 D.46∶92.氯酸钾和二氧化锰的混合物共A克,加热完全反应后得到B克氧气和C克氯化钾,则混合物中二氧化锰的质量为()A.(A+B-C)克B.(A-B-C)克C.(A+B+C)克D.(A+C)克3.已知A物质与B物质反应生成C物质,现有12克A与32克B恰好完全反应,则生成C物质的质量是()A.44克B.32克C.22克D.12克4.已知A物质发生分解反应生成B物质和C物质,当一定量的A反应片刻后,生成56克B 和44克C;则实际发生分解的A物质的质量为()A.12克B.44克C.56克D.100克5.只含铜和氧两种元素的固体样品9.0 g,测得铜的质量为8.0 g。
已知铜的氧化物有CuO和Cu2O,下列说法正确的是()A.固体样品的组成只有两种情况B.固体样品一定是CuO与Cu2O的混合物C.固体样品可能是Cu2OD.若固体样品由两种物质组成,则其中一种质量分数为4/96.在2A+B====2C的反应中,1.2 g A完全反应生成2 g C,又知B的式量是32,则C的式量为___________。
7.已知在反应3A+2B====2C+D中,反应物A、B的质量比为3∶4。
当反应生成C和D的质量共140 g时,B消耗的质量为___________g。
8.蜡烛燃烧后的产物有二氧化碳和水,由质量守恒定律可知,石蜡的组成中一定含有_______、_________元素。
(填写元素名称)9.在化学反应3X+4Y====2Z中,已知X和Z的相对分子质量分别是32和102,则Y的相对分子质量为____________。
10.火力发电厂用石灰石泥浆吸收废气中的二氧化硫以防止污染环境,其反应方程式为:2CaCO3(粉末) + 2SO2+ O2====2CaSO4+ 2CO2。
1.化学反应在防治环境污染中扮演了重要角色。
某工厂废气中的 SO2,可用以下方式处理:方式一:2SO2 +O2+2CaO=2CaSO4方式二:2SO2 +O2 +4NaOH= aNa 2SO4 +bH2O回答下列问题:(1) CaSO4中有两种元素的质量分数呈整数倍关系,这两种元素是硫元素和_______ (填元素符号)。
(2) 若用方式二处理 9.6tSO2 ,理论上可生成 Na2SO4的质量是____? (写出计算过程,结果精确到 0.1t)2.某兴趣小组用氯酸钾与二氧化锰的混合物制取氧气,试管中固体的质量随时间变化的数据见下表。
(1) 氯酸钾中钾、氯、氧元素的质量比是_______。
(2) 完全反应后,生成氧气的质量为_______g。
(3) 求混合物中氯酸钾的质量是_______。
(根据化学方程式进行计算) 3.实验室用锌与稀硫酸反应制取氢气。
若有 9.8g 硫酸参加反应,生成氢气的质量是多少? (反应化学方程式:Zn+H2 SO4=ZnSO4+H2个)4.氢气是最理想的燃料,具有放热量高、无污染的优点。
计算:分析表中数据,完成下列问题:(1) 10kg 氢气完全燃烧可生成水的质量是多少?(2) 消耗氧气的质量至少是多少?5.碳酸氢钠固体受热易分解生成一种盐和两种氧化物,反应的化学方程式为______;将 10g 碳酸钠和碳酸氢钠的混合物充分加热至固体的质量不再改变,冷却,称量剩余固体的质量为 6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为______。
6.实验室常用氯酸钾和二氧化锰的混合物制取氧气。
现有氯酸钾和二氧化锰的混合物 50g,完全反应后称量剩余物质的质量为 40.4g。
请计算:(1) 制得氧气的质量为__________。
(2) 混合物中氯酸钾的质量分数。
7.加热氯酸钾和二氧化锰固体混合物来制取氧气时,反应时间和剩余固体质量的关系如图所示。
计算:的质量是___________g。


利用化学方程式的简单计算习题精选(一)1.在一个密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:试推断该密闭容器中发生的化学反应基本类型为()A.分解反应B.化合反应C.置换反应D.氧化反应2.在反应X+2Y=R+2M中,当1.6gX与Y完全反应后,生成44gR,且反应生成的R 和M的质量之比为11︰9,则在此反应中Y和M的质量之比()A.23︰9 B.19.6︰9 C.32︰9 D.46︰93.小林和小明同学在学习合作中讨论:相同质量的下列物质分别在氧气中完全燃烧,哪种物质消耗氧气最多?请你也参与他们的讨论,你认为消耗氧气最多的物质是()A.C B.H2 C.Fe D.P4.为了测定硫酸铜晶体(CuSO4·xH2O)中的x值,将一定质量的这种硫酸铜晶体放入坩埚中,称量、加热、称量、再加热、再称量直至不含结晶水。
(化学反应为:CuSO4·xH2O∆CuSO4+xH2O)实验中得到如下数据:根据表中数据判断,下列结论不正确...的是()A.坩埚质量为19.13g B.硫酸铜晶体的质量为2.48gC.无水硫酸铜的质量为1.59g D.结晶水的质量为0.63g5.在化学反应3X+4Y=2Z中,已知X和Z的相对分子质量分别是32和102,则Y 的相对分子质量为____。
6.已知在反应3A+2B=2C+D中,反应物A、B的质量比为3︰4。
当反应生成C和D 的质量共140g时,消耗B的质量为____g。
7.取铜与氧化铜的混合物共10g,用足量的H2还原后共得到8.4g铜。
原混合物中含氧化铜的质量分数是____。
8.取22.2g石灰石样品,放入盛有126g稀盐酸的烧杯中,石灰石中的碳酸钙与盐酸恰好完全反应(杂质不反应,也不溶解),烧杯内物质质量变为139.4g。
则石灰石中碳酸钙的质量为____。
(提示:CaCO3+2HCl=CaCl2+H2O+CO2↑)9.已知A、B两种物质反应生成C:A+B→C。
1、在C+O 2CO2的反应中,份质量的碳与份质量的氧气反应生成份质量的二氧化碳。
2、水通电分解的化学方程式为。
如果电解3.6g水,则生成氢气的质量为 g,生成氧气的质量为 g。
3、在一密闭容器内盛有20g H2、O2、N2的混合气体,在实验室中某同学误加热此容器,混合气体发生了爆炸,冷却后,测知生成的H2O为18g,请帮助该同学判断一下,剩余气体是4、碳酸氢铵受热分解(NH4HCO 3NH3↑+CO2↑+H2O),生成二氧化碳共4.4g,那么同时生成氨气的质量为()A、7.9gB、1.8gC、1.7gD、3.5g5、一定质量的氢气和氧气的混合气体,点燃后恰好完全反应生成18g水,则原混合气体中氢气与氧气的质量比为()A、1:8B、1:2C、1:6D、1:16、相同质量的下列物质在氧气中完全燃烧消耗氧气最多的是()A、PB、H2C、SD、C7、某有机物在氧气中完全燃烧,生成二氧化碳和水的质量比是22:9,则该有机物的化学式可能是()A、C6H12O6B、CH4C、C2H2D、C2H5OH[21世纪教育网8、在敞口的试管里加热3.16g高锰酸钾,当试管里的固体的质量为3.0g时,剩余的固体残渣含有() A.KMnO4和MnO2 B.KMnO4、MnO2和K2MnO4 C.K2MnO4和MnO2 D.KMnO4和K2MnO49、碳酸氢钠用于焙制糕点,在270℃时分解,化学方程式为2NaHCO 3Na2CO3+H2O+CO2↑。
现取碳酸氢钠16.8g,在敞口容器中加热到质量不再改变为止,减少的质量为()A、4.4gB、8.8gC、10.6gD、6.2g10、金属X的相对原子质量与金属Y的相对原子质量之比为9:8,等质量的X、Y分别跟足量的稀盐酸反应,相同条件下,产生氢气的体积比为4:3,则X、Y两种元素在化合中的化合价依次是()A、+1、+2B、+1、+3C、+3、+2D、+2、+311、一定质量的铜粉和碳粉的混合物,在空气中充分灼烧后其固体与原混合物的质量不变,则原混合物中铜粉和碳粉的质量比为()A、4:1B、2:1C、3:2D、1:112、碳酸氢铵受热分解(NH4HCO 3NH3↑+CO2↑+H2O),生成二氧化碳共4.4g,那么同时生成氨气的质量为()A、7.9gB、1.8gC、1.7gD、3.5g13、 A、B、C三种物质各15 g,它们化合时只能生成30 g新物质D。
典型例题三例 将氢气通过10g 氧化铜粉末,加热一会儿,冷却后剩余固体的质量为8.4g ,计算参加反应的氧化铜的质量分数为多少?选题角度:考查氢气还原氧化铜的反应和根据化学方程式的计算。
思路分析:解法1:由于10g 氧化铜并未完全被还原,故残留8.4g 固体中即有铜又有氧化铜。
设参加反应的氧化铜的质量为x ,然后可分析生成铜的质量,用代数法即可求解。
设参加反应CuO 的质量为x ,则未参加反应的CuO 为)(10g x -;生成铜的质量为g 6.1)g 10(g 4.8-=--x x2H CuO +O H Cu 2+80 64x g 6.1-xg6.16480-=x x 解得 g 8=x 故80%100%10g8g )CuO (=⨯=w解法2:由反应方程式:2H CuO +O H Cu 2+中可知,每一分子CuO 参加反应就可生成一分子Cu ,失去氧,即质量减少16(80-64=16)份质量。
据题意,实际质量减少为 1.6g 8.4g 10g =-,运用“差量法”也可求解。
设参加反应CuO 的质量为x2H CuO +O H Cu 2+ 质量差80 64 80-64x 10g -8.4g8.4g0g 1648080--=x g 816g 6.180=⨯=x 故80%100%10g8g )CuO (=⨯=w 解法3:设生成铜的质量为x ,再分析有关量的关系,也可用代数法解题。
设生成Cu 的质量为x ,则未参加反应的CuO 为(x -8.4g ),而参加反应的CuO的质量为)(8.4g 10g x --,即为)g 6.1(+x2H CuO +O H Cu 2+80 64g 6.1+x xxx 64g 6.180=+ g 4.6=x 而参加反应的CuO 为8g 1.6g 6.4g =+。
所以,80%100%10g8g )CuO (=⨯=w 。
解法4:直接设参加反应的CuO 的质量分数为%x ,再分析各量的关系,用代数法求解。
有关化学方程式的简单计算经典23道1.冶炼100 kg含杂质2%的生铁,需要含氧化铁80%的赤铁矿石的质量为多少?2.一定量含有氯化钠杂质的氢氧化钠样品,加入25 g水充分溶解后,缓慢加入10%的稀盐酸,当溶液的pH=7时,刚好用去稀盐酸的量为36.5 g。
计算样品中氢氧化钠的质量。
3.将527 g稀盐酸加入盛有50 g碳酸钙的烧杯中,恰好完全反应。
计算反应后所得不饱和溶液中溶质的质量分数。
4.[2019河南25(7)题3分]某潜水艇上有100人,如果每人每分钟消耗氧气为0.001 kg,假如所需要的氧气全部由Na2O2与CO2反应来提供,则该潜水艇一天所需要Na2O2的质量是多少?[提示:2Na2O2+2CO2=== 2Na2CO3+O2]5.[2016河南23(5)题3分]工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将某些金属从其氧化物中置换出来。
若用铝与四氧化三铁反应来制取25.2 kg铁,理论上需要消耗铝的质量是多少?6.[2015河南23(5)题3分]铁和钛合金性能优良,广泛用于航空、造船和化学工业中。
工业上常用钠来制取钛,在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛。
若要用该方法制取2.4 kg钛,理论上需要钠的质量是多少?7.[2018河南25(4)题3分]为测定某石灰石样品中碳酸钙的质量分数,称取10 g 石灰石(杂质不参加反应)放入烧杯中,加入100 g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总质量为106.7 g(气体的溶解忽略不计)。
请计算该样品中碳酸钙的质量分数。
8.[2014河南23(4)题3分]某工厂变废为宝,探究用废硫酸等来制取所需产品。
现有废硫酸4.9 t(H2SO4的质量分数为20%),与足量废铁屑反应来制取硫酸亚铁,同时将生成的全部氢气通入足量氧化铜中并加热(H2+CuO =Δ= Cu+H2O),请计算理论上最多可生产铜的质量。
利用化学方程式的简单计算例一:加热分解6.3g高锰酸钾,可以制得氧气的质量是多少?例二:火箭升空至少要携带100kg液氢,充分燃烧才能获得足够的能量。
假如你是长征系列火箭推进器的设计师,你会在火箭助燃仓中填充多少千克的液氧?练习:1、工业上,煅烧石灰石(主要成分是CaCO3)可制得生石灰(CaO)和二氧化碳,如果要制取5.6t氧化钙,需要碳酸钙的质量是多少?生成多少二氧化碳?2、100g氢气可与多少氯气恰好完全反应生成氯化氢呢?例三:锌与盐酸(HCl)反应生成氢气和氯化锌。
实验室用6.5g锌与足量盐酸反应可制得氢气和氯化锌的质量各是多少?例四:45g的镁带在标准状况下与11.2L的氧气(密度为1.43g/L)发生燃烧反应,可以生成多少克氧化镁?例五:某化学兴趣小组的同学为检测石灰石中碳酸钙的含量,他们在实验室用6g石灰石样品(主要成分是CaCO3,杂质不参加反应)与19g稀盐酸(HCl)恰好完全反应(其生成物为CaCl2、水喝二氧化碳),测得残留物的质量为22.8g,求:1、生成二氧化碳的质量多少克?2、样品中碳酸钙的质量分数。
例六:高铁酸钠(Na2FeO4)是一种高效多功能水处理剂,工业上常采用次氯酸钠(NaClO)氧化法生产,反应原理用化学方程式表示为3 NaClO+2Fe(NO3)3+10NaOH==2 Na2FeO4↓+3NaCl+5H2O(1)求高铁酸钠(Na2FeO4)中铁元素和氧元素的质量比。
(2)现要制得830g含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少?练习二:1、将18g高锰酸钾加热,当产生1.6g氧气时,固体剩余物是什么?2、某干燥剂含氧化钙的质量为80%(杂质不吸水),理论上14g干燥剂能吸收水的质量是多少?【有关反应的化学方程式为CaO+H2O==Ca(OH)2】3、加热8gKMnO4一段时间后,称得剩余固体质量为7.4g,则剩余物的组成是什么?。
有关化学方程式的计算 典型例题【例1】将13g 金属混合物粉末投入足量稀硫酸中,产生1g 氢气。
此金属混合物可能的组成的是可能的组成的是[ [ ] A .Fe 和Zn B .Mg 和Zn C .Cu 和Fe D .Zn 和Cu分析:用平均值法。
用平均值法。
Fe Fe Fe、、Zn Zn、、Mg 和稀硫酸反应的化学方程式为:和稀硫酸反应的化学方程式为:M+H 2SO 4==MSO 4+H 2↑ 设混合物金属的平均相对原子质量为x ,则有,则有x ∶2=13∶1 x=26所以组成混合物的两种金属的相对原子质量必然是一个小于2626,另一个大于,另一个大于2626。
铁的相对原子质量是5656,锌的相对原子质量是,锌的相对原子质量是6565,都大于,都大于2626。
铜是不活泼金属,。
铜是不活泼金属,不能和稀硫酸反应生成氢气。
所以应选B 。
答案:B 。
【例2】下列各组物质共热后产生氧气最多的是 [ [ ] A .4g 氯酸钾和2g 二氧化锰二氧化锰 B .2g 氯酸钾和4g 二氧化锰二氧化锰 C .4g 氯酸钾和2g 高锰酸钾高锰酸钾 D .2g 氯酸钾和4g 高锰酸钾高锰酸钾分析:在氯酸钾、在氯酸钾、高锰酸钾和二氧化锰三种物质中,高锰酸钾和二氧化锰三种物质中,高锰酸钾和二氧化锰三种物质中,二氧化锰不能分解放出氧气,二氧化锰不能分解放出氧气,只是对氯酸钾分解放氧气有催化作用。
在A 和B 两组中,由于A 含氯酸钾的质量比B 多,所以A 放氧气的质量比B 多。
多。
在C 和D 两组中,氯酸钾和高锰酸钾都能分解放出氧气,它们的质量关系表示如下:下:从化学方程式可以看出245g 氯酸钾能生成96g 氧气,而245g 高锰酸钾生成氧气的质量不足96g (约为24.8g 24.8g))。
由于C 含氯酸钾比D 多,所以C 生成氧气质量比D 多。
A 和C 相比,虽所含氯酸钾的质量相同,然而C 中的高锰酸钾也能生成氧气,中的高锰酸钾也能生成氧气,A A 中的二氧化锰却不能,所以C 生成氧气比A 多。
利用化学方程式的简单计算典型例题
一、反应物、生成物均为纯净物的计算
例1、工业用电解氧化铝的方法制取单质铝,计算电解10t 氧化铝最多生产多少吨铝
二、反应生、生成物为不纯物的计算
例2、某同学发现养鱼师傅向鱼塘中撒一种微黄色的固体,咨询得知,这种固体的主要成分是过氧化钙(CaO2)是为了解决鱼塘中氧气不足的问题。
他回家后查阅资料,查到过氧化钠与水反应的原理2Na2O2+2H2O=4NaOH+O2,且CaO2与Na2O2的化学性质非常相似。
(1)写出该反应的化学方程式:_____ ______。
)
(2)该同学为测定这种固体中CaO2的质量分数,称取20g样品加入到足量的水中,结果生成氧气(假设样品中其他成分与水不反应)。
请你帮助计算该样品中CaO2的质量分数。
三、涉及巧解的计算
例3、有一种含CaCO
3与CaO的混合物,测得其中钙元素的质量分数为50% ,取该混合物16g
经高温煅烧后,将剩余固体投入足量水中,固体全部溶解生成Ca(OH)
2,则生成Ca(OH)2的质量为()(技巧:元素质量守恒)
A B C D
》
例4、现有200g澄清石灰水,敞口放在空气中一段时间后,发现液面上产生白膜,称量石灰水质量变为,求:生成白膜质量为多少克(技巧:差量法)
将30g氯酸钾和二氧化锰的混合物加热至没有气体放出,称量剩余固体物质质量为,求:原混合物种KClO3质量为多少克(不知道任意一种参加反应物质的质量,不能直接用化学方程式的计算,运用质量守恒定律求。
突破口:生成氧气多少克)
】
四、图表型计算
例5:(南通市中考)密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
D
物质A B…
C
反应前质量/g O.4
反应后质量/g.
待测
下列说法正确的是( )
A.物质C一定是化合物,物质D可能是单质
B.反应后密闭容器中A的质量为
C.反应过程中,物质B与物质D变化的质量比为87∶36
<
D.若物质A与物质C的相对分子质量比为197∶158,则反应中A与C的系数之比为l∶2
例6、某化工厂生产的纯碱产品中常含有少量氯化钠,工厂的化验员对每批产品进行检测,标出各种成份后才能投放市场。
某厂化验员取取样品44g于烧杯中加水将其溶解,然后分几次逐滴加入溶质质量分数为20%的稀盐酸,并不断搅拌,称量,将得到的有关数据记录如下(注:加盐酸时首先发生反应是:Na2CO3 +HCl = NaHCO3 + NaCl ,然后是NaHCO3 + HCl = NaCl + CO2↑+ H2O)
加入稀盐酸质量/g0737*******
200273
、
烧杯中溶液质量/g
(1)加入g稀盐酸开始产生二氧化碳,
最多产生二氧化碳g。
>
(2)计算出44g样品中各成份的质量。
五、图像型计算
例7、某样品由氯化钡和氯化钠组成。
取固体样品,全部溶于水中,
向所得到的混合溶液中逐滴加入溶质质量分数为%的碳酸钠溶液,记
录了如图所示的曲线关系。
3
已知:水的密度为1g/cm
相对分子质量BaCl2:208 Na2CO3:106 BaCO3:197 NaCl:
!
⑴当氯化钡与碳酸钠恰好完全反应时,消耗%的碳酸钠溶液的质量是g。
⑵产品中氯化钠的质量分数是多少
⑶当氯化钡与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少
11、鸡蛋壳的主要成分是碳酸钙。
某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15 g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80 g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所用盐酸刚好消耗了加入量的一半。
试计算(计算结果保留1位小数):
…
(1)产生CO2的质量为__________ g;
(2)该鸡蛋壳中CaCO3的质量分数。
(3)所用稀盐酸中溶质的质量分数。
:
例8、物质A和B可以直接化合生成C。
甲、乙、丙、丁四位同学分别做A和B的化合反应的实验,充分反应后,每个人所用A、B的质量各不相同,但总质量均为9克,有关数据见下
甲乙丙丁
246
]
A物质的质量(g)
B物质的质量(g)5&
3
C物质的质量(g)3
1.现有23克某物质在氧气中完全燃烧后,生成44克CO2和27克H2O,则该物质的有哪些什么,质量比为多少
、
总结:根据化学方程式进行计算的解题提示:
①认真审题,理清思路,确定解题方法,严格按照解题步骤求解
②要正确书写化学方程式,检查反应物、生成物的化学式以及相对分子质量是否正确
③化学方程式表示的是纯净物之间的质量关系,因此应把不纯物质的质量换算成纯净物的质量,把体积换算成质量,方可代入化学方程式计算
④要注意反应中的条件如“充分反应”、“完全反应”、“恰好反应”、“足量”、“过量”等关键性词语,以便作出正确的判断。
练习
1、根据质量守恒定律,6克镁和6克氧气点燃,生成氧化镁质量为()
A.12克B.10克C.24克D.16克
2、1. 3g木炭和5gO2在密闭容器中完全反应,下列叙述正确的是()
A.产物全是CO B.产物全是CO2
C.产物是CO、CO2的混合物D.木炭过量,产物为CO
3、在反应:X+2Y=R+2M中,已知R和M的相对分子质量之比为22﹕9,当1.6克X与一定量Y完全反应后,生成4.4克R,则在此反应中Y与M的质量比为。
4、在反应:X+Y=Z+M中,已知25克X和10克Y恰好完全反应,生成5克Z。
若要生成9克M,则参加反应的Y 质量为克。
5、现有X、Y、Z物质各10克,加热充分反应,反应后的物质中含有16克Z 、8克新物质W 和若干克X,则反应中X和Y的质量比为。
6、碳酸氢钠、碳酸氢钙、碳酸氢铵三种物质中碳元素的质量相同时,所含氢元素的质量比为()
A. 1:1:1
B. 1:2:1
C. 2:1:2
D. 1:1:5
7、将100g含CaCO3质量分数为80%的石灰石样品(杂质不发生化学反应也不含钙),高温灼烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成CaO的质量约为()
A.B.C.D.。