2 STROBE(观察性研究的报告标准)
- 格式:pdf
- 大小:86.75 KB
- 文档页数:2

Meta分析系列之四观察性研究的质量评价工具一、本文概述本文旨在探讨观察性研究的质量评价工具,为研究者提供一套系统、全面的评价框架,以提高观察性研究的可靠性和有效性。
观察性研究作为医学和社会科学领域重要的研究方法,其质量直接影响到研究结果的准确性和可信度。
因此,开发和应用质量评价工具对于提升观察性研究的质量至关重要。
本文将介绍几种常用的观察性研究质量评价工具,包括其评价原理、应用场景、优缺点等方面,并结合实际案例进行分析和讨论。
通过本文的阐述,读者将能够更好地理解和应用这些质量评价工具,以提高观察性研究的水平和质量。
二、观察性研究的基本概念与特点观察性研究,又称为非实验性研究或自然研究,是医学研究中常用的一种方法。
与实验性研究不同,观察性研究不人为地改变研究对象的状态或干预其进程,而是通过观察自然状态下的现象,收集相关数据,以揭示变量之间的关系和规律。
这种方法强调在自然环境中收集数据,减少了对研究对象的干扰,因此其结果往往更加接近真实情况。
自然性:观察性研究在自然环境下进行,研究对象处于自然状态,不受人为干预的影响。
这有助于获得更真实、更贴近实际的数据。
灵活性:观察性研究可以根据研究目的和问题的不同,选择不同的研究对象、观察指标和数据收集方法。
这种灵活性使得观察性研究能够适应各种复杂的研究场景。
广泛性:观察性研究可以涵盖大量的研究对象和多种不同的观察指标,从而提供丰富的数据支持。
这种广泛性有助于揭示变量之间的复杂关系,为深入研究奠定基础。
实时性:观察性研究能够实时跟踪研究对象的变化,及时捕捉各种现象和事件。
这种实时性有助于获取最新的研究数据,为决策提供有力支持。
然而,观察性研究也存在一些局限性。
由于缺乏对研究对象的干预和控制,观察性研究可能受到多种未知因素的影响,导致结果产生偏差。
观察性研究通常需要较长的时间来收集数据,因此耗时较长。
对于某些特定的问题或疾病,观察性研究可能难以获得足够数量和质量的数据支持。

不同类别M E T A分析文献质量评价工具及使用本页仅作为文档封面,使用时可以删除This document is for reference only-rar21year.March不同类别META分析文献质量评价工具sisiyang2015-11-20 14:37:54(一)随机对照试验的质量评价工具:Cochrane风险偏倚评估工具(最常用),PEDro量表,Delphi清单,CASP清单,Jadad量表,Chalmers量表,CONSORT声明(不专用,但可以用)。
(二)观察性研究的质量评价工具:(1)NOS量表(最常用):病例对照研究和队列研究。
(2)CASP清单:病例对照研究和队列研究。
(3)JBI标准:横断面研究;经验总结、案例分析及专家意见。
(4)AHRQ。
(5)Combie横断面研究评价工具。
(6)STROBE声明。
(7)STREGA声明。
(三)非随机对照实验性研究的质量评价工具:MINORS条目,Reisch评价工具,TREND声明。
(四)诊断性研究:QUADAS工具,CASP清单,STARD声明(五)动物试验:STAIR清单,CAMARADES清单,ARRIV指南。
这个就用Cochrane风险偏倚评估工具,主要从6个领域条项目队偏倚风险进行评价,对每条指标采用“低度偏倚风险”、“偏倚风险部确定”、“高度偏倚风险”进行判定:(一)选择偏倚:(1)随机序列产生:详细描述了产生随机分配序列的方法,以便评估组件可比性;(2)分配隐藏:详细描述了隐藏随机分配序列的方法,以便判断干预措施分配情况是否能预知。
(二)实施偏倚:(1)对研究者和受试者施盲:详细描述了对研究者和受试者实施盲法的方法,以防其知晓受试者的干预措施。
提供了判断盲法是否有效的信息。
(三)测量偏倚:(1)研究结果盲法评价:详细描述了对研究结果评价者实施盲法的方法,以防其知晓受试者的干预措施。
提供了判断盲法是否有效的信息。

流行病学观察性研究报告规范———STROBE声明介绍 流行病学观察性研究(strengtheningthereportingofobservationalstudiesinepidemiology,STROBE)是指应用观察法客观地记录某些现象的现状及相关特征,以评估潜在的有害暴露对个体健康或公共卫生的影响、描述疾病或治疗模式的现状、分析某种治疗的罕见或远期副作用、确定疾病致病因素的一类研究。
准确、详实地报道观察性研究的设计、方法、实施及结果对于客观反映论文的学术水平、应用价值及成果推广、利用等具有重要意义。
为了避免在报道观察性研究时重要信息缺失、不全或含混等现象,提高报道质量,2004年,一个由方法学家、科研人员及编辑组成的国际性合作小组成立,并就3种主要的流行病学观察性研究(即队列研究、病例对照研究、横断面研究)的报告内容制定了规范,即STROBE声明。
随着研究的不断深入,工作组经过反复讨论、磋商,于2005年4月、2005年9月、2007年10月对STROBE声明进行了修订,使其更加全面、细致,更具科学性、合理性。
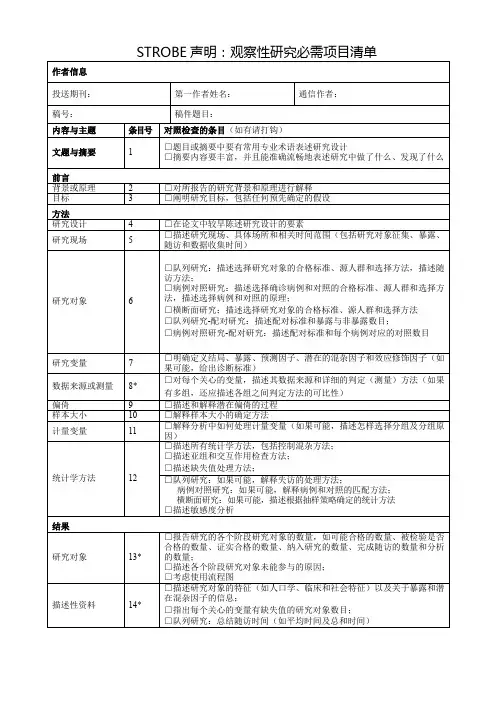
包含22条被认为高质量的报告应写明的项目,具体见表1。
这有利于提高作者撰写观察性研究的质量,帮助评审专家、编辑及读者系统地评价观察性研究报告的价值。
表1 STROBE声明清单条目号描述 项目与主题 文题和摘要1①采用专业术语描述研究类型;②摘要内容丰富,能准确表述研究的方法和结果前言背景和合理性2解释研究的科学背景和依据研究目标3阐明研究目标,包括任何预先确定的假设方法研究设计4描述研究设计的要素研究现场5描述研究现场,包括具体场所和相关时间(研究对象征集、暴露、随访和数据收集时间)研究对象6①队列研究描述研究对象的入选标准、来源和方法,描述随访方法;病例对照研究描述病例和对照的入选标准、来源和方法,描述选择病例和对照的原理;横断面研究描述研究对象的入选标准、来源和方法;②队列研究:配对研究需描述配对标准、暴露与非暴露数量;病例对照研究:配对研究需描述配对标准和与每个病例匹配的对照研究变量7明确界定结局指标、暴露因素、预测指标、潜在混杂因素及效应修饰因子,如有可能应给出诊断标准资料来源与评估8描述每一研究变量的数据来源和详细的测定、评估方法(如有多组,应描述各组之间评估方法的可比性)偏倚9描述潜在的偏倚及消除方法样本量10描述两本量的确定方法定量指标11解释定量指标的分析方法,如有可能应描述如何选择分组及其原因统计学方法12①描述所用统计学方法,包括控制混杂因素的方法;②描述亚组分析和交互作用所用方法;③描述缺失值的处理方法;④如有可能,队列研究应解释失访资料的处理方法;病例对照研究应解释病例和对照的匹配方法;横断面研究应描述根据抽样策略确定的方法;⑤描述敏感性分析方法结果研究对象13①报告各阶段研究对象的数量,包括征集着、接受检验者、检验合格者、纳入研究者、完成随访者和进行分析者的数量;②描述各阶段研究对象退出的原因;③可考虑使用流程图描述性资料14①描述研究对象的特征(如人口学、临床和社会特征)以及暴露因素和潜在混杂因素的信息;②描述各相关变量有缺失值的研究对象数量;③队列研究描述随访时间(如平均随访时间、总随访时间)结局资料15队列研究报告发生结局事件的数量或根据时间总结发生结局事件的数量;病例对照研究报告各暴露类别的数量或暴露的综合指标;横断面研究报告结局事件的数量或总结暴露的测量结果主要结果16①给出未校正和校正混杂因素的关联强度估计值、精确度(如95%CI)。

不同类别M E T A分析文献质量评价工具及使用本页仅作为文档封面,使用时可以删除This document is for reference only-rar21year.March不同类别META分析文献质量评价工具sisiyang2015-11-20 14:37:54(一)随机对照试验的质量评价工具:Cochrane风险偏倚评估工具(最常用),PEDro量表,Delphi清单,CASP清单,Jadad量表,Chalmers量表,CONSORT声明(不专用,但可以用)。
(二)观察性研究的质量评价工具:(1)NOS量表(最常用):病例对照研究和队列研究。
(2)CASP清单:病例对照研究和队列研究。
(3)JBI标准:横断面研究;经验总结、案例分析及专家意见。
(4)AHRQ。
(5)Combie横断面研究评价工具。
(6)STROBE声明。
(7)STREGA声明。
(三)非随机对照实验性研究的质量评价工具:MINORS条目,Reisch评价工具,TREND声明。
(四)诊断性研究:QUADAS工具,CASP清单,STARD声明(五)动物试验:STAIR清单,CAMARADES清单,ARRIV指南。
这个就用Cochrane风险偏倚评估工具,主要从6个领域条项目队偏倚风险进行评价,对每条指标采用“低度偏倚风险”、“偏倚风险部确定”、“高度偏倚风险”进行判定:(一)选择偏倚:(1)随机序列产生:详细描述了产生随机分配序列的方法,以便评估组件可比性;(2)分配隐藏:详细描述了隐藏随机分配序列的方法,以便判断干预措施分配情况是否能预知。
(二)实施偏倚:(1)对研究者和受试者施盲:详细描述了对研究者和受试者实施盲法的方法,以防其知晓受试者的干预措施。
提供了判断盲法是否有效的信息。
(三)测量偏倚:(1)研究结果盲法评价:详细描述了对研究结果评价者实施盲法的方法,以防其知晓受试者的干预措施。
提供了判断盲法是否有效的信息。

继续解读:观察性研究报告规范STROBE声明前一期,我们已对STROBE声明的方法部分做了详细解析,相信大家已了解观察性研究报告的研究设计、研究设置、变量、数据来源、样本大小及统计方法等各方面的规范,本期,我们继续解读STROBE声明的结果部分。
STROBE清单的“结果部分”清单详见下表,主要包括:研究对象、描述性资料、结局资料、主要结果和其他分析等条目。
下面,我们就对每个条目做详细解析。
STROBE清单的“结果部分”Item 13 研究对象1)报告研究各个阶段研究对象的数量,要尽量详细。
➢因为进入研究的人可能不同于研究结果适用的目标人群,导致患病率或发病率的估计值不能反映目标人群的水平;➢例如:母亲生育年龄小和后代患白血病之间的关联,部分原因是有健康孩子的年轻母亲会比有不健康孩子的年轻母亲更少参加这种调查研究。
2)描述各阶段研究对象未能参与的原因,以便读者判断研究人群是否代表目标人群,是否会产生偏倚,例如:➢横断面调查中,所选对象由于与健康无关的原因而不参加研究(如征集信函由于错误的地址而没有邮寄到)会影响估计的精度,但却可能不会产生偏倚。
3)建议使用流程图,例如:Item 14 描述性资料➢描述研究对象的特征(如人口学、临床和社会特征)以及关于暴露和潜在混杂因素的信息以及关于暴露和潜在混杂因子的信息;➢指出每个关心的变量有缺失值的研究对象数目、暴露、潜在混杂因子和患者的其他重要特征,不同程度和原因的失访;➢队列研究总结随访时间,报告随访期限的最大值和最小值或总体分布的百分位数,总随访人年,所获得潜在数据的一些比例指标。
Item 15 结局资料1)报告发生结局事件(队列研究、横断面研究)或暴露类别(病例-对照研究)的数量;2)或根据时间总结发生结局事件的数量。
Item 16 主要结果1)给出未校正的和校正的混杂因素的关联强度估计值、精确度(如95%CI);➢阐明根据哪些混杂因素进行了调整以及选择这些因素的原因;2)当对连续性变量分组时,报告分组界值;3)如有关联,可将有意义时期内的相对危险度转化成绝对危险度。




The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) statement: guidelines for reporting observational studiesErik von Elm, Douglas G Altman, Matthias Egger, Stuart J Pocock, Peter C Gøtzsche, Jan P Vandenbroucke, for the STROBE initiativeMuch biomedical research is observational. The reporting of such research is often inadequate, which hampers the assessment of its strengths and weaknesses and of a study’s generalisability. The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) initiative developed recommendations on what should be included in an accurate and complete report of an observational study. We defi ned the scope of the recommendations to cover thre e main study de signs: cohort, case-control, and cross-se ctional studie s. We conve ne d a 2-day workshop in September, 2004, with methodologists, researchers, and journal editors to draft a checklist of items. This list was subsequently revised during several meetings of the coordinating group and in e-mail discussions with the larger group of STROBE contributors, taking into account e mpirical e vide nce and me thodological conside rations. The workshop and the subsequent iterative process of consultation and revision resulted in a checklist of 22 items (the STROBE statement) that relate to the title, abstract, introduction, methods, results, and discussion sections of articles.18 items are common to all three study designs and four are specifi c for cohort, case-control, or cross-sectional studies.A detailed explanation and elaboration document is published separately and is freely available on the websites of PLoS Medicine, Annals of Internal Medicine, and Epidemiology. We hope that the STROBE statement will contribute to improving the quality of reporting of observational studies.IntroductionMany questions in medical research are investigated in observational studies.1Much of the research into the cause of diseases relies on cohort, case-control, or cross-sectional studies. Observational studies also have a role in research into the benefits and harms of medical interventions.2 Randomised trials cannot answer all important questions about a given intervention. For example, observational studies are more suitable to detect rare or late adverse eff ects of treatments, and are more likely to provide an indication of what is achieved in daily medical practice.3 Research should be reported transparently so that readers can follow what was planned, what was done, what was found, and what conclusions were drawn. The credibility of research depends on a critical assessment by others of the strengths and weaknesses in study design, conduct, and analysis. Transparent reporting is also needed to judge whether and how results can be included in systematic reviews.4,5 However, in published observational research important information is often missing or unclear. An analysis of epidemiological studies published in general medical and specialist journals found that the rationale behind the choice of potential confounding variables was often not reported.6 Only a few reports of case-control studies in psychiatry explained the methods used to identify cases and controls.7 In a survey of longitudinal studies in stroke research, 17 of 49 articles (35%) did not specify the eligibility criteria.8 Others have argued that without sufficient clarity of reporting, the benefi ts of research might be achieved more slowly,9 and that there is a need for guidance in reporting observational studies.10,11 Recommendations on the reporting of research can improve reporting quality. The Consolidated Standards of Reporting Trials (CONSORT) statement was devel-oped in 1996 and revised 5 years later.12 Many medicaljournals supported this initiative,13 which has helped toimprove the quality of reports of randomised trials.14,15Similar initiatives have followed for other researchareas—eg, for the reporting of meta-analyses ofrandomised trials16 or diagnostic studies.17 We estab-lished a network of methodologists, researchers, andjournal editors to develop recommendations for thereporting of observational research: the Strengtheningthe Reporting of Observational Studies in Epidemiology(STROBE) statement.Aims and use of the STROBE statementThe STROBE statement is a checklist of items that shouldbe addressed in articles reporting on the three main studydesigns of analytical epidemiology: cohort, case-control,and cross-sectional studies. The intention is solely toprovide guidance on how to report observational researchwell: these recommendations are not prescriptions fordesigning or conducting studies. Also, while clarity ofreporting is a prerequisite to evaluation, the checklist is notan instrument to evaluate the quality of observationalresearch.Here we present the STROBE statement and explainhow it was developed. In a detailed companion paper, theexplanation and elaboration article,18–20 we justify theinclusion of the different checklist items and givemethodological background and published examples ofwhat we consider transparent reporting. We stronglyrecommend using the STROBE checklist in conjunctionwith the explanatory article, which is available freely on thewebsites of PLoS Medicine (), Annalsof Internal Medicine (), and Epidemiology().Lancet 2007; 370: 1453–57Institute of Social andPreventive Medicine (ISPM),University of Bern, Bern,Switzerland (E von Elm MD,Prof M Egger MD);Centre forStatistics in Medicine,University of Oxford, Oxford,UK (Prof D G Altman DSc);Department of Social Medicine,University of Bristol, Bristol,UK (M Egger);London School ofHygiene and Tropical Medicine,University of London, London,UK (Prof S J Pocock PhD);NordicCochrane Centre, Copenhagen,Denmark (P C Gøtzsche MD);and Department of ClinicalEpidemiology, LeidenUniversity Hospital,Leiden, Netherlands(Prof J P Vandenbroucke MD)Correspondence to:Dr Erik von Elm, Institute ofSocial and Preventive Medicine(ISPM), University of Bern,Finkenhubelweg 11, CH-3012Bern, Switzerlandstrobe@ispm.unibe.chSTROBE StatementSTROBE StatementSTROBE StatementDevelopment of the STROBE statementWe established the STROBE initiative in 2004, obtained funding for a workshop, and set up a website (). We searched textbooks,bibliographic databases, reference lists, and personal fi les for relevant material, including previous recommendations, empirical studies of reporting, and articles describing relevant methodological research. Because observational research makes use of many diff erent study designs, we felt that the scope of STROBE had to be clearly defi ned early on. We decided to focus on the three study designs that are used most widely in analytical observational research: cohort, case-control, and cross-sectional studies.We organised a 2-day workshop in Bristol, UK , in September, 2004. 23 individuals attended this meeting, including editorial staff from Annals of Internal Medicine , BMJ , Bulletin of the World Health Organization , Inter-national Journal of Epidemiology , JAMA , Prev e ntive Medicine , and The Lancet , as well as epidemiologists, methodologists, statisticians, and practitioners from Europe and North America. Written contributions were sought from ten other individuals who declared an interest in contributing to STROBE, but could not attend. Three working groups identifi ed items deemed to be important to include in checklists for each type of study. A provisional list of items prepared in advance (available from our website) was used to facilitate discussions. The three draft checklists were then discussed by all participants and, where possible, items were revised to make them applicable to all three study designs. In a fi nal plenary session, the group decided on the strategy for fi nalising and disseminating the STROBE statement.After the workshop we drafted a combined checklist including all three designs and made it available on our website. We invited participants and additional scientists and editors to comment on this draft checklist. We subsequently published three revisions on the website, and two summaries of comments received and changes made. During this process the coordinating group (ie, the authors of the present paper) met on eight occasions for 1 or 2 days and held several telephone conferences to revise the checklist and to prepare the present paper and the explanation and elaboration paper.18–20 The coordinating group invited three additional co-authors with method o logical and editorial expertise to help write the explanation and elaboration paper, and sought feedback from more than 30 people, who are listed at the end of this paper. We allowed several weeks for comments on subsequent drafts of the paper and reminded collaborators about deadlines by e-mail.STROBE componentsThe STROBE statement is a checklist of 22 items that we consider essential for good reporting of observational studies (table). These items relate to the article’s title and abstract (item 1), the introduction (items 2 and 3), methods (items 4–12), results (items 13–17), anddiscussion sections (items 18–21), and other information(item 22 on funding). 18 items are common to all three designs, while four (items 6, 12, 14, and 15) are design-specific, with diff erent versions for all or part of the item. For some items (indicated by asterisks), information should be given separately for cases and controls in case-control studies, or exposed and unexposed groups in cohort and cross-sectional studies. Although presented here as a single checklist, separate checklists are available for each of the three study designs on the STROBE website.Implications and limitationsThe STROBE statement was developed to assist authors when writing up analytical observational studies, to support editors and reviewers when considering such articles for publication, and to help readers when critically appraising published articles. We developed the checklist through an open process, taking into account the experience gained with previous initiatives, in particular CONSORT . We reviewed the relevant empirical evidence as well as methodological work, and subjected consec-utive drafts to an extensive iterative process of consultation. The checklist presented here is thus based on input from a large number of individuals with diverse back-grounds and perspectives. The comprehensive explana t oryarticle,18–20which is intended for use alongside the check-list, also benefi ted greatly from this consultation process.Observational studies serve a wide range of purposes, on a continuum from the discovery of new fi ndings to the confi rmation or refutation of previous fi ndings.18–20 Some studies are essentially exploratory and raise interesting hypotheses. Others pursue clearly defi ned hypotheses in available data. In yet another type of studies, the collection of new data is planned carefully on the basis of an existing hypothesis. We believe the present checklist can be useful for all these studies, since the readers always need to know what was planned (and what was not), what was done, what was found, and what the results mean. We acknowledge that STROBE is currently limited to three main observational study designs. We would welcome extensions that adapt the checklist to other designs—eg, case-crossover studies or ecologicalstudies—and also to specific topic areas. Four extensions are now available for the CONSORT statement.21–24 A fi rst extension to STROBE is underway for gene-disease association studies: the STROBE Extension to Genetic Association studies (STREGA) initiative.25 We ask those who aim to develop extensions of the STROBE statement to contact the coordinating group fi rst to avoid duplicationof eff ort.The STROBE statement should not be interpreted as an attempt to prescribe the reporting of observational research in a rigid format. The checklist items should be addressedin sufficient detail and with clarity somewhere in an article, but the order and format for presenting informationFor more on theSTROBE initiative see STROBE Statementdepends on author preferences, journal style, and the traditions of the research fi eld. For instance, we discuss the reporting of results under a number of separate items, while recognising that authors might address several items within a single section of text or in a table. Also, item 22, on the source of funding and the role of funders, could be addressed in an appendix or in the methods section of the article. We do not aim at standardising reporting. Authors of randomised clinical trials were asked by an editor of a specialist medical journal to “CONSORT” their manuscripts on submission.26 We believe that manuscripts should not be “STROBEd”, in the sense of regulating style or terminology. We encourage authors to use narrative elements, including the description of illustrative cases, to complement the essential information about their study, and to make their articles an interesting read.27We emphasise that the STROBE statement was not developed as a tool for assessing the quality of published observational research. Such instruments have been developed by other groups and were the subject of a recent systematic review.28 In the explanation and elaboration paper, we used several examples of good reporting from studies whose results were not confi rmed in further research—the important feature was the good reporting, not whether the research was of good quality. However, if STROBE is adopted by authors and journals, issues such as confounding, bias, and generalisability could become more transparent, which might help temper the over-enthusiastic reporting of new fi ndings in the scientific community and popular media,29 and improve the methodology of studies in the long term. Better reporting may also help to have more informed decisions about when new studies are needed, and what they should address.We did not undertake a comprehensive systematic review for each of the checklist items and subitems, or do our own research to fi ll gaps in the evidence base. Further, although no one was excluded from the process, the composition of the group of contributors was infl uenced by existing networks and was not representative in terms of geography (it was dominated by contributors from Europe and North America) and probably was not representative in terms of research interests and disciplines. We stress that STROBE and other recommendations on the reporting of research should be seen as evolving documents that require continual assessment, refinement, and, if necessary, change. We welcome suggestions for the further dissemination of STROBE—eg, by re-publication of the present article in specialist journals and in journals published in other languages. Groups or individuals who intend to translate the checklist to other languages should consult the coordinating group beforehand. We will revise the checklist in the future, taking into account comments, criticism, new evidence, and experience from its use. We invite readers to submit their comments via the STROBE website.ContributorsThe following individuals have contributed to the content and elaboration of the STROBE statement: Douglas G Altman,Maria Blettner, Paolo Boff etta, Hermann Brenner, Geneviève Chêne, Cyrus Cooper, George Davey-Smith, Erik von Elm, Matthias Egger, France Gagnon, Peter C Gøtzsche, Philip Greenland, Sander Greenland, Claire Infante-Rivard, John Ioannidis, Astrid James, Giselle Jones, Bruno Ledergerber, Julian Little, Margaret May, David Moher,Hooman Momen, Alfredo Morabia, Hal Morgenstern,Cynthia D Mulrow, Fred Paccaud, Stuart J Pocock, Charles Poole, Martin Röösli, Dietrich Rothenbacher, Kenneth Rothman,Caroline Sabin, Willi Sauerbrei, Lale Say, James J Schlesselman, Jonathan Sterne, Holly Syddall, Jan P Vandenbroucke, Ian White, Susan Wieland, Hywel Williams, Guang Yong Zou.Confl ict of interest statementWe declare that we have no confl ict of interest.AcknowledgmentsThe workshop was funded by the European Science Foundation (ESF). Additional funding was received from the Medical Research Council Health Services Research Collaboration, and the National Health Services Research and Development Methodology Programme. We are grateful to Gerd Antes, Kay Dickersin, Shah Ebrahim, andRichard Lilford for supporting the STROBE initiative. We are grateful to the following institutions that have hosted working meetings of the coordinating group: Institute of Social and Preventive Medicine (ISPM), University of Bern, Bern, Switzerland; Department of Social Medicine, University of Bristol, Bristol, UK; London School of Hygiene and Tropical Medicine, London, UK; Nordic Cochrane Centre, Copenhagen, Denmark; and Centre for Statistics in Medicine, Oxford, UK. We are grateful to six reviewers who provided helpful comments on a previous draft of this paper.References1 Glasziou P, Vandenbroucke JP, Chalmers I. Assessing the quality ofresearch. BMJ 2004; 328: 39–41.2 Black N. Why we need observational studies to evaluate theeff ectiveness of health care. BMJ 1996; 312: 1215–18.3 Papanikolaou PN, Christidi GD, Ioannidis JP. Comparison ofevidence on harms of medical interventions in randomized andnonrandomized studies. CMAJ 2006; 174: 635–41.4 Jüni P, Altman DG, Egger M. Systematic reviews in health care:assessing the quality of controlled clinical trials. BMJ 2001; 323:42–46.5 Egger M, Schneider M, Davey Smith G. Spurious precision?Meta-analysis of observational studies. BMJ 1998; 316: 140–44.6 Pocock SJ, Collier TJ, Dandreo KJ, et al. Issues in the reporting ofepidemiological studies: a survey of recent practice. BMJ 2004; 329: 883.7 Lee W, Bindman J, Ford T, et al. Bias in psychiatric case-controlstudies: literature survey. Br J Psychiatry 2007; 190: 204–09.8 Tooth L, Ware R, Bain C, Purdie DM, Dobson A. Quality ofreporting of observational longitudinal research. Am J Epidemiol2005; 161: 280–88.9 Bogardus ST Jr, Concato J, Feinstein AR. Clinical epidemiologicalquality in molecular genetic research: the need for methodological standards. JAMA 1999; 281: 1919–26.10 Anon. Guidelines for documentation of epidemiologic studies.Epidemiology Work Group of the Interagency Regulatory LiaisonGroup. Am J Epidemiol 1981; 114: 609–13.11 Rennie D. CONSORT revised – improving the reporting ofrandomized trials. JAMA 2001; 285: 2006–07.12 Moher D, Schulz KF, Altman DG. The CONSORT statement:revised recommendations for improving the quality of reports ofparallel-group randomised trials. Lancet 2001; 357: 1191–94.13 Moher D, Altman DG, Schulz KF, Elbourne DR. Opportunities andchallenges for improving the quality of reporting clinical research: CONSORT and beyond. CMAJ 2004; 171: 349–50.14 Plint AC, Moher D, Morrison A, et al. Does the CONSORT checklistimprove the quality of reports of randomised controlled trials? Asystematic review. Med J Aust 2006; 185: 263–67.15 Egger M, Jüni P, Bartlett C. Value of fl ow diagrams in reports ofrandomized controlled trials. JAMA 2001; 285: 1996–99.STROBE Statement16 Moher D, Cook DJ, Eastwood S, Olkin I, Rennie D, Stroup DF.Improving the quality of reports of meta-analyses of randomisedcontrolled trials: the QUOROM statement. Quality of Reporting of Meta-analyses. Lancet 1999; 354: 1896–900.17 Bossuyt PM, Reitsma JB, Bruns DE, et al. Towards complete andaccurate reporting of studies of diagnostic accuracy: The STARDInitiative. Ann Intern Med 2003; 138: 40–44.18 Vandenbroucke JP, von Elm E, Altman DG, et al, for the STROBEinitiative. Strengthening the Reporting of Observational Studies in Epidemiology (STROBE): explanation and elaboration. PLoS Med2007; 4: e297.19 Vandenbroucke JP, von Elm E, Altman DG, et al, for the STROBEinitiative. Strengthening the Reporting of Observational Studies in Epidemiology (STROBE): explanation and elaboration. Ann Intern Med (in press).20 Vandenbroucke JP von Elm E, Altman DG, et al, for the STROBEinitiative. Strengthening the Reporting of Observational Studies in Epidemiology (STROBE): explanation and elaboration. Epidemiology (in press).21 Ioannidis JP, Evans SJ, Gotzsche PC, et al. Better reporting ofharms in randomized trials: an extension of the CONSORTstatement. Ann Intern Med 2004; 141: 781–88.22 Campbell MK, Elbourne DR, Altman DG. CONSORT statement:extension to cluster randomised trials. BMJ 2004; 328: 702–08.23 Piaggio G, Elbourne DR, Altman DG, Pocock SJ, Evans SJ.Reporting of noninferiority and equivalence randomized trials: an extension of the CONSORT statement. JAMA 2006; 295: 1152–60. 24 Gagnier JJ, Boon H, Rochon P, Moher D, Barnes J, Bombardier C.Reporting randomized, controlled trials of herbal interventions: an elaborated CONSORT statement. Ann Intern Med 2006; 144: 364–67.25 Ioannidis JP, Gwinn M, Little J, et al. A road map for effi cient andreliable human genome epidemiology. Nat Genet 2006; 38: 3–5.26 Ormerod AD. CONSORT your submissions: an update for authors.Br J Dermatol 2001; 145: 378–79.27 Schriger DL. Suggestions for improving the reporting of clinicalresearch: the role of narrative. Ann Emerg Med 2005; 45: 437–43.28 Sanderson S, Tatt ID, Higgins JP. Tools for assessing quality andsusceptibility to bias in observational studies in epidemiology: asystematic review and annotated bibliography. Int J Epidemiol 2007;36: 666–76.29 Bartlett C, Sterne J, Egger M. What is newsworthy? Longitudinalstudy of the reporting of medical research in two Britishnewspapers. BMJ 2002; 325: 81–84.© 2007 The Authors。

临床脓毒症亚型的治疗时间和死亡率摘要背景脓毒症是常见的、致命和异质性的一类疾病。
先前对纽约州脓毒症和脓毒症休克患者的分析显示,及时的抗生素使用和捆绑护理完成之间存在风险调整相关性,但与静脉推注液体无关,与院内死亡率降低有关。
然而,目前尚不清楚临床上可识别的脓毒症亚型是否改变了这些关联。
方法对2015年1月1日至2016年12月31日在纽约州卫生部队列研究的脓毒症和脓毒症休克患者的二次分析。
采用急诊CAre 分型(SENECA)方法将患者分为临床脓毒症亚型(a、B、Y、3型)。
暴露变量包括3小时脓毒症集束完成的时间、抗生素使用和静脉注射输液完成。
然后,逻辑回归模型评估了暴露、临床脓毒症亚型和院内死亡率之间的相互作用。
结果来自155家医院的55,169名住院患者(34% α ,30% B, 19% Y ,17% δ )。
a亚型的住院死亡率最低(N=I905,10%), δ亚型的住院死亡率最高(N=3776,41%)。
完成3小时的集束化治疗(aOR, 1.04 [95%CI, 1.02 - 1.05])和抗生素启动治疗后每1小时(aOR, 1.03 [95%CI, 1.02- 1.04])与风险调整后的住院死亡率增加相关。
不同亚型之间的关联也有所不同(p-interactions<0.05)。
例如,与α 亚型(aOR, 1.02 [95%CI, 0.99 —L04])相比,δ 亚型(aOR, 1.07[95%CI, 1.05 - 1,10]) 中3小时束完成时间的结果相关性更大。
静脉推注液体的时间与风险调整后的院内死亡率无关(aOR, 0.99 [95%CI,0.97 - 1.01]),并且在亚型之间没有差异(p-interactions=0.41)结论及时完成3小时脓毒症束治疗和开始抗生素治疗与风险调整后的院内死亡率降低相关,这种关联因临床可识别的脓毒症亚型而改变。
关键词脓毒症,亚型,精准医疗,抗生素介绍脓毒症是一种宿主对感染的反应失调,会导致危及生命的器官功能障碍,每年造成全球数百万人死亡。
consort2010 版是指医学研究报告共同规范,是一种用于指导进行随机对照试验(RCT)的报告的准则。
它是为了提高文献报告的透明度和质量而制定的,旨在帮助研究人员全面地、准确地报告他们的研究,从而使读者能够更好地理解和评价报道的研究结果。
consort2010版准则已被广泛使用,并得到了持续的更新和完善。
在 consor2010版准则中,主要包括以下内容:一、Title and abstract(标题和摘要):1. 标题的准确描述研究的目的和方法,同时应当包括随机对照试验的相关信息;2. 摘要应当简明扼要地概括研究的目的、方法、主要结果和结论,以便读者能够快速了解研究的主要内容。
二、Introduction(概述):1. 概述部分应当清晰地陈述研究的背景和目的,以及研究的重要性;2. 应当阐明研究假设和研究问题,并澄清研究对象的选择标准。
三、Methods(方法):1. 描述实验设计的详细信息,包括实验对象、样本规模、随机分配、盲法等;2. 描述干预措施或治疗措施的详细信息,包括治疗方案、药物剂量等;3. 描述结果的测量方法和评价标准,包括主要终点和次要终点;4. 描述统计分析的方法,包括样本容量、数据处理等。
四、Results(结果):1. 描述实验的主要结果,包括主要终点和次要终点的数据;2. 描述实验中的不良事件和副作用,以及其发生的频率和严重程度。
五、Discussion(讨论):1. 讨论结果的可靠性,包括实验设计的合理性、偏倚控制、结果的一致性等;2. 订正偏向、展望未来,提出改进研究的建议。
六、Other information(其他信息):1. 在结果报告中应当包含完整的实验数据,以便读者能够进行验证和重复实验;2. 应当附录参与研究的研究人员和机构的信息。
consort2010版准则旨在提高医学研究报告的透明度和准确性,使读者能够更好地理解和评价报道的研究结果。
通过遵循这一准则,研究人员可以更好地透露他们的研究设计、实施和结果,从而提高了科学研究的信誉度和可靠性。
姓名:郭进挺学号:20131031231 班级:13社工二班STROBE规范:横断面研究报告项目清单条目建议题目与摘要1(a)表明在标题或摘要中常用的一个术语研究设计;(b)在摘要中对所做工作和获得的结果做一个简要的总结。
前言部分背景/理由:2说明调查报告的科学背景和理论基础。
目标:3 解释的具体目标,包括任何预先的假设。
方法部分研究设计:4尽早陈述研究设计的关键内容。
设置:5描述研究机构,即研究地点及相关资料,包括招募患者的时间范围(起止时间),暴露,随访和数据收集等。
参与者:6(a) 给出纳入标准,病例和对照的来源及确认病例和选择对照的方法,病例和对照选择原理;(b)如果是配对设计,应说明配对标准和每个病例配对的对照数。
变量:7明确定义结局、暴露、预测因子、可能的混杂因素及效应修饰因素,如果相关,给出诊断标准。
数据来源/测量:8*对每个有意义的变量,给出数据来源和详细的测量方法,如果有一个以上的组,描述各组之间测量方法的可比性。
偏见:9描述解决潜在偏倚的方法。
研究尺寸:10描述样本量确定的方法。
定量变量:11解释定量变量是如何分析的,如果相关,描述分组的方法。
和原因。
统计方法:12(a) 描述所用的所有统计方法,包括减少混杂因素的方法;(b)描述所有分析亚组和交互作用的方法;(c)解释如何解决数据缺失;(d) 如果相关,描述如何对病例和对照进行配对;(e) 描述所有的敏感性分析方法。
结果部分参与者:13*(a)报告研究各阶段参与的人数,如可能合格的人数,参与合各性检查的人数,证实各格的人数,纳入研究的人数,完成随访的人数及完成分析的人数;(b) 解释在各阶段参与者退出研究的原因;(c) 建议使用流程图。
描述数据:14*(a)描述参与者的特征(人口学特征,临床与社会特征)以及暴露和潜在混杂因素的相关信息;(b) 描述每一个待测变量而言,缺失的数据的参与者人数。
结果数据:15*报告各种暴露类别的人数或暴露综合指标主要结果:16(a)报告未校正的估计值。
sci写作标准strobe
STROBE是一种用于观察性研究的报告标准,其全称为Strengthening the Reporting of Observational Studies in Epidemiology。
STROBE标准旨在提高观察性研究报告的透明度和质量,使读者更容易评估研究的可信度和适用性。
STROBE标准包括了
研究设计、样本选择、变量、数据源、偏倚、统计方法等方面的报
告要求。
首先,STROBE标准要求研究报告应清晰地描述研究的背景和目的,包括研究设计、参与者招募和纳入标准等信息。
此外,研究报
告还应包括研究中使用的变量和测量方法,以及数据收集和处理过
程的详细描述。
其次,STROBE标准要求研究报告应对可能存在的偏倚进行全面
的讨论,包括选择偏倚、信息偏倚和混杂等,以及采取的控制措施。
此外,研究报告还应对统计方法进行清晰的描述,包括分析方法、
结果的解释和可能的限制等方面。
最后,STROBE标准还要求研究报告应包括对研究结果的全面呈现,包括主要结果和次要结果,以及对结果的解释和可能的影响因
素进行讨论。
总的来说,STROBE标准对观察性研究的报告提出了全面的要求,旨在提高研究报告的透明度和质量,使读者能够更好地评估研究的
可信度和适用性。
符合STROBE标准的研究报告能够为科学研究提供
更可靠的证据,促进科学知识的积累和传播。
2. STROBE(观察性研究的报告标准)项目条目队列研究病例对照研究横断面题目和摘要 1 ①在题目和摘要中 确定是 确定是确定队列研究 病例对照研究 横断面研究②摘要是结构式的对文章内容的高度总结,应包括以下各项目引言背景 2 解释其科学背景及研究的理由目的 3 目的和假设方法研究设计 4 陈述设计中主要因素研究场所 5 陈述研究场所,收集资料的时间、地点、周期参加者 6 入选和排除标准 对病例和对照分别 入选及排除选择参加者的来源和方法 给出入选和排除标准 标准,说明分别描述暴露和非暴露 选择病例与对照的 参加者的来列出随访时间 来源和方法。
源和方法病例组有确切的诊断标准选择对照的合理性,配对研究给出配对标准和每个病例配对对照数目感兴趣的变量 7 列出并清楚地定义所有列出并清楚地定义所有列出并清楚结局,潜在的预测变量暴露因素,潜在的混杂地定义所有和混杂因素,预先确定因素,预先确定亚组结局,潜在的亚组预测变量、混杂因素,预先定义亚组测量8 ①对每一个兴趣变量给出详细的测定方法②描述两队列间测定 描述病例与对照间 描述组间措施的可比性 措施的可比性 措施可比性偏倚 9 描述任何在测定过程中可能产生偏倚的原因样本量 10 描述研究样本量的合理性,包括实际与统计学两方面的考虑统计方法 11 ①描述所有统计方法包括如何控制混杂因素描述如何失访和如何处理失访资料;说明设计的处理失访资料和配对作用和如何处理失访资料②必要时描述亚组分析和敏感性分析暴露因素 12 ①对暴露因素的定量分析有清晰的解释,分组如何选定,为什么这样选 定量分析 ②展示连续分析及成组分析结果经费 13 写出经费来源,资助者的作用结果参加者 14 报告每组可能入选的数目 分别报告病例和 报告可能入进行检查的入选人数, 对照的可能入选 选人数,受最后进入研究的的人数, 人数,受检人数, 检人数,进入完成随访和进入研究分析 进入研究人数和 研究人数及的人数,报告确定的随访 分析人数,配对 进行分析的日期 研究给出一个 人数病例配几个对照描述资料 15 ①陈述参加对象的基础资料,包括地理、临床、社会等资料,暴露因素和潜在的混杂因素②对每一个感兴趣变量有完整的资料结局资料 16 报告发生结局事件的数量 报告对每个暴露 报告发生结局事件的数量总结整段时间对每个比较 因素的病例数和 总结整段时间对每个比较组的测定情况 对照 组的测定情况主要结果 17 给予矫正混杂因素前后的因果关系的测定值和95%可信区间,说明哪个混杂因子被矫正必要时转换,将相对值转换为绝对危险性差值其他分析 18 报告任何其他分析,包括亚组分析和敏感性分析讨论关键发现 19 总结关键发现及对于假设的参考文献局限性 20 讨论研究局限性,说明可能产生的偏倚和由于暴露和结局多重性分析引起的问题 外推性 21 讨论研究发现的外推性和普遍应用价值解释 22 小心地解释研究结果形成的目前证据的内容,研究的局限性(王吉耀译, 2009)。
2. STROBE(观察性研究的报告标准)
项目条目队列研究病例对照研究横断面
题目和摘要 1 ①在题目和摘要中 确定是 确定是
确定队列研究 病例对照研究 横断面研究
②摘要是结构式的对文章内容的高度总结,应包括以下各项目
引言
背景 2 解释其科学背景及研究的理由
目的 3 目的和假设
方法
研究设计 4 陈述设计中主要因素
研究场所 5 陈述研究场所,收集资料的时间、地点、周期
参加者 6 入选和排除标准 对病例和对照分别 入选及排除
选择参加者的来源和方法 给出入选和排除标准 标准,说明
分别描述暴露和非暴露 选择病例与对照的 参加者的来
列出随访时间 来源和方法。
源和方法
病例组有确切的诊断标准
选择对照的合理性,
配对研究给出配对标准
和每个病例配对对照数目
感兴趣的变量 7 列出并清楚地定义所有列出并清楚地定义所有列出并清楚
结局,潜在的预测变量暴露因素,潜在的混杂地定义所有
和混杂因素,预先确定因素,预先确定亚组结局,潜在的
亚组预测变量、
混杂因素,
预先定义亚组
测量8 ①对每一个兴趣变量给出详细的测定方法
②描述两队列间测定 描述病例与对照间 描述组间
措施的可比性 措施的可比性 措施可比性
偏倚 9 描述任何在测定过程中可能产生偏倚的原因
样本量 10 描述研究样本量的合理性,包括实际与统计学两方面的考虑
统计方法 11 ①描述所有统计方法包括如何控制混杂因素
描述如何失访和如何处理失访资料;
说明设计的处理失访资料和配对作用和如何处理失访资料
②必要时描述亚组分析和敏感性分析
暴露因素 12 ①对暴露因素的定量分析有清晰的解释,分组如何选定,为什么这样选 定量分析 ②展示连续分析及成组分析结果
经费 13 写出经费来源,资助者的作用
结果
参加者 14 报告每组可能入选的数目 分别报告病例和 报告可能入
进行检查的入选人数, 对照的可能入选 选人数,受
最后进入研究的的人数, 人数,受检人数, 检人数,进入
完成随访和进入研究分析 进入研究人数和 研究人数及
的人数,报告确定的随访 分析人数,配对 进行分析的
日期 研究给出一个 人数
病例配几个对照
描述资料 15 ①陈述参加对象的基础资料,包括地理、临床、社会等资料,暴露因素
和潜在的混杂因素
②对每一个感兴趣变量有完整的资料
结局资料 16 报告发生结局事件的数量 报告对每个暴露 报告发生结局事件的数量
总结整段时间对每个比较 因素的病例数和 总结整段时间对每个比较
组的测定情况 对照 组的测定情况
主要结果 17 给予矫正混杂因素前后的因果关系的测定值和95%可信区间,说明哪个
混杂因子被矫正
必要时转换,将相对值转换为绝对危险性差值
其他分析 18 报告任何其他分析,包括亚组分析和敏感性分析
讨论
关键发现 19 总结关键发现及对于假设的参考文献
局限性 20 讨论研究局限性,说明可能产生的偏倚和由于暴露和结局多重性分析引起的问题 外推性 21 讨论研究发现的外推性和普遍应用价值
解释 22 小心地解释研究结果形成的目前证据的内容,研究的局限性
(王吉耀译, 2009)。