甲醇的合成操作技术原理
- 格式:ppt
- 大小:965.50 KB
- 文档页数:34

10万吨甲醇操作法全套第一篇合成岗位操作规程第一章工艺原理一、合成工艺原理甲醇合成是在5.0MPa压力下,在催化剂的作用下,气体中的一氧化碳、二氧化碳与氢反应生成甲醇,基本反应式为:CO+2H2=CH3OH+QCO2+3H2=CH3OH+H2O+Q在甲醇合成过程中,尚有如下副反应:2CO+4H2=(CH3)2O+H2O2CO+4H2=C2H5OH+H2O4CO+8H2=C4H9OH+3H2O此外,还有甲酸甲酯,乙酸甲酯及其它高级醇、高级烷烃类生成。
以铜为主体的铜基催化剂,对于甲醇合成具有极高的选择性,而且在不太高的压力及温度下,要求合成气的净化要彻底,否则其活性将很快丧失,它的耐热性也较差,要求维持催化剂在最佳的稳定的温度下操作。
铜基催化剂一般可在210-280℃下操作,视催化剂的型号及反应器型式不同,其最佳操作温度范围与略有不同。
管壳式反应器的最佳操作温度在230-260℃之间。
在铜基催化剂上合成甲醇,合适的操作压力是5.0~10.0MPa,对于合成气中二氧化碳较高的情况,压力的提高对提高反应速度有比较明显的效果。
合成气的成份对甲醇合成反应的影响较大,由前述反应式可见,要降低能耗,应采用适量的二氧化碳浓度的合成气,若合成气中二氧化碳含量过高,会加重精馏工序的负担并增加了能耗,但二氧化碳含量太低,会导致催化剂活性和转化率过低。
理论的合成新鲜气成份,应满足以下比值:氢碳比f=(H2-CO2)/(CO+CO2)=2.05实际操作中氢碳比应适当增大,大约在2.05~2.15之间。
空速一般控制在8000~10000h-1左右。
甲醇合成是强烈的放热反应,必须在反应过程中不断的将热量移走,反应才能正常进行,管壳式反应器利用管子与壳体间副产中压蒸汽来移走热量,这样,合成反应适宜的温度条件维持就几乎全依赖于副产品中压蒸汽压力操作的正常与稳定。
第二章工艺流程简述由压缩工序来的循环气经入塔气预热器(C0401)预热至225℃,由顶部进入管壳式等温甲醇合成塔(D0401),在铜基触媒的作用下,CO、CO2与H2反应生成甲醇和水,同时还有少量的其它有机杂质生成。

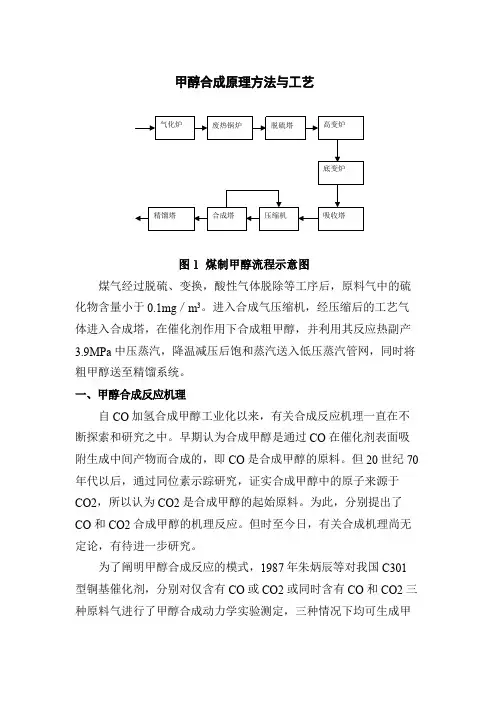
甲醇合成原理方法与工艺图1煤制甲醇流程示意图煤气经过脱硫、变换,酸性气体脱除等工序后,原料气中的硫化物含量小于0.1mg/m3。
进入合成气压缩机,经压缩后的工艺气体进入合成塔,在催化剂作用下合成粗甲醇,并利用其反应热副产3.9MPa中压蒸汽,降温减压后饱和蒸汽送入低压蒸汽管网,同时将粗甲醇送至精馏系统。
一、甲醇合成反应机理自CO加氢合成甲醇工业化以来,有关合成反应机理一直在不断探索和研究之中。
早期认为合成甲醇是通过CO在催化剂表面吸附生成中间产物而合成的,即CO是合成甲醇的原料。
但20世纪70年代以后,通过同位素示踪研究,证实合成甲醇中的原子来源于CO2,所以认为CO2是合成甲醇的起始原料。
为此,分别提出了CO和CO2合成甲醇的机理反应。
但时至今日,有关合成机理尚无定论,有待进一步研究。
为了阐明甲醇合成反应的模式,1987年朱炳辰等对我国C301型铜基催化剂,分别对仅含有CO或CO2或同时含有CO和CO2三种原料气进行了甲醇合成动力学实验测定,三种情况下均可生成甲醇,试验说明:在一定条件下,CO和CO2均可在铜基催化剂表面加氢生成甲醇。
因此基于化学吸附的CO连续加氢而生成甲醇的反应机理被人们普遍接受。
对甲醇合成而言,无论是锌铬催化剂还是铜基催化剂,其多相(非匀相)催化过程均按下列过程进行:①扩散——气体自气相扩散到气体一催化剂界面;②吸附——各种气体组分在催化剂活性表面上进行化学吸附;③表面吸附——化学吸附的气体,按照不同的动力学假说进行反应形成产物;④解析——反应产物的脱附;⑤扩散——反应产物自气体一催化剂界面扩散到气相中去。
甲醇合成反应的速率,是上述五个过程中的每一个过程进行速率的总和,但全过程的速率取决于最慢步骤的完成速率。
研究证实,过程①与⑤进行得非常迅速,过程②与④的进行速率较快,而过程③分子在催化剂活性界面的反应速率最慢,因此,整个反应过程的速率取决于表面反应的进行速率。
提高压力、升高温度均可使甲醇合成反应速率加快,但从热力学角度分析,由于CO、C02和H2合成甲醇的反应是强放热的体积缩小反应,提高压力、降低温度有利于化学平衡向生成甲醇的方向移动,同时也有利于抑制副反应的进行。

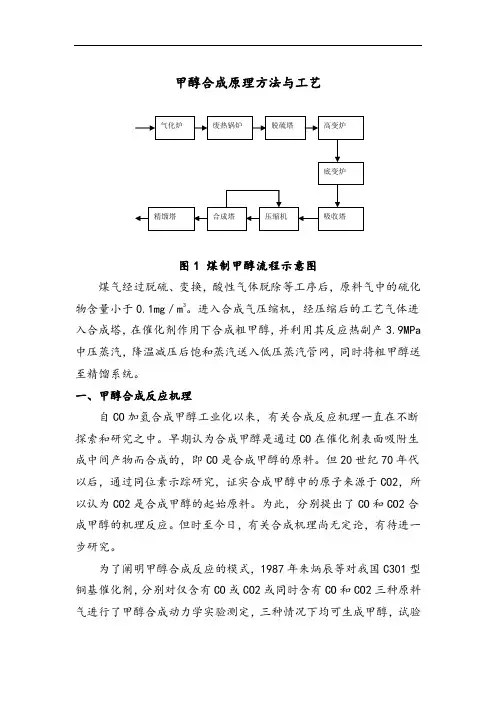
甲醇合成原理方法与工艺图1 煤制甲醇流程示意图煤气经过脱硫、变换,酸性气体脱除等工序后,原料气中的硫化物含量小于0.1mg/m3。
进入合成气压缩机,经压缩后的工艺气体进入合成塔,在催化剂作用下合成粗甲醇,并利用其反应热副产3.9MPa 中压蒸汽,降温减压后饱和蒸汽送入低压蒸汽管网,同时将粗甲醇送至精馏系统。
一、甲醇合成反应机理自CO加氢合成甲醇工业化以来,有关合成反应机理一直在不断探索和研究之中。
早期认为合成甲醇是通过CO在催化剂表面吸附生成中间产物而合成的,即CO是合成甲醇的原料。
但20世纪70年代以后,通过同位素示踪研究,证实合成甲醇中的原子来源于CO2,所以认为CO2是合成甲醇的起始原料。
为此,分别提出了CO和CO2合成甲醇的机理反应。
但时至今日,有关合成机理尚无定论,有待进一步研究。
为了阐明甲醇合成反应的模式,1987年朱炳辰等对我国C301型铜基催化剂,分别对仅含有CO或CO2或同时含有CO和CO2三种原料气进行了甲醇合成动力学实验测定,三种情况下均可生成甲醇,试验说明:在一定条件下,CO和CO2均可在铜基催化剂表面加氢生成甲醇。
因此基于化学吸附的CO连续加氢而生成甲醇的反应机理被人们普遍接受。
对甲醇合成而言,无论是锌铬催化剂还是铜基催化剂,其多相(非匀相)催化过程均按下列过程进行:①扩散——气体自气相扩散到气体一催化剂界面;②吸附——各种气体组分在催化剂活性表面上进行化学吸附;③表面吸附——化学吸附的气体,按照不同的动力学假说进行反应形成产物;④解析——反应产物的脱附;⑤扩散——反应产物自气体一催化剂界面扩散到气相中去。
甲醇合成反应的速率,是上述五个过程中的每一个过程进行速率的总和,但全过程的速率取决于最慢步骤的完成速率。
研究证实,过程①与⑤进行得非常迅速,过程②与④的进行速率较快,而过程③分子在催化剂活性界面的反应速率最慢,因此,整个反应过程的速率取决于表面反应的进行速率。
提高压力、升高温度均可使甲醇合成反应速率加快,但从热力学角度分析,由于CO、C02和H2合成甲醇的反应是强放热的体积缩小反应,提高压力、降低温度有利于化学平衡向生成甲醇的方向移动,同时也有利于抑制副反应的进行。

段落一:引言甲醇是一种重要的有机化工原料和清洁燃料,也是工业生产中广泛应用的化学品之一。
煤制甲醇作为一种非石化甲醇生产方式,具有资源丰富、技术成熟、环保节能等优势,是未来甲醇工业发展的重要方向之一。
本文将从煤制甲醇的原理、技术路线、优缺点、发展趋势、挑战与机遇等多角度对其进行详细介绍。
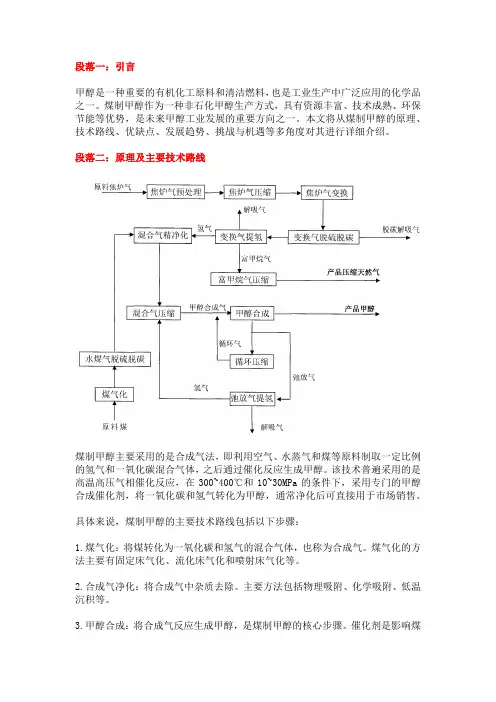
段落二:原理及主要技术路线煤制甲醇主要采用的是合成气法,即利用空气、水蒸气和煤等原料制取一定比例的氢气和一氧化碳混合气体,之后通过催化反应生成甲醇。
该技术普遍采用的是高温高压气相催化反应,在300~400℃和10~30MPa的条件下,采用专门的甲醇合成催化剂,将一氧化碳和氢气转化为甲醇,通常净化后可直接用于市场销售。
具体来说,煤制甲醇的主要技术路线包括以下步骤:1.煤气化:将煤转化为一氧化碳和氢气的混合气体,也称为合成气。
煤气化的方法主要有固定床气化、流化床气化和喷射床气化等。
2.合成气净化:将合成气中杂质去除。
主要方法包括物理吸附、化学吸附、低温沉积等。
3.甲醇合成:将合成气反应生成甲醇,是煤制甲醇的核心步骤。
催化剂是影响煤制甲醇产率和选择性的关键因素,主要包括铜基、锌基和铬基等。
4.甲醇精馏:从合成的混合物中将甲醇纯化出来的过程。
经过2~3级分馏后,可以得到高纯度的甲醇。
总之,煤制甲醇技术路线相对成熟,具有较为明确的分离纯化工艺和催化剂合成技术。
未来,随着科技不断进步,煤制甲醇的生产工艺也会不断创新和完善,以更好地满足市场需求和环保要求。
段落三:优点与传统石化甲醇生产方式相比,煤制甲醇具有以下优点:1.资源丰富:煤作为我国的主要能源来源之一,具有储量丰富、分布广泛的特点,可以为煤制甲醇提供充足的原料保障。
2.技术成熟:煤制甲醇技术在国内外已经经历了数十年的发展和实践,技术路线已经相对成熟,可以提供稳定高效的甲醇生产工艺。
3.环保节能:煤制甲醇生产不仅能够节约石油等化石能源的消耗,还可以降低CO2等温室气体的排放,具有更好的环保效益。

一、甲醇合成原理1、化学反应合成甲醇的主要化学反应为CO和H2在多相铜基催化剂上的反应:CO+2H2⇋CH3OH(g)-90.8kJ/mol反应气体中含有CO2时,发生以下反应:CO2+3H2⇋CH3OH(g)+H2O-49.5kJ/mol同时CO2和H2发生CO的逆变换反应:CO2+H2⇋CO+H2O(g)+41.3kJ/mol反应过程中除生成甲醇外,还伴随一些副反应的发生,生成少量的烃、醇、醛、醚、酸和酯等化合物。
这些副反应的产物还可以进一步发生脱水、缩合、酰化或酮化等反应,生成烯烃、酯类、酮类等副产物。
当催化剂中含有碱类化合物时,这些化合物的生成更快。
副产物不仅消耗原料,而且影响甲醇的质量和催化剂的寿命。
尤其是生成甲烷的反应为一个强放热反应,不利于反应温度的操作控制,且甲烷不能随着产品冷凝,在循环系统中循环,更不利于主反应的化学平衡和反应速率。
2、甲醇合成反应的特点(1)放热反应甲醇合成是一个可逆放热反应,为了使反应过程能够向着有利于生成甲醇的方向进行,适应最佳温度曲线的要求,达到较好的产量,需及时移走热量。
(2)体积缩小反应从化学反应可以看出,无论是CO还是CO2分别与H2合成CH3OH,都是体积缩小的反应,因此压力增高,有利于反应向着生成CH3OH的方向进行。
(3)可逆反应即在CO、CO2和H2合成生成CH3OH的同时,甲醇也分解为CO2、CO和H2,合成反应的转化率与压力、温度和氢碳比ƒ=(H2-CO2)/(CO+CO2)有关。
(4)催化反应在有催化剂时,合成反应才能较快进行。
二、甲醇合成催化剂随着英国ICI公司铜‐锌‐铝催化剂的研制成功,甲醇生产进入了低温(220~280℃)、中低压(5~10MPa)时代。
近年来,低压铜基催化剂的使用逐渐普遍,各种新型甲醇催化剂层出不穷,无论活性、选择性、寿命等各方面均大大超过前代产品,从而推动甲醇生产实现了长周期、低能耗、低成本运行。
1、铜基催化剂(1)CuO‐ZnO‐Al2O3催化剂英国ICI公司开发的CuO‐ZnO‐Al2O3催化剂是比较有代表性的铜基催化剂。


第十二部分甲醇合成操作法第一章概述第一节岗位任务1将合成气压缩机送来的合格合成气,经换热器提温后送入甲醇合成塔内,在适宜的压力、温度与催化剂的作用下合成甲醇。
2•利用废热锅炉回收出甲醇合成塔气体热量,副产0.5Mpa蒸汽。
3. 将分离器后的粗甲醇经降压闪蒸后送入粗甲醇中间槽或精馏系统。
第二节工艺原理甲醇合成是H2与CO CO在一定压力、温度及催化剂的条件下,按下述反应式进行的化学反应;一、主反应:C0+2年CHOH+90.56kj/molCO+3H = CH0H+H0+49.43kj/mol二、主要副反应:2CO+4涉CHOCH+HO4CO+8涉GF9OH+3HDCO+3涉CH+H2O2CO+2H=2H?O+2CO三、甲醇合成反应有如下特点:1放热反应:甲醇合成是可逆放热反应,反应过程中应采取必要的移热手段,使反应适应最佳温度曲线,达到较高的甲醇产量。
2、体积缩小反应:无论是CO与Hz合成甲醇还是CO与Hz合成甲醇,都是体积缩小反应,因此压力高有利于反应向生成甲醇的方向进行。
但是,压力提高将增加压缩机动力能耗,增加设备投资,且反应过程中的副产物将增加。
3、可逆反应:即CO CO与H合成甲醇的同时,甲醇也分解成CO CO与Hz,合成反应的转化率与反应压力、温度及(Hz- CO) / (C3 CQ)的比值有关,一般合成新鲜气的(Hz-CQ) / (CO^ CO) 控制在2.05〜2.15之间。
4、催化反应:甲醇反应在催化剂存在条件下才能较快的进行,没有催化剂存在时,即使在较高的温度和压力条件下,反应仍极慢的进行,低压法甲醇合成催化剂最佳使用温度范围为210〜270°C;5、循环反应:反应生成的甲醇与未反应的f、N2 CO CO等气体必须得到及时分离,降低反应生成物的浓度,以利提高合成反应的平衡浓度,甲醇分离后的一部分气体经循环机进行循环,为防止循环气中N2.CH4等惰性气累积和有效气组分降低,分离后的一部分排出甲醇合成装置。

低压甲醇工作原理与工艺流程一、工作原理低压甲醇技术是一种利用天然气或煤炭等碳源经过一系列化学反应得到甲醇的工艺。
其工作原理如下:1.脱气:将天然气或煤炭等碳源通过脱氧装置,去除其中的氧分子,得到纯净的氢气和一氧化碳混合气体。
2.催化转化:将脱气得到的混合气体经过催化剂床层,在适当的温度和压力下将一氧化碳和氢气进行催化反应,生成一定比例的甲醇。
3.分离和纯化:通过冷凝和蒸馏等分离工艺,将反应产生的甲醇与未反应的气体和其他杂质分离,得到高纯度的甲醇产品。
二、工艺流程低压甲醇工艺通常包括以下几个主要步骤:1. 脱气在脱气步骤中,天然气或煤炭等碳源首先被送入脱氧装置。
脱氧装置通过高温条件下将气体与氧分子接触,将氧分子从气体中剔除。
这一步骤的主要目的是去除氧分子,以防止在催化转化过程中产生不必要的化学反应。
2. 催化转化脱氧后的气体进入催化剂床层,经过催化剂的作用,在适当的温度和压力下进行化学反应。
催化剂通常使用金属氧化物,如氧化铜、氧化锌等,以提高反应效率和甲醇产率。
在反应过程中,一氧化碳和氢气会发生催化反应,产生甲醇。
该反应通常是放热反应,因此需要控制反应温度,以避免过高的温度对催化剂造成破坏。
3. 分离和纯化催化转化反应产生的气体和甲醇混合物需要经过分离和纯化处理,以得到高纯度的甲醇产品。
首先,通过冷凝装置将气体和甲醇混合物冷却,使其变为液体。
然后,通过蒸馏或其他方法将甲醇与气体和其他杂质分离。
最后,通过进一步的纯化步骤,如吸附和过滤,去除残留的杂质,得到甲醇的终产物。
三、优势和应用低压甲醇技术具有以下优势:1.实现碳资源的高效利用:低压甲醇工艺可以利用天然气、煤炭等碳源生产甲醇,实现碳资源的高效利用,可以有效降低碳排放量和对有限化石能源的依赖。
2.适应性广泛:低压甲醇工艺适用于多种碳源,包括天然气、煤炭等。
这使得低压甲醇技术在各个地区都具有广泛的应用前景。
3.高纯度甲醇产品:低压甲醇工艺通过分离和纯化步骤,可以获得高纯度的甲醇产品,用于工业和化学领域的各种应用。
生产原理和原料来源原理甲醇合成是在一定温度、压力和催化剂作用下,CO、CO2与H2反应,主要生成CH3OH和H2O的放热可逆复杂反应过程。
其主要反应方程式如下:CO + 2H2 →CH3OH+102.37kJ/mol副反应: 2CO+4H2 →(CH3)2O +H2O+200.39kJ/molCO+3H2→CH4+H2O+115.69kJ/mol4CO+8H2→C4H9OH+3H2O+49.62kJ/molCO2+H2→CO+H2O-42.92kJ/mol目前,甲醇生产普遍采用CuO-ZnO-Al2O3或CuO-ZnO-Cr2O3系列催化剂,活性区域在473~563K之间,最佳活性使用温区500~530 K之间。
活性温区较窄,而甲醇合成反应又是一个强烈放热反应,虽然对化学反应来说,温度升高会使分子运动加快,分子内的有效碰撞增多,并使分子有效结合的机会增加,使甲醇合成反应加快;但是由于CO、CO2与H2生成CH3OH的反应是可逆放热反应,随着温度增高逆反应的化学平衡常数增大,对甲醇生成不利。
因此,要求甲醇反应放出的热量,应及时移走。
另外,从上述化学反应方程式可以看出, CO、CO2与H2生成CH3OH的反应是一个体积缩小的反应,提高合成的压力有利于反应;由于催化剂厂家开发了高活性的催化剂,近年来,低压甲醇合成工艺得到了广泛的应用。
原料来源早期用木材或木质素干馏法制甲醇的方法,今天在工业上已经被淘汰了。
今后,木质以及农作物、有机废料以至城市垃圾等,都可以可以作为制造甲醇的主要原料,这些物质是作为碳资源,转化为碳的化合物,再以人工和成方法而制取甲醇。
工业合成甲醇的原料来源有天然气、石脑油、重油、焦炭、煤、焦炉气、乙炔尾气等。
本世纪50年代以来,原料结构发生了很大变化,以气体、液体燃料为原料生产甲醇原料气,不论从工程投资、能量消耗、生产成本来看都有明显的优越性,很快得到重视。
于是甲醇生产由固体燃料为主转移到以气体、液体燃料为主。