初三化学溶解度曲线知识点
- 格式:doc
- 大小:40.50 KB
- 文档页数:2

初三化学溶解度知识点归纳
化学溶解度是指在一定温度下,溶质在溶剂中溶解的最大量。
溶解度可以用溶解度曲线、溶解度表和溶解度规律来描述和预测。
1. 溶解度曲线:溶解度曲线是描述溶解度随温度变化的图形。
通常溶解度随温度的升高而增加,但也有一些物质在温度升高时溶解度会减小。
2. 溶解度表:溶解度表是列出不同温度下物质的溶解度的表格。
通过溶解度表可以了解不同温度下物质的溶解度变化规律。
3. 溶解度规律:常见的溶解度规律有以下几种:
- 溶解度随温度升高而增加的物质,称为热溶质;
- 溶解度随温度升高而减小的物质,称为冷溶质;
- 溶解度随温度变化不大的物质,称为中性溶质;
- 溶解度随温度变化无规律的物质,称为理想溶质;
- 溶解度随温度升高或降低都有明显变化的物质,称为非理想溶质。
4. 影响溶解度的因素:溶解度受到温度、压力和溶液浓度等因素的影响。
一般情况下,溶解度随温度的升高而增加,但也有例外情况。
溶解度还受到物质之间的相互作用力、溶质和溶剂的极性等因素的影响。
5. 饱和溶液和过饱和溶液:当溶液中已经溶解了最大量的溶质时,称为饱和溶液。
过饱和溶液是指溶液中溶质的溶解度超过了饱和溶
液的溶解度,此时溶液处于不稳定状态,稍微的扰动就会使溶质析出。
6. 溶解度的单位:溶解度通常用摩尔溶解度(mol/L)或质量溶解度(g/L)来表示。
总结起来,化学溶解度是描述溶质在溶剂中溶解的最大量的性质。
溶解度受到温度、压力、溶液浓度和物质之间的相互作用力等因素的影响。
了解溶解度的规律可以帮助我们理解溶液的性质和溶解过程。

溶解度/gt/℃21Om 3m 4 m 1m 2 Bca b A 溶解度曲线一、溶解度曲线的涵义 1.涵义:物质的溶解度受温度影响,温度变化溶解度也变化。
如果在直角坐标系中,用横坐标表示温度,纵坐标表示溶解度,根据物质在不同温度下的溶解度,我们可以得到一系的点,将这些点以光滑的曲线连贯起来就得到了溶解度曲线。
溶解度曲线就是在直角坐标系中,用来描述物质的溶解度随温度变化而变化的曲线。
根据溶解度曲线可进行溶液的配制,混合物的分离与提纯,以及进行物质结晶或溶解的计算。
2.说明 (1)点① 曲线上的点:表示对应温度下该物质的溶解度。
如:下图中a 表示A 物质在t 1℃时溶解度为m 1g 。
曲线上方的点:表示在对应温度下该物质的饱和溶液中存在 不能继续溶解的溶质。
如:图中b 表示在t 1℃时,A 的饱和溶液中有 (m 2-m 1)g 未溶解的溶质。
曲线下方的点:表示在对应温度下该物质的不饱和溶液。
如:图中C 表示在t 1℃时,A 的不饱和溶液中,还需要加入(m 1-m 3)gA 物质才达到饱和。
②曲线交点:表示在对应温度下不同物质的溶解度相同。
如图中d 表示在t 2℃,A 、B 两物质的溶解度都为m 4g 。
(2)线○1如图中A 物质的溶解度随温度升高而明显增大,A 曲线为“陡升型”。
如KNO 3等大多数固体物质:○2图中B 物质的溶解度随温度变化不大,B 曲线为“缓升型”,如NaCl 等少数固体物质。
○3图中C 物质的溶解度随温度升高而减小,C 曲线为“下降型”,如气体及Ca(OH)2等极少数固体物质。
二、溶解度曲线的应用1.溶解度曲线上的每一点,代表着某温度下某物质的溶解度,因此利用溶解度曲线可以查出某物质在不同温度下的溶解度,并根据物质的溶解度判断其溶解性。
2.可以比较在同一温度下不同物质溶解度的相对大小。
3.根据溶解度曲线的形状走向,可以看出某物质的溶解度随温度的变化情况。
并根据此情况可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。

化学溶解度曲线是描述物质在不同温度和压力下溶解度变化的图形。
这种图形通常以溶质在溶剂中的摩尔浓度(或质量浓度)为纵坐标,温度为横坐标。
在一定温度和压力下,溶解度曲线反映了溶质在溶剂中的溶解特性。
一般来说,溶解度曲线可分为以下几个区域:
1.不饱和区域:在曲线的起始部分,溶质的摩尔浓度较低,此时溶液中的溶质尚未达到饱和状态,仍然能够溶解更多的溶质。
2.饱和区域:曲线逐渐上升,进入饱和区域。
在这个区域,溶质的摩尔浓度达到最大值,溶解度曲线呈水平或略微上升趋势。
此时,溶质在给定的温度和压力下已经达到最大的溶解度。
3.过饱和区域:超过饱和区域的溶质摩尔浓度,这是一种不稳定状态。
在这个区域,溶质实际上溶解得比饱和状态更多,但是一点点扰动就可能导致溶质析出。
过饱和通常是在饱和溶液中冷却或者加入过量溶质的情况下发生。
溶解度曲线的形状取决于物质的性质,不同物质在不同温度和压力下具有不同的溶解度规律。
一些物质的溶解度随温度的升高而增加,而另一些物质则相反。
对于气体溶解度,通常随温度升高而降低。
化学工程师、研究人员和实验室技术员经常使用溶解度曲线来了解和控制溶液的性质,以优化反应条件或提高产品纯度。
这对于药物制造、食品工业和化工等领域都有着重要的应用。

溶液(溶解度曲线)知识集结知识元溶液的形成知识讲解一、溶液的形成1、溶液的特征:(1)定义一种或几种物质分散到另一种物质中,形成的均一、稳定的混合物叫溶液。
(2)特征溶液的特征是均一性和稳定性。
均一性是指溶液中各部分的性质和成分均相同(如一瓶溶液中,上下左右等各部分的密度都是一样的);稳定性是指在条件不变(即温度、压强等不改变,溶剂不蒸发等)的情况下,溶液中的溶质永远不会分层或析出(即溶质与溶剂永不分离)。
(3)组成溶液是由溶质(被溶解的物质)和溶剂(能溶解其他物质的物质)两部分组成的。
常见的溶剂有水、汽油、酒精等。
2、浊液:不均一、不稳定的混合物。
(1)乳浊液小液滴分散到液体里形成的混合物叫做乳浊液,乳浊液不均一、不稳定,静置会分层。
(2)悬浊液固体小颗粒悬浮于液体里形成的混合物。
悬浊液不均一、不稳定,静置会分层。
3、溶液和浊液的区别(1)悬浊液中的小颗粒和乳浊液中的小液滴都是由许多分子的集合而成的分子集合体,远远大于溶剂中的单个分子或离子,不能共同运动;宏观表现为分层,即形成的是不均一、不稳定的混合物。
(2)溶液中的溶质则是以单个分子(或离子)的形式分散着的,与溶剂中的分子或离子大小级别相同,能共同运动;宏观表现为不分层,即形成的是均一、稳定的混合物。
4、溶解时的吸热或放热现象有的物质在溶解时会明显放出热量。
如:氢氧化钠、浓硫酸。
有的物质在溶解时会明显吸收热量。
如:硝酸铵。
大多数物质在溶解时即不明显放热也不明显吸热。
如:氯化钠。
物质溶解的过程包含有以下两个过程:一个过程是物质的分子(或离子)向水中扩散,该过程吸收热量;另一个过程是物质的分子(或离子)和水分子作用,生成水合分子(或水合离子),该过程放出热量。
不同的溶质,在这两个过程中吸收和放出的热量也不同;这就导致在物质的溶解过程中表现为吸热或放热现象。
注意:(1)溶液不一定是无色的,如硫酸铜溶液为蓝色,氯化铁溶液为黄色。
溶液的状态可以是固态、液态或气态。

初中化学溶解度知识要点归纳学校化学溶解度学问溶解度1、固体的溶解度溶解度定义:在肯定温度下,某固态物质在100g溶剂里到达饱和状态时所溶解的质量四要素:①条件:肯定温度②标准:100g溶剂③状态:到达饱和④质量:单位:克溶解度的含义:20℃时NaCl的溶液度为36g含义:在20℃时,在100克水中最多能溶解36克NaCl或在20℃时,NaCl在100克水中到达饱和状态时所溶解的质量为36克2、影响固体溶解度的因素①溶质、溶剂的性质(种类)②温度大多数固体物的溶解度随温度上升而上升;如KNO3少数固体物质的溶解度受温度的影响很小;如NaCl极少数物质溶解度随温度上升而降低。
如Ca(OH)23、溶解度曲线t3℃时A的溶解度为80gP点的的含义在该温度时,A和C的溶解度相同N点为t3℃时A的不饱和溶液,可通过加入A物质,降温,蒸发溶剂的方法使它变为饱和t1℃时A、B、C、溶解度由大到小的挨次CBA从A溶液中猎取A晶体可用降温结晶的方法猎取晶体。
从A溶解度是80g。
t2℃时A、B、C的饱和溶液各W克,降温到t1℃会析出晶体的有A和B无晶体析出的有C,所得溶液中溶质的质量分数由小到大依次为A除去A中的泥沙用过滤法;分别A与B(含量少)的混合物,用结晶法4、气体的溶解度气体溶解度的定义:在压强为101kPa和肯定温度时,气体溶解在1体积水里到达饱和状态时的气体体积。
影响因素:①气体的性质②温度(温度越高,气体溶解度越小)③压强(压强越大,气体溶解度越大)5、混合物的分别过滤法:分别可溶物+难溶物结晶法:分别几种可溶性物质结晶的两种方法:①蒸发溶剂,如NaCl(海水晒盐)②降低温度(冷却热的饱和溶液,如KNO3)初三化学基础学问氧气一、氧气的性质【物理性质】密度略大于空气的密度。
不易溶于水。
气态的氧是无色无味的,液态氧和固态氧是淡蓝色的。
【化学性质】氧气化学性质比较活泼。
氧气具有助燃性和氧化性。
注:氧气具有助燃性,没有可燃性,不能作燃料。

(山西专版)2024年中考化学复习方案滚动小专题(一)溶解度曲线嘿,同学们,备考2024年中考化学,溶解度曲线可是个重点内容。
今天,咱们就一起来攻克这个难题,让溶解度曲线不再成为你的心头大患。
一、溶解度曲线的基本概念咱们得弄明白什么是溶解度曲线。
溶解度曲线,顾名思义,就是描述在一定温度下,某种溶质在溶剂中的溶解度随温度变化的曲线。
这条曲线可是咱们解决溶解问题的关键。
二、溶解度曲线的五大关键点1.溶解度的定义:在一定温度下,100g溶剂中最多能溶解的溶质的质量,称为该温度下的溶解度。
2.溶解度曲线的形状:一般来说,溶解度曲线呈上升趋势,但也有例外。
比如,硫酸钡的溶解度随温度升高而减小。
3.溶解度曲线的交点:两条溶解度曲线的交点表示在某一温度下,两种溶质的溶解度相同。
4.溶解度曲线的斜率:斜率越大,说明该溶质的溶解度随温度变化越敏感。
5.溶解度曲线的应用:通过溶解度曲线,我们可以判断溶液是否饱和、结晶方法、比较不同溶质的溶解度等。
三、溶解度曲线的实战演练1.题目一:已知某温度下,氯化钠的溶解度为35g。
求该温度下,100g水中最多能溶解多少克氯化钠?解析:根据溶解度的定义,35g氯化钠是100g水在该温度下最多能溶解的质量。
所以,答案为35g。
2.题目二:已知某温度下,硫酸铜的溶解度随温度升高而增大。
若将该温度下的硫酸铜溶液加热,溶液的饱和度会发生什么变化?解析:由于硫酸铜的溶解度随温度升高而增大,所以加热后,溶液的饱和度会减小,溶液变为不饱和溶液。
3.题目三:有A、B两种溶质,它们的溶解度曲线如下:(1)在某一温度下,A、B两种溶质的溶解度是否相同?(2)在某一温度下,若要使A、B两种溶质的溶液同时饱和,应如何操作?解析:(1)通过观察溶解度曲线,可以发现A、B两种溶质在某温度下的溶解度曲线交点处,溶解度相同。
(2)要使A、B两种溶质的溶液同时饱和,可以通过降低温度或增加溶质的方法。
1.学会利用溶解度曲线解决实际问题,如结晶方法、溶液饱和度的判断等。
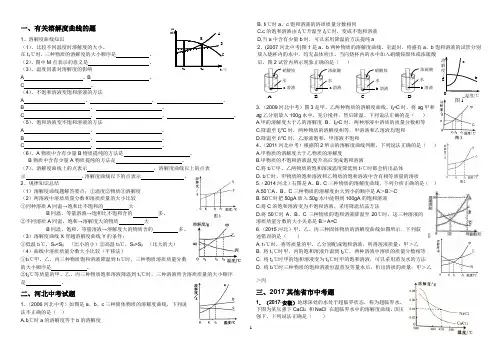
一、有关溶解度曲线的题1、溶解度曲线知识(1)、比较不同温度时溶解度的大小。
在t 1℃时,三种物质的溶解度的大小顺序是 。
(2)、图中M 点表示的意义是 。
(3)、温度因素对溶解度的影响A 。
B 。
C 。
(4)、不饱和溶液变饱和溶液的方法A , , 。
B , 。
C , , 。
(5)、饱和溶液变不饱和溶液的方法A , 。
B , 。
C , 。
(6)、A 物质中含有少量B 物质提纯的方法是 。
B 物质中含有少量A 物质提纯的方法是 。
(7)、溶解度曲线上的点表示 ,溶解度曲线以上的点表示 ,溶解度曲线以下的点表示 。
2、规律知识总结(1)溶解度曲线题解答要点:①温度②物质③溶解度 (2)两溶液中溶质质量分数和溶质质量的大小比较 ①同种溶质A 同温→饱和比不饱和的 大B 同温、等量溶液→饱和比不饱和含的 多。
②不同溶质A 同温、饱和→溶解度大的物质 大B 同温、饱和、等量溶液→溶解度大的物质含的 多。
(3)溶解度曲线X 穿越溶解度曲线Y 的条件:①低温t 1℃,S x <S y (比小的小)②高温t 3℃,S x >S y (比大的大) (4)曲线中溶质质量分数大小比较(平移法)①t 3℃甲、乙、丙三种物质饱和溶液降温到t 1℃时,三种物质溶质质量分数的大小顺序是 。
②t 3℃等质量的甲、乙、丙三种物质饱和溶液降温到t 1℃时,三种溶液所含溶质质量的大小顺序是 。
二、河北中考试题1、(2006河北中考)如图是a 、b 、c 三种固体物质的溶解度曲线,下列说法不正确的是( )A.t 2℃时a 的溶解度等于b 的溶解度B. t 1℃时a 、c 饱和溶液的溶质质量分数相同C.c 的饱和溶液由t 1℃升温至t 2℃时,变成不饱和溶液D.当a 中含有少量b 时,可以采用降温的方法提纯a2、(2007河北中考)图1是a 、b 两种物质的溶解度曲线。
室温时,将盛有a 、b 饱和溶液的试管分别放入烧杯内的水中,均无晶体析出。

化学初三知识点总结溶解度一、溶解度的概念1. 溶解度是指在一定条件下,单位量的溶剂中最多能溶解的溶质质量。
2. 溶解度通常用溶质的质量分数或溶质溶液的摩尔浓度表示。
二、影响溶解度的因素1. 温度- 大多数固体在溶剂中的溶解度随温度的升高而增大。
- 气体在液体中的溶解度随温度的升高而减小。
- 气体在液体中的溶解度还随着压强的增大而增大。
2. 溶剂的种类- 溶质与溶剂之间的化学性质相仿的话,通常溶解度较大,反之溶解度较小。
3. 溶质的种类- 溶质颗粒的大小、形状和结晶度也会影响其在溶剂中的溶解度。
4. 溶解度的动力学因素- 搅拌速度、溶解过程中的晶体碰撞等均会影响溶解度。
三、饱和溶液1. 饱和溶液的特点- 饱和溶液是指在一定条件下,溶剂中溶质的质量达到最大值的溶液。
- 饱和溶液中的溶质以结晶或沉淀的形式存在。
- 在饱和溶液中,溶液中的溶质的质量分数或溶质的浓度是不变的,称之为饱和溶质的溶解度。
2. 饱和溶液的准则- 饱和溶液的组成和性质是确定的,可根据实验来确定。
- 饱和溶液中含有一定数量的溶质,在温度保持不变的情况下,饱和溶液中总质量不变。
四、饱和溶液中的平衡1. 反溶质的沉淀平衡- 在饱和溶液中的溶质的溶度是稳定的,但溶质颗粒始终在与溶质溶解的过程相互平衡着。
2. 溶解和析出的平衡- 在饱和溶液中,溶质颗粒在自发地溶解和析出过程之间达到动态平衡。
五、溶解度曲线1. 溶解度曲线的概念- 指在一定条件下,溶质在溶剂中的溶解度随温度的变化而变化的曲线。
- 溶解度曲线一般用温度为横坐标,单位量溶剂中的溶质质量为纵坐标。
2. 溶解度曲线的特点- 大多数溶解度随温度升高而增加的固体溶质的溶解度曲线均为上升曲线。
- 气体溶质在液体溶剂中的溶解度随温度升高而减小。
3. 溶解度曲线的应用- 溶解度曲线可用于实验方法中溶质溶解度的研究与测定。
- 溶解度曲线可用于反应热力学研究与计算。
- 溶解度曲线还可用于在溶液中进行不同溶质组成的晶体提纯等工业生产中。

溶解度曲线知识点总结(一)前言溶解度曲线是化学领域中的重要知识点,它描述了在不同温度下溶质在溶剂中的溶解程度。
通过研究溶解度曲线,可以了解溶解度随温度的变化规律,进一步推测溶质与溶剂之间的相互作用。
本文将介绍溶解度曲线的基本概念、表示方法以及相关的应用。
正文什么是溶解度曲线溶解度曲线是指在一定条件下,溶质在溶剂中溶解度与温度的关系曲线。
溶解度是指在一定温度和压力下,单位溶剂中存在的溶质的物质量。
溶解度曲线可以用来研究溶液的饱和度,即在某一温度下是否能溶解更多的溶质。
溶解度曲线表示方法溶解度曲线的表示方法有两种常用的方式: 1. 双坐标图:以温度为横坐标,溶质在溶剂中的溶解度为纵坐标。
通过连接各点,可以得到溶解度随温度变化的曲线。
2. 表格形式:将不同温度下溶质在溶剂中的溶解度整理成表格,以便进行比较和分析。
溶解度曲线的影响因素溶解度曲线的形状受到多种因素的影响,主要包括: - 温度:一般来说,温度升高,溶解度会增大;温度降低,溶解度会减小。
- 压力:对固体溶质在液体溶剂中的溶解度影响较小;对气体溶质在液体溶剂中的溶解度有明显影响。
- 溶质、溶剂的性质:溶质和溶剂之间的相互作用力会影响溶解度曲线的形状。
溶解度曲线的应用溶解度曲线在实际应用中有着广泛的用途,包括: - 判断溶液的饱和度:通过对溶解度曲线的观察,可以判断溶液是否达到饱和状态,并进一步分析不同条件下的溶解度变化情况。
- 预测溶解度:可以通过溶解度曲线来预测在不同温度下某种溶质在溶剂中的溶解度,为科研和工程实践提供依据。
- 调控晶体生长:通过控制温度、压力等条件,可以调控晶体的生长速率和形态,溶解度曲线为实现晶体生长的精确控制提供了理论基础。
结尾通过本文对溶解度曲线的介绍,我们了解到溶解度曲线是描述溶质在溶剂中溶解程度随温度变化的曲线。
溶解度曲线不仅有助于理解溶解度的基本概念,还可以应用于实际生产和科研中,提供重要参考和指导。
因此,熟悉和掌握溶解度曲线的知识对于化学领域的从业者来说是非常重要的。

溶解t/t 2 t 1 O m m 溶解度曲线知识点一、正确理解溶解度曲线的含义溶解度曲线就是在直角坐标系中,用来描述物质的溶解度随温度变化而变化的曲线。
根据溶解度曲线可进行溶液的配制,混合物的分离与提纯,以及进行物质结晶或溶解的计算。
下面,我们从溶解度曲线的特点入手,对溶解度作进一步的理解。
(一)点1.曲线上的点:表示对应温度下该物质的溶解度。
如:下图中a 表示A 物质在t 1℃时溶解度为m 1g 。
2.曲线上方的点:表示在对应温度下该物质的饱和溶液中存在不能继续溶解的溶质。
如:图中b 表示在t 1℃时,A 的饱和溶液中有(m 2-m 1)g 未溶解的溶质。
3.曲线下方的点:表示在对应温度下该物质的不饱和溶液。
如:图中C表示在t1℃时,A的不饱和溶液中,还需要加入(m1-m3)g A物质才达到饱和。
4.曲线交点:表示在对应温度下不同物质的溶解度相同。
如图中d表示在t2℃,A、B两物质的溶解度都为m4g。
(二)线t/如图中A物质的溶解度随温度升高而明显增大,A曲线为“陡升型”。
如KNO3等大多数固体物质。
图中B物质的溶解度随温度变化不大,B曲线为“缓升型”,如NaCl等少数固体物质。
图中C物质的溶解度随温度升高而减小,C曲线为“下降型”,如气体及Ca(OH)2等极少数固体物质。
二、掌握溶解度曲线的应用1.溶解度曲线上的每一点,代表着某温度下某物质的溶解度,因此利用溶解度曲线可以查出某物质在不同温度下的溶解度,并根据物质的溶解度判断其溶解性。
2.可以比较在同一温度下不同物质溶解度的相对大小。
3.根据溶解度曲线的形状走向,可以看出某物质的溶解度随温度的变化情况。
并根据此情况可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。
例如:某物质的溶解度曲线“陡”,表明该物质溶解度随温度变化明显,提纯或分离该物质时适合采用降温结晶法。
某物质溶解度曲线“平缓”,提纯或分离该物质时适合采用蒸发溶剂法。
4.从溶解度曲线上的交点,可以判断哪些物质在该点所示的温度下具有相同的溶解度。

溶解度曲线总结★★★★★固体溶解度曲线:○1固体溶解度曲线表示固体物质的 溶解度 随 温度 的变化情况。
○2溶解度曲线上的点表示_一定温度时某物质的溶解度为多少克_. ○3几条溶解度曲线的交点表示_一定温度时,几种物质的溶解度相等(都为多少克)_. ○4一定温度时某物质的饱和溶液中,溶质、溶剂的质量比为 S:100g ,溶质和饱和溶液的质量比为 S:(100g+S) ,溶质、溶剂、饱和溶液的质量比为 S:100g:(S+100g) .○5一定温度时,若不同固体的溶解度相等,则该温度时这几种物质的饱和溶液中溶质的质量分数相等。
○6一定温度时,几种不同固体,若溶解度越小,则该温度时其饱和溶液就越稀;若溶解度越大,则该温度时其饱和溶液就越浓。
○7一定温度时,几种不同固体,溶解度越大,则用等量的水配制饱和溶液时溶解的该物质就越多。
○8一定温度时,等质量的几种不同固体,若溶解度越小,则配制饱和溶液时所需要的水就越多。
○9一定温度时,等质量的几种饱和溶液,若溶解度越小,则其对应的饱和溶液越稀,溶质越少,溶剂就越多。
○10固体溶解度受温度影响的变化规律:大多数固体物质的溶解度随温度的升高而_增大_,如KNO 3 ;少数固体物质的溶解度受温度的影响_变化不大__,如_NaCl__;极少数固体物质的溶解度随温度的升高反而_减少_,如_熟石灰【Ca(OH)2】_。
结晶方法的选择:溶解度受温度影响变化相当大(温度升高溶解度明显增大,温度降低溶解度明显降低)的物质从溶液中结晶宜采用_降温结晶(冷却热饱和溶液)_,如_KNO 3 __,而且等溶剂或等质量的饱和溶液,若物质的溶解度受温度的影响变化越大,则降温时析出的晶体就越多;溶解度受温度影响变化不大的物质从溶液中结晶宜采用 蒸发结晶 ,如 NaCl 。
极少数溶解度随温度的升高反而减小的固体溶质从溶液中析出则采用升温结晶,如_熟石灰【Ca(OH)2】 。
从混合溶液中分离提纯几种可溶性固体溶质的混合物时,采用哪种结晶方法,则取决于固体的主要成分的溶解度受温度的影响情况。
初中化学溶解度曲线知识点讲解初中化学溶解度曲线知识点讲解溶解度曲线溶解度曲线,是同种物质在不同温度下的溶解度绘制出来的曲线。
下面是店铺整理的初中化学溶解度曲线知识点讲解,欢迎阅览。
溶解度曲线的意义①溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
②溶解度曲线上的每一个点表示溶质在某一温度下的溶解度。
此时,溶液必定是饱和溶液。
③两条曲线的交叉点表示两种物质在该温度下具有相同的溶解度。
在该温度下,这两种物质的饱和溶液中溶质的质量分数相等。
④在溶解度曲线的下方的点,表示该温度下的溶液是该物质的不饱和溶液。
⑤在溶解度曲线上方的点,表示该温度下的溶液是该物质的过饱和溶液,也就是说,在溶液中存在未溶解的溶质。
相信上面对化学中溶解度曲线的意义知识点的讲学习,同学们都能很好的掌握了吧,希望同学在考试中取得优异成绩。
初中化学溶解度曲线表示知识点讲解关于化学中溶解度曲线表示知识点的内容学习,希望同学们很好的掌握下面的内容。
溶解度曲线表示1点溶解度曲线上的每个点表示的是某温度下某种物质的溶解度。
2线溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
根据溶解度曲线,选择分离某些可溶性混合物的方法。
3交点两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同,此时两种物质饱和溶液的溶质质量分数也相同。
大部分固体随温度升高溶解度增大,如硝酸钾;少部分固体溶解度受温度影响不大,如食盐;极少数物质溶解度随温度升高反而减小,如氢氧化钙。
希望上对化学中溶解度曲线表示知识点的讲解学习,同学们都能很好的掌握上面的知识,相信同学们会从中学习的更好的。
初中化学金属与酸的置换反应知识讲解下面是对化学中金属与酸的置换反应知识的内容讲解,希望同学们认真学习下面的知识。
金属与酸的置换反应(1)金属的活动顺序。
只有排在氢前面的金属才能置换出酸里的氢(不是氢气);这里的酸常用稀盐酸和稀硫酸,不能用浓硫酸和硝酸(氧化性太强,得不到氢气而是水,不属于置换反应)。
初三化学溶解度曲线知识点初三化学溶解度曲线知识点一、溶解度曲线图上的点1、溶解度曲线上的点:表示在该点所示温度下某物质的溶解度。
如A点表示当温度为t2时,物质R的溶解度为ag。
2、两条曲线的交点:表示在该点所示温度下,两种物质的溶解度相同。
如B 点表示当温度为t1时,物质R和N的溶解度相等,都为bg。
二、溶解度曲线图上的线每一条曲线都表示这种物质的溶解度随温度变化而变化的总趋势,主要有:1、陡升型:绝大多数固体物质的溶解度随温度的升高而增大,曲线陡峭。
如曲线R,代表物质有KNO3、NH4NO3等。
2、缓升型:少数固体物质的溶解度受温度的影响较小。
如曲线M,代表物质有NaCl。
3、下降型:极少数固体物质的溶解度随温度的升高而减小。
如曲线N,代表物质有Ca(OH)2。
三、溶解度曲线图上的面1、在溶解度曲线上方平面上的任何点:表示在该点所示温度下形成了含有部分固体溶质的饱和溶液,即按照该点所示温度和溶质质量,在100g溶剂中配制得到的溶液是饱和溶液,且还有未溶解完的溶质存在。
如C点。
2、在溶解度曲线下方平面上的任何点:表示在该点所示温度下形成了不饱和溶液,即按照该点所示温度和溶质质量,在100g溶剂中配制得到的溶液是不饱和溶液。
如D点。
四、溶解度曲线图的综合应用1、溶解度曲线上的每一点都代表着对应温度下该物质的溶解度,所以利用溶解度曲线可以查找出某种物质在不同温度时的溶解度。
2、根据溶解度曲线的走向,可以判断或比较各物质的溶解度随温度变化的趋势。
3、可以比较在同一温度下不同物质的溶解度大小。
如在t3时,R、M、N三种物质的溶解度由小到大的顺序为N < M < R。
初三化学,溶解度曲线解题技巧溶解度曲线题型可从点、线、面和交点四个方面进行解答:1.溶解度曲线上的点:溶解度曲线上的每一个点都是表示的是某温度下某种物质的溶解度。
溶解度曲线上的点有以下作用:1⃣️可根据已知温度查出相关物质对应的溶解度;2⃣️可根据物质的溶解度查出其对应的温度;3⃣️也可以比较相同温度下不同物质溶解度的大小或者饱和溶液中溶质的质量分数的大小。
常用化学知识同步推荐溶解度曲线表示知识点讲解
溶解度曲线表示
1点
溶解度曲线上的每个点表示的是某温度下某种物质的溶解度。
2线
溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
根据溶解度曲线,选择分离某些可溶性混合物的。
3交点
两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同,此时两种物质饱和溶液的溶质质量分数也相同。
大部分固体随温度升高溶解度增大,如硝酸钾;少部分固体溶解度受温度影响不大,如食盐;极少数物质溶解度随温度升高反而减小,如氢氧化钙。
初三化学知识点总结:溶解度曲线的意义
①溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
②溶解度曲线上的每一个点表示溶质在某一温度下的溶解度。
此时,溶液必定是饱和溶液。
③两条曲线的交叉点表示两种物质在该温度下具有相同的溶解度。
在该温度下,这两种物质的饱和溶液中溶质的质量分数相等。
④在溶解度曲线的下方的点,表示该温度下的溶液是该物质的不饱和溶液。
⑤在溶解度曲线上方的点,表示该温度下的溶液是该物质的过饱和溶液,也就是说,在溶液中存在未溶解的溶质。
初三化学溶解度知识点的归纳初三化学溶解度知识1、温度是影响固体物质溶解的唯一外界因素,振荡、搅拌只能加快固体物质的溶解速率,而不能改变固体的溶解度。
2、溶解度曲线既能定性地反映固体的溶解度受温度影响而变化的趋势(溶解度曲线的伸展方向),也能表示某固态物质在某温度下的溶解度,还能用于比较同一温度不同溶质的溶解3、气体的溶解度受温度和压强的影响。
温度一定,气体的溶解度随压强的增大而增大,随压强的减小而减小;压强一定,气体的溶解度随温度的升高而减小,随温度的降低而增大。
4、四点理解溶解度概念:①一定温度。
同一种固体物质在不同温度下对应的溶解度是不同的,因此必须指明温度。
②100g溶剂。
此处100 g是指溶剂质量,不能误认为溶液质量。
③饱和状态。
在一定温度下,某固态物质在100 g溶剂里所溶解的最大质量为这种物质在这种溶剂里的溶解度。
④单位:g[严格地说应该是g/100g(溶剂)]。
5、二角度比较饱和溶液与不饱和溶液:①首先要明确“一定条件”、“一定量的溶剂”。
在某一温度和一定量的溶剂里,对某种固态溶质来说饱和了,但若改变温度或改变溶剂的量,就可能使溶液不饱和了。
如室温下,100 g水中溶解31.6 g KNO3达到饱和,若升高温度或增大溶剂(水)量,原来饱和溶液就变为不饱和溶液。
所以溶液饱和与否,首先必须明确“一定条件”和“一定量的溶剂”。
②必须明确是某种溶质的饱和溶液或不饱和溶液。
如:在一定条件下不能再溶解食盐的溶液,可能还能继续溶解蔗糖,此时的溶液对于食盐来说是饱和溶液,但是对于蔗搪来说就是不饱和溶液。
6、根据溶解度曲线可以查出某温度下该物质的溶解度;也可以查出该物质已知溶解度所对应的温度。
曲线上的点即该物质对应温度时的溶解度,按其数据配成的溶液正好为饱和溶液;不同物质在同一温度下的溶解度的大小可借助不同物质的溶解度曲线加以比较。
几种物质溶解度曲线的交点,表示对应温度下几种物质的溶解度相等。
初中化学知识重点一、电离方程式H2SO4=2H++SO42-NaOH=Na++OH-Al2(SO4)3=2Al3++3SO42-二、物质的俗称和主要成分生石灰――CaO熟石灰、消石灰、石灰水的主要成分――Ca(OH)2石灰石、大理石――CaCO3食盐的主要成分――NaCl纯碱、口碱――N a2CO3烧碱、火碱、苛性钠――NaOH胆矾、蓝矾――CuSO4.5H2O碳酸钠晶体――Na2CO3.10H2O氨水――NH3.H2O三、金属活动性1、金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au2、金属活动性顺序的'意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
中考复习专题——溶解度曲线及溶质质量分数计算一、正确理解溶解度曲线的涵义溶解度曲线就是在直角坐标系中,用来描述物质的溶解度随温度变化而变化的曲线。
根据溶解度曲线可进行溶液的配制,混合物的分离与提纯,以及进行物质结晶或溶解的计算。
1、点① 曲线上的点:表示对应温度下该物质的溶解度。
曲线下方的点:表示在对应温度下该物质的不饱和溶液,可以通过加溶质或者降温的方法使其达到饱和状态。
②曲线交点:表示在对应温度下不同物质的溶解度相同。
2、线如图中A 物质的溶解度随温度升高而明显增大,A 曲线为“陡升型”。
如KNO 3等大多数固体物质:图中B 物质的溶解度随温度变化不大,B 曲线为“缓升型”,如NaCl 等少数固体物质。
图中C 物质的溶解度随温度升高而减小,C 曲线为“下降型”,如气体及Ca(OH)2等极少数固体物质。
二、掌握溶解度曲线的应用1. 溶解度曲线上的每一点,代表着某温度下某物质的溶解度,因此利用溶解度曲线可以查出某物质在不同温度下的溶解度,并根据物质的溶解度判断其溶解性。
2. 可以比较在同一温度下不同物质溶解度的相对大小。
3. 根据溶解度曲线的形状走向,可以看出某物质的溶解度随温度的变化情况。
并根据此情况可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。
例如:某物质的溶解度曲线“陡”,表明该物质溶解度随温度变化明显,提纯或分离该物质时适合采用降温结晶法。
某物质溶解度曲线“平缓”,提纯或分离该物质时适合采用蒸发溶剂法。
4. 从溶解度曲线上的交点,可以判断哪些物质在该点所示的温度下具有相同的溶解度。
5. 利用溶解度曲线可以确定一定质量的某物质的饱和溶液降温时析出晶体的质量。
练习:溶解度/g1.NaCl和KNO3的溶解度如下,请回答下列问题。
(1)60 ℃时,KNO3的溶解度是________;(2)20 ℃时,将50g NaCl固体加入盛有100 g水的烧杯中,充分溶解形成溶液的溶质质量分数是________;(3)当KNO3中混有少量NaCl时,提纯KNO3所采用的方法是________________________;(4)将60 ℃等质量的KNO3的饱和溶液和NaCl的饱和溶液降温到20 ℃,分别得到溶液甲和乙。
溶解度/g
t/℃
21m m m m 溶解度曲线知识点
一、正确理解溶解度曲线的涵义
溶解度曲线就是在直角坐标系中,用来描述物质的溶解度随温度变化而变化的曲线。
根据溶解度曲线可进行溶液的配制,混合物的分离与提纯,以及进行物质结晶或溶解的计算。
近年来,以溶解度曲线为切入点的题目已成为中考、竞赛命题的一个热点。
下面,我们从溶解度曲线的特点入手,对溶解度作进一步的理解。
1、 点
①曲线上的点:表示对应温度下该物质的溶解度。
如:下图中a 表示A 物质在t 1℃时溶解度为m 1g 。
曲线上方的点:表示在对应温度下该物质的饱和溶液中存在不能继续溶解的溶质。
如:图中b 表示在t 1℃时,A 的饱和溶液中有(m 2-m 1)g 未溶解的溶质。
曲线下方的点:表示在对应温度下该物质的不饱和溶液。
如:图中C 表示在t 1℃时,A 的不饱和溶液中,还需要加入(m 1-m 3)gA 物质才达到饱和。
②曲线交点:表示在对应温度下不同物质的溶解度相同。
如图中d 表示在t 2℃,A 、B 两物质的溶解度都为m 4g 。
2、线
如图中A 物质的溶解度随温度升高而明显增大,A 曲线为“陡升型”。
如KNO 3
等大多
溶解度/g
t/℃
数固体物质:
图中B物质的溶解度随温度变化不大,B曲线为“缓升型”,如NaCl等少数固体物质。
图中C物质的溶解度随温度升高而减小,C曲线为“下降型”,如气体及Ca(OH)2等极少数固体物质。
二、掌握溶解度曲线的应用
1. 溶解度曲线上的每一点,代表着某温度下某物质的溶解度,因此利用溶解度曲线可以查出某物质在不同温度下的溶解度,并根据物质的溶解度判断其溶解性。
2. 可以比较在同一温度下不同物质溶解度的相对大小。
3. 根据溶解度曲线的形状走向,可以看出某物质的溶解度随温度的变化情况。
并根据此情况可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。
例如:某物质的溶解度曲线“陡”,表明该物质溶解度随温度变化明显,提纯或分离该物质时适合采用降温结晶法。
某物质溶解度曲线“平缓”,提纯或分离该物质时适合采用蒸发溶剂法。
4. 从溶解度曲线上的交点,可以判断哪些物质在该点所示的温度下具有相同的溶解度。
5. 利用溶解度曲线可以确定一定质量的某物质的饱和溶液降温时析出晶体的质量。