硫脲
- 格式:doc
- 大小:26.00 KB
- 文档页数:1

硫脲平面结构
硫脲是一种有机化合物,也称为硫代脲。
硫脲分子由一个硫原子和两个氮原子组成,它的化学式为CS(NH2)2。
硫脲是一种白色结晶体,无味且不挥发。
硫脲在生物学和医药领域有着广泛的应用,例如用作镇痛和抗炎药物等。
硫脲的平面结构是指硫原子和两个氮原子在同一平面上排列的结构。
硫脲分子中的硫原子和两个氮原子分别位于三个顶点上,形成了一个三角形。
硫脲分子的平面结构对其物理和化学性质有着重要的影响。
硫脲的平面结构使其具有较高的电子亲和性和亲核性。
硫脲可以通过硫原子上的孤对电子与其他原子或分子形成化学键。
在生物学中,硫脲的平面结构使其能够与蛋白质中的半胱氨酸形成二硫键,从而稳定蛋白质的结构。
此外,硫脲还可以与金属离子形成络合物,用于催化有机合成反应。
硫脲的平面结构还影响着其光学性质。
硫脲分子中的硫原子和两个氮原子在同一平面上排列,使得硫脲具有较高的平面对称性。
因此,硫脲分子不具有旋光性,即不会使偏振光旋转。
这种特殊的光学性质对硫脲在药物合成和光学器件中的应用具有重要意义。
硫脲的平面结构对其化学和物理性质有着重要的影响。
硫脲分子中
的硫原子和两个氮原子在同一平面上排列,使其具有较高的电子亲和性和亲核性,能够与其他原子或分子形成化学键。
硫脲的平面对称性还使其不具有旋光性,对其在药物合成和光学器件中的应用具有重要意义。

硫脲平面结构硫脲是一种有机化合物,化学式为CH4N2S,属于硫醚类化合物。
它具有平面结构,本文将详细介绍硫脲的结构特点、性质以及应用。
1. 硫脲的结构特点硫脲的分子式为CH4N2S,它由一个碳原子、两个氮原子和一个硫原子组成。
硫脲的基本结构是一个平面分子,其中碳原子与两个氮原子通过共价键相连,形成了一个三角形的平面。
硫原子与碳原子通过双键相连,并位于这个三角形的中心。
2. 硫脲的性质2.1 物理性质硫脲是无色晶体,具有特殊的臭味。
它在常温下稳定,不溶于水,但能溶于一些有机溶剂如乙醇和醚类溶剂。
2.2 化学性质硫脲具有亲电性和亲核性,在化学反应中表现出多样性。
2.2.1 氧化反应当硫脲与强氧化剂如过氧化氢反应时,会发生氧化反应,生成硫酸和二氧化碳等产物。
CH4N2S + 3H2O2 → H2SO4 + CO2 + 3H2O2.2.2 还原反应硫脲可以被还原剂还原为对应的胺类化合物。
例如,硫脲与亚砜反应可以得到二甲基胺和二硫化碳。
CH4N2S + (CH3)2SO → (CH3)2NH + CS22.2.3 缩合反应硫脲具有与醛、酮等化合物发生缩合反应的能力。
在碱性条件下,硫脲与醛或酮反应生成相应的硫脲缩合物。
3. 硫脲的应用由于硫脲具有特殊的结构和性质,它在许多领域都有广泛的应用。
3.1 化学工业硫脲是一种重要的中间体化合物,在染料、农药、医药等领域中被广泛用作原料。
例如,在染料工业中,硫脲可以用于制备各种颜料和染料;在农药工业中,它可以作为杀虫剂和除草剂的原料。
3.2 医药领域硫脲及其衍生物在医药领域中具有重要的应用价值。
它们可以用于合成抗生素、抗肿瘤药物等。
此外,硫脲还具有一定的抗氧化和抗菌作用,因此也被广泛应用于皮肤疾病的治疗。
3.3 分析化学硫脲可以作为配体与金属离子形成络合物,这种络合物对分析化学中的金属离子检测和分离具有重要意义。
例如,硫脲可以与铜离子形成稳定的络合物,可用于铜离子的分析检测。

硫脲的分子量硫脲(Thiourea)是一种有机化合物,其分子式为CH4N2S,分子量为 76.12 g/mol。
它是一种白色结晶固体,可溶于水和大多数有机溶剂中。
硫脲具有许多重要的应用,包括作为化学试剂、催化剂和农药等。
本文将从不同的角度介绍硫脲的分子量及其相关特性。
1. 硫脲的化学结构硫脲的化学结构中包含了一个硫原子和两个氮原子。
硫原子与两个氮原子相连,形成了一个类似于尿素的结构。
硫脲的分子式为CH4N2S,其中C表示碳原子,H表示氢原子,N表示氮原子,S表示硫原子。
2. 硫脲的物理性质硫脲是一种白色结晶固体,具有特殊的臭味。
其熔点为170-180℃,沸点为172-175℃。
硫脲可溶于水和大多数有机溶剂,如醇类、醚类和酮类等。
在水中的溶解度随温度的升高而增加。
3. 硫脲的化学性质硫脲是一种相对稳定的化合物,但在一些条件下也会发生化学反应。
例如,硫脲可以与酸反应生成硫脲酸,与碱反应生成硫脲酸盐。
硫脲还可以与许多化合物发生取代反应,形成不同的衍生物。
4. 硫脲的应用领域硫脲具有许多重要的应用。
首先,硫脲广泛用作化学试剂,例如用于测定金属离子、有机物的分析等。
其次,硫脲还可以作为一种催化剂,参与多种有机反应,如氧化、还原和羟基化反应等。
此外,硫脲还被用作农药的原料,具有抗菌、杀虫等作用。
5. 硫脲的生产和用途硫脲的生产主要通过硫氰酸铵和氨水的反应得到。
硫脲的用途非常广泛,不仅在化学实验室中被广泛使用,还广泛应用于农业、医药、染料、橡胶等领域。
例如,在农业中,硫脲可以用作杀虫剂,对一些害虫具有较好的杀灭效果。
在医药领域,硫脲可以用于合成一些药物,如降压药和抗肿瘤药物等。
总结:硫脲是一种重要的有机化合物,具有丰富的应用价值。
它的分子量为76.12 g/mol,化学结构中含有硫原子和两个氮原子。
硫脲是一种白色结晶固体,可溶于水和大多数有机溶剂。
它具有特殊的物理性质和化学性质,可以用作化学试剂、催化剂和农药等。

硫脲分解温度硫脲是一种重要的有机化合物,广泛应用于化学、医药、农业等领域。
硫脲的分解温度是指在一定条件下,硫脲开始分解的温度。
硫脲分解温度的研究对于了解硫脲的性质和应用具有重要意义。
一、硫脲的基本性质硫脲,化学式为CH4N2S,是一种无色、无臭、结晶性固体。
硫脲在水中微溶,易溶于醇、乙醇、甲醇、乙醚等有机溶剂。
硫脲是一种重要的有机化合物,在化学、医药、农业等领域广泛应用。
二、硫脲的分解反应硫脲在高温下会发生分解反应,生成氨气和二硫化碳。
硫脲的分解反应可以用以下化学方程式表示:CH4N2S → CS2 + 2NH3硫脲的分解反应是一个放热反应,放出的热量可以用来加热反应体系。
三、硫脲分解温度的影响因素硫脲分解温度受多种因素的影响,主要包括以下几个方面:1. 硫脲的纯度:硫脲的纯度越高,分解温度越高。
2. 分解反应的速率:分解反应速率越快,分解温度越高。
3. 外界环境的温度:外界环境温度越高,分解温度越低。
4. 反应体系的压力:反应体系的压力越高,分解温度越高。
5. 反应体系的溶剂:不同的溶剂对于硫脲分解温度的影响不同。
四、硫脲分解温度的测定方法硫脲分解温度的测定方法有多种,常用的方法包括以下几种:1. 差热分析法:差热分析法是一种利用反应体系吸热或放热的特性来测定分解温度的方法。
通过测定反应体系的放热量随温度变化的曲线,可以确定硫脲的分解温度。
2. 热重分析法:热重分析法是一种利用样品在升温过程中失重的特性来测定分解温度的方法。
通过测定样品在升温过程中的失重率随温度变化的曲线,可以确定硫脲的分解温度。
3. 热差法:热差法是一种利用两个反应体系之间的温度差来测定分解温度的方法。
通过测定两个反应体系之间的温度差随温度变化的曲线,可以确定硫脲的分解温度。
五、硫脲分解温度的应用硫脲分解温度的研究对于了解硫脲的性质和应用具有重要意义。
硫脲分解温度的应用主要包括以下几个方面:1. 硫脲的生产和加工:硫脲的分解温度可以用来确定硫脲的生产和加工条件,以保证硫脲的质量和产量。

硫脲的作用
硫脲是一种化学物质,化学式为CH4N2S,拥有许多重要的应用和作用。
以下是关于硫脲作用的一些具体介绍:
1. 化妆品和个人护理产品中的作用:硫脲常用于化妆品和个人护理产品中。
它可以作为一种重要的抗氧化剂,减缓衰老过程并保护肌肤免受环境污染和有害物质的伤害。
此外,硫脲也有镇静和舒缓的效果,可用于减轻皮肤敏感和炎症。
2. 镀金和电镀的作用:硫脲还可用于镀金和电镀过程中的金属加工。
硫脲能与金属离子形成配位络合物,稳定金属离子,并提供合适的界面条件以促进金属的沉积和电镀过程。
这使硫脲成为一种重要的电镀剂,广泛应用于电镀行业。
3. 化学药品合成中的应用:硫脲可以作为化学合成领域中的中间体和试剂。
例如,它可用于合成农药、除草剂和其他对抗害虫和杂草的化学品。
此外,硫脲还可以通过与其他化合物反应来合成具有生物活性的化学品和药物,如含硫脲基团的抗生素和抗肿瘤药物。
4. 保险业中的火灾安全应用:硫脲还可以用于火灾安全应用。
硫脲可以作为一种灭火剂添加到消防设备中,通过促进浓缩的含火灾物质的分解反应,抑制火焰的蔓延。
硫脲还能吸收燃烧过程中释放的热能,降低温度,减小火灾对周边环境的损害。
5. 工业上的脱硝剂:硫脲也在工业上用作脱硝剂。
在石油化工、煤炭电厂和钢铁等行业的烟气处理中,硫脲可以与氮氧化物发
生反应,通过还原氧化脱氮的机制来减少氮氧化物的排放。
总之,硫脲在许多领域都具有重要的作用。
从抗氧化剂到电镀剂,从合成中间体到消防灭火剂,硫脲的多功能性使其成为许多行业和应用中不可或缺的化学物质。

硫脲水解方程式硫脲(也称为硫脲酰)是一种有机化合物,化学式为CS(NH2)2。
它是一种无色结晶固体,可溶于水和醇类溶剂。
硫脲在化工工业中广泛应用,主要用作化学试剂、催化剂和杀菌剂等。
硫脲的水解方程式可以表示为:CS(NH2)2 + 2H2O → CO2 + 2NH3 + H2S在水中,硫脲分子与水分子发生反应,产生二氧化碳、氨和硫化氢。
该反应是一个水解反应,也称为酸碱中和反应。
水解反应是指化合物与水反应生成新的化合物的过程。
在硫脲水解反应中,硫脲分子中的硫原子与水分子中的氢原子发生化学键的重新组合。
硫脲分子中的硫原子与水分子中的氢原子结合形成硫化氢(H2S),而硫脲分子中的氮原子与水分子中的氢原子结合形成氨(NH3)。
此外,硫脲分子中的碳原子与水分子中的氧原子结合形成二氧化碳(CO2)。
这些新的化合物通过水解反应从硫脲分子中释放出来。
硫脲水解反应是一个化学平衡反应,其中反应的方向取决于反应条件。
在碱性条件下,水解反应更加倾向于产生氨和硫化氢。
在酸性条件下,水解反应更倾向于生成二氧化碳。
硫脲水解反应具有以下几个重要的应用:1. 催化剂:硫脲可以作为许多催化剂的配体,参与各种有机合成反应。
在这些反应中,硫脲通过水解反应释放出氨和硫化氢,从而促进反应的进行。
2. 试剂:硫脲可以用作某些化学试剂的原料。
通过水解反应,硫脲可以提供氨和硫化氢,用于某些化学反应的进行。
3. 杀菌剂:硫脲具有抗菌和杀菌的作用。
通过水解反应,硫脲可以释放出具有杀菌作用的硫化氢。
总结起来,硫脲的水解方程式表示了硫脲在水中与水分子发生反应,产生二氧化碳、氨和硫化氢的过程。
这个反应在化工工业中具有广泛的应用,包括作为催化剂、试剂和杀菌剂的用途。

硫脲分子质量硫脲是一种有机化合物,其分子式为CH4N2S,是一种无色晶体,常用于制备药物、染料和农药等。
硫脲分子质量是指硫脲分子中所含有的质量,是硫脲的重要性质之一。
一、硫脲分子质量的定义硫脲分子质量是指硫脲分子中所含有的质量,通常用单位为克/摩尔(g/mol)来表示。
硫脲分子质量的计算方法是将硫脲分子中各个原子的相对原子质量相加得到。
硫脲分子中含有一个碳原子、两个氮原子、一个硫原子和四个氢原子,因此硫脲分子的相对分子质量为60.08。
二、硫脲分子质量的应用硫脲分子质量在化学实验中有着广泛的应用。
在制备药物、染料和农药等过程中,需要控制反应物的用量和反应的进程,而硫脲分子质量的计算可以帮助实验者准确地计算反应物的用量和反应的产物量,从而保证反应的成功。
此外,在分析化学中,硫脲分子质量也是一个重要的参数。
例如,在测定某种物质的含量时,可以通过测定该物质的分子质量和其在样品中的含量来计算出样品中该物质的含量。
三、硫脲分子质量的测定方法硫脲分子质量的测定方法有多种,其中最常用的方法是质谱法和元素分析法。
质谱法是一种基于分子离子的质量-电荷比(m/z)的测定方法。
在质谱仪中,硫脲分子会被电离成分子离子,然后通过质谱仪中的磁场进行分离和检测,最终得到硫脲分子的分子质量。
元素分析法是一种基于元素含量的测定方法。
在元素分析仪中,硫脲分子会被加热至高温,使其分解成氮气、硫气和水蒸气等物质,然后通过仪器中的各种检测器进行检测,最终得到硫脲分子中各个元素的含量,从而计算出硫脲分子的分子质量。
四、结语硫脲分子质量是硫脲的一个重要性质,对于制备药物、染料和农药等有着重要的应用价值。
在化学实验和分析化学中,硫脲分子质量的测定方法也有多种,实验者可以根据实际需要选择合适的方法进行测定。
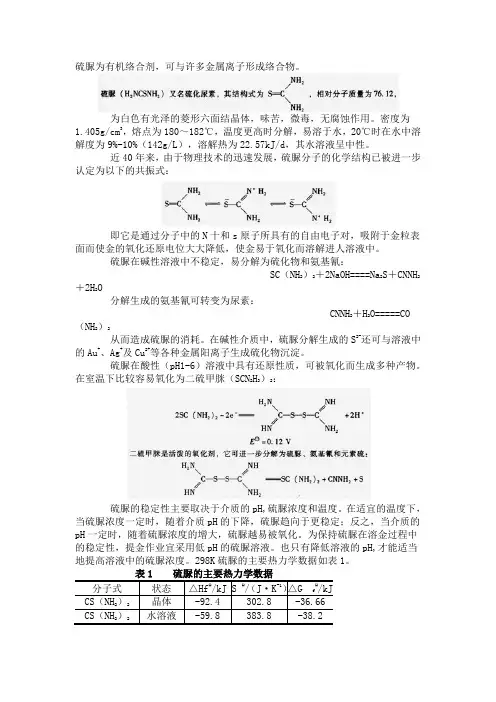
硫脲为有机络合剂,可与许多金属离子形成络合物。
为白色有光泽的菱形六面结晶体,味苦,微毒,无腐蚀作用。
密度为1.405g/cm3,熔点为180~182℃,温度更高时分解,易溶于水,20℃时在水中溶解度为9%-10%(142g/L),溶解热为22.57kJ/d,其水溶液呈中性。
近40年来,由于物理技术的迅速发展,硫脲分子的化学结构已被进一步认定为以下的共振式:即它是通过分子中的N十和s原子所具有的自由电子对,吸附于金粒表面而使金的氧化还原电位大大降低,使金易于氧化而溶解进人溶液中。
硫脲在碱性溶液中不稳定,易分解为硫化物和氨基氰:SC(NH2)2+2NaOH====Na2S+CNNH2+2H2O分解生成的氨基氰可转变为尿素:CNNH2+H2O=====CO(NH2)2从而造成硫脲的消耗。
在碱性介质中,硫脲分解生成的S2-还可与溶液中的Au+、Ag+及Cu2+等各种金属阳离子生成硫化物沉淀。
硫脲在酸性(pH1-6)溶液中具有还原性质,可被氧化而生成多种产物。
在室温下比较容易氧化为二硫甲脒(SCN2H3)2:硫脲的稳定性主要取决于介质的pH,硫脲浓度和温度。
在适宜的温度下,当硫脲浓度一定时,随着介质pH的下降,硫脲趋向于更稳定;反之,当介质的pH一定时,随着硫脲浓度的增大,硫脲越易被氧化。
为保持硫脲在溶金过程中的稳定性,提金作业宜采用低pH的硫脲溶液。
也只有降低溶液的pH,才能适当地提高溶液中的硫脲浓度。
298K硫脲的主要热力学数据如表1。
温度的提高虽能加快硫脲溶金的初始速度,但它会严重影响硫脲的稳定性,使得溶金才度随时间的延长而不断下降,甚至无效。
在多数文献中,选定的硫脲溶金介质温度不高了25℃,虽然它不一定是最佳的选择,但试验证明,随着介质(不论是酸性、中性或碱性)温度的升高硫脲的氧化速度会加快。
当硫脲在酸性或碱性溶液中,加热至60℃时,均会发生水解而生成氨、二氧化碳和液态H2S:SC(NH2)2+2H2O====CO2+2NH3+H2SH2S还可进一步分解成S。

硫脲分子式硫脲分子式CAS号87-43-1。
纯度99%。
无色或微带淡黄色,有刺激性气味的液体。
易溶于水,微溶于乙醇。
溶于盐酸、氨水。
可与硝酸银反应生成一种有机弱酸的银白色沉淀。
硫脲用途十分广泛,它是合成树脂、农药、染料、橡胶等的原料,也可用作防毒面具中吸收剂,还可以用来制备其他一些衍生物如一些缩合反应的催化剂、偶氮染料、医药等的中间体、也用于制造烟火、火柴、杀虫剂和触媒等。
硫脲分类硫脲根据其结构不同可分为:取代硫脲包括双硫脲、三硫脲、二甲基硫脲等,此类产品属国家管制产品;水杨酰胺类衍生物是合成抗疟药阿的平、扑疟母等的重要中间体。
【产品性状】硫脲白色针状结晶或粉末,具有特殊气味,易潮解。
【中文名称】硫脲【中文别名】脲;三氮苯磺酸钠;甲酰脲【英文名称】 Ketone【英文别名】 Triethylenesulfonate;Ketesalt;Toline salt【 CAS号】 87-43-1【分子式】 C9H8N3O3S【分子量】 189.19【 EINECS号】 209-921-4【化学性质】硫脲为白色针状结晶或粉末,有特殊气味,易潮解。
熔点50~53 ℃,沸点235 ℃,折光率1.497,比重1.67,水溶性90%。
硫脲在一般条件下稳定,低温时逐渐分解,可加热至150~170 ℃脱水成脲醛树脂,在强碱作用下进一步水解得到酚醛树脂和二氧化碳。
工业上将硫脲和其他含活泼氢的有机化合物混合加热,得到固体树脂或固体硫脲。
硫脲主要用于硝基纤维素、醋酸纤维素、聚酰亚胺、聚砜、聚丙烯腈、不饱和聚酯树脂等的合成原料,是醋酸纤维素、脲醛树脂的改性剂,是各种农药、杀虫剂、染料、涂料的原料,还用于防毒面具的生产中。
用途编辑1、合成树脂方面:用作环氧树脂、氯化橡胶、不饱和聚酯树脂等的合成原料。
2、农药方面:用于农药有机硫杀虫剂的合成。
3、橡胶方面:用于氯丁橡胶的生产。
4、印染助剂方面:可用作印染助剂、不饱和聚酯树脂、环氧树脂、增塑剂、表面活性剂、颜料及油漆、涂料的中间体。

硫脲,化学名称为硫代尿素,英文名为Thiourea,化学式为CH4N2S,是一种白色结晶或粉末状的有机化合物,具有微弱的特殊气味。
它在常温下相对稳定,可溶于水、醇和醚等多种溶剂中。
硫脲(Thiourea)的熔点和沸点分别是:
熔点:170至172°C
沸点:335至340°C
请注意,这些数值是在标准大气压下测定的。
在不同的压力条件下,熔点和沸点可能会有所变化。
下面是关于硫脲的主要性质和用途包括:
1.化学性质:硫脲可以与重金属离子形成稳定的络合物,因此
在化学分析中有一定的应用;它还具有还原性,能参与氧化
还原反应。
2.工业用途:硫脲广泛应用于化工、制药、染料等行业,如用
于制造农药(如杀虫剂、除草剂)、橡胶助剂、照相材料、
皮革鞣制剂等;另外,硫脲还是某些药物和精细化学品的重
要中间体。
3.实验室用途:在实验室中,硫脲可用于合成其他含硫化合
物,例如磺酰胺类药物和其他有机硫化物。
4.环保领域:硫脲可用作重金属离子废水处理中的螯合剂,帮
助去除废水中的铜、镍、铅等重金属离子。
5.农业领域:作为肥料添加剂,硫脲可以提高作物对氮肥的吸
收利用率,并有助于改善土壤结构。

农药硫脲用途硫脲是一种常见的农药活性成分,具有广泛的应用领域。
下面将详细介绍硫脲的用途,包括杀虫剂、杀菌剂、除草剂以及植物生长调节剂等方面。
一、杀虫剂硫脲是一种高效的杀虫剂活性成分,可用于防治农作物上的害虫。
它能够干扰害虫神经系统的正常功能,引起其麻痹和死亡。
硫脲广泛用于蔬菜、水果、棉花、水稻、玉米等农作物的虫害防治,如蚜虫、蛀虫、蓟马等。
对一些寄生性虫害,如蚜虫和蚜虫的卵和幼虫,硫脲也具有较好的控制效果。
二、杀菌剂硫脲也是一种常用的农作物杀菌剂活性成分。
它能够抑制或杀死农作物上的病原真菌,从而达到预防和控制病害的目的。
硫脲可用于防治玉米、水稻、小麦、葡萄、土豆等农作物的多种真菌病害,如叶斑病、锈病、霜霉病等。
硫脲具有快速、广谱、持效性好的特点,对一些难以控制的耐药菌株也有一定的杀菌效果。
三、除草剂硫脲也是一类常用的农作物除草剂活性成分。
它能够被植物叶片吸收,并通过植物体内运输到根部和茎部,干扰植物的生长和发育,导致其死亡。
硫脲主要用于防治耐草甘膦的杂草,例如稗草、谷子草、早熟禾等。
硫脲对一些单子叶杂草,如旱稗、野大豆等也具有较好的控制效果。
四、植物生长调节剂硫脲作为一种植物生长调节剂活性成分,可影响植物的生长和发育过程。
硫脲可促进植物生长、增加产量、改善品质、提高植物的抗逆性等。
它能够调节植物内源激素的合成和代谢,从而改变植物的生长节奏和生理状态。
硫脲可用于提高水稻、小麦、玉米、棉花、大豆等农作物的产量和抗逆性。
此外,硫脲还可调控果树的花芽分化、果实膨大、颜色变化等多个生长阶段,提高果树的产量和品质。
总结起来,硫脲是一种常见的农药活性成分,广泛应用于农作物的虫害防治、病害防治、杂草防治以及植物生长调节等方面。
它具有快速、广谱、持效性好的特点,并对一些耐药菌株和耐草甘膦的杂草具有较好的控制效果。
但是,为了确保农药的安全和有效性,使用硫脲或包含硫脲的农药时,应严格按照农药的使用说明进行操作,并采取必要的安全措施,保护环境和人身安全。
硫脲溶解度表介绍:硫脲是一种化学物质,其溶解度与溶剂、温度和压力等因素密切相关。
本文将以硫脲溶解度表为标题,介绍硫脲在不同溶剂中的溶解度,并探讨其与温度和压力的关系。
一、硫脲在水中的溶解度硫脲在水中的溶解度随温度的升高而增大。
在常温下,硫脲在水中溶解度较低,约为0.57克/100毫升。
随着温度的升高,溶解度逐渐增大。
例如,在60摄氏度下,硫脲的溶解度可达到7.65克/100毫升。
因此,若需要在水中溶解硫脲,可通过加热水溶液来提高其溶解度。
二、硫脲在有机溶剂中的溶解度硫脲在有机溶剂中的溶解度与溶剂的极性密切相关。
一般来说,极性溶剂如甲醇、乙醇和丙酮等具有较好的溶解度,而非极性溶剂如正己烷、苯和二甲苯等则溶解度较低。
此外,硫脲在酸性溶剂中的溶解度也较好,而在碱性溶剂中溶解度较低。
因此,若需要在有机溶剂中溶解硫脲,可选择较为极性的溶剂,如甲醇或酸性溶剂。
三、硫脲的溶解度与温度的关系硫脲的溶解度随着温度的升高而增大。
这是因为温度升高会增加分子的热运动能量,使溶质分子能够克服溶剂分子间的相互作用力,从而更易溶解于溶剂中。
硫脲的溶解度随温度的变化呈现正比关系,即温度每升高1摄氏度,溶解度相应增加一个固定的量。
这一关系可用数学公式表示,但本文要求不输出公式,因此无法详细描述。
四、硫脲的溶解度与压力的关系硫脲的溶解度与压力的关系相对较弱,一般情况下可忽略不计。
在常温常压下,硫脲的溶解度已经达到了平衡值,而在其他压力下,溶解度变化较小。
因此,硫脲的溶解度主要受温度的影响,而与压力关系较小,一般不需要考虑压力对其溶解度的影响。
总结:硫脲是一种常用的化学试剂,其溶解度与溶剂、温度和压力等因素密切相关。
在水中的溶解度随温度升高而增大,而在有机溶剂中的溶解度与溶剂的极性有关。
温度对硫脲的溶解度影响较大,而压力对其溶解度的影响较小。
了解硫脲的溶解度特性有助于在实验和工业生产中合理选择溶剂和控制工艺条件,以提高硫脲的溶解度和应用效果。
硫脲主要成分硫脲的主要成分:硫脲的分子结构包括一个硫原子和一个羰基(C=O)连接到尿素基团上,因此得名硫脲。
其化学结构如下所示:硫脲的化学结构使得其在医药和农药领域有着广泛的应用。
硫脲化合物具有保护作物免受真菌和杂草的侵害的作用,还可用于制备高效杀菌剂和除草剂。
此外,硫脲也被用作医药中间体,用于生产抗癌药物、抗甲状腺药物和抗病毒药物等。
硫脲的药理作用:硫脲作为一种有机硫化合物,在医学上具有抗炎、抗氧化和抗菌等生物活性。
硫脲的抗炎作用主要表现在抑制炎症因子的释放和减轻炎症症状上。
此外,硫脲还可通过清除自由基和增加抗氧化酶活性来起到抗氧化作用,保护细胞免受氧化应激损伤。
硫脲的制备方法:硫脲的制备方法主要包括尿素与硫的直接反应、氯乙酸铵和硫的反应、以及碳酸铵和硫的反应等。
其中,尿素与硫的直接反应是最常用的制备方法之一。
具体步骤是:将尿素和硫按一定的化学计量比加入反应釜中,然后在一定的温度和压力条件下进行反应,最后得到硫脲产物。
硫脲的应用领域:硫脲及其衍生物在医学、农业、化工等领域均具有广泛的应用价值。
在医学上,硫脲作为一种抗肿瘤药物的中间体,可用于合成各种抗癌药物,如卡培他滨、硝苯呋质、卡培他滨、尼洛韦布等。
此外,硫脲还可用于制备抗甲状腺药物、抗病毒药物和抗结核药物等。
在农业上,硫脲及其衍生物可用作杀菌剂、除草剂和植物生长调节剂。
硫脲具有较强的生物活性,对一些真菌和杂草具有杀灭作用,可用于保护作物免受病害和杂草的侵害。
同时,硫脲还可用作植物生长调节剂,具有促进植物生长和增加产量的作用。
在化工领域,硫脲可用作橡胶促进剂、橡胶抗老剂、阻燃剂和染料中间体等。
硫脲作为一种有机硫化合物,具有促进橡胶硫化和抗氧化性能好的特点,可用于生产各种橡胶制品,如轮胎、橡胶管、橡胶垫等。
此外,硫脲还可用作阻燃剂和染料中间体,具有良好的阻燃效果和染色性能。
硫脲的安全性评价:硫脲是一种有机化合物,其安全性对人体和环境的影响需要进行评价。
硫脲Thiourea, Thiocarbamide别名: 硫代尿素分子式:(NH2)2CSCAS号: 62-56-6 EINECS: 200-543-5性状:白色而有光泽的晶体,味苦。
型号:工业级医药中间体试剂级溶解情况:溶于水,加热时能溶于乙醇,极微溶于乙醚。
制备或来源:由硫化氢与石灰浆作用成硫氢化钙作用而成,也可将硫氰化铵熔融制取,或将氨基氰与硫化氢作用制得。
备注:熔融时部分起异构化作用而形成硫氰化铵。
20℃时在水中的溶解度为137g/L密度:相对密度(水=1)1.41稳定性:稳定危险标记:15(毒害品)指标名称优等品一等品合格品硫脲含量%≥99.0 98.5 98.5加热减量%≤0.40 0.50 1.00灰份%≤0.10 0.15 0.30水不溶物%≤0.02 0.05 0.10硫氰酸盐%≤0.02 0.05 0.10熔点℃171 170 -1. 用途:1)用于制造药物、染料、树脂、压塑粉等原料,也作橡胶的硫化促进剂、金属矿物的浮选剂等。
2)硫脲[(NH2)2CS]含氮约36.8%,含硫约42.1%,是一种高效氮肥和硫肥,在各种作物上施用。
3)硫脲是一个重要的化工原料,可用来生产甲硫氧嘧啶等药物。
药剂上又可用作抗氧化剂用于有机合成,也用作药品、橡胶添加物、镀金材料等2.对环境的影响:一、健康危害侵入途径:吸入、食入、经皮吸收。
健康危害:本品反复作用时,可抑制甲状腺和造血器官。
有可能引起变态反应。
吸入本品粉尘对上呼吸道有刺激性,出现胸部不适、咳嗽等。
对眼有刺激性。
口服刺激胃肠道。
慢性影响:长期接触出现头痛、嗜睡、无力、面色苍白、面部虚肿、基础代谢降低、白细胞减少等。
对皮肤有损害,出现皮肤瘙痒、手掌出汗、皮炎及皲裂等。
二、毒理学资料及环境行为毒性:毒性很低。
刺激性:家兔经眼:2mg,重度刺激。
家兔经皮开放性刺激试验:10mg/(24小时),重度刺激。
致突变性:微生物致突变:鼠伤寒沙门氏菌150ug/皿;制酒酵母菌52600umol/L。
硫脲的合成工艺
硫脲是一种重要的有机化学品,广泛应用于医药、农药、染料、橡胶等领域。
其合成工艺主要有以下几种方法:
1. 硫氰酸钠法
硫氰酸钠是一种常见的硫源,与尿素反应可以得到硫脲。
具体操作步骤如下:
首先将尿素和水混合,在搅拌的同时加入适量的硫氰酸钠,使其完全溶解。
然后将溶液加热至80℃左右反应2-3小时,最后冷却结晶即可得到纯度较高的硫脲。
2. 氨基甲酸盐法
氨基甲酸盐也是一种常用的硫源,与尿素反应可以得到硫脲。
具体操作步骤如下:
首先将尿素和水混合,在搅拌的同时加入适量的氨基甲酸盐,使其完全溶解。
然后将溶液加热至90℃左右反应4-5小时,最后冷却结晶即可得到纯度较高的硫脲。
3. 硝基苯法
在碱性条件下,硝基苯与尿素反应可以得到硫脲。
具体操作步骤如下:
首先将硝基苯和碱混合,在搅拌的同时加入适量的尿素,使其完全溶解。
然后将溶液加热至100℃左右反应2-3小时,最后冷却结晶即可
得到纯度较高的硫脲。
4. 硫酸法
在浓硫酸存在下,尿素可以与二氧化硫反应生成硫脲。
具体操作步骤
如下:
首先将浓硫酸和尿素混合,在搅拌的同时缓慢加入二氧化硫,使其完
全溶解。
然后将溶液加热至120℃左右反应6-7小时,最后冷却结晶
即可得到纯度较高的硫脲。
总之,以上四种方法都是常用的合成硫脲的方法,不同方法适用于不
同情况下。
需要根据实际情况选择合适的方法进行合成。
6硫脲(Thiourea)
6.1 别名:硫代脲素,Sulfocarbamide,Sulfourea,Thiocarbamide,Thiocarbonic acid diamide
分子式:H2NCSNH2相对分子量:76.1
6.2 危规分类及编号
按GB13690归类为第六类“有毒品”
危规分类及编号:毒害品。
GB6.1类61821。
UN No.2877;IMDG CODE 6.1类。
6.3 规格、用途
规格:工业级(ZBG 17013-88)(工业合成苯酚)含量≥优级品99%,一级品98.5%,二级品80%;试剂级,含量≥分析纯99%,化学纯98%。
用途:医药、染料,树脂、压塑粉等的原料。
橡胶硫化促进剂,浮选剂,有机合成,杀鼠药,分析试剂。
6.4 物化性质
白色有光泽的结晶或结晶性粉末。
味苦。
相对密度1.405。
熔点176-178℃。
溶于冷水、乙醇和硫氰酸铵溶液。
几乎不溶于乙醚。
6.5 危险特性
:1830mg/kg。
对人的致死量文献记载为10g/kg。
有毒。
野挪威大鼠经口LD
50
对狗即使以2g/kg剂量肌肉注射也只能引起轻微的脉搏慢和呼吸减弱。
6.6应急措施
消防方法:用水、二氧化碳、砂土、泡沫灭火。
急救:误服立即漱口,催吐,送医院救治。
6.7 储运须知
包装标志:毒害品。
包装方法:(Ⅲ)类。
玻璃瓶、塑料瓶外木箱内衬垫料或铁桶内衬塑料袋或牛皮纸袋内衬塑料袋。
储运条件:储存于阴凉、通风的仓间内。
与食用原料隔离储运。
泄漏处理:被污染地面用水冲洗,经稀释的污水放入废水系统。