双向凝胶电泳技术.
- 格式:ppt
- 大小:484.00 KB
- 文档页数:15

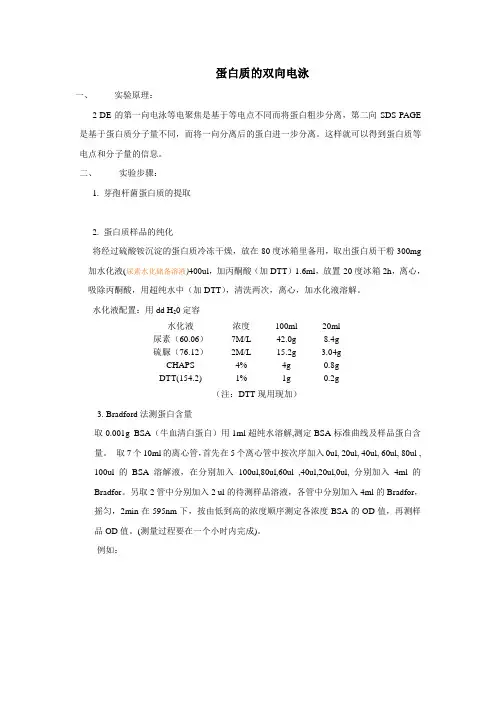
蛋白质的双向电泳一、实验原理:2-DE的第一向电泳等电聚焦是基于等电点不同而将蛋白粗步分离,第二向SDS-PAGE 是基于蛋白质分子量不同,而将一向分离后的蛋白进一步分离。
这样就可以得到蛋白质等电点和分子量的信息。
二、实验步骤:1. 芽孢杆菌蛋白质的提取2. 蛋白质样品的纯化将经过硫酸铵沉淀的蛋白质冷冻干燥,放在-80度冰箱里备用,取出蛋白质干粉300mg 加水化液(尿素水化储备溶液)400ul,加丙酮酸(加DTT)1.6ml,放置-20度冰箱2h,离心,吸除丙酮酸,用超纯水中(加DTT),清洗两次,离心,加水化液溶解。
水化液配置:用dd H20定容水化液浓度100ml 20ml尿素(60.06)7M/L 42.0g 8.4g硫脲(76.12)2M/L 15.2g 3.04gCHAPS 4% 4g 0.8gDTT(154.2) 1% 1g 0.2g(注:DTT现用现加)3. Bradford法测蛋白含量取0.001g BSA(牛血清白蛋白)用1ml超纯水溶解,测定BSA标准曲线及样品蛋白含量。
取7个10ml的离心管,首先在5个离心管中按次序加入0ul, 20ul, 40ul, 60ul, 80ul , 100ul的BSA溶解液,在分别加入100ul,80ul,60ul ,40ul,20ul,0ul, 分别加入4ml的Bradfor。
另取2管中分别加入2 ul的待测样品溶液,各管中分别加入4ml的Bradfor,摇匀,2min在595nm下,按由低到高的浓度顺序测定各浓度BSA的OD值,再测样品OD值。
(测量过程要在一个小时内完成)。
例如:标准曲线方程式:Y= aX+b.其中Y为OD值,X为蛋白含量。
a、b通过作图输入数据可知G250的配置:称取G250 固体0.1g加水定容至1L。
使用前滤纸过滤。
比色皿用70%的乙醇保存,待用时用双蒸水冲洗,再用无水乙醇冲洗,双蒸水冲洗,再加入待测样品溶液润洗,然后,加入样品,测定OD值。



双向电泳(two-dimensional electrophoresis,2-DE)-1一、蛋白质组学概论随着人类基因组计划的实施,生命科学步入了后基因组时代,出现了不同于以往经典生物实验科学的全新的研究方式─“生物大科学”。
这种生物大科学的核心思想是整体性研究,即以生物体内某类物质为对象进行完整的研究。
过去对生命活动的研究仅限于研究细胞内个别的基因或蛋白质,而基因组学和蛋白质组学的目标则是细胞内全部的基因和蛋白质。
因此,生物大科学与经典实验生物学在研究思路上有一个重要的区别:前者通常不针对具体的生物学问题或科学假设,其目标主要是把全部研究对象测定清楚,被称为“发现的科学”(Disco very Science);而后者属于“小科学”,其实施则离不开具体的生物学问题或科学假设,被称为“假设驱动的科学”(Hypothesis-drive n Science)。
显然,生物大科学与经典实验生物学各有其所长,前者“广”而后者“深”。
如何把这二者有机地结合起来,使得人们能够更深刻更全面的揭示生命复杂体系和行为,这是后基因组时代生命科学工作者面临的重要课题,系统生物学(Systems Biology)就是针对这样一个时代需求而产生的生命科学研究领域的一门新兴学科。
它以基因组学和蛋白质组学为基础,通过实验观察和数学建模的反复迭代过程来描述和预测生物系统的动态行为。
点此下载本文的PDF全文:双向电泳(two-dimensional electrophores is).pdf蛋白质组学是系统生物学的基础和组成部分之一,在后基因组学时代的地位尤为突出。
蛋白质组学的内容包括:表达蛋白质组学(express ion proteomics)、结构蛋白质组学(structural proteomics)和功能蛋白质组学(functional proteomics)。
双向电泳是蛋白质组学研究的经典方法之一,特别是对于表达蛋白质学的研究是不可缺少的手段。

3.1 全菌蛋白的制备将细菌接种于DMEM培养基,置于28℃培养箱培养18h。
参照Coelho 等(Coelho et al. 2004)的方法,略有改动。
用Wash buffer(10mmol/L TrisCl pH8.0,5mmol/L 醋酸镁)清洗细胞3次。
离心,细胞沉淀在Lysis Buffer( 7mol/L 尿素,2mol/L硫尿,1% IPG Buffer pH3-10或pH4-7,4% CHAPS,1% DTT,1%蛋白酶抑制剂,1%核酶抑制剂)中悬浮,使其浓度范围在5~10mg/mL。
置于冰上裂解2h。
13000r/min离心1h取上清,-80℃保存。
用2-D clean-up Kit 纯化蛋白,再用2-D Quant Kit测定样本中蛋白浓度。
3. 2 2-D Clean-Up Kit的使用方法(全程小心)蛋白质样本在1.5mL微型离心管中处理,所有步骤均在冰上进行。
1)将体积100μL的蛋白质样本(含1~100μg蛋白质)置于1.5mL微型离心管中。
加入300μL沉淀剂。
振荡或倒置搅匀。
冰浴中(4~5℃)培育15min。
2)加入300μL共沉淀剂,简单振荡混合一下,12000r/min离心5min。
3)将上清液尽量多地倾析或吸出,不要搅散沉淀。
保持沉淀不变,在其上面加入一层40μL共沉淀剂,冰上培育5min。
后离心5min,去上清。
4)往沉淀加入25μL蒸馏水或去离子水。
将管振荡5~10s,这时沉淀应散开,但并未溶解于水中。
在管中加入1mL洗涤缓冲液(在-20℃下至少预冷1h)和5μL洗涤添加剂,振荡直至沉淀完全散开。
-20℃下培育至少30min,每10min振荡20~30s。
5)将离心管以最大速度(至少12000r/min)离心5min。
小心地将上清液移走弃去。
此时应可见白色沉淀,将沉淀简单风干一下(不要超过5min)。
6)用裂解液溶解沉淀,以备第一向IEF电泳。
振荡管子至少30s,在室温下孵育,振荡或用移液管抽吸使之完全溶解。

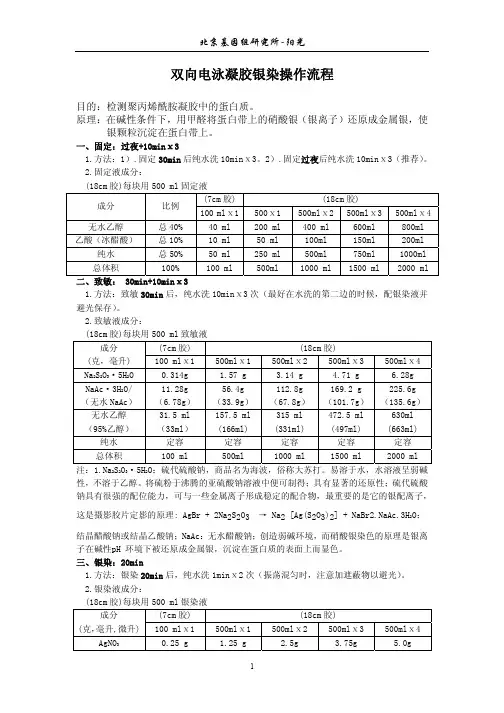
双向凝胶电泳(2-DE)双向凝胶电泳的原理是第一向基于蛋白质的等电点不同用等电聚焦分离,第二向则按分子量的不同用SDS-PAGE分离,把复杂蛋白混合物中的蛋白质在二维平面上分开。
近年来经过多方面改进已成为研究蛋白质组的最有使用价值的核心方法。
分离蛋白质组所有蛋白的两个关键参数是其分辨率和可重复性。
在目前情况下,双向凝胶电泳的一块胶板(16cm×20cm)可分出3~4千个,甚至1万个可检测的蛋白斑点,这与10万个基因可表达的蛋白数目相比还是太少了。
80年代开始采用固定化pH梯度胶,克服了载体两性电解质阴极漂移等许多缺点而得以建立非常稳定的可以随意精确设定的pH梯度。
由于可以建立很窄的pH范围(如0.05U/cm),对特别感兴趣的区域可在较窄的pH范围内做第二轮分析,从而大大提高了分辨率。
此种胶条已有商品生产,因此基本上解决了双向凝胶电泳重复性的问题。
这是双向凝胶电泳技术上的一个非常重要的突破。
第二向SDS-PAGE有垂直板电泳和水平超薄胶电泳两种做法,可分离10~100kD分子量的蛋白质。
其中灵敏度较高的银染色法可检测到4ng蛋白,最灵敏的还是用同位素标记,20ppm的标记蛋白就可通过其荧光或磷光的强度而测定。
用图像扫描仪、莱赛密度仪、电荷组合装置可把用上述方法得到的蛋白图谱数字化,再经过计算机处理,去除纵向和横向的曳尾以及背景底色,就可以给出所有蛋白斑点的准确位置和强度,得到布满蛋白斑点的图像,即所谓“参考胶图谱”。
蛋白质组研究的主要困难是对用双向凝胶电泳分离出来的蛋白,进行定性和定量的分析。
最常用的方法是先把胶上的蛋白印迹到PVDF(polyvinylidene difluoride)膜上后再进行分析,确定它们是已知还是未知蛋白。
现在的分级分析法是先做快速的氨基酸组成分析,也可先做4~5个循环的N末端微量测序,再做氨基酸组成分析;结合在电泳胶板上估计的等点电和分子量,查对数据库中已知蛋白的数据,即可作出判断。


蛋白质双向凝胶电泳原理及应用一、双向凝胶电泳(2-DE)的原理双向凝胶电泳(two-dimensional electrophoresis,2-DE)的原理是第一向基于蛋白质的等电点不同用等电聚焦分离,蛋白质沿pH梯度分离至各自的等电点;第二向则按分子量的差异用SDS-PAGE聚丙烯酰胺凝胶进行分离,把复杂蛋白混合物中的蛋白质在二维平面上分开。
近年来经过多方面改进已成为研究蛋白质组的最有使用价值的核心方法。
二、关键参数分辨率和可重复性。
目前,双向凝胶电泳的一块胶板(16cm×20cm)可分出3~4千个,甚至1万个可检测的蛋白斑点。
采用固定化pH梯度胶,克服了载体两性电解质阴极漂移等许多缺点而得以建立非常稳定的、可以随意精确设定的pH梯度。
建立很窄的pH范围(如0.05U/cm),对意向区域在pH范围内做第二轮分析,从而大大提高分辨率,威斯腾生物实验中心对这方面的研究比较全面和成熟。
灵敏度。
双向凝胶电泳灵敏度较高的银染色法可检测到4ng蛋白,最灵敏的是用同位素标记,20ppm的标记蛋白可通过其荧光或磷光的强度而测定。
双向凝胶电泳用图像扫描仪、莱赛密度仪、电荷组合装置可把用上述方法得到的蛋白图谱数字化,再经过计算机处理,就可以给出所有蛋白斑点的准确位置和强度,得到布满蛋白斑点的图像,即“参考胶图谱”。
三、蛋白质组研究的主要困难对用双向凝胶电泳分离出来的蛋白,进行定性和定量分析。
双向凝胶电泳最常用的方法是先把胶上的蛋白印迹到PVDF膜上后再进行分析,确定是已知还是未知蛋白。
现在的分级分析法是先做快速的氨基酸组成分析,也可先做4~5个循环的N末端微量测序,再做氨基酸组成分析;结合在电泳胶板上估计的等点电和分子量,查对数据库中已知蛋白的数据,即可作出判断。
四、蛋白质的翻译后修饰和加工指在肽链合成完成后进行的化学反应,如磷酸化、羟基化、糖基化、二硫键形成等,可能有一百种以上。
双向凝胶电泳翻译后修饰和加工对蛋白质的正常生理功能是必需的,它们的变化往往和疾病的发生有关。

双向凝胶电泳和二维色谱技术检测大肠癌蛋白质谱的意义李峰师庆红张晓静何成彦赵丽纯1郭宏华(吉林大学中日联谊医院,吉林长春130033)〔摘要〕目的利用双向凝胶电泳和二维色谱技术分析Dukes B 期大肠癌肿瘤与癌旁组织蛋白质差异,为大肠癌的早期诊断、生物学治疗寻找新的靶点。
方法①双向凝胶电泳技术和质谱技术鉴定大肠癌肿瘤与癌旁组织的差异蛋白质组;②二维色谱技术和质谱技术鉴定大肠癌肿瘤与癌旁组织的差异蛋白质组。
结果在大肠癌肿瘤组织与癌旁组织差异蛋白中两种技术路线有13个蛋白得到一致的鉴定结果,其中在肿瘤组织中表达上调的有7个,表达下调的有6个。
结论两种技术路线共同鉴定出的差异蛋白质是有意义的,对研究大肠癌的发病、转移及复发机制提供了依据和方向。
〔关键词〕双向凝胶电泳;二维色谱技术;质谱;大肠癌;蛋白质组学〔中图分类号〕R735〔文献标识码〕A〔文章编号〕1005-9202(2012)03-0497-03;doi :10.3969/j.issn.1005-9202.2012.03.026基金项目:吉林省科技厅资助项目(No.20100742,200705387,20050702-4,20090461)1吉林大学药学院通讯作者:郭宏华(1964-),女,副教授,副主任医师,硕士生导师,主要从事消化道肿瘤的发病机制及治疗研究。
第一作者:李峰(1979-),女,在读硕士,主要从事肿瘤分子生物学研究。
大肠癌(colon cancer )是一种常见的消化道恶性肿瘤,死亡率在世界范围内居各种肿瘤的第三位,在西方居第二位,并且发病率和死亡率均有逐年上升的趋势〔1,2〕。
大肠癌的发生和发展受到基因和环境等多种因素的影响,其病理机制复杂,从单一的基因突变和分子通道的变化难以全面理解大肠癌的发生机制。
蛋白质组学是近年来发展起来的新兴学科,已经广泛应用于肿瘤研究的诸多方面。
本文拟采用双向凝胶电泳和二维色谱技术分析Dukes B 期大肠癌肿瘤与癌旁组织蛋白质的差异性,为大肠癌的早期诊断、生物学治疗寻找新的靶点。