化学反应工程-第5章-复习
- 格式:ppt
- 大小:606.50 KB
- 文档页数:51


《化学反应工程原理》复习思考题第一章绪论1、了解化学反应工程的研究内容和研究方法。
2、几个常用指标的定义及计算:转化率、选择性、收率。
第二章化学反应动力学1、化学反应速率的工程表示,气固相催化反应及气液相非均相反应反应区的取法。
2、反应速率常数的单位及其换算。
3、复杂反应的反应速率表达式(可逆、平行、连串、自催化)。
4、气固相催化反应的步骤及基本特征。
5、物理吸附与化学吸附的特点。
6、理想吸附等温方程的导出及应用(单组分吸附、解离吸附、混合吸附)。
7、气固相催化反应动力学方程的推导步骤。
8、不同控制步骤的理想吸附模型的动力学方程的推导。
9、由已知的动力学方程推测反应机理。
第三章理想间歇反应器与典型化学反应的基本特征1、反应器设计的基本方程式。
2、理想间歇反应器的特点。
3、理想间歇反应器等温、等容一级、二级反应反应时间的计算及反应器体积的计算。
4、自催化反应的特点及最佳工艺条件的确定及最佳反应器形式的选择。
5、理想间歇反应器最优反应时间的计算.7、可逆反应的反应速率,分析其浓度效应及温度效应。
8、平行反应选择率的浓度效应及温度效应分析。
9、平行反应反应器形式和操作方式的选择。
10、串连反应反应物及产物的浓度分布,t opt C p.max的计算。
11、串连反应的温度效应及浓度效应分析。
第四章理想管式反应器1、理想管式反应器的特点。
2、理想管式反应器内进行一级、二级等容、变容反应的计算。
3、空时、空速、停留时间的概念及计算。
4、膨胀率、膨胀因子的定义,变分子数反应过程反应器的计算。
第五章理想连续流动釜式反应器1、全混流反应器的特点。
2、全混流反应器的基础方程及应用。
3、全混釜中进行零级、一级、二级等温、等容反应时的解析法计算。
4、全混釜的图解计算原理及图解示意。
5、全混流反应器中的浓度分布与返混,返混对反应的影响。
6、返混产生的原因及限制返混的措施。
7、多釜串联反应器进行一级、二级不可逆反应的解析法计算。



第一章绪论1. 化学反应工程是一门研究______________的科学。
(化学反应的工程问题)2。
化学反应工程是一门研究化学反应的工程问题的科学,既以_______作为研究对象,又以_______为研究对象的学科体系。
(化学反应、工程问题)3。
_______是化学反应工程的基础。
(三传一反)4。
化学反应过程按操作方法分为_______、_______、_______操作.(分批式操作、连续式操作、半分批式)5。
化学反应工程中的“三传一反"中的三传是指_______、_______、_______。
(传质、传热、动量传递)6。
不论是设计、放大或控制,都需要对研究对象作出定量的描述,也就要用数学式来表达个参数间的关系,简称_______.(数学模型)7. 在建立数学模型时,根据基础资料建立物料、热量和动量衡算式的一般式为_______。
(累积量=输入量-输出量)8。
“三传一反”是化学反应工程的基础,其中所谓的一反是指_______.(D) A.化学反应 B。
反应工程 C。
反应热力学 D。
反应动力学9.“三传一反”是化学反应工程的基础,下列不属于三传的是_______。
(A)A. 能量传递B. 质量传递C. 热量传递D. 动量传递第二章均相反应动力学1. 均相反应是指_。
(参与反应的物质均处于同一相)2. 对于反应,则_______.()3。
着眼反应组分K的转化率的定义式为_______。
()4.当计量方程中计量系数的代数和等于零时,这种反应称为_______,否则称为_______。
(等分子反应、非等分子反应)5。
化学反应速率式为,用浓度表示的速率常数为,假定符合理想气体状态方程,如用压力表示的速率常数,则=_______.()6.化学反应的总级数为n,如用浓度表示的速率常数为,用逸度表示的速率常数,则=_______.()7. 化学反应的总级数为n,如用浓度表示的速率常数为,用气体摩尔分率表示的速率常数,则=_______。



反应工程复习题摘要第一章绪论.1 .化学反应工程是一门研究__ _ _ _ _的科学。
2 .化学反应工程是一门研究化学反应的工程问题的科学,既以__ _作为研究对象,又以_ _ _ _为研究对象的学科体系。
3 . _ _ _是化学反应工程的基础。
4 .化学反应困呈按操作方法分为__ _、__ _、__ _操作。
5 .化学反应工程中的“三传一反”中的三传是指、、。
6 .不论是设计、放大或控制,都需要对研究对象作出定量的描述,也就要用数学式来表达个参数间的关系,简称。
第二章均相反应动力学一、填空1 .均相反应是指。
5 .活化能的大小直接反映了对温度的敏感程度。
P (主)6 .平行反应A S (副)均为一级不可逆反应,若E E >副主,选择性P S 与无关,仅是的函数。
8 . 一级连串反应 12K K A P S ??→??→在全混流釜式反应器中,则目的产物P 的最大浓度max pC =___apv t =____9 . 一级连串反应 12K K A P S ??→??→在平推流反应器中,则目的产物P 的最大浓度max p C =___apv t =____二、选择题1 .化学反应222222NO H N H O +?+,其中化学反应计量系数为+2的是哪种物质_。
A.NOB.H2C.N2D.H2O 2 .对于一非恒容均相化学反应B A B A αα?,反应组分A的化学反应速率A r -=_。
A .Vdt dn r A A -=- B. Vdt dn r A A =- C. dt dC r A A =- D.dt dC rB A =-3 .对于反应aA + bB 一pP +sS ,则P r ____()A r - A.a pB.a pC. p aD. p a4 .气相反应43A B R S +→+进料时无惰性气体,A 与B 以3:1的摩尔比进,则膨胀因子A δ= ____A.1/4B.2/3C.-1/4D.-2/35 . 气相反应2423CO H CH H O ++?进料时无惰性气体,CO 与2H 以1:2摩尔比进料,则膨胀因子CO δ=___A.-2B.-1C.1D.2 7 . 反应4102422C H C H H →+,12.0k s -=,则反应级数n=____。

第一章习题1化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系?答:化学反应式中计量系数恒为正值,化学计量方程中反应物的计量系数与化学反应式中数值相同,符号相反,对于产物二者相同。
2 何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么?何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么?答:如果反应物严格按照化学反应式一步直接转化生成产物,该反应是基元反应。
基元反应符合质量作用定律。
基元反应的活化能指1摩尔活化分子的平均能量比普通分子的平均能量的高出值。
基元反应的反应级数是该反应的反应分子数。
一切不符合质量作用定律的反应都是非基元反应。
非基元反应的活化能没有明确的物理意义,仅决定了反应速率对温度的敏感程度。
非基元反应的反应级数是经验数值,决定了反应速率对反应物浓度的敏感程度。
3若将反应速率写成tc rd d AA -=-,有什么条件? 答:化学反应的进行不引起物系体积的变化,即恒容。
4 为什么均相液相反应过程的动力学方程实验测定采用间歇反应器?答:在间歇反应器中可以直接得到反应时间和反应程度的关系,而这种关系仅是动力学方程的直接积分,与反应器大小和投料量无关。
5 现有如下基元反应过程,请写出各组分生成速率与浓度之间关系。
(1)A+2B →C (2)A+2B →C (3)2A+2B →CA+C →D B+C →D A+C →D C+D →E 解(1)D4C A 3D D 4C A 3C 22BA 1C C22B A 1B D4C A 3C 22B A 1A 22c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=(2)E6D C 5D 4C B 3D E 6D C 5D 4C B 3C 22BA 1C D4C B 3C 22B A 1B C22B A 1A 22c k c c k c k c c k r c k c c k c k c c k c k c c k r c k c c k c k c c k r c k c c k r +--=+-+--=+-+-=+-=(3)D4C A 3D D 4C A 3C 22B2A 1C C22B 2A 1B D 4C A 3C 22B 2A 1A 2222c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=6 气相基元反应A+2B →2P 在30℃和常压下的反应速率常数k c =2.65×104m 6kmol -2s -1。
第五章 非均相反应动力学1.工业催化剂所必备的三个主要条件是:_______、_______、_______。
(活性好、选择性高、寿命长)2.气体在固体表面上的吸附中物理吸附是靠_______结合的,而化学吸附是靠_______结合的。
(范德华力、化学键力)3.气体在固体表面上的吸附中物理吸附是_______分子层的,而化学吸附是_______分子层的。
(多、单)4.气体在固体表面上发生吸附时,描述在一定温度下气体吸附量与压力的关系式称为_______。
(吸附等温方程)5. _______吸附等温方程式是假定吸附热是随着表面覆盖度的增加而随幂数关系减少的。
(Freundlich )6._______吸附等温方程式是按吸附及脱附速率与覆盖率成指数函数的关系导出的。
(Temkin )7.固体催化剂的比表面积的经典测定方法是基于_______方程。
(BET )8.在气—固相催化反应中,反应速率一般是以单位催化剂的重量为基准的,如反应A →B ,A 的反应速率的定义为_______。
(dt dn W r A A ⋅-=-1) 9.对于气—固相催化反应,要测定真实的反应速率,必须首先排除_______和_______的影响。
(内扩散、外扩散)10.测定气固相催化速率检验外扩散影响时,可以同时改变催化剂装量和进料流量,但保持_______不变。
(0A F W )11.测定气固相催化速率检验外扩散影响时,可以同时改变_______和_______,但保持0A F W 不变。
(催化剂装量、进料流量)12.测定气固相催化速率检验内扩散影响时,可改变催化剂的_______,在恒定的0A F W 下测_______,看二者的变化关系。
[粒度(直径p d )、转化率]13.测定气固相催化速率检验内扩散影响时,可改变催化剂的粒度(直径p d ),在恒定的_______下测转化率,看二者的变化关系。
(0A F W ) 14.催化剂回转式反应器是把催化剂夹在框架中快速回转,从而排除_______影响和达到气相_______及反应器_______的目的。
反应工程知识点第1章绪论1.反应动力学主要研究化学反应进行的机理和速率。
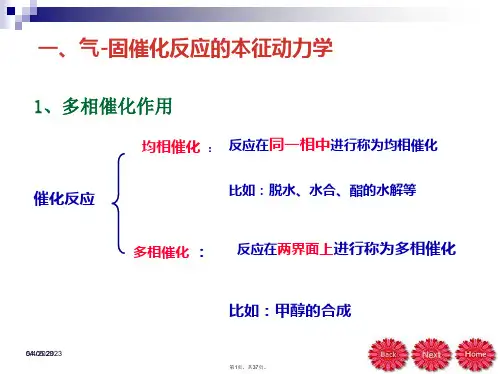
2.反应工程一般是按反应物系的相态来分类,将化学反应分为均相反应和多相反应两大类.3.根据反应过程是否使用催化剂,将化学反应分为催化反应和非催化反应两大类。
4.反应进度是指任何反应组分的反应量与其化学计量系数之比,反应进度永远为正值。
5.转化率是针对反应物而言的,收率则是对反应产物而言,转化率、收率和选择性三者的关系:Y=SX。
6.化学反应工程的主要研究对象是工业反应器,反应器设计的核心内容是确定反应体积,反应器设计最基本的内容是:①选择合适的反应器型式;②确定最佳的操作条件;③确定反应体积。
7.工业反应器放大主要方法是逐级经验放大法和数学模型法。
8.反应器类型可以搞看图填写。
9.工业反应器有三种操作方式:①间歇操作;②连续操作;③半间歇(或半连续操作).第2章反应动力学基础1。
反应速率是指单位时间内单位体积反应物系中某一反应组分的反应量.2。
以反应为例,其反应速率的表达式是或或,用反应进度表式反应速率的表达式:,其反应物转化量与反应产物生产量之间的关系。
3.在溶剂及催化剂和压力一定的情况下,定量描述反应速率与温度及浓度的关系的关系式叫做速率方程或动力学方程,其数学函数表达式,以以不可逆基元反应为例,其速率方程为.4.k为反应速率常数,为温度的函数,其关系式为。
5.绝大多数反应都是非基元反应,但是非基元反应可以看成是若干基元反应的综合结果,即反应机理。
6。
不论可逆反应还是不可逆反应,反应速率总是随着转化率的升高而降低(降低或升高);不可逆反应及可逆吸热反应,反应速率总是随着温度的升高而加快(减慢或加快);至于可逆吸热反应,反应温度按最佳温度曲线操作,反应速率最大.7。
在同一反应物系中同时进行若干个化学反应时,称为复合反应。
8。
独立反应是指这些反应中任何一个反应都不可能由其余反应进行线性组合而得到。
9.复合反应包括三个基本反应类型,即并列反应、平行反应和连串反应.10.当一个反应的反应产物同时又是另一个反应的反应物时,这类反应称为连串反应。
化学反应工程知识点化学反应工程知识点—郭锴主编1、化学反应工程学不仅研究化学反应速率与反应条件之间的关系,即化学反应动力学,而且着重研究传递过程对宏观化学反应速率的影响,研究不同类型反应器的特点及其与化学反应结果之间的关系。
2、任何化工生产,从原料到产品都可以概括为原料的预处理、化学反应过程和产物的后处理这三个部分,而化学反应过程是整个化工生产的核心。
3.化学反应工程的基本研究方法是数学模型法。
数学模型法是对复杂的、难以用数学全面描述的客观实体,人为地做某些假定,设想出一个简化模型,并通过对简化模型的数学求解,达到利用简单数学方程描述复杂物理过程的目的。
模型必须具有等效性,而且要与被描述的实体的那一方面的特性相似;模型必须进行合理简化,简化模型既要反映客观实体,又有便于数学求解和使用。
4.反应器按型式来分类可以分为管式反应器、槽式反应器(釜式反应器)和塔式反应器。
5反应器按传热条件分类,分为等温反应器、绝热反应器和非等温非绝热反应器。
第一章均相单一反应动力学和理想反应器1、目前普遍使用关键组分A 的转化率来描述一个化学反应进行的程度,其定义为:00A A A A A A n n n x -==组分的起始量组分量转化了的 2、化学反应速率定义(严格定义)为单位反应体系内反应程度随时间的变化率。
其数学表达式为dtd V r ξ1=。
3、对于反应D C B A 432+=+,反应物A 的消耗速率表达式为dt dn V r A A 1-=-;反应产物C 的生成速率表达式为:dtdn V r C C 1= 4.反应动力学方程:定量描述反应速率与影响反应速率之间的关系式称为反应动力学方程。
大量的实验表明,均相反应的速率是反应物系的组成、温度和压力的函数。
5.阿累尼乌斯关系式为RT E C C e k k -=0,其中活化能反应了反应速率对温度变化的敏感程度。
6、半衰期:是指转化率从0变为50%所需时间为该反应的半衰期。