第三节化学平衡---等效平衡
- 格式:ppt
- 大小:642.00 KB
- 文档页数:24
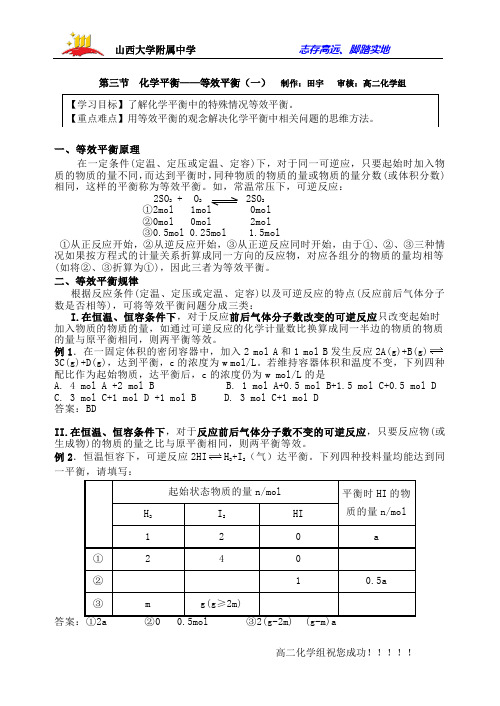
第三节 化学平衡——等效平衡(一) 制作:田宇 审核:高二化学组一、等效平衡原理在一定条件(定温、定压或定温、定容)下,对于同一可逆应,只要起始时加入物质的物质的量不同,而达到平衡时,同种物质的物质的量或物质的量分数(或体积分数)相同,这样的平衡称为等效平衡。
如,常温常压下,可逆反应:2SO 2 + O 22SO 2①2mol ②0mol 0mol 2mol③0.5mol 0.25mol 1.5mol①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者为等效平衡。
二、等效平衡规律根据反应条件(定温、定压或定温、定容)以及可逆反应的特点(反应前后气体分子数是否相等),可将等效平衡问题分成三类:I.在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效。
例1.在一固定体积的密闭容器中,加入2 mol A 和1 mol B 发生反应2A(g)+B(g)3C(g)+D(g),达到平衡,c 的浓度为w mol/L 。
若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,c 的浓度仍为w mol/L 的是A. 4 mol A +2 mol BB. 1 mol A+0.5 mol B+1.5 mol C+0.5 mol DC. 3 mol C+1 mol D +1 mol BD. 3 mol C+1 mol D答案:BDII.在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量之比与原平衡相同,则两平衡等效。
例2.恒温恒容下,可逆反应2HI H 2+I 2(气)达平衡。
下列四种投料量均能达到同III.在恒温、恒压下,改变起始时加入物质的物质的量,只要按化学计量数换算成同一半边的物质的物质的量之比与原平衡相同,则达平衡后与原平衡等效。



化学平衡----等效平衡有关化学平衡的等效平衡类知识,是高考考查的重点知识之一。
(I)等效平衡有以下三种情况1、恒温恒容,可逆反应前后气体前化学计量数之和不等。
条件:加入的物质的物质的量与原平衡相同结论:①平衡时各物质的物质的量与原平衡相同②平衡时各物质的含量与原平衡相同2、恒温恒容,可逆反应前后气体前化学计量数之和相等。
条件:加入的物质的物质的量之比例与原平衡相同①平衡时各物质的含量与原平衡相同②平衡时,各物质是原平衡时的倍数与起始加入的为原平衡的倍数相同3、恒温、恒压条件、结论与乙相同(Ⅱ)方法:通过可逆反应的化学计量数比换算成同一边物质的物质的量看成是否相同或比例是否相同。
例6(2003江苏)恒温、恒压下,在一个可变容积的容器中发生如下反应:A(气)+B(气)C(气)(1)若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为_______________mol.(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为______mol。
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3amol,则x=________mol,y=________mol。
平衡时,B的物质的量____________(选填一个编号)(甲)大于2mol (乙)等于2mol(丙)小于2mol (丁)可能大于、等于或小于2mol作出此判断的理由是__________________________。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是_________________。
II 若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成bmolC.将b与(1)小题中的a进行比较__________(选填一个编号)(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a 和b 的大小 作出此判断的理由是_______________________________。

《化学平衡》平衡中的等效平衡在化学世界中,“化学平衡”是一个至关重要的概念,而其中的“等效平衡”更是理解和解决许多化学问题的关键。
今天,咱们就来好好聊聊这神奇的等效平衡。
想象一下,在一个封闭的容器里,发生着一场化学变化。
反应物们努力地转化为生成物,生成物们也不甘示弱,又试图变回反应物。
当双方的转化速率达到相等的时候,化学平衡就形成了。
而等效平衡呢,就是在不同的起始条件下,最终达到的平衡状态相同。
等效平衡有三种类型,咱们一个一个来。
第一种是恒温恒容条件下的等效平衡。
比如说,对于一个反应 aA(g) + bB(g) ⇌ cC(g) + dD(g),如果 a + b = c + d,那么只要起始加入的物质的量按照化学计量数换算成同一边的物质,其物质的量对应相等,就能达到等效平衡。
举个例子,有个容器中发生反应 2A(g) + B(g) ⇌ 3C(g) + D(g),如果一开始加入 2 mol A 和 1 mol B,和一开始加入 4 mol A 和 2 mol B,最终达到的平衡状态就是等效的。
因为在恒温恒容的条件下,这两种起始加入的情况,经过反应的进行,最终各物质的浓度、分压等都会相同。
再来说说恒温恒容下,当 a +b ≠ c + d 时的情况。
这时候,要想达到等效平衡,起始加入的物质就必须完全相同。
比如反应 A(g) +2B(g) ⇌ 3C(g),如果一开始是 1 mol A 和 2 mol B,那要想达到等效平衡,起始加入的就必须也是 1 mol A 和 2 mol B,不能有任何偏差。
接下来是恒温恒压条件下的等效平衡。
在这种情况下,不管反应的方程式中各物质的化学计量数关系如何,只要起始加入的物质的量按照化学计量数换算成同一边的物质,其物质的量之比相等,就能达到等效平衡。
比如说,对于反应 2A(g) + 3B(g) ⇌ 4C(g) + 5D(g),一开始加入 2 mol A 和 3 mol B,和一开始加入 4 mol A 和 6 mol B,在恒温恒压的条件下,最终达到的平衡状态就是等效的。

等效平衡知识一、等效平衡的概念:在一定条件下,可逆反应无论从正反应开始还是从逆反应开始,还是从中间状态开始,达到的化学平衡状态是相同的,相同组分(同种物质)的百分含量(物质的量分数、体积分数、质量分数)相同,这样的平衡称为等效平衡。
对于:mA(g) +nB(g) 催化剂加热pC(g) +qD(g)m+n = p+q (△n(g)=0)恒温恒容m+n≠p+q (△n(g)≠0)等效平衡m+n = p+q (△n(g)=0)恒温恒压m+n≠p+q (△n(g)≠0)二、等效平衡的判断方法方法:放大缩小法、极限转换法或一边倒法(最重要的方法)【归纳总结】:(一)恒温、恒容:1:对于气态物质反应前后分子数不变化的可逆反应等效平衡的判断方法是: mA(g) +nB(g) 催化剂加热pC(g) +qD(g)m+n = p+q (△n(g)=0)使用极限转化的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的物质的量比是否相等。
若相等各组分百分量相同,n 、c 同比例变化,则为等效平衡2:对于气态物质反应前后分子数有变化的可逆反应等效平衡的判断方法是:mA(g) + nB(g) 催化剂加热 pC(g) + qD(g)m+n ≠p+q (△n(g)≠0)使用极限转化的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的物质的量是否对应完全相等。
若相等各组分百分量、n 、c 均相同,则为等效平衡(等同平衡)例1、恒温恒容时对于反应:H2(g) + I2(g) 催化剂加热 2HI(g)下列条件能与下图达到等效平衡的是( )A. 2 mol HIB. 2 mol H 2+2 mol I 2C. 1 mol H2+1 mol I 2+2 mol HID. 0.5 mol H 2+0.5 mol I 2+1 mol HI例2:在一个1L 的密闭容器中,加入2molA 和1molB ,发生下述反应: 2A(g)+B(g) 催化剂加热 3C(g)+D(s) 达到平衡时, C 的浓度为1.2mol/L 。
第三节化学平衡(3)—等效平衡学习目标知识与技能:理解等效平衡的含义。
过程与方法:1.自主学习,培养学生自学的能力。
2.通过比较、分析、归纳、总结,提高学生的理解能力。
情感态度与价值观:通过等效平衡的学习,加深理解“透过现象看本质”的道理。
自主学习(先学后教)1.等效平衡的含义在同一条件下的同一可逆反应,由于起始浓度不同可形成多个不同的平衡体系。
对同一可逆反应体系,起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的百分含量相同,这样的平衡称为等效平衡。
理解等效平衡的含义,回答下列问题:【问题1】形成“等效平衡”有什么条件?【问题2】形成“等效平衡”的反应类型?【问题3】形成“等效平衡”的对象是什么?【问题4】形成“等效平衡”的标志是什么?练习:在相同温度和压强下,1 L密闭容器中发生如下反应:CO(g)+H2高温2(g)+H2(g)CO H2O CO2H2投料1(mol) 1 1 0 0平衡时物质的量(mol)0.5 0.5 0.5 0.5 浓度(mol/L)0.5 0.5 0.5 0.5 物质的量的分数0.25 0.25 0.25 0.25 体积分数0.25 0.25 0.25 0.25 投料2(mol)0 0 1 1平衡时物质的量(mol)0.5 0.5 0.5 0.5 浓度(mol/L)0.5 0.5 0.5 0.5 物质的量的分数0.25 0.25 0.25 0.25 体积分数0.25 0.25 0.25 0.25观察上表,回答下列问题:【问题1】投料1和2达到化学平衡时,是否形成等效平衡?【问题2】若形成等效平衡,以上哪些数据可作为判断依据?【问题3】除上表数据外,你还可以根据什么数据判断是否形成等效平衡?2.等效平衡的分类(1)恒温恒容已知投料1、2、3能形成等效平衡,你能找出其中的规律吗?(2)恒温恒压已知投料1、2、3能形成等效平衡,你能找出其中的规律吗? 练习:对于反应2SO 2(g)+O 2(g)2SO 3(g),在500 ℃、1个标准大气压时,进行六次实验,实验时的有关物质的起始浓度数据如下:编 号 SO 2 O 2 SO 3 ⑴ 2a a 0 ⑵ 0 0 2a ⑶ a 0.5a a ⑷ 4a 2a 0 ⑸ 0 a 3a ⑹a0.5a3a其中达到平衡时属于等效平衡的体系有_ 。
仙源学校讲学稿课题:第三节化学平衡(第5课时)编号:0402035 日期月日【学习目标】1.了解化学平衡常数及其意义;Array2. 掌握化学平衡常数的应用【重点难点】化学平衡常数的应用。
【知识梳理】【学点一】化学平衡常数1.定义:在一定的温度下,当一个可逆反应达到化学平衡时,浓度幂之积与浓度幂之积的比值是一个常数,这个常数就是该反应的平衡常数。
符号为2.表达式:K= (对于 mA(g)+nB(g) pC(g)+qD(g) 来说)3.意义:(1) 表示可逆反应进行的程度,K值越大,正反应进行的程度,反应物的转化率(2)化学平衡常数只与有关,与其他因素无关。
若改变温度,引起平衡向正向移动,则K值增大;若改变温度,引起平衡向逆向移动,则K值减小。
4.注意事项(1)各物质的浓度必须是浓度,同时,固体和纯液体不列入平衡常数的表达式(2)若反应方向改变,则平衡常数变为原平衡的。
(3)若方程式中各物质的化学计量数等倍扩大或缩小,平衡常数也会改变。
(4)若两个方程式相加得出新的方程式,则新方程式的平衡常数等于两个方程式的平衡常数相乘。
【探究讨论】写出下列反应的化学平衡常数表达式:CaCO3CaO(s)+CO2(g) K=Cl2+H2O H++Cl-+HClO K=Cr2O72-+H202CrO42-+2H+ K=【学点二】化学平衡常数的应用应用1:利用平衡常数,计算逆反应的平衡常数【例题1】在相同温度下,①N2(g)+3H2(g) 2NH3(g) K1 =②2NH3(g) N2(g)+3H2(g) K2=③ 1/2 N2(g)+3/2 H2(g) NH3(g) K3=则K1与K2两者的关系则K1与K3两者的关系〖强化训练〗某温度下,SO2(g)+1/2O2(g) SO3(g)的平衡常数K1=50,在同一温度下2SO3(g) 2SO2(g)+O2(g)的平衡常数K2的值为()A.2500B.100C.4×10-4D.2×10-2应用2:利用平衡常数,判断反应的热效应【例题2】不同温度下,反应:H2(g)+I2(g) 2HI(g)的浓度平衡常数与温度的关系如下:O(g) CO【当堂训练】1.下列化学平衡常数的说法正确的是()A.化学平衡发生移动,平衡常数必发生变化 B.平衡常数发生变化,化学平衡必发生移动C.改变温度,平衡常数一定改变 D.催化剂改变达到平衡的时间,必引起平衡常数的改变2.在某温度下,可逆反应mA(g) + nB(g) pC(g) + qD(g)的平衡常数为K,下列说法正确的是()A.K值越小,达到平衡时,反应物的转化率越大B.K值越大,达到平衡时,生成物的含量越大C.反应物的转化率越大,达到平衡时,K值越大D.温度越高,达到平衡时,K值越大3.在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:请回答下列问题:(1)该反应的化学平衡常数表达式K = 。
第3节化学平衡——等效平衡教学目标1.构建等效平衡的模型,掌握等效平衡在解题中的应用2.通过对化学反应进行方向及其应用的学习,提高运用比较、归纳的能力,培养学生学习化学思维能力,以及应用理论解决实际问题能力3.建立化学平衡的观点,并通过分析化学平衡的建立,增强学生的归纳和形象思维能力教学重点等效平衡教学难点等效平衡教学过程一、导入水往低处流,而不会自发的向上流;一般在室温下,冰块会融化,铁器在潮湿空气中会生锈,甲烷与氧气的混合气体遇明火就燃烧,这些过程都是自发的。
这些不用借助于外力就可以自动进行的自发过程的共同特点是,体系会对外部做功或释放热量,即体系趋向于从高能状态转变为低能状态。
那是否就意味着放热反应自发进行,吸热反应就是非自发进行呢?二、知识讲解等效平衡对于一些学生理解起来不是特别容易,希望老师在讲解此内容的时候多一些耐心,重点讲典型例题和习题。
考点1 等效平衡含义及原理1.含义在一定条件下(等温等容或等温等压),对同一可逆反应体系,起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的百分含量相同。
2.原理同一可逆反应,当外界条件一定时,反应无论从正反应开始,还是从逆反应开始,最后都能达到平衡状态。
其中平衡混合物中各物质的含量相同。
由于化学平衡状态与条件有关,而与建立平衡的途径无关。
因而同一可逆反应,从不同的状态开始,只要达到平衡时条件(温度、浓度、压强等)完全相同,则可形成等效平衡。
考点2 等效平衡规律对于可逆反应aA(g)+bB(g)cC(g)+dD(g)三、例题精析使用建议说明:此处内容主要用于教师课堂的精讲,每个题目结合试题本身、答案和解析部分,教师有的放矢的进行讲授或与学生互动练习。
例题1 一定温度下,在3个体积均为1.0 L 的恒容密闭容器中反应2H 2(g)+CO(g)CH 3OH(g) 达到平衡。
下列说法正确的是A .该反应的正反应放热B .达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大C .达到平衡时,容器Ⅱ中c(H 2)大于容器Ⅲ中c(H 2)的两倍D .达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大【答案】AD【解析】A 项,根据Ⅰ、Ⅲ中数据可知反应开始时Ⅰ中加入的H 2、CO 与Ⅲ中加入甲醇的物质的量相当,平衡时甲醇的浓度:Ⅰ>Ⅲ,温度:Ⅰ<Ⅲ,即升高温度平衡逆向移动,该反应正向为放热反应,所以A 项正确。