高一专题训练(实验部分一)
- 格式:doc
- 大小:172.00 KB
- 文档页数:9

第二章专题训练 初速度为零的匀加速直线运动的规律 1.16世纪末,意大利物理学家伽利略在研究自由落体运动时做了著名的斜槽实验。
他让一个铜球从阻力很小的斜槽上由静止开始滚下,并且重复做了数百次实验。
模型简化如图所示,小球从光滑斜面上的A 点由静止释放,经连续相等时间,依次到达斜面上的B 、C 、D 点,速度分别为v 1、v 2、v 3,A 点到B 、C 、D 点的距离分别为x 1、x 2、x 3。
下列关系式正确且是伽利略用来证明小球沿光滑斜面向下的运动是匀变速直线运动的是( )A .2l 32x x x x -=-B .2l 32v v v v -=-C .l 231:3:5x x x =:: D .l 231:4:9x x x =:: 2.如图所示,一列火车做匀减速直线运动进站,每节车厢长度相等,小明在站台某处观察,火车停下时发现恰好有4节车厢从他身边经过,下列说法正确的是( )A .第1、2、3、4节车厢经过观察者所经历时间之比是1:2:3:4B .第1、2、3、4节车厢经过观察者所经历时间之比是()(1:21:32:23C .第1、2、332D .第1、2、3323.一小物体以一定的初速度自足够长的光滑固定斜面的底端a 点上滑,最远可到达b 点,e 点为ab 的中点。
已知物体由e 点运动到b 点的时间为t 0,则它从e 点经b 点再返回a 点所需的时间为( )A .0(21)tB .02tC .0(21)tD .0(221)t 4.水球可以挡住高速运动的子弹。
实验证实:如图所示,用极薄的塑料膜片制成三个完全相同的水球紧挨在一起水平排列,子弹在水球中沿水平方向做匀变速直线运动,恰好能穿出第三个水球,则可以判定(忽略薄塑料膜片对子弹的作用,子弹视为质点)( )A .子弹穿过每个水球的时间之比为t 1∶t 2∶t 3=1∶1∶1B .子弹穿过每个水球的时间之比t 1∶t 2∶t 3=(3-2)∶(2-1)∶1C .子弹在穿入每个水球时的速度之比为v 1∶v 2∶v 3=3∶2∶1D .子弹在穿入每个水球时的速度之比为v 1∶v 2∶v 3=(3-2)∶(2-1)∶1 5.如图所示,在水平面上固定着四个完全相同的木块,一粒子弹以速度0v 射入。

高一化学竞赛专题训练1 氧化还原反应与离子反应一、选择题1.下列说法中正确的是 (A.强氧化剂和弱还原剂易发生氧化还原反应B.实验室制氯气的反应中,氯离子通过还原反应生成氯气C.由HgCl2生成Hg2Cl2时,汞元素被还原了D.I-、Br-、Cl-的还原性依次减弱,氧化性依次增强答案:C2.(2011·西城模拟物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质浓度、反应温度等有关。
下列各组物质:①Cu与HNO3溶液②Fe与FeCl3溶液③Zn与H2SO4溶液④Fe与HCl溶液由于浓度不同而能发生不同氧化还原反应的是 (A.①② B.①③C.③④ D.②④解析:Cu与浓HNO3溶液反应时生成NO2,与稀HNO3溶液反应时生成NO;Fe与FeCl3溶液的反应与浓度无关;Zn与浓H2SO4溶液反应时生成SO2,与稀H2SO4溶液反应时生成H2;Fe与HCl溶液的反应与浓度无关。
答案:B3.在一种酸性溶液中,可能存在NO、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下的推测中不正确的是 (A.一定有碘离子 B.不含铁离子C.一定有氯离子 D.不含硝酸根离子答案:C4.(2011·汕头模拟下列物质在空气中久置变质,在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是 (A.食盐 B.漂白粉 C.氯水 D.生石灰答案:B5.据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。
撞击时发生反应的化学方程式为:5KClO3+6P===3P2O5+5KCl,则下列有关叙述错误的是 (A.上述反应中氧化剂和还原剂的物质的量之比为5 6B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾C.上述反应中消耗3 mol P时,转移电子的物质的量为15 molD.上述火药中的红磷可以用白磷代替答案:D6.根据下表下列叙述中正确的是(序号氧化剂还原剂其他反应物氧化产物还原产物①Cl2FeBr2FeCl3②KMnO4H2O2H2SO4O2MnSO4③KClO3HCl(浓Cl2Cl2④KMnO4HCl(浓Cl2MnCl2A.表中第①组反应的氧化产物一定只有FeCl3(实为Fe3+B.氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+C.还原性比较:H2O2>Mn2+>Cl-D.④的离子方程式配平后,H+的化学计量数为16答案:D7.(2011·皖西四校模拟24 mL0.05 mol·L-1的Na2SO3溶液恰好与40 mL 0.02 mol·L -1的K2RO4酸性溶液反应生成硫酸钠,则元素R在还原产物中的价态是 (A.+6 B.+3 C.+2 D.0解析:设元素R在还原产物中的价态为+x,已知在K2RO4中R的化合价为+6,据电子守恒可得:0.05 mol/L×24×10-3L×(6-4=0.02 mol/L×40×10-3L×(6-x,x=3。
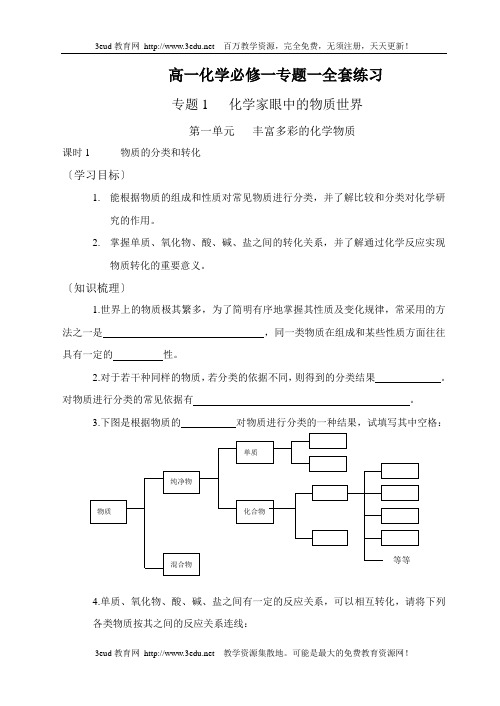
高一化学必修一专题一全套练习专题1 化学家眼中的物质世界第一单元丰富多彩的化学物质课时1 物质的分类和转化〔学习目标〕1.能根据物质的组成和性质对常见物质进行分类,并了解比较和分类对化学研究的作用。
2.掌握单质、氧化物、酸、碱、盐之间的转化关系,并了解通过化学反应实现物质转化的重要意义。
〔知识梳理〕1.世界上的物质极其繁多,为了简明有序地掌握其性质及变化规律,常采用的方法之一是,同一类物质在组成和某些性质方面往往具有一定的性。
2.对于若干种同样的物质,若分类的依据不同,则得到的分类结果。
对物质进行分类的常见依据有。
3.下图是根据物质的对物质进行分类的一种结果,试填写其中空格:4.单质、氧化物、酸、碱、盐之间有一定的反应关系,可以相互转化,请将下列各类物质按其之间的反应关系连线:[例题解析]例1.现有下列五种物质:锌粒、硫酸锌、氢氧化锌、氧化锌、硫酸,试关于它们回答下列问题:(1)根据它们组成或性质的不同,把它们分成两大类。
(2)写出它们之间转化的化学方程式。
解析:(1)对所给物质进行分类,首先应根据它们在组成、性质、状态等方面的不同,明确分类的依据,然后再针对不同的依据得出不同的分类结果。
从组成上看,镁条是只含一种元素的纯净物,为单质;另四种物质都是含两种或两种以上元素的纯净物,为化合物。
从状态上看,硫酸为液体,另四种物质为固体。
从性质上看,硫酸镁和硫酸都是易溶物,另三种物质为难溶物,等等(2)单质、氧化物、酸、碱、盐之间有一定的转化规律,可先明确上述物质所属物质类型,再根据此类型物质所具有的性质,写出相应的化学方程式(注意复分解反应发生的条件)。
如:锌属于活泼金属,可与酸(或盐)反应生成相应的盐,据此可写出反应式:Zn + H 2SO 4 == ZnSO 4 + H 2↑ , 依此类推,有:2 Zn + O 2 == 2 ZnO ,Zn(OH)2 + H 2SO 4 == ZnSO 4 + 2H 2O , ZnO + H 2SO 4 == ZnSO 4 + H 2O Zn(OH)2 △= ZnO + H 2O , ZnO + H 2 △= Zn + H 2O 〔基础训练〕1. 下列物质中都含有氢元素,按照已学知识判断其中属于酸的是( )A.NH3B.CH4C.NaHCO3D.HClO32.同种类型的物质往往具有某些相同的性质。

基因在染色体上和伴性遗传--高一生物专题训练一、萨顿的假说(类比推理法)萨顿的假说:基因是由染色体携带着从亲代传递给下一代的。
即基因在染色体上,基因和染色体行为存在明显的平行关系。
(1)基因在杂交过程中保持完整性和独立性。
染色体在配子形成和受精过程中,也有相对稳定的形态结构。
(2)在体细胞中基因成对存在,染色体也是成对的。
在配子中只有成对的基因中的一个,同样,也只有成对的染色体中的一条。
(3)体细胞中成对的基因一个来自父方,一个来自母方。
同源染色体也是如此。
(4)非等位基因在形成配子时自由组合,非同源染色体在减数第一次分裂后期也是自由组合的。
二、基因位于染色体上的实验证据1.果蝇作为遗传学实验材料的优点:(1)具有易于区分的相对性状;(2)体型小,易饲养,繁殖快;(3)产生的后代数量多,便于统计;(4)染色体数目少,便于观察。
2.基因位于染色体上的实验证据——摩尔根的果蝇杂交实验(假说——演绎法)(1)摩尔根用偶然发现的白眼雄果蝇与野生型红眼雌果蝇进行杂交,结果发现F1全为红眼果蝇;(2)F1的红眼果蝇进行雌雄交配,结果F2中红眼与白眼的数量比为3:1。
(3)这样的遗传表现符合分离定律,表明果蝇的红眼与白眼是受一对等位基因控制的。
所不同的是白眼性状的表现,总是与性别相关联。
(4)摩尔根和其同事提出假说:控制白眼的基因在X染色体上,而Y染色体上不含有它的等位基因。
果蝇杂交实验遗传图解:教材P10页(5)后来他们又通过测交实验等方法,进一步验证了这个解释。
测交实验遗传图解:如右图。
3.每种生物的基因数量,都要远远多于这种生物的染色体的数目。
一条染色体上有许多个基因,基因在染色体上呈线性排列。
三、孟德尔遗传规律的现代解释1.基因的分离定律的实质是:在杂合子的细胞中,位于一对同源染色体上的等位基因,具有一定的独立性;在减数分裂形成配子的过程中,等位基因会随同源染色体的分开而分离,分别进入两个配子中,独立地随配子遗传给后代。

高一数学基础知识专题训练高一基础知识专题训练011.设集合{}{}1,2,3,4,2,==|-2≤≤∈P Q x x x R ,则P Q 等于 ( )A 、{1,2}B 、{3,4}C 、{1}D 、{-2,-1,0,1,2} 2.已知全集}6,5,4,3,2,1{=U ,集合}5,2,1{=A ,U {4,5,6}C B =,则集合=B A ( )A .}2,1{B .}5{C .}3,2,1{D .}6,4,3{ 3. 已知集合}12|{+==x y x A ,}1|{2++==x x y y B ,则B A 等于 ( )A .)}3,1(),1,0{( C.),0(+∞ D.),43[+∞4.设{}{}(,)46,(,)38A x y y x B x y y x ==-+==-,则A B =( ) {}{}{}{}.(2,1).(2,2).(3,1).(4,2).A B C D ----5. 已知集合M 满足{}{}3,2,12,1= M , 则集合M 的个数是( ) A. 1 B. 2 C. 3 D. 46. {()}2137x x x -<-,则 A Z 的元素的个数 .7. 满足},,,{}{d c b a M a ⊂⊆的集合M 有 个8、集合}02)6(|{2=+-+=x a ax x A 是单元素集合,则实数 9. 集合{3,2},{,},{2},a A B a b A B A B ====若则.10. 已知集合 {|lg(1)}x y x =-,集合e R x e y y N x }(,|{∈==为自然对数的底数),则N M =11..已知集合N M M a a x x N M 则集合},,2|{},2,1,0{∈===等于 12. 设全集为U ,用集合A 、B 、C 的交、并、补集符号表图中的阴影部分。
(1) (2)高一基础知识专题训练02⎧≥-)10(,2x x2. 下列函数中,在区间()0,1上是增函数的是( )A .x y = B .x y -=3 C . D .42+-=x y3.若偶函数)(x f 在(]1,-∞-上是增函数,则下列关系式中成立的是( )A .B .C .D .4.已知3()4f x ax bx =+-其中,a b 为常数,若(2)2f -=,则(2)f 的值等于( )A .2-B .4-C .6-D .10-5.某学生离家去学校,由于怕迟到,所以一开始就跑步,等跑累了再走余下的路程. 在下图中纵轴表示离学校的距离,横轴表示出发后的时间,则下图中的四个图形中较符合该学生走法的是( )6.下列函数中,在其定义域内既是奇函数又是减函数的是 ( )(A )R x x y ∈-=,3 (B ) R x x y ∈=,sin (C ) R x x y ∈=, (D ) 7.若函数x x x f 2)12(2-=+,则)3(f = . 8.函数的定义域 。

武汉市新高一下学期化学实验题专项训练本练习含答案有解析1.葡萄是一种常见水果,可以生食或制作葡萄干,除此之外,葡萄还可用于酿酒。
(1)检验葡萄汁含有葡萄糖的方法是:向其中加碱调至碱性,再加入新制的Cu(OH)2并加热,其现象是________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式:C6H12O6(葡萄糖)酶 2_________+ 2 C2H5OH(3)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验室可用如图所示装置制备乙酸乙酯:①试管a中生成乙酸乙酯的化学方程式是__________。
②试管b中盛放的试剂是饱和____________溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是________。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是_______(填字母)。
A.普通漏斗B.分液漏斗C.长颈漏斗2.氢化钙(CaH2)固体是登山运动员常用的能源提供剂。
氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。
氢化钙道常用氢气与纯净的金属钙加热制取,如图是模拟制取装置:(1)为了确认进入装置C的氢气已经干燥应在B、C之间再接一装置,该装置中加入的试剂是______________。
(2)该实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞,接下来的操作顺序是_______(填序号)。
①加热反应一段时间②收集气体并检验其纯度③关闭分液漏斗活塞④停止加热,充分冷却(3)某同学取一定质量的产物样品(m1g),加入过量碳酸钠溶液,过滤、洗涤、干燥后称量固体碳酸钙质量(m2g),计算得到样品中氢化钙的质量分数为101.14%。
若该同学所有操作均正确,则产生这种情况的原因可能是________。
3.二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。
1高一物理【利用牛顿第二定律解决动力学实验】专题训练 题组一 探究加速度与力、质量的关系1.甲、乙、丙三个实验小组分别采用如图(a)、(b)、(c)所示的实验装置,探究“当质量一定时,物体运动的加速度与它所受的合力成正比”这一物理规律。
已知他们使用的小车完全相同,小车的质量为M ,重物的质量为m ,试回答下列问题:(1)①甲、乙、丙三个实验小组中,必须补偿小车和长木板之间的阻力的实验小组是 。
A.甲、乙、丙B.甲、乙C.甲、丙②实验时,必须满足“M 远大于m ”的实验小组是 (填“甲”“乙”或“丙”)。
③实验时,甲、乙、丙三组同学的操作均完全正确,他们作出的a-F图线如图(d)中A、B、C所示,则甲、乙、丙三组实验对应的图线依次是(填“A、B、C”“C、B、A”或“C、A、B”)。
(2)实验中,有同学用打点计时器得到了在不同拉力作用下的几条较为理想的纸带,并在纸带上每5个点取一个计数点,按打点先后依次标为0,1,2,3,4,5。
由于不小心,几条纸带都被撕断了,如图所示(交流电源的频率为50 Hz,图中数据为相邻两计数点间的距离),请根据给出的四段纸带判断:在b、c、d三段纸带中,可能是从纸带a上撕下的是。
A.bB.cC.dD.无法确定(3)小明同学采用图(b)所示实验装置探究“质量一定时加速度与力的关系”实验,以弹簧测力计的示数F为横坐标,加速度a为纵坐标,画出的a-F图像是图(d)中的一条直线,图线与横坐标的夹角是θ,求得图线的斜率为k,则小车的质量为。
题组二测定动摩擦因数232.如图(a)所示,某同学设计了测量铁块与木板间动摩擦因数的实验。
所用器材有:铁架台、长木板、铁块、米尺、电磁打点计时器、频率为50 Hz 的交流电源、纸带等。
某次实验时,调整木板与水平面的夹角使θ=30°。
接通电源,开启打点计时器,释放铁块,铁块从静止开始沿木板滑下。
多次重复后选择点迹清晰的一条纸带,如图(b)所示。
第一章从实验学化学第二节化学计量在实验中的应用第2课时气体摩尔体积易错点一气体摩尔体积1.下列叙述中正确的是A.一定温度、压强下,气体体积由其分子的大小决定B.一定温度、压强下,气体体积由其物质的量的多少决定C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 LD.不同的气体,若体积不等,则它们所含的分子数一定不等【答案】B【解析】决定气体体积大小的主要因素是气体分子数目的多少和气体分子间的距离。
一定温度、压强下,气体体积之比等于其物质的量之比,故A项错误,B项正确;说明某气体的摩尔体积时必须指明所处状况,C项错误;不同的气体,若体积不等,但在不同的特定温度和压强下,它们所含的分子数也可能相等,D项错误。
2.下列叙述中,正确的是A.摩尔是国际单位制七个基本物理量之一B.在标况下,1 mol任何物质的体积都约是22.4 LC.25℃和101 kPa的条件下,气体的摩尔体积大于22.4 L/molD.22.4 L气体所含的分子数一定大于11.2 L气体所含的分子数【答案】C【解析】A.摩尔是物质的量的单位,物质的量是国际单位制七个基本物理量之一,故A错误;B.在标况下,1 mol气体物质的体积约是22.4 L,固体和液体的体积不是22.4 L,故B错误;C、气体摩尔体积是1 mol气体在一定温度和压强下的体积,单位为L/mol,25 ℃和101 kPa的条件下,气体的摩尔体积大于22.4 L/mol,故C正确;D.未注明温度和压强,气体摩尔体积不确定,不能计算气体的物质的量,也不能判断气体分子数目的关系,故D错误;故选C。
3.下列说法正确的是①标准状况下,6.02×1023个分子所占的体积约是22.4 L②0.5 mol H2所占体积为11.2 L③标准状况下,1 mol H2O的体积为22.4 L④常温常压下,28 g CO与N2的混合气体所含的原子数为2N A⑤各种气体的气体摩尔体积都约为22.4 L·mol−1⑥标准状况下,体积相同的气体的分子数相同A.①③⑤B.④⑥C.③④⑥D.①④⑥【答案】B【解析】①标准状况下,6.02×1023个分子为1 mol,但该物质不一定是气体,故占有的体积不一定是22.4 L,故①错误;②氢气所处的状态不一定是标准化状况,气体摩尔体积不一定是22.4 L/mol,0.5 mol H2所占体积不一定为11.2 L,故②错误;③标准化状况下,水是液体,1 mol水的体积远大于22.4 L,故③错误;④28 g CO与N2的混合气体为1 mol,二者都是双原子分子,所含的原子数为2N A,故④正确;⑤影响气体摩尔体积的因素有温度、压强,气体所处的状态不确定,各气体的气体摩尔体积不一定是22.4 L/mol,故⑤错误;⑥同温同压下,体积相同,含有的分子数目相同,故⑥正确;故选B。
一、选择题1.若集合,则实数的取值范围是 ( )A .B .C .D .【答案】D【解析】2.已知集合{}0,5,10A =,集合{}22,1B a a =++,且{}5A B ⋂=,则满足条件的实数a 的个数有 ( )A . 0个B . 1 个C . 2 个D . 3 个【答案】B【解析】{}22,1B a a =++,且{}5A B ⋂=,则有25a +=或215a +=. 32a =,或-2.当3a =时, {}5,10B =,此时{}510A B ⋂=,,不满足题意;当2a =时, {}54B =,,满足题意;当2a =-时, {}0,5B =,此时{}50A B ⋂=,,不满足题意,所以满足条件的实数a 只有1个.故选B.3.已知点)在平面直角坐标系的第二象限内,则的取值范围在数轴上可表示为(阴影部分)( )A. B.C. D.【答案】C【解析】因为在第二象限,所以,所以,故选C.4.已知m,,集合,集合,若,则A. 1 B. 2 C. 4 D. 8【答案】A【解析】5.已知集合A={x|x2-2x-3≤0},B={x|x<a},若A⊆B,则实数a的取值范围是()A. (-1,+∞)B. [-1,+∞)C. (3,+∞)D. [3,+∞)【答案】C【解析】[]13A =-,, (),B a =-∞;∵A B ⊆;∴3a >;∴a 的取值范围为3+∞(,),故选C . 点睛:研究一个集合,我们首先要看清楚它的研究对象,是实数还是点的坐标还是其它的一些元素,这是很关键的一步.第二步常常是解一元二次不等式,我们首先用十字相乘法分解因式,求得不等式的解集.在解分式不等式的过程中,要注意分母不能为零.解指数或对数不等式要注意底数对单调性的影响.元素与集合之间是属于和不属于的关系,集合与集合间有包含关系. 在求交集时注意区间端点的取舍,熟练画数轴来解交集、并集和补集的题目.6.已知集合,,若,则实数的取值范围为( )A .B .C .D . 【答案】C【解析】7.已知集合A ={-1,0,a },B ={ x |0<x <1},若A ∩B ≠Ø,则实数a 的取值范围是A . {1}B . (0,1)C . (1,+∞)D . (-∞,0)【答案】B【解析】1,0,B B -∉∉ 若A B φ⋂≠ ,则a B ∈ ,则01a << ,选B .8.已知集合2{|280}P x x x =--≤, {|}Q x x a =≥, ()C P Q ⋃=R R ,则a 的取值范围是 A . ()2,∞-+ B . ()4,∞+ C . (],2∞-- D . (],4∞-【答案】C【解析】因为{|24}P x x =-≤≤, {|}Q x x a =≥,则{|24}C P x x x =-R 或,又因为()C P Q ⋃=R R ,所以2a ≤-本题选择C 选项.9.集合,,若,则的取值范围是( )A .B .C .D .【答案】B【解析】 根据题意,可得,,要使,则,故选B.二、填空题10.已知集合,.若,则实数__________.【答案】0【解析】11.设全集 ,,,则的值为____________.【答案】2或8【解析】 由题意,可知,依据补集可得, 则有,即,解得或,即实数的值为或.12.集合{}{}1,|A x x B x x a ==<,若R A C B ⊆,则实数a 的取值范围_________【答案】1a ≤ 【解析】∵集合{}{}1,|,{|},1R R A x x B x x a C B x x a A C B a ==<∴=⊆∴,,厔∴实数a 的取值范围是 1.a ≤13.已知,若,则的取值范围是___________.。
2015级城东中学高一年段实验班专题训练一(实验)一、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。
这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
请回答:(1)W的电子式是______________。
(2)X与Y在溶液中反应的离子方程式是___________________________。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
①装置Ⅰ中反应的化学方程式是______________________________。
装置Ⅱ中物质的化学式是_____________。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是__________,所需仪器装置是________(从上图选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X 生成,该反应的化学方程式是______________________________。
二、某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。
反应过程中有一种气体是红棕色。
请回答下列问题:(1)由强酸性条件即可判断溶液X中一定不存在的离子有。
(2)溶液X中,关于N03-的判断一定正确的是。
a.一定有 b.一定没有 c.可能有(3)产生气体A的离子方程式为。
(4)转化⑥发生反应的现象为。
(5)转化④中产生H的离子方程式为。
(6)若转化③中,D、H20、02三种物质恰好发生化合反应生成E,则反应中D与02的物质的量之比为____________。
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是。
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMn04溶液,⑥氯水和KSCN的混合溶液三、FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:I.实验需要90mL 0.1mol/LFeBr2溶液(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是________(2)下列有关配制过程中说法错误的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中d.容量瓶贴签存放配好的FeBr2溶液e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高II.探究FeBr2的还原性取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。
某同学对产生黄色的原因提出了假设:假设1:Br-被Cl2氧化成Br2溶解在溶液中;假设2:Fe2+被Cl2氧化成Fe3+。
四、某学习小组用下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.(提示:镁、铝均与酸反应,铝还能和碱反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是除去铝镁合金表面的氧化膜。
(1)A中试剂为。
(填“NaOH溶液”或“稀盐酸”)(2)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温;④由A向B中滴加足量试剂;⑤检查气密性;⑥调整橡胶软管使D和C的液面相平。
上述操作的顺序是;(填序号)(3)B中发生反应的离子方程式为 .(4)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将.(填“偏大”、“偏小”、“不受影响”)(5)若实验用铝镁合金的质量为a g,测得氢气体积为b ml(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为.(用含a、b、c的代数式表示)七、硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。
某课外小组的同学欲测定该补血剂中铁元素的含量。
实验步骤如下:请回答下列问题:(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加,该过程的现象为__________________________________________。
(2)步骤②加入过量H2O2的目的是 _____________________________________。
(3)步骤③中反应的离子方程式是 _____________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、________、灼烧、、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为g。
八、利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:(1)“酸溶”时,Fe2O3与硫酸反应的化学方程式为____________________________________________________________________________________________________________。
(2)滤渣Ⅰ的主要成分是FeS2、S和________(填化学式);Fe3+被FeS2还原的离子方程式为________________________________________________________________________。
(3)“氧化”中,生成FeOOH的离子方程式为________________________________________________________________________________________________________________。
(4)滤液Ⅱ中溶质是Al2(SO4)3和________(填化学式);“洗涤”时,检验铁黄表面已洗涤干净的操作是____________________________________________________________________。
五、某小组取一定质量的FeSO4固体,利用下图装置进行实验。
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8℃。
(1)加热前,先通入一段时间N2的目的是_____________________。
(2)实验③反应的离子方程式是_______________________。
(3)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有_____________气体。
依据是______________________。
(4)实验④反应的离子方程式是________________________。
六、两个化学兴趣小组进行了以下探究活动:第一组:为研究铁质材料与热浓硫酸的反应,(1)称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。
若要确认其中是否含有Fe2+,应选择加入的试剂为(选填序号)。
a.KSCN溶液和氯水b.铁粉和KSCN溶液 c.浓氨水d.酸性KMnO4溶液②乙同学取672 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g。
据此推知气体Y 中SO2的体积分数为。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。
为此设计了下列探究实验装置(图中夹持仪器省略)。
(2)写出产生CO2的化学方程式。
(3)装置A中试剂的作用是,反应的离子方程式。
(4)如果气体Y中含有H2,预计实验现象应是。
(5)简述确认气体Y中含有CO2的实验现象。
第二组:拟用下列装置定量分析空气中SO2的含量:(6)KMnO4溶液中导管末端做成球状多孔结构的作用是。
(7)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。
若从气体通入到紫色恰好褪去,用时5分钟。
则此次取样处的空气中二氧化硫含量为 g/L九、某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出):实验选用细铜片、98.3%硫酸、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品。
铜片一端没入浓硫酸中。
根据上述材料回答下列问题:(1)D、E两容器中CCl4的作用是____________________________。
(2)加热过程中,随着反应的进行,A容器中有白色沉淀生成,你认为该沉淀物是________,分析可能的原因________________________________。
(3)对A容器中的浓硫酸和铜片进行加热,很快发现C容器中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。
你的猜想是________。
设计实验验证你的猜想___________________________________________。
(4)实验结束后,为了减少环境污染,排除各装置中的SO2,可采取的操作是__________________________________。
十、某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:________________________________________________________________________与盐酸反应最剧烈,________________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:________________________________________________________________________________________________________________________________________________。