参考区间确定资料全
- 格式:docx
- 大小:36.08 KB
- 文档页数:8

尚红教授:我国新的ALT参考范围确定,ALT检测结果需全面分析2013年,我国卫生部发布了一个新的行业标准--《血清丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、碱性磷酸酶、γ-谷氨酰基转移酶参考区间》。
感染科和肝病科医生无疑对其中关于丙氨酸氨基转移酶(ALT)的水平标准非常关注,因为这是临床最常用的判断肝脏功能的指标,也是决策是否应该进行抗病毒治疗和疗效观察的重要指标。
在今年的感染病年会上,中华医学会检验学分会主任委员、中国医科大学的尚红教授受邀报告了我国新的ALT标准的确定研究及ALT影响因素,使与会者对ALT标准和可能影响因素有了充分的了解,为临床ALT结果的解释提供了理论基础。
尚教授介绍说,长期以来我国所采用的ALT标准均基于20~30年前欧美人群的研究数据而制定,2006年我国发布的全国临床检验操作规程(第三版)中关于ALT 的标准为:男性5~40 U/L,女性5~35 U/L。
此次共有六家三甲医院参与了新的ALT标准制定,六家医院分布在全国的六大地区。
最终确定了适合中国人群的新ALT 参考范围:男性9~50 U/L,女性7~40 U/L。
12个省、市、自治区的21家医院参与了新的ALT参考区间的验证。
结果显示,男性ALT标准区间的通过率为95%,女性ALT区间的通过率为100%。
因此,新的ALT参考区间适合于全国大多数地区质量有保证的实验室使用。
参与验证的21家医院既往使用的ALT参考区间差异很大,ALT上限最高的超过70 U/L,也有一些为50 U/L或超过50 U/L,40 U/L居多。
新的参考区间统一了不同医院的检验标准,为检验结果的互认奠定了基础。
入组的1274名男性志愿者中,有51(4%)人的ALT介于新旧参考区间的上限,即40~50 U/L。
通过与ALT在9~40 U/L的人群比较,ALT介于新旧参考区间的上限的人群未受相关因素干扰,例如BMI、城乡分布无显著差异,且无已知疾病和明显不适、无长期用药及2周内用药史、无采血前剧烈运动、无大量饮酒史。


附件2体外诊断试剂参考区间确定注册审查指导原则本指导原则旨在指导注册申请人对注册申报资料中参考区间研究资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是对体外诊断试剂参考区间确定的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。
如果有能够满足相关法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围本指导原则适用于定量检测体外诊断试剂参考区间的确定研究。
本文主要讨论健康人群相关的参考区间,申请人也可用类似方法建立其他类型参考人群的参考区间,如其他特定生理或病理条件的参考区间。
本指导原则不适用于定性和半定量检测试剂;不适用于药物浓度监测用途的检测试剂;不适用于致病性病原体相关检测试剂;不适用于医学决定水平的确定。
已经有国内公认、统一的参考区间和医学决定水平的检测项目,可不再建立参考区间,此类产品应将评估重点放在标准化方面。
本指导原则适用于进行相关产品注册和变更注册的体外诊断试剂参考区间确定,包括申报资料中的部分要求,其他未尽事宜,应当符合《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令48号)(以下简称《办法》)等相关法规要求。
二、基本原则应按照以下情况,分别选择建立和验证的方式确定申报产品的参考区间:1.首个申报产品(境内无同类已批准上市注册产品)1.1境内申报产品应通过建立的方法,确定申报产品的参考区间。
1.2进口申报产品,如在境外申请人注册地或者生产地所在国家(地区)已批准上市,申请人需验证申报产品说明书载明的参考区间的适用性。

第二类体外诊断试剂产品注册资料白蛋白测定试剂盒(溴甲酚绿法)参考区间确定资料XXXXXX有限公司一、参考依据依据NCCLS C28-A2 如何确定临床检验的参考区间:批准指南(2000)文件。
该文件是确定定量临床检验项目的参考区间的指南。
二、材料与方法1.标本来源按健康人群要求选择XXXXXXXXX医院健康体检者,收取该医院检验科检测已完成的临床样本。
样本采集/检验时间:XXXX.XX。
对象:在XX地区居住的性别不限、年龄不限的健康人。
健康人的要求:(1)一月内无急性感染史;(2)发育正常,无心血管、肺、肾和肝、胆、胰等器质性疾患;(3)半年内无输血和大手术史;(4)3月内未服用影响凝血功能的药物,2周内无中毒史,未接触毒物及其他有害物质;(5)妇女不在妊娠或哺乳期。
2.使用仪器HITACHI 7020全自动生化仪。
3.检测试剂XXXXXX有限公司生产的白蛋白测定试剂盒(溴甲酚绿法)。
规格:XXmL;批号:XXXXXX;生产日期:XXXXXXXX;有效期XXXXXXXX。
4. 质量控制按照技术要求3.1、3.3~3.6.1、3.7进行产品性能的测定,结果应符合要求。
5. 参考值确定根据项目制定双侧界限或单测界限,采用95%参考区间范围。
6.统计方法应用SPSS20进行数据统计分析。
正态性检验采用Kolmogorov–Smirnov(K-S) 检验。
结果属于正态分布的,用正态分布法计算参考区间范围,其95%参考区间范围分别用下式计算:双侧:SD.1X96单测下限:SD.1+X64-单测上限:SD.1X64结果属于偏态分布的,用百分位法计算参考区间范围,其95%参考区间范围分别用下式计算:双侧:P2.5~P97.5单测下限:P5单侧上限:P95三、试验结果用白蛋白测定试剂盒(溴甲酚绿法)对收集到的标本进行测定,测定结果呈正态分布(见图1)。
95%参考区间用公式求出,得出了本试剂盒测定ALB的参考值范围上下限,见表1。

医院实验室参考范围的确定与调整程序1.目的:规范各检测项目生物参考区间的建立。
2.范围:实验室开展的检测项目。
3.定义3.1参考个体:依据临床对某检验项目的使用要求确定选择原则,以此选择的检测参考值的个体。
所有参考个体的集合为参考总体。
3.2参考抽样组:从统计意义上,一定数量的参考个体是对参考总体的一个抽样。
在现今的参考值建立中,都是对参考抽样组作具体研究,在一定的可信限条件下,成为某项目的参考值和参考区间。
3.3参考值:对一个参考个体进行某项目检测得到的值为该个体的参考值,所有参考抽样组的各个参考值合起来即为参考值范围。
3.4参考区间和参考限:依据所有参考值的分布特性以及临床使用要求,选择合适的统计方法进行归纳分析后,确定参考值范围中的一部分为参考区间,区间的两端为参考区间的限值,分为低参考限和高参考限。
4.权责4.1各专业组组长负责评审本组检验项目的生物参考区间。
4.2技术负责人批准评审后的生物参考区间。
5.制度内容5.1检验科在下列情况下应重新评审生物参考区间。
5.1.1开展新的检验项目。
5.1.2改变当的检测系统。
5.1.3实验室有理由可以相信某一特定参考区间对参考人群不再适用时。
5.2工作程序5.2.1各专业组应为所运行的检验项目确定可靠的生物参考值区间。
5.2.2生物参考区间的设立可直接采用由国家权威机构发布或权威刊物出版的适合实验室的生物参考区间;还可直接引用试剂供应商提供的对应的生物参考区间;也可自行建立生物参考区间。
5.2.3自行建立参考值范围和参考区间计划。
5.2.3.1根据文献和实验研究,总结对该项目检测结果产生的生物变异和分析下扰的因素,供选择参考个体时用。
5,2.3.2确定参考个体的选择原则(或排除非参考个体的原则),编写与之对应调查表。
5.2.3.3依据调查表和其他有关记录,挑选候选的参考个体。
5.2.3.4依据排除原则,剔去不符合要求的候选对象。
5.2.3.5将采集标本前和采集时对受检查的要求,告诉各个受检参考个体,做好准备。

c28-a2医学实验室参考区间的定义和确定医学实验室参考区间是指在正常人群中,某项生理指标的测量结果在某一范围内的概率分布。
其确定的目的是为了将正常值与异常值区分开来,从而对疾病进行诊断和监测。
下面将详细介绍医学实验室参考区间的定义和确定。
医学实验室参考区间的定义:医学实验室参考区间又称正常范围,是指某项生理指标的测量结果在正常人群中观察到的分布范围。
它由下限和上限所组成,表示了该指标测量结果在正常人群中所占的百分比。
一般使用95%的置信区间来确定参考区间,即该指标测量结果有95%的概率分布在该范围内。
医学实验室参考区间的确定:确定医学实验室参考区间需要考虑多个因素,包括样本来源、样本数量、性别、年龄、种族等。
下面将逐一介绍这些因素的影响。
1.样本来源:医学实验室参考区间的确定需要选择来自正常人群的样本。
这些样本应该是没有明显疾病症状,且无明显影响该指标的因素,如未使用药物、未患有慢性疾病等。
选择样本时需要考虑性别、年龄、种族等因素,以保证参考区间的准确性。
2.样本数量:样本数量是确定参考区间的重要因素之一。
较少的样本数量容易导致偏差,不准确地估计参考区间。
一般来说,样本数量越多,结果越可靠。
根据统计学原理,当样本数量达到一定程度时,参考区间的计算结果将更加可靠。
3.性别、年龄和种族:某些生理指标的参考区间可能会因性别、年龄和种族的不同而有差异。
因此,在确定参考区间时需要对这些因素进行分层分析,以准确划定不同人群的参考区间。
4.统计方法:确定参考区间常用的统计方法有光谱法和非参数法。
光谱法是根据正态分布的假设来估计参考区间,适用于样本数量充足且近似正态分布的情况。
非参数法是基于分位数回归方法来估计参考区间,适用于样本数量较少、分布非正态的情况。
在确定参考区间时,也需要考虑参考区间的可靠性和灵敏度。
参考区间的可靠性指的是该区间的结果在不同实验室、不同设备、不同测量者之间能够重复,能够给出一致的结果。

百分位数法(非参数法)确定参考区间的方法说实话百分位数法(非参数法)确定参考区间这事儿,我一开始也是瞎摸索。
我最早想确定一个数据的参考区间的时候,都不知道从哪下手。
我就先把收集到的所有数据都堆在一起,然后就开始在那瞎琢磨。
我试着找特殊值,比如最大值、最小值,觉得说不定这就和参考区间有点关系呢,结果发现这简直太幼稚了,这根本就不是百分位数法的思路嘛。
后来我就开始看书查资料,才大概知道点皮毛。
百分位数法呢,简单说就是要看不同百分位的数值。
打个比方,就好像你要给一个班级的同学身高确定参考区间,你不能只看最高最矮的几个人,得看看从最矮到最高排好队之后,中间不同位置的人的身高情况。
比如说第5百分位的身高和第95百分位的身高,那中间这一大部分人的身高范围就可能是比较正常的参考区间。
那具体怎么做呢?首先你得把数据按照从小到大的顺序排列好。
这一步可不能乱,我之前就有一次数据排得乱七八糟的,结果算出来的百分位数都不对。
排好序之后,就开始确定你要的百分位数。
比如说100个数据里,第5个最小的数据就是第5百分位。
但这里面有个问题我不太确定,就是如果数据的数量不是这种正好是100 、1000这样好计算的怎么办?我试过按比例去估算,但是总觉得不太靠谱。
比如说有一次我研究某个人群的血糖数值参考区间,最开始我以为只要挑出几个我觉得像是边缘的数值就好了,大错特错啊。
后来我老老实实把几百个血糖数据排序,再依照找第百分位和第百分位的数据,最后得出的数值范围才有点像个参考区间的样子。
要是想做准确呢,数据量也要多一些。
要是只有很少的数据就去用这个方法,就好比用很少的砖头去砌一堵墙,根本就不牢固,得出来的参考区间肯定也不怎么可靠。
我在确定一个新指标的参考区间的时候,就因为数据太少,结果得到的结果和后来数据足够多的时候差别老大了。
总之呢,用百分位数法确定参考区间虽然不难,但是细节得特别注意,不然就容易出岔子。
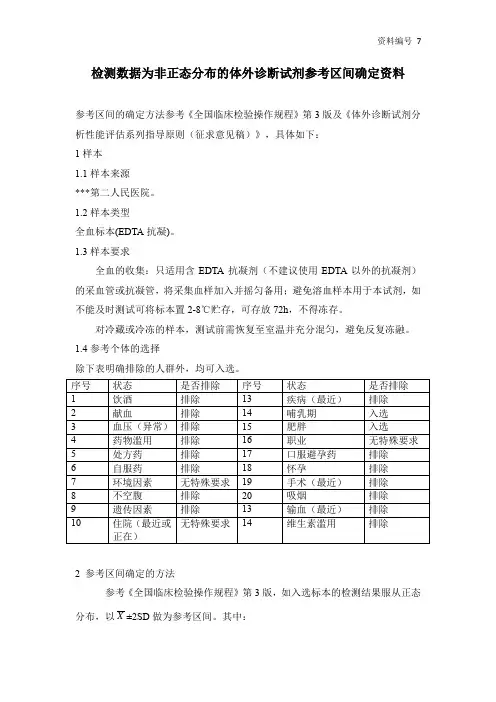
检测数据为非正态分布的体外诊断试剂参考区间确定资料参考区间的确定方法参考《全国临床检验操作规程》第3版及《体外诊断试剂分析性能评估系列指导原则(征求意见稿)》,具体如下:1样本1.1样本来源***第二人民医院。
1.2样本类型全血标本(EDTA抗凝)。
1.3样本要求全血的收集:只适用含EDTA抗凝剂(不建议使用EDTA以外的抗凝剂)的采血管或抗凝管,将采集血样加入并摇匀备用;避免溶血样本用于本试剂,如不能及时测试可将标本置2-8℃贮存,可存放72h,不得冻存。
对冷藏或冷冻的样本,测试前需恢复至室温并充分混匀,避免反复冻融。
1.4参考个体的选择除下表明确排除的人群外,均可入选。
2 参考区间确定的方法参考《全国临床检验操作规程》第3版,如入选标本的检测结果服从正态分布,以X±2SD做为参考区间。
其中:X = 检测结果的算术平均数SD=()12--∑n X Xn=120如入选标本的检测结果不服从正态分布,则采用95%分位法计算参考区间。
3 参考区间确定试验步骤:使用前请仔细阅读本说明书及干式荧光免疫分析仪操作手册,测试应在室温下进行。
取20ul 样本加入缓冲液中,混匀;解离15分钟后混匀;取40ul 稀释过后的样本加入到卡条的加样窗口,层析15分钟,按照仪器操作方法的详细说明读取检测结果。
质量控制:当测试出现异常值时,建议进行校准和质控测试。
校准:在加样检测前,请将检测卡放于仪器卡槽中,扫描检测卡背面的二维码,进行仪器校准,不同批次的检测卡,缓冲液及二维码不能混用。
质控:用质控品(选购品,非试剂盒标配品)进行测试,测试结果应在靶值范围内。
45离群值检查经分析,各组数据D<1/3R,无离群值,均纳入后续的统计分析。
4.1.3性别及年龄差异比较(n=200)男女组、<=30岁及>30岁样本数量均为100,则Z*=3(200/240)1/2=2.739,如果z值超过了对应的Z*值,两组之间即存在显著性差别,应分别报告参考区间。

精选文档临床实验室怎样确立和成立生物参照区间(赞同指南――第二版)1内容简介此指南是专为指导临床诊断实验室、诊断仪器试剂制造商和临床检验工作者在定量实验检测中确立参照值和参照区间而拟订的。
它包括在临床医学实验室中成立可靠的参照区间所用的方法步骤和介绍程序。
而该介绍程序的主要内容是怎样用最简单和最务实的方法去成立一个能保证足够可靠性和适用性的参照区间的草案。
此文件不能够能每一种状况都左右逢源,所以有些内容需要经过指南外来充足。
但在特定的地域内,额外的步骤或努力能够提高参照区间的可信度和精确度。
当前的现状是,临床实验室科研人员和仪器试剂制造商缺乏一致的收集数据及操作方法去成立参照区间,故小组委员会希望此文件能为成立可靠的参照区间供应最基本的、一致的实验草案,并为进一步的研究夯实基础。
该程序指南的要点在于决定“相对健康” 集体参照值或参照区间时所选择的样品组可否本源于健康优异的人群,这也是此文件的议论的要点。
自然,关于其他种类诸如生理或病理状况下的参照值的成立,也应该采用相似的方法。
此程序大纲适用于任何种类的参照区间确实定,由于它充足考虑了合适的参照个体的选择及各种剖析方法影响因素等状况。
但是,这份文件没有特意地谈到怎样成立诊断域值(如紧急值或各种医学决定值)。
这些值的决定方法各异,部分还经常要在特定医学条件下由诊断方法的敏感性和特异性来决定。
不同样状况下的参照值研究的各种需求本指南也将涉及,包括:新剖析物的测量用新的或不同样的剖析方法测量开初已明确知道的剖析物或已标准化测定的生理学的数据和参照值。
用同样也许有可比性的方法去测量同一剖析物,并利用其他实验室或试剂生产商供应的参照值作比较研究(参照值的调用)。
被称为“参照值调用”的最后一项议题是比较复杂的。
由于今后所有的临床诊断实验室将会不断地碰到调用参照值的考据和随后的采用它这个问题,而试剂生产商和其他实验室所供应的参照值是不能够够直接应用的。
这一问题的解决方法到此刻依旧不是特别严格。

β-羟丁酸检测试剂注册审查指导原则(征求意见稿)本指导原则旨在指导注册申请人对β-羟丁酸检测试剂注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是针对β-羟丁酸检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。
如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,相关内容也将适时进行调整。
一、适用范围本指导原则适用于采用β-羟丁酸脱氢酶法,利用全自动、半自动生化分析仪或分光光度计,在医学实验室进行β-羟丁酸定量测定所使用的临床化学体外诊断试剂。
基于其他方法的β-羟丁酸检测试剂盒可参照本指导原则,但应根据产品的具体特性确定其中的内容是否适用,若不适用,应另外选择适合自身方法学特性的研究步骤及方法。
二、注册审查要点注册申报资料的撰写应符合《体外诊断试剂注册申报资料要求及说明》的相关要求。
(一)监管信息1.产品名称产品名称由三部分组成。
第一部分:被测物质的名称,如β-羟丁酸;第二部分:用途,如测定试剂盒;第三部分:方法或者原理,如β-羟丁酸脱氢酶法等,本部分应当在括号中列出。
2.分类依据根据2013版《体外诊断试剂分类子目录》,β-羟丁酸检测试剂产品类别为:Ⅱ-2 用于糖类检测的试剂,管理类别为第二类,分类编码为6840。
3.注册单元划分按照《医疗器械注册单元划分指导原则》对注册单元划分。
如包含不同的包装规格,不同规格间仅试剂组分装量或检测数有差异,原则上划分为同一注册单元;如包含不同的包装规格,不同规格间除试剂装量或检测数的差异外,适用于不同的仪器机型,原则上划分为同一注册单元。

附件 3 C反应蛋白测定试剂盒注册技术审查指导原则(2016年修订版)需规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围本指导原则适用于基于分光光度法原理,利用手工和半自动、全自动生化分析仪,在医学实验室进行对人血清或血浆中的C-反应蛋白进行定量检测所使用的临床化学体外诊断试剂(盒)。
本指导原则不适用于:是白(常规CRP)和超敏C反应蛋白(超敏CRP)。
一次性检测常规CRP和超敏CRP,这种方法被称为全程C反应蛋白检测。
常规CRP和超敏CRP在化学本质上无区别,是同一种物质,只是检测方法的定量下限不同。
常规CRP测定包括定性、半定量和定量分析,可用于评价感染,组织损伤和炎症性疾病。
对于常规的CRP测定,参考值通常被认为是临床上含量高于10毫克/升。
在健康人群血液中CRP水平低于5毫克/升,而在各种条件下,急性炎症4—8小时内,CRP值达到约20至500毫克/升。
常规CRP作为急性炎症评估指标比红细胞沉降率(ESR)和白细胞计数更敏感、更可靠。
超敏C反应蛋白线性范围低端低于常规CRP,这种较低的范围可扩大使用适应症,C反应蛋白是非特异性的,必须结合临床症状综合评估,不能作为特定的疾病或疾病的风险的确诊依据。
图1 超敏CRP与常规CRP的区别超敏C反应蛋白常见的用途可作为心血管疾病风险识别的辅助手段。
配合传统的急性冠脉综合征临床诊断使用,可作为冠状动脉疾病或急性冠脉综合征复发的预警指示物。
图2 超敏CRP的临床意义表1 各种CRP的区别及性能要求常规CRP 超敏CRP用途感染,组织损伤和炎症性疾病的评价。
提供炎症性疾病的诊断,治疗和监控的信息是区分低水平炎症状态的灵敏指标, 血清hs-CRP 水平与动脉粥样硬化及急性脑梗死( ACI) 等心脑血管疾病的发生、严重程度及预后密切相关参考值范围参考值范围: 约10mg/ L健康人群:≤ 5mg / L急性范围: 20—500 mg/L参考值范围: 1mg/L推荐线性范围≥ 5mg/L到上限0.5 mg/L 到≤ 10.0mg/L灵敏度明确在线性范围低端的性能确定定量限(功能灵敏度)综述资料主要包括CRP的代谢、产品预期用途、产品描述、参考品的详细溯源性、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,其中同类产品上市情况介绍部分应着重从方法学、临床应用情况、性能指标等方面写明拟申报产品与目前市场上已获批准的同类产品之间的异同。
附件3C反应蛋白测定试剂盒注册技术审查指导原则(2016年修订版)本指导原则旨在指导注册申请人对C反应蛋白测定试剂盒,包括常规C反应蛋白定量检测试剂盒/超敏(高敏)C反应蛋白定量检测试剂盒/全量程C反应蛋白定量检测试剂盒注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是对C反应蛋白测定试剂盒的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供申请人和审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围本指导原则适用于基于分光光度法原理,利用手工和半自动、全自动生化分析仪,在医学实验室进行对人血清或血浆中的C-反应蛋白进行定量检测所使用的临床化学体外诊断试剂(盒)。
本指导原则不适用于:1.对C反应蛋白校准品和质控品的评价。
2.各类胶体金标记试纸。
二、注册申报资料要求(一)综述资料C-反应蛋白(C-reactive protein,CRP)由肝细胞合成,在胎儿期产生,非母体胎盘传递。
其产生机理是:当机体受感染或组织受损伤时巨噬细胞和其他白细胞等被激活,产生白细胞介素-6(IL-6)、白细胞介素-1(IL-1)、肿瘤坏死因子TNF-a等细胞因子及其他介导物,这些细胞因子和介导物到达肝脏,刺激肝细胞和上皮细胞合成CRP。
在结构上,CRP含5个多肽链亚单位,非共价地结合为盘形多聚体,分子量为11.5万—14万,CRP是一种典型的急性时相蛋白。
全程C反应蛋白包括常规C反应蛋白(常规CRP)和超敏C反应蛋白(超敏CRP)。
人绒毛膜促性腺激素检测试剂(胶体金免疫层析法)注册技术审查指导原则(2016年修订版)本指导原则旨在指导注册申请人对人绒毛膜促性腺激素检测试剂(胶体金免疫层析法)注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是对人绒毛膜促性腺激素检测试剂(胶体金免疫层析法)的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供申请人和审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围本指导原则用于人绒毛膜促性腺激素检测试剂(胶体金免疫层析法)产品注册和相关许可事项变更时注册申报资料的准备及技术审评的参考。
适用于运用双抗体夹心免疫胶体金层析技术实现对人尿液中人绒毛膜促性腺激素进行体外定性检测,不可用于滋养细胞肿瘤的检测。
根据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号)、编码代号为6840,属于二类医疗器械。
本指导原则不适用于以125I等放射性同位素标记、(电)化学发光标记、(时间分辨)荧光标记等标记方法为捕获抗体,以胶乳颗粒、微孔板、管、磁颗粒、微珠和塑料珠等为载体包被抗体,定量测定HCG的免疫分析试剂。
二、注册申报资料要求(一)综述资料人绒毛膜促性腺激素(HCG),是由胎盘的滋养层细胞分泌的一种糖蛋白,它是由α和β二聚体的糖蛋白组成。
其中α-亚单位为垂体前叶激素所共有;β-亚单位是HCG所特异的。
检测数据呈正态分布的体外诊断试剂参考区间确定资料参考区间的确定方法参考《全国临床检验操作规程》第3版及《体外诊断试剂分析性能评估系列指导原则(征求意见稿)》,具体如下:1样本1.1样本来源****附属第五医院。
1.2样本类型血清、血浆标本。
1.3样本要求血清/血浆的收集:只适用含EDTA抗凝剂(不建议使用EDTA以外的抗凝剂)的采血管或抗凝管,将采集血样加入并摇匀备用;避免溶血样本用于本试剂,如不能及时测试可将标本置4℃贮存,可存放72h,超过3天应置-20℃冷冻保存,可存放6个月。
对冷藏或冷冻的样本,测试前需恢复至室温并充分混匀,避免反复冻融。
1.4参考个体的选择除下表明确排除的人群外,均可入选。
2 参考区间确定的方法参考《全国临床检验操作规程》第3版,如入选标本的检测结果服从正态分布,以X±1.96SD做为参考区间。
其中:X = 检测结果的算术平均数SD=()12--∑n X Xn=120如入选标本的检测结果不服从正态分布,则采用95%分位法计算参考区间。
3 参考区间确定试验步骤:使用前请仔细阅读本说明书及***分析仪操作手册,测试应在室温下进行。
取70ul 样本加入到缓冲液中,混匀;取40ul 稀释过后的样本加入到卡条的加样窗口,层析15分钟,按照仪器操作方法的详细说明读取检验结果。
质量控制:当测试出现异常值时,建议进行校准和质控测试。
校准:在加样检测前,请将检测卡放于仪器卡槽中,扫描检测卡背面的二维码,进行仪器校准,不同批次的检测卡,缓冲液及二维码不能混用。
质控:用质控品(选购品,非试剂盒标配品)进行测试,测试结果应在靶值范围内。
5离群值检查经分析,各组数据D<1/3R,无离群值,均纳入后续的统计分析。
6两组之间差异比较(n=120)男女组数量均为60,则Z*=3(120/240)1/2=2.12,如果z值超过了对应的Z*值,两组之间即存在显著性差别,应分别报告参考区间。
另外,应检查标准偏差较大者,如S2,是否大于1.5S1。
医学参考值范围制定一、概念和意义1. 医学参考值的概念:医学参考值又称临床参考值或正常值,是指“正常”人体和动物的各种生理常数、体液、排泄物中各种成分含量及人体对各种试验的反应值。
广义的医学参考值还包括各类“卫生标准”。
应注意的是,医学参考值的不是一个单一的数值,而是许多数值的集合或全体,即是一个范围。
2.医学参考值的作用及意义:(1)用以区分“正常”和“异常”个体,为临床诊断提供参考;(2)可用以反映不同时间、地区人群某项指标的生理变迁。
二、制定参考值范围的基本步骤1. 确定“正常人”对象的范围:即根据研究目的确定的未患被研究疾病的个体。
2. 统一测定标准:即检验用的试剂批号、仪器、人员、条件等应相同。
3. 确定分组:一般需用年龄、性别等对“正常人”对象进行分组,分组特征也可根据检验判断。
4. 样本含量确定:一般来讲,正态分布资料所需的样本含量应在100以上,偏态或未知分布时样本含量应更大。
5. 确定参考值范围的单双侧:一般生理物质指标多为双侧、毒物指标则多为单侧。
6. 确定百分位点:一般取95%或99%。
三、参考值范围的制定方法(1)正态分布法:据正态分布原理,一定可信度(如95%)下的正常值范围,双侧为:均数±u0.05*S;单侧上限为:均数+u0.05*S,单侧下限为:均数-u0.05*S。
(2)百分位数法:对于偏态分布或未知分布的资料,正常值范围的确定常用百分位数法,如95%可信度下的正常值范围双侧为P2.5--P97.5,单侧上限为P95,单侧下限为P5。
四、制定参考值范围时的注意事项1. 应注意参考值范围是基于一定可信度而建立的的,即它最多仅能包含95%或99%的“正常”个体;2. 临床应用中采用多指标联合诊断可提高判断的效率;3. 观察值的正常值范围要与均数的可信区间相区别。
五、质量控制此外,工业生产、实验中的质量控制方法也是基于上述原理提出的,即根据质量指标多数服从正态分布的性质,用均数加减2倍标准差(约包含95%的个体观察值)作为上、下警戒值,均数加减3倍标准差(约包含99.73%的个体观察值)作为上、下控制值,若质量指标超出上、下警戒值,则发出警报,若超出上、下控制值,则停止生产或实验过程。
第二类体外诊断试剂产品注册资料
白蛋白测定试剂盒
(溴甲酚绿法)
参考区间确定资料
XXXXXX
一、参考依据
依据NCCLS C28-A2 如何确定临床检验的参考区间:批准指南(2000)文件。
该文件是确定定量临床检验项目的参考区间的指南。
二、材料与方法
1.标本来源
按健康人群要求选择XXXXXXXXX医院健康体检者,收取该医院检验科检测已完成的临床样本。
样本采集/检验时间:XXXX.XX。
对象:在XX地区居住的性别不限、年龄不限的健康人。
健康人的要求:(1)一月无急性感染史;(2)发育正常,无心血管、肺、肾和肝、胆、胰等器质性疾患;(3)半年无输血和大手术史;(4)3月未服用影响凝血功能的药物,2周无中毒史,未接触毒物及其他有害物质;(5)妇女不在妊娠或哺乳期。
2.使用仪器
HITACHI 7020全自动生化仪。
3.检测试剂
XXXXXX生产的白蛋白测定试剂盒(溴甲酚绿法)。
规格:XXmL;批号:XXXXXX;生产日期:XXXXXXXX;有效期XXXXXXXX。
4. 质量控制
按照技术要求3.1、3.3~3.6.1、3.7进行产品性能的测定,结果应符合要
求。
5. 参考值确定
根据项目制定双侧界限或单测界限,采用95%参考区间围。
6.统计方法
应用SPSS20进行数据统计分析。
正态性检验采用Kolmogorov–Smirnov(K-S) 检验。
结果属于正态分布的,用正态分布法计算参考区间围,其95%参考区间围分别用下式计算:
双侧:SD
.1
X96
单测下限:SD
.1
X64
+
X64
-单测上限:SD
.1
结果属于偏态分布的,用百分位法计算参考区间围,其95%参考区间围分别用下式计算:
双侧:P2.5~P97.5
单测下限:P5单侧上限:P95
三、试验结果
用白蛋白测定试剂盒(溴甲酚绿法)对收集到的标本进行测定,测定结果呈正态分布(见图1)。
95%参考区间用公式求出,得出了本试剂盒测定ALB的参考值围上下限,见表1。
确定白蛋白试剂盒(溴甲酚绿法)参考值围为:38-44g/L。
图1 200例总胆汁酸测定结果的K-S检验
表1 白蛋白测定试剂盒(溴甲酚绿法)参考值围确定
例数X SD
X
-1.96SD
X
+1.96SD
200 40.97 1.513 38 44
备注:详细实验数据资料(质量控制数据、参考值样本测定数据)见附件1
四、讨论
1.某项目的临床参考值是指在特定条件用特定方法所得到的生理生化参数,不同的条件(如地区,时间,性别,年龄,生活水平,测定方法等)测出的参考值围可能有所差异,建议用户建立自己实验室的参考值围。
2.不能盲目地把参考值围作为正常与异常的分界点,因参考值通常采用95%可信区间,此围仅覆盖研究人群的95%,有5%的健康人群落在参考值围之外。
3.参考值在作为诊断与监测疾病时的判断依据时,还应考虑年龄、性别、饮食、锻炼、个人喜好等多种因素的影响,综合评价,仔细判定。
附件1:
质量控制数据
参考值样本测定数据。