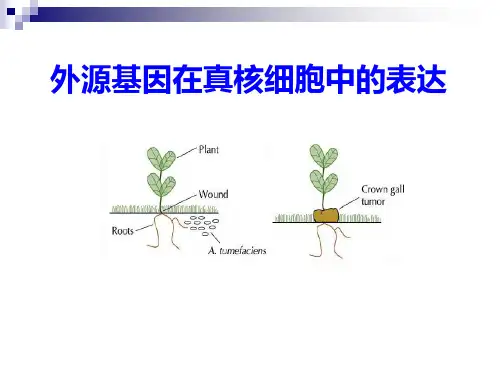
第九章外源基因在真核细胞中的表达
- 格式:ppt
- 大小:804.50 KB
- 文档页数:93

真核细胞常见表达载体1. pCMVp-NEO-BAN载体特点: 该真核细胞表达载体分子量为6600碱基对,主要由CMVp启动子、兔β-球蛋白基因内含子、聚腺嘌呤、氨青霉素抗性基因和抗neo基因以及pBR322骨架构成,在大多数真核细胞内都能高水平稳定地表达外源目的基因。
更重要的是,由于该真核细胞表达载体中抗neo基因存在,转染细胞后,用G418筛选,可建立稳定的、高表达目的基因的细胞株。
插入外源基因的克隆位点包括Sal1、BamH1和EcoR1位点。
注意在此载体中有二个EcoR1位点存在。
2. pEGFP, 增强型绦色荧光蛋白表达载体(Enhanced Fluorecent Protein Vector特点: pEGFP表达载体中含有绿色荧光蛋白,在PCMV启动子驱动下,在真核细胞中高水平表达。
载体骨架中的SV40 origin使该载体在任何表达SV40 T 抗原的真核细胞内进行复制。
Neo抗性盒由SV40早期启动子、Tn5的neomycin/kanamycin抗性基因以及HSV-TK基因的聚腺嘌呤信号组成,能应用G418筛选稳定转染的真核细胞株。
此外,载体中的pUC origin 能保证该载体在大肠杆菌中的复制,而位于此表达盒上游的细菌启动子能驱动kanamycin抗性基因在大肠杆菌中的表达。
用途: 该表达载体EGFP上游有Nde1、Eco47111和Age1克隆位点,将外源基因扦入这些位点,将合成外源基因和EGFP的融合基因。
借此可确定外源基因在细胞内的表达和/或组织中的定位。
亦可用于检测克隆的启动子活性(取代CMV启动子,Acet1-Nhe1。
Excitation maximum = 488 nm; Emission maximum = 507图示为启动子分泌信号肽和多克隆位点区域:Ase1.pCMV…ccg cta gcg cta ccg gtc gcc acc atg- .EGFP…BamH1…SV40 poly A+Nhe1 Age13. pEGFT-Actin, 增强型绿色荧光蛋白/人肌动蛋白表达载体特点: pEGFP-Actin表达载体中含有绿色荧光蛋白和人胞浆β-肌动蛋白基因,在PCMV启动子驱动下,在真核细胞中高水平表达。

外源基因在真核细胞中的转录与翻译机制外源基因指的是不同于自身天然基因的DNA序列,也称为异基因。
它们通常来自其他生物体或者人工合成。
将外源基因导入真核细胞中,可以用于基因治疗等生物学应用。
但是,外源基因在真核细胞中的转录与翻译机制是如何实现的呢?本文将从转录与翻译两个方面进行探讨。
一、外源基因的转录在真核细胞中,外源基因的转录需要利用细胞核内的RNA聚合酶Ⅱ及其辅助因子。
具体而言,首先,在外源基因导入真核细胞后,其中的DEAE(二乙氨基乙烷磺酰氯)结构可以与细胞核膜上的负电性磷脂结合,从而增加外源基因进入细胞核的概率。
其次,外源基因所带有的启动子因子通常与细胞内自身基因的启动子因子不同,因此,需要利用转录激活因子(transcriptional activator)来激活RNA聚合酶Ⅱ。
这些转录激活因子可以通过识别外源基因启动子上的绑定位点,与RNA聚合酶Ⅱ的载体克服反式构象的阻碍,使其启动并开始转录。
最后,转录过程中所合成的外源mRNA需要经过RNA后处理过程。
比如,转录的外源mRNA首先要剪切成正确的3’端与5’端,接着经过去除内含子、加上头部甲基等修饰,最终整合成成熟的mRNA。
这一过程让外源mRNA得以正常运作,供翻译酶读取序列信息。
二、外源基因的翻译外源基因的翻译与自身基因类似,需要使用细胞质内的翻译体系。
通常来说,外源蛋白的合成与自身蛋白合成的过程没什么不同,遵循着标准的mRNA翻译规则。
具体而言,首先,mRNA上的翻译起始密码子(AUG)被识别后,tRNA带着对应的氨基酸A(甲硫氨酰胺)进入到翻译终点—核糖体R(ribosome)上。
其次,核糖体R从mRNA的5’端不断向3’端移动,逐渐合成蛋白。
这一过程中,外源基因上的密码子和tRNA发生配对,tRNA合成链不断变长,新合成的肽链不断生长。
最后,当核糖体R到达mRNA终止密码子时,翻译过程终止,蛋白质合成结束。
需要注意的是,由于外源蛋白和自身蛋白在A、T、G、C序列的组合上并无区别,因此在翻译过程中往往会和自身蛋白一同被翻译和进入细胞质中。

实验九外源基因在大肠杆菌中的诱导表达和降解物阻遏作用【实验目的】1.了解外源基因在原核细胞中表达的基础理论。
2.掌握乳糖操纵子的调节机制和操作方法。
【实验原理】1.外源基因在原核细胞中的表达蛋白质通常是研究的最终目标,因此蛋白质的表达在基因工程中占有非常重要的地位。
常用的表达系统有原核细胞和真核细胞。
原核细胞表达系统主要使用大肠杆菌,真核细胞表达系统主要有酵母细胞、哺乳动物细胞和昆虫细胞。
这些表达系统各有优缺点,应根据实验目的和实验室条件加以选择。
本实验主要介绍以大肠杆菌为代表的原核细胞表达系统。
(1)大肠杆菌表达系统的特点:生物学特性和遗传背景清楚,易于操作;已开发较多的克隆载体可供选择;容易获得大量的外源蛋白(外源蛋白可占细菌总蛋白50%左右)。
(2)蛋白质在原核细胞中的表达特点:原核细胞有其固有的RNA聚合酶,识别原核基因的启动子。
因此,在用原核细胞表达目的基因(无论是真核基因还是原核基因)时,一般应使用原核启动子。
原核基因的mRNA含有SD序列,启动蛋白质的合成。
而在真核基因上则缺乏该序列。
因此,一些商品化原核表达载体上设计有SD序列,以方便真核基因的表达。
原核细胞没有mRNA转录后加工的能力。
因此,在原核细胞中表达真核基因时,应使用cDNA 为目的基因。
原核细胞缺乏真核细胞对蛋白质进行翻译后加工的能力。
如表达产物的功能和蛋白质的糖基化、高级结构的正确折叠有关,必须慎重使用原核表达系统。
外源基因在大肠杆菌中高效表达时,表达产物往往在胞浆聚集,形成均一密度的包涵体。
包涵体的形成有利于保护表达产物不被胞内的蛋白酶降解,而且可以通过包涵体和胞内其他蛋白质密度不同来纯化包涵体蛋白。
但包涵体蛋白不具有该蛋白的所有生物学活性,往往需要通过变性复性的方法恢复活性,有时只能回复部分活性。
(3)蛋白质在原核细胞表达的调控启动子是转录水平调控的主要因素。
根据启动子起始mRNA合成效率的不同,可分为强、弱启动子,但是启动子的强弱是相对于不同基因而言的。

真核细胞表达外源基因步骤.txt丶︶ ̄喜欢的歌,静静的听,喜欢的人,远远的看我笑了当初你不挺傲的吗现在您这是又玩哪出呢?真核细胞表达外源基因步骤点击: 538 作者:来源:时间: 2007-11-10 本站论坛在真核细胞中表达蛋白的步骤比大肠杆菌复杂得多。
首先要考虑选用什么载体。
一般人们趋向于使用分泌表达载体,以便于蛋白的纯化。
但有的蛋白并不适合于分泌表达,如一些胞质蛋白,非糖基化蛋白等。
此外分泌表达的蛋白信号肽存在一个效率问题。
有的蛋白即使存在信号肽,也不能分泌。
并且有的分泌蛋白较易受到蛋白酶的降解。
所有这些因素都需综合考虑。
1 克隆选用合适的内切酶把外源基因克隆于表达载体的多克隆位点。
如果选用的是分泌型表达载体,则外源基因的阅读框架和信号肽的阅读框架应该保持一致。
2 重组栽体线性化重组载体只有被酶切线性化整合效率才能大大提高,环状质粒整合效率是很低的。
选用不同的内切酶线性化可得到不同的转化子。
如对载体pPC19选用BgiⅡ线性化,转化后可得到Muts表型转化子;选用SaI或StuI线性化,转化后可得到Mut表型转化子。
3 转化目前对真核细胞的转化方法有多种,例如对于P.Pastoris的转化目前有4种方法:①锂盐法;②PEG法;③原生质球法;④电穿孔法。
锂盐法和PEG法方法简便,但效率很低,每微克DNA只有几十个转化子或更低,一般不多用。
原生质球法和电穿孔法转化率都较高,而且一般可得到高拷贝重组,其转化率都可达到105/μg。
但原生质球法操作繁琐费时;电穿孔法简便、快速、高效,是理想的转化方法。
选用上述四种方法中的一种转化。
一般选用原生质球或电击法。
4 筛选转化子可先在不含组氨酸的培养基上初筛。
复筛可用PCR进行。
即提取转化子DNA,用外源基因两侧特异引物扩增筛选。
然而,这只限于少量转化子转化子太多,则工作量太大。
对于大量转化子的筛选.可用原位点杂交进行。
即把相同量的不同转化子点在NC膜上,在原位对酵母细胞壁进行裂解,使之释放DNA。


真核表达质粒的构建与表达1. 真核表达质粒的构建真核表达质粒是一种含有真核基因的质粒,它可以用于在真核细胞中表达外源基因。
真核表达质粒的构建主要包括以下步骤:(1)选择表达载体:首先,需要选择一种合适的表达载体,例如质粒、质杆菌、噬菌体等,以及一种合适的表达系统,例如T7系统、T3系统、SP6系统等。
(2)构建表达质粒:其次,通过合成或克隆技术将外源基因插入到表达载体中,构建表达质粒。
(3)筛选表达质粒:最后,通过PCR、Southern blotting等技术筛选出含有外源基因的表达质粒。
2. 真核表达质粒的表达真核表达质粒的表达是一种细胞内的转录和翻译过程,它可以将外源基因插入真核细胞中,从而实现基因的表达。
表达质粒的表达通常由以下几个步骤组成:首先,将外源基因与表达质粒的启动子序列结合,以形成表达质粒;其次,将表达质粒转染到真核细胞中,以便在细胞中表达外源基因;最后,真核细胞将表达质粒中的基因转录成mRNA,然后翻译成蛋白质,从而实现基因的表达。
此外,表达质粒的表达过程还可以通过调节启动子序列的表达水平来调控基因的表达。
真核表达质粒的稳定性是指质粒在不同的环境条件下,表达量不受外界环境变化的影响,能够保持恒定的表达量。
稳定性的提高可以改善表达质粒的性能,并且能够更好地满足实验要求。
为了提高真核表达质粒的稳定性,一般采用以下几种方法:一是优化质粒的结构特征。
质粒结构特征包括质粒的大小、碱基组成、表达载体的类型等。
优化质粒的结构特征可以有效提高质粒的稳定性,从而改善质粒的性能。
二是改变质粒的表达系统。
质粒的表达系统包括表达调控因子、载体、表达调控序列等。
改变表达系统可以改变质粒的表达量,从而提高质粒的稳定性。
三是改变质粒的表达条件。
质粒的表达条件包括培养基、温度、pH值、溶液浓度等。
改变质粒的表达条件可以改变表达量,从而提高质粒的稳定性。
四是改变质粒的表达调控序列。
表达调控序列是控制质粒表达的关键因素,改变表达调控序列可以改变质粒的表达量,从而提高质粒的稳定性。


真核细胞常见的表达载体及真核细胞表达外源基因的调控真核细胞常见表达载体1. pCMVp-NEO-BAN载体特点: 该真核细胞表达载体分⼦量为6600碱基对,主要由CMVp启动⼦、兔β-球蛋⽩基因内含⼦、聚腺嘌呤、氨青霉素抗性基因和抗neo基因以及pBR322⾻架构成,在⼤多数真核细胞内都能⾼⽔平稳定地表达外源⽬的基因。
更重要的是,由于该真核细胞表达载体中抗neo基因存在,转染细胞后,⽤G418筛选,可建⽴稳定的、⾼表达⽬的基因的细胞株。
插⼊外源基因的克隆位点包括Sal1、BamH1和EcoR1位点。
注意在此载体中有⼆个EcoR1位点存在。
2. pEGFP, 增强型绦⾊荧光蛋⽩表达载体(Enhanced Fluorecent Protein Vector)特点: pEGFP表达载体中含有绿⾊荧光蛋⽩,在PCMV启动⼦驱动下,在真核细胞中⾼⽔平表达。
载体⾻架中的SV40 origin使该载体在任何表达SV40 T 抗原的真核细胞内进⾏复制。
Neo抗性盒由SV40早期启动⼦、Tn5的neomycin/kanamycin抗性基因以及HSV-TK基因的聚腺嘌呤信号组成,能应⽤G418筛选稳定转染的真核细胞株。
此外,载体中的pUC origin 能保证该载体在⼤肠杆菌中的复制,⽽位于此表达盒上游的细菌启动⼦能驱动kanamycin抗性基因在⼤肠杆菌中的表达。
⽤途: 该表达载体EGFP上游有Nde1、Eco47111和Age1克隆位点,将外源基因扦⼊这些位点,将合成外源基因和EGFP的融合基因。
借此可确定外源基因在细胞内的表达和/或组织中的定位。
亦可⽤于检测克隆的启动⼦活性(取代CMV启动⼦,Acet1-Nhe1)。
Excitation maximum = 488 nm; Emission maximum = 507图⽰为启动⼦分泌信号肽和多克隆位点区域:Ase1.pCMV…ccg cta gcg cta ccg gtc gcc acc atg- .EGFP…BamH1…SV40 poly A+ Nhe1 Age13. pEGFT-Actin, 增强型绿⾊荧光蛋⽩/⼈肌动蛋⽩表达载体特点: pEGFP-Actin表达载体中含有绿⾊荧光蛋⽩和⼈胞浆β-肌动蛋⽩基因,在PCMV 启动⼦驱动下,在真核细胞中⾼⽔平表达。

真核载体的应用和原理简介真核生物是指细胞内含有真核细胞核的生物,包括动植物、真菌等。
真核生物的细胞包含多个细胞器,如细胞核、线粒体等。
对于研究真核生物的基因功能和表达调控,研究人员常常利用真核载体作为工具进行基因转染和表达。
本文将介绍真核载体的应用领域和基本原理。
应用领域基因转染真核载体可以用于将外源基因导入真核生物细胞中,通过基因转染可实现以下应用: - 基因功能研究:通过敲除或过表达外源基因,研究其对细胞和生物体的影响。
- 蛋白质表达:利用真核载体实现外源蛋白质在真核细胞中的高效表达。
- 基因治疗:将治疗基因导入患者体内,用于治疗一些遗传性疾病等。
转基因生物研究真核载体也被广泛应用于转基因生物研究,通过在真核生物细胞中导入外源基因,研究人员可以: - 验证基因功能:通过外源基因的表达,研究其在生物体中的功能和调控。
- 制备抗体:将外源蛋白表达在真核细胞中,制备特异性抗体,用于蛋白质识别和研究。
基本原理选择适合的真核载体在进行基因转染实验时,选择适合的真核载体非常重要。
常用的真核载体有:- 原核真核双操作子表达载体:这种载体结构合理,适合真核生物的表达。
- mama 单元载体:这类载体包含起始子,终止子,选择子,选择子较为灵活。
载体构建和转染技术为了实现外源基因的转染,通常需要进行以下步骤:1. 基因克隆:将外源基因插入载体中,构建重组载体。
2. 载体扩增:利用细菌进行大量的载体扩增。
3. 纯化载体DNA:纯化扩增后的载体DNA,去除可能存在的杂质。
4. 细胞培养:培养要转染的真核细胞,使其进入合适的状态。
5. 转染:将纯化的载体DNA导入培养的真核细胞中,实现外源基因的表达。
表达调控真核载体的应用还包括对外源基因的表达调控,研究人员通过改变载体中的启动子、转录因子结合位点等元件,可以实现基因的定量、定位和时序调控。
成果分析在转染后,需要进行相关结果的分析以验证实验效果。
常用的方法包括: - 蛋白质表达分析:通过免疫印迹法或荧光染色等技术,检测外源蛋白的表达情况和定位。

外源基因的导入和表达技术生物工程是一个仍在不断发展的领域,其中的基因工程尤其备受关注。
而外源基因的导入和表达技术则是基因工程领域中的重要组成部分。
本文将从外源基因的导入方式、表达技术、应用等方面进行讲解,以期为读者展开一个全面的了解之旅。
一、外源基因的导入方式外源基因的导入方式包括:化学转化、物理转化和生物转化三种。
其中,化学转化指的是利用一系列的化学试剂将外源基因导入到细胞中;物理转化是将外源基因通过物理方式(如电击、微射膜等)直接导入到细胞膜内;生物转化则是利用微生物(如农杆菌)的天然转化机制,将外源基因转移至宿主细胞中。
三种导入方式各有优缺点,需根据具体情况进行选择。
例如,化学转化可以较为方便地实现基因导入,但同时也容易导致不可逆的细胞损伤;生物转化虽然安全可靠,但其稳定性与效率相对较低;物理转化则可以在不影响细胞生存的前提下完成基因转化,但也存在操作复杂、转化效率低等问题。
二、外源基因的表达技术对于外源基因的表达技术而言,主要有以下几种:1.原核细胞表达:指在原核细胞(如大肠杆菌等)中实现外源基因的转录和翻译。
该方式快速、高效,适用于小分子蛋白的表达和药物筛查。
2.真核细胞表达:指在真核细胞(如哺乳动物细胞等)中实现外源基因的转录和翻译。
与原核细胞表达相比,该方式可满足更多的表达需求,但同时也更为复杂。
3.质粒表达:指将外源基因插入质粒中,利用质粒的复制和转录机制实现基因的表达。
该方式容易操作,但不适用于大分子蛋白的表达。
以上三种方式各有利弊,需根据具体需求进行选择。
例如,对于高产量、大分子量的蛋白表达而言,真核细胞表达较为优越;对于筛查药物、构建基因工程菌等,则可以采用原核细胞表达。
三、外源基因表达技术的应用外源基因表达技术在许多领域都具有广泛的应用,以下列举几个典型示例:1.蛋白质表达:基因重组技术可以有效地提高某些蛋白质的表达量,为生物学研究和医药开发提供了有力的技术支持。
例如,基因重组技术在制备重组人胰岛素、静脉营养液等方面得到了广泛应用。
一、名词解释1。
分配常数:又称分配系数,是指一种分析物在两种不相混合溶剂中的平衡常数。
2.多肽链的末端分析:确定多肽链的两末端可作为整条多肽链一级结构测定的标志,分为氨基端分析和羧基端分析。
3。
连接酶:指能将双链DNA中一条单链上相邻两核苷酸连接成一条完整的分子的酶。
4。
预杂交:在分子杂交实验之前对杂交膜上非样品区域进行封闭,用以降低探针在膜上的非特异性结合。
5.反转录PCR:是将反转录RNA与PCR结合起来建立的一种PCR技术。
首先进行反转录产生cDNA,然后进行常规的PCR反应。
6。
稳定表达:外源基因转染真核细胞并整合入基因组后的表达。
7.基因敲除:是指对一个结构已知但功能未知或未完全知道的基因,从分子水平上设计实验,将该基因从动物的原基因组中去除,或用其它无功能的DNA片断取代,然后从整体观察实验动物表型,推测相应基因的功能。
8.物理图谱:人类基因组的物理图是指以已知核苷酸序列的DNA片段为“路标”,以碱基对(bp,kb,Mb)作为基本测量单位(图距)的基因组图。
9。
质谱图 :不同质荷比的离子经质量分析器分开后,到检测器被检测并记录下来,经计算机处理后所表示出的图形.10。
侧向散射光:激光束照射细胞时,光以90度角散射的讯号,用于检测细胞内部结构属性。
11。
离子交换层析:是以离子交换剂为固定相,液体为流动相的系统中进行的层析。
12。
Edman降解:从多肽链游离的N末端测定氨基酸残基的序列的过程.13.又称为限制性核酸内切酶(restriction endonuclease):是能够特异识别双链DNA序列并进行切割的一类酶。
14。
电转移:用电泳技术将凝胶中的蛋白质,DNA或RNA条带按原位转移到固体支持物,形成印迹。
15。
多重PCR:是在一次反应中加入多对引物,同时扩增一份模板样品中不同序列的PCR 过程.16.融合表达: 在表达载体的多克隆位点上连有一段融合表达标签(Tag),表达产物为融合蛋白(有分N端或者C端融合表达),方便后继的纯化步骤或者检测.17。