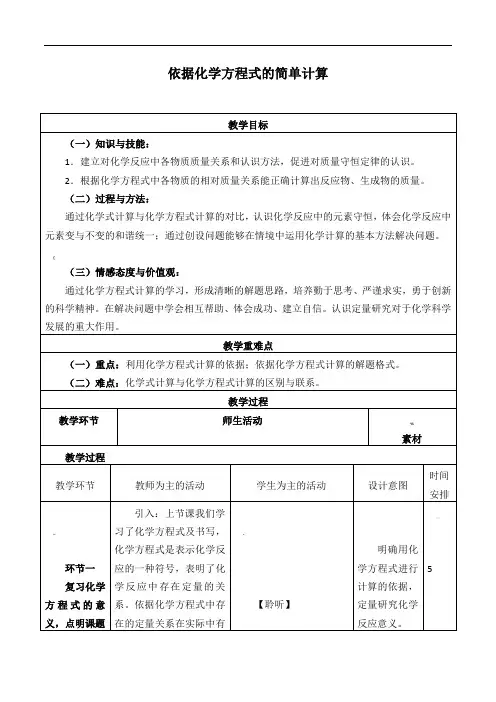
北京课改版化学-九年级上册-《依据化学方程式的简单计算》名师教案2
- 格式:doc
- 大小:48.50 KB
- 文档页数:6


《利用化学方程式的简单计算》教学教案设计《利用化学方程式的简单计算》教学教案设计教学目标:1、知识与技能在正确书写化学方程式的基础上,进行简单的计算。
2、过程与方法通过由易到难的题组和一题多解的训练,开阔思路,提高解题技巧,培养思维能力,加深对化学知识的认识和理解。
3、情感与价值观培养学生按照化学特点进行思维及审题、分析、计算能力。
教学重点:1、由一种反应物(或生成物)的质量求生成物(或反应物)的质量。
2、根据化学方程式计算的书写格式要规范化。
教学难点:训练和培养学生按照化学特点去思维的科学方法。
教学方法:讲练结合f教学课时:二课时教学过程:复习提问:写出下列化学方程式并说明化学方程式的.涵义(1)氯酸钾与二氧化锰共热(2)氢气还原氧化铜引入新课:(情景设计)根据化学方程式的涵义,反应物与生成物之间的质量比可表示为:2KClO3==2KCl+3O2↑245 149 96若()g ()g 48g同理: C+ O2 == CO212 32 44若()g ()g 22g讲解:这说明:在化学反应中,反应物与生成物之间质量比是成正比例关系,因此,利用正比例关系根据化学方程式和已知的一种反应物(或生成物)的质量,可生成物(或反应物)的质量。
讲授新课根据化学方程式的计算例1:加热分解5.8克氯酸钾,可得到多少克的氧气?提问:怎样计算?(在引入的基础上学生回答)讲解:解题步骤:设、方、关、比、算、答设:设未知量方:写出正确的化学方程式(配平)关:找关系(写出有关物质的相对分子质量与计量数的关系,然后再写出已知量与未知量质量关系,并写在化学式下面。
比:列出正确的比例式算:计算正确答案(保留小数点一位)答:说明:书写格式[解]:设:可得氧气的质量为x。
生成氯化钾的质量为y ………………(1)设2KClO3 == 2KCl+3O2↑…………(2)方245 149 96…………(3)关5.8g y x…………(4)比x=2.3g y=3.5g …………(5)算答:分解5.8克氯酸钾可得到氧气2.3克…………(6)答练习:若将[例题1]改为:实验室要制取2.3克的氧气。



依据化学方程式的简单计算-北京版九年级化学上册教案1. 教学目标在本课学习中,学生将会:1.了解化学方程式的化学计算及其应用;2.了解物质的化学计算步骤;3.了解如何计算某些物质的摩尔质量及其化学式;4.掌握普通化学反应方程式的化学计算;5.应用所学知识,计算与解决一些简单的现实问题。
2. 教学内容本课程主要内容包括:1.化学方程式的基本概念及应用;2.化学计算步骤及其应用;3.某些物质的摩尔质量及其化学式计算;4.普通化学反应方程式的化学计算;5.应用所学知识,计算与解决一些简单的现实问题。
3. 教学重点和难点3.1 教学重点1.化学方程式的基本概念及应用;2.化学计算步骤及其应用;3.普通化学反应方程式的化学计算和应用。
3.2 教学难点1.某些物质的摩尔质量及其化学式的计算;2.应用所学知识,计算与解决一些简单的现实问题,需较强的逻辑思维。
4. 教学方法本课程教学与学习采用情境模拟、案例对比、问题导入、应用解决问题等一系列教学方法,帮助学生养成综合分析及解决问题的能力。
5. 教学过程5.1 学习前情境模拟:案例对比太阳能是一种取之不尽用之不竭的能源,它可以通过光伏发电转化为电能。
但在实际应用中,太阳能发电的效率往往受到影响,如不同角度收集光线的光伏电池发电效率不同等。
现在请你思考一个问题,如果把10 km²的光伏电池板铺在华北区域,发电效率为10%,每天从早上8点到下午18点,实际发电时间为10个小时,那么一天可以发电多少千瓦时?(提示:需要化学方程式的应用)5.2 学习中5.2.1 第一步:化学方程式的基本概念及应用概念介绍化学方程式是描述化学反应的化学式,包括反应物、生成物及反应的化学计量关系。
化学方程式可以反映出反应物的种类和数量,而且可以通过方程式进行化学计算,例如反应物的质量和摩尔数、生成物的质量和摩尔数、反应物和生成物之间的化学计量关系等。
应用介绍化学方程式可以帮助我们计算物质的?质量及其构成,进而计算反应物和生成物之间的化学计量关系。


人教版九年级上册《利用化学方程式的简单计算》教案2【学习目的】1.依据化学方程式的意义,看法化学变化中各物质量的关系;2.模拟例题,感受应用化学方程式计算的普通步骤;3.初步学会用规范的格式停止化学方程式的复杂计算。
【重点难点】教学重点:依据化学方程式计算的步骤教学难点:物质间的质量关系;依据化学方程式计算的要领及关键。
【教学方法】模拟、纠错、练习【教学进程】【创设情境】2021年9月15日22时04分,中国在酒泉卫星发射中心用长征二号FT2运载火箭将天宫二号空间实验室发射升空。
长征二号运载火箭搭载的燃料推进剂有液氢、液氧,它们反响时会放出庞大的能量,你们能写出氢气熄灭的化学方程式吗?反响时氢分子、氧分子和水分子的个数比为多少?参与反响的氢气、氧气以及生成水的质量比为多少呢?在氢气熄灭这个反响中物质间的质量关系是这样的:每4份质量的氢气完全反响时会消耗32份质量的氧气,失掉36份质量的水。
氢气在氧气中熄灭的化学方程式:2H2+O22H2O各物质之间的质量比:〔〕∶〔〕∶〔〕4g 〔〕〔〕〔〕8kg 〔〕〔〕〔〕72t〖启示〗我们发如今此反响中知道氢气、氧气、水中恣意一种物质的质量,就能求出其他物质的质量,假定其他化学反响中你知道恣意一种物质的质量,能求出其他物质的质量吗?【点评提升】由于化学反响时,各反响物和各生成物之间都有固定的质量比,由实践参与反响的一种物质的质量,可以计算出反响中其它物质的质量。
【过渡】知道可以应用化学方程式停止计算,但是计算进程该如何表示呢?活动一感受依据化学方程式计算的普通步骤〖阅读〗课本P102例题1,学习应用化学方程式计算的步骤和方法,留意解题的规范格式。
〖归结〗请用繁复的言语归结应用化学方程式计算的普通步骤:〖例题〗模拟例题处置下面的效果。
8t的液氢完全熄灭,需求消耗多少液氧?【点评提升】依据化学方程式停止计算普通有5步,可概括为5个字:设〔是设未知量而不是普通意义上的未知数,比如:设某物质质量为x,x前面不带单位,由于x是一个量,其中曾经隐含有单位;普通问什么就设什么〕、写〔正确书写方程式〕、找〔量和未知量都必需是纯真物的质量〕、列〔应用正比例列出比利式,既可横着列也可竖着列〕、答。

代入量均为纯净物的质量三个要领:步骤要完整格式要规范计算要准确新知学习环节:一、涉及物质体积的计算。
例1:实验室需要180克氧气,如果用电解水的方法来制取,那么同时可以得到氢气的体积是多少升(标准状况下ρ(H2)=0.1克/升)【讲解】学会运用密度公式:ρ=m/V二、涉及物质含杂的计算。
例2:工业上高温煅烧石灰石(含CaCO3 80%)125g,可制得二氧化碳多少克?【讲解】学会使用纯量公式:纯物质的质量=不纯物质的质量×某物质的质量分数三、涉及物质过量的计算。
例3:若将1g氢气和10g氧气混合在一密闭的容器中使之充分反应,生成水的质量为多少?【讲解】关于过量的问题,“实际参加反应的物质的量”才可直接使用。
【小结】强化解决三类题型的技巧与方法。
学生尝试解题学生代表讲解,统计加分。
学会运用密度公式:ρ=m/V。
学生尝试解题(例2)(利用小组合作,解决较难的题目。
)学生代表讲解,统计加分。
学会使用纯量公式:纯物质的质量=不纯物质的质量×某物质的质量分数。
学生尝试解题(利用小组合作,解决较难的题目。
)学生代表讲解,统计加分。
学会分析过量问题。
况,为本节课重点内容做铺垫。
学生展示学习成果,锻炼学生思维的敏性捷和表达的准确性,提高学生的化学素养。
小组合作式学习(加分制),激发学生的学习兴趣,养成生生互动的良好习惯。
【课堂检测】见“目标检测”【总结】重点强化解题步骤的规范性和对三种题型的梳理。
表彰优秀小组。
布置课后作业。
学生进行课堂检测,小组互判,加分。
目标达成度检测,教师及时掌握本节课学生的学习效果。
九、目标检测含杂质20%的石灰石100g(石灰石主要成分是碳酸钙CaCO3),高温煅烧后,(1)可得氧化钙(CaO)多少吨,(2)可得二氧化碳的体积是多少升?(标准状况下,二氧化碳的密度约为2克/升)。

《利用化学方程式的简单计算》教案《利用化学方程式的简单计算》教案《利用化学方程式的简单计算》教案1 教学目的1.知识技能初步掌握利用化学方程式计算的步骤和方法。
2.过程方法通过化学方程式中物质间的质量比,初步理解反响物、生成物之间的质和量的关系。
3.情感态度价值观认识定量研究对于化学科学开展的重大作用。
教学重难点【教学重点】根据化学方程式计算的步骤。
【教学难点】物质之间量的关系。
教学过程一、导入新课:创设学习情境,引出探究问题二、课内探究:探究利用化学方程式进展简单计算的根本步骤【提出问题】为了满足0.4吨液氢充分燃烧,你会在助燃仓中至少填充多少吨液氧呢?要求:(1)先在学案上写出计算过程;(2)组内交流计算根据。
按照老师要求,先独立完成计算过程,然后组内交流。
并得出如下结论:在化学反响中,反响物和生成物之间的质量比是成比例关系的。
因此,利用正比例关系,根据化学方程式和的一种物质的质量(反响物或生成物),可求出反响中其他物质的质量。
帮助学生建立化学方程式中各物质之间的质量关系,这是根据化学方程式进展计算的主要根据。
2.【提出问题】各小组在刚刚讨论的根底上,考虑你的计算过程有哪几个步骤?学生1:先写出反响的化学方程式,然后列出比例式;学生2:需要先设未知量为xg;学生3:最后还需要作答给学生提供充分自主学习的时机,让学生先自主讨论得出不完善、不准确的步骤、格式,然后通过阅读教材进展比照,发现问题,纠正问题,从而自主构建解题的步骤和格式。
老师的讲解是对学生思维过程的一个概括提升,而不是将一个程序化的步骤灌输给学生。
3.【提出问题】阅读教材P102-例题1,比照分析^p 大家刚刚概括出来的解题过程,看还有没有需要补充(或纠正的)?【讲解】老师利用学生的讨论,通过投影讲解强化计算的根本步骤和格式要求。
(1)设未知量;(2)写出有关反响的正确化学方程式;(3)写出相关物质的相对分子质量和量、未知量;(4)列出比例式,求解;(5)简明地写出答案。
5.3 利用化学方程式的简单计算第一课时【教学目标】知识与技能1、在正确书写化学方程式的基础上,进行简单的计算。
2、掌握化学方程式计算的步骤和书写格式。
过程与方法从化工生产的实际需要出发,通过对化学方程式中各反应物、生成物之间质量关系的分析,运用数学计算方法处理相关物质之间的量的问题,培养学科之间交融的思维方法。
情感态度与价值观认识化学变化中的质量关系以及它在生产及科学研究中的意义。
【教学重点】利用化学方程式计算的步骤和格式【教学难点】化学计算题中设答的量纲与物理、数学学科的区别。
【课时安排】2课时【教学过程】一、情景导入1、化学方程式表示了、和。
2、的质的读法为:。
二、自主探究1、根据化学方程式计算的一般步骤是:(1);(2);(3);(4);(5)。
2、写出下列反应的化学方程式(1)用高锰酸钾加热的方法制氧气(2)氢气和氧化铜加热条件下的反应(3)用氯酸钾在二氧化锰作催化剂并加热的条件下制氧气2、在4P+5O22P2O5的反应中,份质量的磷跟份质量的氧气起反应,生成份质量的五氧化二磷。
三、合作探究(一)学习教材例题P102,讨论完成下列问题:1、你能说出化学方程式表示的意义吗?能否利用化学方程式中各物质之间的量的关系来计算生成物(产品)或反应物(原料)的质量呢?例:在水通电生成氢气和氧气的反应中,水和氢气的质量比为;那么,36克水完全分解能生成克氢气;18克水完全分解能生成克氢气。
2H2O2H2↑+O2↑36 436克(?)18克(?)依据物质的质量比来计算,这就是根据化学方程式的计算。
2、根据化学方程式计算的依据是。
3、根据化学方程式计算的方法和步骤:(1)设:(2)写:(3)找:(4)列:(5)答:(二)下面是某同学的做题步骤,请你帮他指出错在哪里。
在做电解水实验时,对应步骤的解题部分解:设需要电解x 克水,同时产Y 克氧气。
(四)、计算类型:例1——已知的质量计算的质量。
例2——已知的质量计算的质量。
第三节 依据化学方程式的简单计算【学习目标】1.在正确书写化学方程式的基础上,进行简单的计算;2.掌握化学方程式计算的格式和步骤。
【旧知回顾】1.书写化学方程式的两个原则:①___________________________;②_______________________________。
2.写出电解水的化学方程式____________________________________________;【新知学习】1. 用实例说明利用化学方程式进行计算的步骤和方法。
例1:加热分解6 g 高锰酸钾,可以得到多少克氧气?(1)该题涉及的化学方程式为_______________________________________;(2)题目给出的已知量为__________________,未知量为_______________。
(3)解:①________________________ 设:加热分解6g 高锰酸钾可以得到氧气的质量为x②_________________________ 2KMnO 4——加热K 2MnO 4十MnO 2+O 2↑ ③_________________________ 2×158 32 _____________________________ 6g xxg x g 326316632316==或 x=0.6g ④____________________ 答:加热分解6g 高锰酸钾可得到0.6g 氧气。
在实际运算过程中,还可以再简化些,具体格式可参照例题2。
工业上电解氧化铝制取单质铝的反应式为:2Al 2O 3——通电4Al+3O 2↑。
请计算电解10t 氧化铝可得多少吨铝?解:设电解10t 氧化铝可得铝x2Al 2O 3——通电4Al+3O 2↑204 10810t x204 :108==10t :xx=5.3t答:可得5.3吨铝。
【自我检测】1.根据已知填空:2.在反应2A+5B=2C+4D中,C、D的相对分子质量之比为9:22。
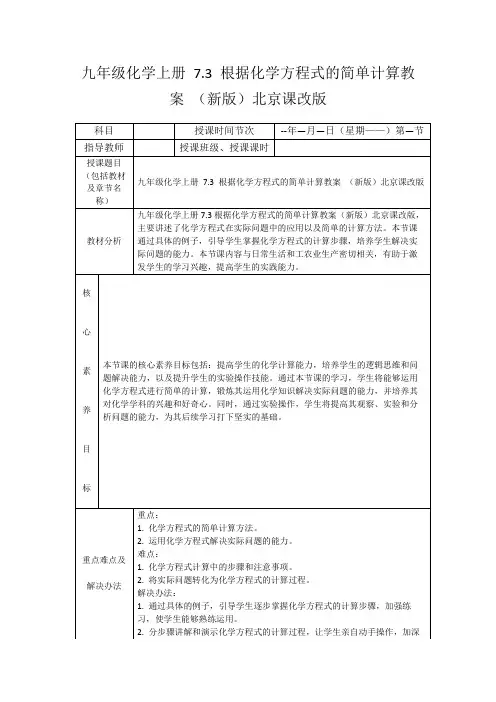
7.3依据化学方程式的简单计算【教学目标】1、学会利用化学方程式的简单计算,正确掌握计算的格式和步骤。
2、在正确书写化学方程式的基础上,进行简单的计算。
3通过对化学方程式中物质间质量比,初步理解反应物和生成物之间的质和量的关系。
培养学生按照化学特点去进行思维的良好习惯和熟练的计算技能。
4 认识定量研究对于化学科学发展的重大作用。
培养学生严谨求实、勇于创新和实践的学习态度和科学精神。
【教学重点】根据化学方程式计算的步骤。
【教学难点】1、物质间量的关系;2、根据化学方程式计算的要领及关键。
【教学过程】氢气是未来汽车的理想燃料。
1Kg的氢气就能供一辆功率为50KW的汽车跑大约100Km。
水是生命之源,找到合适的催化剂,即可利用光能将水分解制取氢气。
可能得到的结果:1、无从下手。
2、根据化学式计算,求出水的质量。
3、利用化学方程式解题。
等。
1、若学生根据化学式计算,应给予肯定。
但叮嘱他们在使用此法解题时,应说明所得氧气中氧元素即为水中氧元素。
困惑:若某种元素没有全部转化为某种物质,求该物质的质量怎么办呢?2、若利用化学方程式解题。
引导学生说出解题思路,引导回忆化学方程式的意义。
化学方程式的意义?(以电解水的反应为例)1、表示水通电生成氢气和氧气。
2、表示每36份质量的水完全反应,生成4份质量的氢气和32份质量的氧气。
思路2:利用化学方程式来计算。
学生试着计算(由学生自己做的目的是:在清楚解题思路的基础上,自己先探讨解题格式)。
由利用化学方程式得出正确答案的同学说出解题过程。
阅读教材100页:使学生初步学会利用化学方程式计算的书写格式。
练习1:加热分解6g高锰酸钾,可以得到多少g氧气?1、设未知量(未知数后不加单位);2、正确书写化学方程式(注意化学方程式的书写要完整、准确,指出若不配平,直接影响计算结果);3、计算相关物质的相对分子质量;4、标出已知量、未知量;5、列出比例式;6、解比例式(结果保留两位小数);7、简明地写出答语。
第三节依据化学方程式的简单计算
教学目标
1.正确书写化学方程式的基础上,进行简单的计算。
2.认识定量研究对于化学科学发展的重大作用。
教学重点
1.由一种反应物(或生成物)的质量求生成物(或反应物)的质量。
2.根据化学方程式计算的书写格式要规范化。
教学难点
训练和培养学生按照化学特点去思维的科学方法。
教学方法
复习提问→引入新课→例题讲解→总结归纳→学生练习→巩固提高。
教具准备
教师用具:投影仪、有关例题的投影片、一些相关练习题。
学生用具:有关化学方程式计算的习题,根据化学方程式计算的步骤总结。
教学过程
根据化学方程式所表示的含义,可以知道反应物与生成物之间存在数量关系。
而研究物质的化学变化常涉及到量的计算,例如,用一定量的原料最多可以生产出多少产品?制备一定量的产品最少需要多少原料?等等。
通过这些计算,可以加强生产的计划性,并有利于合理地利用资源,而这些计算的进行都需要根据化学方程式。
本节就是从“量”的角度来研究化学方程式的计算的。
前面我们学过根据化学式的简单计算,今天我们进一步学习根据化学方程式的计算。
如何利用化学方程式进行计算呢?计算时有哪些步骤和方法呢?请看例题1。
展示例题1
加热分解6 g高锰酸钾,可以得到多少克氧气?
这道题是已知反应物的质量来求生成物的质量,即已知原料的质量求产品的质量。
我们一起来看课本中的解题步骤。
解:设加热分解6 g高锰酸钾,可以得到氧气的质量为x。
2KMnO 4
K 2MnO 4+MnO 2+O 2↑ 2×158
32 6 g x。
,g 6.0158
2g 632x x 32g 61582=⨯⨯==⨯ 答:加热分解6 g 高锰酸钾,可以得到0.6 g 氧气。
根据刚才对例题1的阅读和讲解说出根据化学方程式计算的解题步骤分为几步?
1.根据化学方程式计算的解题步骤
(1)设未知量;
(2)写出反应的化学方程式并配平;
(3)写出相关物质的相对分子质量和已知量、未知量;
(4)列出比例式,求解;
(5)简明地写出答案。
刚才同学们总结出了根据化学方程式计算的步骤和方法,接下来我就一些问题进行补充。
(1)设未知量时一定要注意质量单位,已知量和未知量单位不一致的,一定要进行单位换算,单位必须一致才能计算。
(2)写出方程式一定要注意配平,而且要注意方程式的完整,反应条件、气体和沉淀的符号要注意标明,不完整的方程式计算时是要扣分的。
(3)相关物质的相对分子质量写在相应化学式的下面,一定要注意用相对分子质量乘以化学式前面的系数,已知量和未知量写在相应相对分子质量的下边。
(4)比例式有两种列法,可以横列也可以纵列。
例题1中采用的是纵列,即x 32g 61582=⨯;还可以采用横列,即2×158∶32=6 g∶x。
一般情况下采用纵列比较好,因为有时题中所给的质量数字会和相对分子质量有某种关系,从而使得计算简单。
如用158 g 高锰酸钾加热分解,可以制得多少克氧气?采用纵列法得
x
32g 1581582=⨯计算非常简便。
计算结果的小数位保留按题中要求进行,若题中没有要求,又得不到整数时,一般保留一位小数,如例题1中就是。
在实际运算过程中,我们往往需要把过程再简化些,具体格式可以参照下面的例题2。
展示例题2
工业上高温煅烧石灰石(CaCO 3)可制得生石灰(CaO)和二氧化碳,如果要制取10 t 氧化钙,
需要碳酸钙多少吨?
解:设需要碳酸钙的质量为x 。
CaCO 3CaO +CO 2↑
100 56 x 10 t
,t
1056x 100= x =56
t 10100⨯=18 t 。
答:需要碳酸钙18 t 。
根据上述两例可知,已知反应物的质量可以求生成物的质量,已知生成物的质量也可求出反应物的质量,那么,假如已知一种反应物的质量可不可以求另一种反应物的质量,或者已知一种生成物的质量可不可以求另一种生成物的质量呢?
我们一起来看课堂练习。
展示课堂练习
氢气在氯气中燃烧生成氯化氢气体,燃烧100 g 氢气需要氯气多少克?生成氯化氢气体多少克?
题中是已知什么求什么?(反应物或者生成物)
已知一种反应物的质量求另一种反应物的质量和生成物的质量。
此计算题该如何进行呢?请同学们先试着做一做。
(学生练习,教师巡视,发现步骤和格式上的错误及时纠正)
解:设需要氯气的质量为x ,生成氯化氢气体的质量为y 。
H 2 + Cl 22HCl
2 71 7
3 100 g x y
2
71g 100x x 71g 1002⨯==,=3550 g , 2
73g 100y y 73g 1002⨯==,=3650 g 。
答:需要氯气3550 g ,生成氯化氢气体3650 g 。
(1)因为此题有两问,所以一个未知数设为x ,另一个未知数设为y 。
(2)仍和前面例题一样,写出并配平化学方程式,列出有关物质的相对分子质量、已知量、未知量,并写在相应化学式的下面。
(3)不管有几个未知数,列比例式和前面例题一样。
根据已知量求出一个未知量,另一个未知量可以根据已知量求出,也可以根据求出的未知量来求。
如此题中氯化氢气体的质量也可以这样求出:y
73x 71=, 代入x =3550 g ,
,y
73g 355071= 解得y =3650 g 。
可见计算结果相同。
该同学不仅计算步骤和结果完全正确,而且讲解得也非常好,讲出了多种方法,真是难能可贵。
由此可知,已知一种反应物的质量可以计算另一种反应物的质量,同理,已知一种生成物的质量也可以计算另一种生成物的质量。
可见根据化学方程式计算共有四种类型。
2.化学方程式计算的四种类型:
①已知反应物的质量求生成物的质量;
②已知生成物的质量求反应物的质量;
③已知一种反应物的质量求另一种反应物的质量;
④已知一种生成物的质量求另一种生成物的质量。
通过前面例题的讲解,大家总结一下根据化学方程式计算的要领是什么?关键是什么?
3.化学方程式计算的三个要领和三个关键。
三个要领:①步骤要完整;
②格式要规范;
③得数要准确。
三个关键:①准确书写化学式;
②化学方程式要配平;
③准确计算相对分子质量。
根据前面的例题和理论知识,请同学们进行练习。
展示下列练习
1.用氢气还原氧化铜,要得到6.4 g 铜,需要多少克氧化铜?
2.5.6 g 铁跟足量的稀硫酸起反应,可制得氢气多少克?(Fe +H 2SO 4==FeSO 4+H 2↑)
3.12 g 镁与足量稀盐酸起反应,可制得氯化镁和氢气各多少克?(Mg +2HCl==MgCl 2+H 2↑)
①化学方程式反映的是纯物质间的质量关系,因此遇到不纯物,要先把不纯的反应物或生成物的质量换算成纯物质的质量,才能代入化学方程式进行计算。
②计算中注意单位统一(必须是质量单位,如果是体积,须根据密度换算)。
通过本节内容学习,我们知道了根据化学方程式计算的过程、步骤、方法,同时也懂得了化学计算题是从“量”的方面来反映物质及其变化的规律,它与侧重于从性质角度去研究和理解物质及其变化规律是相辅相成的。
所以说化学计算题包括化学和数学两个因素,两个因素同时考虑,才能得到正确的答案。
板书设计
第三节 依据化学方程式的简单计算
1.根据化学方程式计算的解题步骤:
①根据题意设未知数;
②写出化学方程式;
③求有关物质质量比,写出已知量、未知量;
③列比例式,求解;
④简明写出答案。
2.根据化学方程式计算的四种类型:
①已知反应物的质量求生成物的质量;
②已知生成物的质量求反应物的质量;
③已知一种反应物的质量求另一种反应物的质量;
④已知一种生成物的质量求另一种生成物的质量。
3.根据化学方程式计算的三个要领和三个关键
三个要领:①步骤要完整;
②格式要规范;
③得数要准确。
三个关键:
①准确书写化学式;
②化学方程式要配平;
③准确计算相对分子质量。