高考化学复习有机化学信息方程式或结构简式(含流程设计)的书写.docx
- 格式:docx
- 大小:730.34 KB
- 文档页数:7

学习好资料欢迎下载
高三有机方程式汇总
、烷烃反应类型反应方程式
取代反应
匕%+% " 9凡⑦+十方同时生成CH2c^、CHC^、CCl4
二、烯烃
反应类型反应方程式
加成反应
①能与H2、
HX、X2、
H2O加成 2 ②与X2加
成不需要
催化剂CH2=也+凡:、%巩
CHEHbErL CH2- CH2 Br B L
=强 + HX 催可剂》CHW% X
CH2 = CH2 + H20 催7剂1 CH3CH2OH
吗~CH= CH2 +期催?剂》风照萍或CH^CHCH^ X M
CHkCH —CH=CH2+E门-C1H2-CH-CH=CH3(1, 2 加成)
Er Br
CH L CH CH-CH2+Br2^ CH2 CH-CH /(L 4 加成)
Br Br
一吒CH,C也士聚乙烯
加聚反应
催化剂
“CH- - CH = CH^ -- 受上工——H CH—CH2七
3 2加蛰、加压 | "
匕*
的为=CH—CH= CH2催化剂、y H「UA=CH—C%上
三、芳香烃
四、炔烃
五、卤代烃
六、醇
七、苯酚
八、醛
九、酮
十、羧酸
十一、酯
十二、油脂
十三、糖类
十四、氨基酸
十五、蛋白质。

【考情导引】多年来,同分异构现象和同分异构体一直是高考化学命题的热点。
它综合性强,考查范围广,不仅能考查考生对同分异构体概念的理解、有机物结构等知识的掌握程度,还能考查考生的思维能力及品质。
特别是思维的严密性、有序性。
同分异构体现象和同分异构体在有机化学知识体系中所占的特殊地位,使得它一直是高考化学命题的热点。
而且命题形式不断变化,先后历经了三个阶段:简单的同分异构体的书写与数目计算阶段给予部分同分异构体要求补充、书写完全阶段;对较复杂有机物所满足特定要求的同分异构体的书写与数目计算。
同分异构体的考查突出体现了“能力立意”的出题思路,仍是今后考查的重要形式。
【精选例题】例1. (1)分子式为C4H10O并能与金属钠反应放出H2的有机化合物有________种。
(2)与化合物C7H10O2互为同分异构体的物质不.可能为________。
A.醇B.醛 C.羧酸 D.酚(3)与具有相同官能团的同分异构体的结构简式为_______________。
(4)苯氧乙酸()有多种酯类的同分异构体。
其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是_____________________ (写出任意2种的结构简式)。
(5)分子式为C5H10的烯烃共有(不考虑顺反异构)________种。
【参考答案】(1)4(2)D(3)CH2===CHCH2COOH、CH3CH===CHCOOH(5)5【解析】(1)分子式为C4H10O并能与Na反应放出H2,符合饱和一元醇的通式和性质特点,应为一元醇C4H9OH,因—C4H9有4种,则C4H9OH也有4种。
(2)C7H10O2若为酚类物质,则应含有苯环,7个C最多需要8个H,故不可能为酚。
(3)该化合物中有和—COOH两种官能团,由于官能团不变,只将官能团的位置移动即可得其同分异构体:CH2===CHCH2COOH、CH3CH===CHCOOH。
(4)根据题意,符合条件的同分异构体满足:①属于酯类即含有酯基,②含酚羟基,③苯环上有两种一硝基取代物。

高考化学有机化学方程式书写方法化学反应的背后往往都会有一个化学方程式,查字典化学网为您准备的是高考化学有机化学方程式书写方法,希望对你有帮助!有机化学方程式书写方法一、综观近几年来的高考有机化学试题中有关有机物组成和结构部分的题型,其共同特点是:通过题给某一有机物的化学式(或式量),结合该有机物性质,对该有机物的结构进行发散性的思维和推理,从而考查“对微观结构的一定想象力”。
为此,必须对有机物的化学式(或式量)具有一定的结构化处理的本领,才能从根本上提高自身的“空间想象能力”。
1. 式量相等下的化学式的相互转化关系:一定式量的有机物若要保持式量不变,可采用以下方法:(1) 若少1个碳原子,则增加12个氢原子。
(2) 若少1个碳原子,4个氢原子,则增加1个氧原子。
(3) 若少4个碳原子,则增加3个氧原子。
2. 有机物化学式结构化的处理方法若用CnHmOz (m≤2n+2,z≥0,m、n N,z属非负整数)表示烃或烃的含氧衍生物,则可将其与CnH2n+2Oz(z≥0)相比较,若少于两个H原子,则相当于原有机物中有一个C=C,不难发现,有机物CnHmOz分子结构中C=C数目为个,然后以双键为基准进行以下处理:(1) 一个C=C相当于一个环。
(2) 一个碳碳叁键相当于二个碳碳双键或一个碳碳双键和一个环。
(3) 一个苯环相当于四个碳碳双键或两个碳碳叁键或其它(见(2))。
(4) 一个羰基相当于一个碳碳双键。
二、有机物结构的推断是高考常见的题型,学习时要掌握以下规律:1.不饱和键数目的确定(1) 有机物与H2(或X2)完全加成时,若物质的量之比为1∶1,则该有机物含有一个双键;1∶2时,则该有机物含有一个叁键或两个双键;1∶3时,则该有机物含有三个双键或一个苯环或其它等价形式。
(2) 由不饱和度确定有机物的大致结构:对于烃类物质CnHm,其不饱和度W=① C=C:W=1;② CoC:W=2;③ 环:W=1;④ 苯:W=4;⑤ 萘:W=7;⑥ 复杂的环烃的不饱和度等于打开碳碳键形成开链化合物的数目。
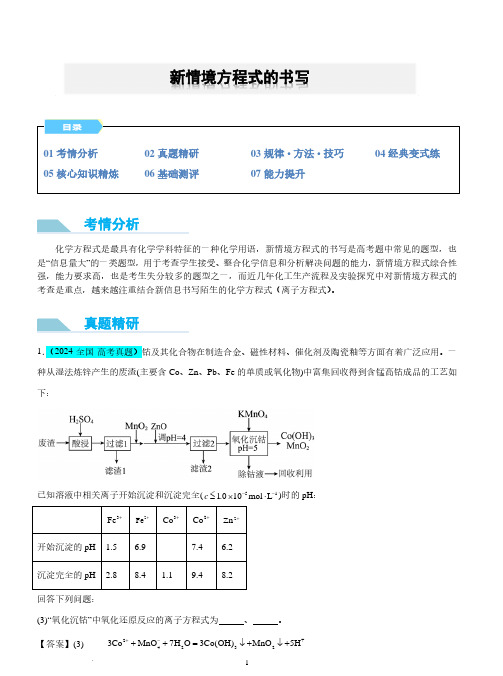
回答下列问题:(3)“氧化沉钴”中氧化还原反应的离子方程式为 、 。
【答案】(3) 2+42323Co MnO 7H O 3Co(OH)MnO 5H +−++=↓+↓+ 新情境方程式的书写考情分析真题精研24223Mn 2MnO 2H O 5MnO 4H +−+++=↓+ 【解析】(3)由分析可知,该过程发生两个氧化还原反应,根据分析中两个反应的反应物、产物与反应环境(pH 5=),结合得失电子守恒、电荷守恒和原子守恒可写出两个离子方程式:242323Co MnO 7H O 3Co(OH)MnO 5H +−+++=↓+↓+、24223Mn 2MnO 2H O 5MnO 4H +−+++=↓+; 2.(2024·江苏·高考真题)贵金属银应用广泛。
Ag 与稀3HNO 制得3AgNO ,常用于循环处理高氯废水。
(1)沉淀Cl −。
在高氯水样中加入24K CrO 使24CrO −浓度约为31510mol L −−×⋅,当滴加3AgNO 溶液至开始产生24Ag CrO 沉淀(忽略滴加过程的体积增加),此时溶液中Cl −浓度约为 1mol L −⋅。
[已知:()10sp K AgCl 1.810−=×,()12sp 24K Ag CrO 2.010−=×] (2)还原AgCl 。
在AgCl 沉淀中埋入铁圈并压实,加入足量10.5mol L −⋅盐酸后静置,充分反应得到Ag 。
①铁将AgCl 转化为单质Ag 的化学方程式为 。
②不与铁圈直接接触的AgCl 也能转化为Ag 的原因是 。
③为判断AgCl 是否完全转化,补充完整实验方案:取出铁圈,搅拌均匀,取少量混合物过滤, [实验中必须使用的试剂和设备:稀3HNO 、3AgNO 溶液,通风设备](3)Ag 的抗菌性能。
纳米Ag 表面能产生+Ag 杀死细菌(如图所示),其抗菌性能受溶解氧浓度影响。
①纳米Ag 溶解产生+Ag 的离子方程式为 。

2022高考化学有机信息方程式〔结构简式〕的书写(1) 有机化学信息方程式或结构简式〔含流程设计〕的书写1、以下是一种药物Ⅳ合成局部路线:H2NHOCHCOOHCH3①C2H5OH,H+②调节pHH2NHOCHCOOC2H5CH3ⅠCl一定条件COClC18H16O3NCl①NaOH②H+ⅡNClOCHCOOHCH3ⅢⅣ请答复以下问题:〔5〕OHNH2与COCl在一定条件下发生类似化合物Ⅱ转化为Ⅲ的反响,试写出该反响的化学方程式。
2、在250℃时,吲哚与乙醇酸在碱的存在下反响,可以得到植物生长素吲哚乙酸:由邻硝基甲苯1和草酸二乙酯2反响最终可合成吲哚5〔Et表示CH3CH2—〕:乙醇酸的合成:〔4〕乳酸的结构简式为,请写出乳酸与吲哚发生反响的化学方程式〔不用写反响条件〕:;3、芳香醛与活性亚甲基化合物的缩合反响在有机合成中有重要应用,化合物III 是医药中间体,其合成方法如下:反响①:OCHOOOOO化合物I化合物IICH3CH3催化剂OCHOO化合物IIICH3CH3++H2O 1化合物Ⅱ也可以由化合物IV〔C3H6Cl2〕经以下途经合成:(4) E是化合物II的同分异构体,且E是一种链状结构,在核磁共振氢谱中有3种氢, 1mol E能与2 molNaHCO3反响,写出化合物E的结构简式。
(任写一种;不考虑顺反异构。
) 〔5〕化合物I与化合物〔〕在催化剂条件下也能发生类似反响①的 COOC2H5CN反响得到另一医药中间体,写出该反响化学方程式 4、〔2022年肇庆一模〕有增长碳链是有机合成中非常重要的反响。
例如:反响①O CH 3CHO CH 3+ Br-CH-COOC2H5(Ⅱ)Zn 苯H2O OH CH 3CH-CH-COOC2H5(Ⅰ)O CH 3Cl〔4〕对二氯苯 Cl 也能与有机物(Ⅰ) (过量)发生类似反响①的系列反响,其生成有机物的结构简式为。
5、〔2022年高三期末考试〕〔16分〕有机物A可以通过不同的反响得到B和C:OBOACOOHOHCCOOHCHO〔4〕芳香族化合物D是A的同分异构体,1molD可以和3mol NaOH发生中和反响;D苯环上的一氯代物只有一种且分子中没有甲基。

有机化学方程式书写(一)1、甲烷与氯气在光照条件下反应 : 反应类型:2、苯与液溴在FeBr 3作催化剂时生成一溴代苯:反应类型:3、苯与浓硝酸、浓硫酸在60℃时反应: 反应类型:4、苯与浓H 2SO 4在催化剂、70—80℃条件下发生反应; 反应类型:5、甲苯与浓硝酸、浓硫酸在100℃时制TNT (烈性炸药)反应类型:6、甲苯与液溴在催化剂(Fe )作用下制一溴代物。
反应类型:7、2—氯丙烷与KOH 的水溶液共热: 反应类型:8、1,2—二氯丁烷与NaOH 的水溶液共热: 反应类型:9、与NaOH 的水溶液共热: 反应类型:10、苯酚与浓溴水反应: 反应类型:11、 与浓溴水反应: 反应类型:12、与浓溴水反应: 反应类型:13、乙醇与氢卤酸(HBr)共热: 反应类型:14、乙醇与浓硫酸共热(140℃)反应类型:15、乙醇与乙酸(浓硫酸作催化剂)共热:反应类型:16、乙二酸与乙醇混合(浓硫酸作催化剂)共热:反应类型:17、乙酸与乙二醇混合(浓硫酸作催化剂)共热:反应类型:18、乙二酸与乙二醇混合(浓硫酸作催化剂)共热:反应类型:19。
对苯二甲酸与乙二醇混合(浓硫酸作催化剂)共热:反应类型:20、纤维素在适当的条件下可与硝酸发生酯化反应生成纤维素硝酸酯(俗称硝化纤维)反应类型:21、纤维素在适当的条件下可与醋酸酐等发生酯化反应生成纤维素醋酸酯(俗称醋酸纤维)反应类型:22、在催化剂作用下生成二肽:反应类型:23、乙酸乙酯在H2SO4催化作用下发生水解反应:反应类型:24、乙酸丙酯在NaOH溶液催化作用下反应:反应类型:25、硬脂酸甘油酯在NaOH溶液催化作用下反应: 反应类型:26、在H2SO4催化作用下发生水解反应:反应类型:有机化学方程式书写(二)27、乙烯与氢气、催化剂作用下反应:反应类型:28、丙烯与溴水反应: 反应类型:29、乙烯与HBr 反应:反应类型:30、乙烯与水在催化剂作用下反应:反应类型:31、乙炔和少量 H2在催化剂作用下反应:反应类型:32、乙炔和足量 H2在催化剂作用下反应:反应类型:33、苯与氢气在温度为180—250℃、压强为18MPa 条件下反应:反应类型:34、苯酚与H催化剂作用下反应; 反应类型:2(1:1)催化剂作用下反应:反应类型:35、1,3—丁二烯与H2(1:1)催化剂作用下反应:反应类型:36、1,3—丁二烯与Br2(1:2)催化剂作用下反应:反应类型:37、1,3-丁二烯与Br2在催化剂作用下反应:反应类型:38、与足量H2反应:反应类型:39、乙醛与加热、加压和有催化剂(如Ni\Pt)条件下与H2反应:反应类型: 40、丙酮与加热、加压和有催化剂条件下与H2反应:反应类型:41、催化剂条件下与H242、与溴水反应:反应类型:有机化学方程式书写(三)43、乙烯在催化剂条件下制聚乙烯:反应类型:44、氯乙烯在催化条件下制聚氯乙烯: 反应类型:45、2—甲基—1、3—丁二烯制聚橡胶(聚合物):反应类型:46、用1,2—二氯乙烯制聚1,2-二氯乙烯:反应类型:47、苯乙烯催化剂作用下制聚苯乙烯: 反应类型:48、苯乙烯和1,3-丁二烯催化剂条件下制丁苯橡胶;反应类型:49、乳酸在催化剂作用下生成聚乳酸;反应类型:50、对苯二甲酸与乙二醇混合(浓硫酸作催化剂)共热生成高聚物:反应类型:51、苯酚与甲醛在催化剂(盐酸)作用下生成酚醛树脂:反应类型:52、丙氨酸催化剂作用下生成聚丙氨基酸: 反应类型:有机化学方程式书写(四)53、甲烷与氧气点燃:反应类型:54、乙烯与氧气点燃:反应类型:55、乙炔在氧气中燃烧:反应类型:56、苯在氧气中燃烧:反应类型:57、乙醇与氧气点燃:反应类型:58、烷烃与氧气点燃: 反应类型:59、烯烃与氧气点燃:反应类型:60、炔烃与氧气点燃:反应类型:61、苯的同系物与氧气点燃:反应类型:62、甲苯被酸性KMnO溶液氧化:(只需写出甲苯的生成物)463、1—丁醇(伯醇)与氧气(Cu或 Ag作催化剂):反应类型:64、2-丁醇(仲醇)与氧气(Cu或 Ag作催化剂):反应类型:65、乙醛与氧气催化剂条件下反应:反应类型:66、乙醛与银氨溶液发生银镜反应: 反应类型:加热: 反应类型:67、丙醛与新制的Cu(OH)2加热:反应类型:68、乙二醛与新制的Cu(OH)269、甲醛与银氨溶液发生银镜反应:反应类型:70、甲酸乙酯与银氨溶液混合:反应类型:有机化学方程式书写(五)71、实验室制乙烯:反应类型:72、2—甲基—2-戊醇与浓硫酸共热(温度:170℃)反应类型:73、氯乙烷与NaOH的醇溶液共热:反应类型:74、3-甲基—3—溴己烷与NaOH醇溶液共热:反应类型:有机化学方程式书写(六)75、苯与液溴在FeBr 3作催化剂时生成一溴代苯: 反应类型:76、苯与浓硝酸、浓硫酸在60℃时反应: 反应类型:77、苯与浓H 2SO 4在催化剂、70—80℃条件下发生反应; 反应类型:78、乙烯与水在催化剂作用下反应: 反应类型:79、油酸甘油酯催化作用下与H 2反应: 反应类型:80、乙二酸与乙醇混合(浓硫酸作催化剂)共热: 反应类型:81、乙醇与浓硫酸共热(140℃) 反应类型:82、辛烷高温条件(隔绝空气)反应: 反应类型:83、硬脂酸甘油酯在NaOH 溶液催化作用下反应: 反应类型:化学方程式书写(七)84、甲烷高温条件(隔绝空气)反应: 反应类型: 85、辛烷高温条件(隔绝空气)反应: 反应类型: 86、乙烯能使酸性KMnO 4溶液褪色: 反应类型:87、乙炔的实验室制取:88、乙醇与金属钠反应:89、乙酸与金属钠反应:90、苯酚与金属钠反应:91、乙酸与Na 2CO 3溶液反应:92、乙酸与NaHCO 3溶液反应:93、苯酚与碳酸钠溶液反应:94、 与碳酸钠溶液反应:95、苯酚与NaOH 溶液反应:96、苯酚钠溶液中通入二氧化碳:97、苯酚钠溶液与盐酸混合:。
高中重要有机化学方程式与思维导图高中重要有机化学方程式甲烷甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂) 甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl(条件都为光照。
)实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO加热)乙烯乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH(条件为催化剂)乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3(条件为催化剂)乙烯聚合nCH2=CH2→-[-CH2-CH2-]n-(条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n-(条件为催化剂)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O(条件为加热,浓H2SO4)乙炔乙炔燃烧C2H2+3O2→2CO2+H2O(条件为点燃)乙炔和溴水C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6(条件为催化剂)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO3=== CaO + CO2 2CaO+5C===2CaC2+CO2CaC2+2H2O→C2H2+Ca(OH)2C+H2O===CO+H2-----高温C2H2+H2→C2H4----乙炔加成生成乙烯C2H4可聚合苯苯燃烧2C6H6+15O2→12CO2+6H2O(条件为点燃)苯和液溴的取代C6H6+Br2→C6H5Br+HBr苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O(条件为浓硫酸)苯和氢气C6H6+3H2→C6H12(条件为催化剂)乙醇乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O(条件为点燃)乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O(条件为浓硫酸170摄氏度)两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2CH3+H2O(条件为催化剂浓硫酸140摄氏度)乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O乙酸乙酸和镁Mg+2CH3COOH→(CH3COO)2Mg+H2乙酸和氧化钙2CH3COOH+CaO→(CH3CH2)2Ca+H2O乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑醛类甲醛和新制的氢氧化铜HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O乙醛和新制的氢氧化铜CH3CHO+2CU(OH)2=CH3COOH+CU2O+2H2O乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)物质制备方法乙炔的实验室制法:CaC2+2H2O→Ca(OH)2+C2H2↑实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO加热)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O(条件为加热,浓H2SO4) 实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑工业制取乙醇:C2H4+H20→CH3CH2OH(条件为催化剂)乙醛的制取乙炔水化法:C2H2+H2O→C2H4O(条件为催化剂,加热加压)乙烯氧化法:2CH2=CH2+O2→2CH3CHO(条件为催化剂,加热)乙醇氧化法:2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂,加热) 乙酸的制取乙醛氧化为乙酸:2CH3CHO+O2→2CH3COOH(条件为催化剂和加温) 其他反应加聚反应:乙烯聚合nCH2=CH2→-[-CH2-CH2-]n-(条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n-(条件为催化剂)氧化反应:甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙炔燃烧C2H2+3O2→2CO2+H2O(条件为点燃)苯燃烧2C6H6+15O2→12CO2+6H2O(条件为点燃)乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O(条件为点燃)乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)乙醛的催化氧化:CH3CHO+O2→2CH3COOH(条件为催化剂加热)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl(条件都为光照。
高三化学有机知识点方程式一、碳的共价键化学中,碳是一种非金属元素,具有正四面体结构。
在化学反应中,碳通常形成四个共价键,与其他原子形成稳定的化合物。
1. 单键结构:碳与另一个碳原子或其他非金属原子形成共价键时,会共享一个电子,形成单键结构。
例如,乙烷的化学结构式为CH3-CH3。
2. 双键结构:碳与另一个碳原子或其他非金属原子形成双键结构时,会共享两个电子,形成双键。
例如,乙烯的化学结构式为CH2=CH2。
3. 三键结构:在某些情况下,碳可以形成三键结构。
例如,乙炔的化学结构式为HC≡CH。
二、烷烃与烯烃烷烃是一种仅包含碳和氢原子的有机化合物。
它们的结构式通常是CH3-(CnH2n-CH3,其中n为烷烃的碳原子数量)。
烷烃是高三化学中的一个重要知识点。
烯烃是一类含有碳碳双键的有机化合物,它们的结构式通常为CH3-(CnH2n-2)-CH3,其中n为烯烃的碳原子数量。
烯烃的结构比烷烃更加复杂,它们具有不饱和的化学性质。
三、醇与醚醇是碳链上含有羟基(-OH)的有机化合物。
羟基赋予醇一些独特的化学性质。
例如,乙醇(CH3CH2OH)是一种常见的醇,它是乙烷(CH3CH3)中一个氢原子被羟基取代而成。
醚是一类含有氧原子的有机化合物,其结构通常为R1-O-R2,其中R1和R2可以是单独的碳链。
醚由于其低活性,可以被用作溶剂或反应中的中间体。
四、醛与酮醛和酮是含有碳氧双键的化合物。
醛是一类结构通式为R1-COH的有机化合物。
醛中的碳原子与氢原子和羰基(碳氧双键)连接。
酮是一类结构通式为R1-CO-R2的有机化合物。
酮中的碳原子与两个碳原子连接,并且之间有一个羰基。
五、酸与酯有机酸是含有羧基(-COOH)的有机化合物。
它们可以通过碳氧双键上的羟基失去氢原子形成负离子,从而呈现酸性。
酯是由醇和有机酸反应生成的产物,其结构通式为R1-COO-R2。
酯通常具有芳香气味,常被用作食品香精或化妆品中的香味成分。
六、肠相互转化反应在有机化学中,许多化合物之间可以通过一系列的反应途径转化。
⾼考化学⽅程式的书写规则⾼中化学在学习上不如物理那样有规律可循,⼤部分同学认为⾼中化学在学习上知识⽐较杂和繁乱。
下⾯给⼤家分享⼀些关于⾼考化学⽅程式的书写规则,希望对⼤家有所帮助。
⾼考化学⽅程式的书写规则1、只能将强电解质(指溶于⽔中的强电解质)写出离⼦形式,其它(包括难溶强电解质)⼀律写成分⼦形式。
如碳酸钙与盐酸的反应:CaCO3+2H+=Ca2++CO2↑+H2O 因此熟记哪些物质是强电解质、哪些强电解质能溶于⽔是写好离⼦⽅程式的基础和关键。
2、不在⽔溶液中反应的离⼦反应,不能书写离⼦⽅程式。
如铜与浓H2SO4的反应,浓H2SO4与相应固体物质取HCI、HF、HNO3的反应,以及Ca(OH)2与NH4Cl制取NH3的反应。
3、碱性氧化物虽然是强电解质,但它只能⽤化学⽅程式写在离⼦⽅程式中。
如CuO与盐酸的反应:CuO+2H+=Cu2++H2O4、有酸式盐参加的离⼦反应,对于弱酸酸式根离⼦不能拆成H+和酸根阴离⼦(HSO4-除外)。
如NaHCO3溶液和NaOH溶液混合:HCO3-+OH-=CO32-+H2O不能写成:H++OH-=H2O5、书写氧化还原反应的离⼦⽅程式时,⾸先写好参加反应的离⼦,然后确定氧化产物和还原产物,再⽤观察配平并补齐其它物质即可;书写盐类⽔解的离⼦⽅程式时,先写好发⽣⽔解的离⼦,然后确定产物,再配平并补⾜⽔分⼦即可。
6、必须遵守质量守恒和电荷守恒定律,即离⼦⽅程式不仅要配平原⼦个数,还要配平离⼦电荷数和得失电⼦数。
如在FeCl2溶液中通⼊Cl2,其离⼦⽅程式不能写成: Fe2++Cl2=Fe3++2Cl-,因反应前后电荷不守恒,应写成:2Fe2++Cl2=Fe3++2Cl-。
7、不能因约简离⼦⽅程式中局部系数⽽破坏整体的关系量。
如稀H2SO4和Ba(OH)2溶液的反应,若写出为:Ba2++OH-+H++SO42-=BaSO4+H2O就是错误的,正确应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O。
高中有机化学方程式总结1.甲烷烷煌通式:C n H 2 n-2 (1)氧化反应点燃甲烷的燃烧: CH 4+2O 2 ―PO 2+2H 2O 甲烷不可使酸性高镒酸钾溶液及滨水褪色。
(2)取代反应*一氯甲烷:CH 4+C12 -------------- CH 3C1+HC1 一 光 二氯甲烷:CH 3C1+C1 2 ------------ --- --- ^CH 2c12+HC1一光三氯甲烷:CH 2c12+C12 - ...................... > CHC13+HC1 (CHC13 又叫氯仿) 四氯化碳:CHCl 3+CI 2------------------------------------------------------------------- ^CCl 4+HCl2 .乙烯乙烯的制取:CH 3CH 20H 烯煌通式:C n H 2n(1)氧化反应 高温乙烯的燃烧: H 2C=CH 2+302 ----------------------- 2CO 2+2H 2O乙烯可以使酸性高镒酸钾溶液褪色,发生氧化反应。
(2)加成反应H 2C=CH 2+Br 2—-―—>CH 2Br —CH 2Br 催化剂H 2C=CH 2+H 2 CH 3CH 3H 2C=CH 2+HCl ----------- » CH 3CH 2CI与水加成:H 2C=CH 2+H 2O-------------- > CH 3CH 20H (3)聚合反应 一定条件__乙烯加聚,生成聚乙烯: n H 2C=CH 2 ----------------- ►1C H2—CH1-n3 .乙快乙快的制取:CaC 2+2H 20 --------------- >HC CH T+Ca(0H )2 (1)氧化反应点燃乙快的燃烧:HC CH+5O2——--"4CO2+2H2O 乙快可以使酸性高镒酸钾溶液褪色,发生氧化反应。
高中化学学习材料
鼎尚图文收集整理
有机化学信息方程式或结构简式(含流程设计)的书写
1、 以下是一种药物Ⅳ合成部分路线:
①C 2H 5OH ,H
+
②调节pH
CHCOOC 2H 5HO
CH 3
H 2N Cl
COCl
C 18H 16O 3NCl
①NaOH ②H +
N
O
CHCOOH CH 3
Cl
CHCOOH HO
CH 3
H 2N Ⅰ
Ⅱ
Ⅲ
Ⅳ
一定条件
请回答下列问题: (5)
OH NH 2
COCl 与
在一定条件下发生类似化合物Ⅱ转化为Ⅲ的反应,试写
出该反应的化学方程式 。
2、在250℃时,吲哚与乙醇酸在碱的存在下反应,可以得到植物生长素吲哚乙酸:
由邻硝基甲苯1和草酸二乙酯2反应最终可合成吲哚5(Et 表示CH 3CH 2—):
乙醇酸的合成:
(
4
)已知乳酸的
结构简式为 ,请写出乳酸与吲哚发生反应的化学方程式(不用写反应条件): ;
3、芳香醛与活性亚甲基化合物的缩合反应在有机合成中有重要应用,化合物III 是医药中间体,其合成方法如下: 反应①:
CHO
+O O CH 3CH 3
O
O
催化剂
O
O CH 3
CH 3H
O
O
C +
H 2O
化合物II
化合物III
化合物I
化合物Ⅱ也可以由化合物IV (C 3H 6Cl 2)经以下途经合成:
(4) E 是化合物II 的同分异构体,且E 是一种链状结构,在核磁共振氢谱中有3种氢, 1mol E 能与2 molNaHCO 3反应,写出化合物E 的结构简式 。
(任写一种;不考虑顺反异构。
) (5)化合物I 与化合物 ( )在催化剂条件下也能发生类似反应①的
反应得到另一医药中间体,写出该反应化学方程式 4、(2014年肇庆一模)有增长碳链是有机合成中非常重要的反应。
例如: 反应①
(4)对二氯苯 也能与有机物(Ⅰ) (过量)发生类似反应①的系列反应,
其生成有机物的结构简式为。
5、(2014年高三期末考试)(16分)有机物A 可以通过不同的反应得到B 和C :
(4)芳香族化合物D 是A 的同分异构体,1molD 可以和3mol NaOH 发生中和反应;D 苯环上的一氯代物只有一种且分子中没有甲基。
请写出D 的结构简式 (任写一种)。
6、(2014年深圳六校联考)
CN
COOC 2H 5+ Zn 苯
H 2O
(Ⅰ)
CH 3
Br -CH -COOC 2H 5
(Ⅱ)
CH 3
O CH -CH -COOC 2H 5
CH 3
OH CH
CH 3
O Cl Cl O
O
OH
COOH
COOH CHO
A
B
C
请回答下列问题:
(6)化合物II 也能发生类似反应②的反应得到一种分子中含3个碳原子的有机物,该物质
的结构简式为 。
(7)写出满足下列条件的IV 的同分异构体的结构简式 。
①苯环上只有两个处于对位的取代基; ②能发生银镜反应;③核磁共振氢谱有5组吸收峰 7、(2014年广东四校联考)脱羧反应形成新的C-C 键为有机合成提供了一条新的途径,例如:
(3)
与
也可以发生类似反应①的反应,有机产物的结构简式为:_______________。
8.(2014年清远期末)(16分)A 为药用有机物,从A 出发可发生下图所示的一系列反应。
已知A 在一定条件下能跟醇发生酯化反应,A 分子中苯环上的两个取代基连在相邻的碳原子上;D 不能跟NaHCO 3溶液反应,但能跟NaOH 溶液反应。
(3)已知:酰氯能与含有羟基的物质反应生成酯类物质。
例如:
写出草酰氯(结构式:C C O
Cl
O
Cl
)与足量有机物D 反应的化学方程
式: 。
(4)已知:
由邻甲基苯酚经过两步反应可生成有机物A :
[请写出“中间产物”的结构简式 。
9.A 与B 在一定条件下反应生成C ,进一步反应生成抗氧化剂“安维那”D ,其分子式为C 10H 10O 4。
A 对氢气的相对密度为52,1 mol A 与足量NaHCO 3反应生成2 mol 气体。
B 属于芳香类化合物。
已知: RCHO +CH 2(COOH )2一定条件
RCH=C (COOH )2+H 2O ,
RCH=C (COOH )2一定条件
RCH=CHCOOH +CO 2
COOH
CHO
+
CH 3
Br
一定条件
CHO
CH 3I
II
III
反应①
CH
3OCCOOH O
Br
(3)A 的分子式是____________。
(4)反应①的化学方程式是__________________________________ ________________。
10、【2012深圳一模】30. ( 17分)有机物结构可用键线式表示,如CH 3CH(CH 3)CH 2CH 3 (2-1甲基丁烷)的键线式:
下列反应称为Diels-Alder 反应,常用于有机物的合成: 其中.化合物II 由以下路线合成:
(2 ) 2甲基-2-丁烯经过两步反应可制得
化合物I .请写出两步化学反应方程式(注明反应条件):____ ________; _______ _____
(4)实验发现,
与
(乙炔〉也能发生Diels-Alder 反应,请写出该反应产物的
结构简式____________ 11、(2014年上海高考·八)丁烷氯代可得到2-氯丁烷(CH 3CH(Cl)CH 2CH 3),设计一条从2-氯丁烷合成1,3-丁二烯(CH 2=CHCH=CH 2)的合成路线。
(合成路线常用的表示方法为:
A ——————→反应试剂反应条件B……——————→反应试剂
反应条件目标产物)
12、(2014上海宝山区模拟·八)请写出以CH 2=CHCH 3为主要原料(无机试剂任用)制备CH 3CH(OH)COOH
的合成路线流程图(须注明反应条件)。
(合成路线常用的表示方式为:A −−−−→反应试剂
反应条件B ……−−−−→反应试剂
反应条件目标产物)
13.(2014年江苏高考)非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
(5
)根据已有知识并结合相关信息,写出以
为原料制备的合
成路线流程图(无机试剂任用)。
合成路线流程图示例如下:
有机化学信息方程式或结构简式(含流程设计)的书写)参考答案:
1、(5)
COCl
OH NH 2
+
一定条件
N
O +HCl+H 2O
(3分,HCl 加“↑”也可以)
2、(4)(3分)
3、(4)
HOOCCH 2CH=CHCH 2COOH
或CH 2=C(CH 2COOH)2
(5)CN
COOC 2H 5
CHO
+
催化剂
+
H 2O
CH=C
CN COOC 2H 5
(方程式3分,其余每空2分)
4、(4)(2分)CH 3O
CH
OH
OCH 3
CH
OH
5、(4)(共3分)CH 2CH=CH 2
OH HO
OH
或
CH 2CH=CH 2
OH
HO
OH
6、(6)CH 3COCH 3(2分)
(7)
(3分)
7、(3)COCH 3O
(2分)
8、
9、⑶C 3H 4O 4(1分)
⑷
+CH 2
(COOH)2
一定条件
+H 2O(2分) 10、
(2)(各3分 共6分)
(或者用Cl 2)
(4) 11、
12、
13、
CH 3 CH 3C=CHCH 3 CH 3
Br Br
CH
3C -CHCH 3 + Br 2 + 2NaOH
无水乙醇 ∆
CH 3
Br Br
CH 3C -CHCH 3 CH 2=C -CH=CH 2 CH 3
+ 2NaBr + 2H 2O
CCl 4。