H7N9-张声霆
- 格式:ppt
- 大小:10.08 MB
- 文档页数:66

复方戊二醛消毒剂对鸡禽流感病毒(H9 N2株)杀灭效果的研究武卫平;禚宝山;李富金;陈溥言;孙中成;李英;鞠洪涛;崔道石【期刊名称】《中国兽药杂志》【年(卷),期】2005(39)12【摘要】研究了一种复方戊二醛消毒剂对鸡禽流感病毒(AIV H9N2株)的杀灭效果及稳定性.将该消毒剂1:500稀释度的溶液在20℃条件下与等量2×105EID50AIV(H9N2株)病毒液作用,10 min内可完全杀灭AIV(H9N2株)病毒;该消毒剂1:500稀释度的溶液在室温下放置2 d,仍能保持原有的消毒效果.【总页数】3页(P25-27)【作者】武卫平;禚宝山;李富金;陈溥言;孙中成;李英;鞠洪涛;崔道石【作者单位】山东省济南市齐鲁动物保健品有限公司,山东,济南,250100;山东省济南市齐鲁动物保健品有限公司,山东,济南,250100;山东省济南市齐鲁动物保健品有限公司,山东,济南,250100;南京农业大学,江苏,南京,210095;山东省济南市齐鲁动物保健品有限公司,山东,济南,250100;山东省济南市齐鲁动物保健品有限公司,山东,济南,250100;山东省济南市齐鲁动物保健品有限公司,山东,济南,250100;山东省济南市齐鲁动物保健品有限公司,山东,济南,250100【正文语种】中文【中图分类】S859.799.1【相关文献】1.一株H9(N2)型禽流感病毒HA基因的克隆与序列分析 [J], 袁建琴;高斌战2.2株 H9 N2亚型禽流感病毒的致病性 [J], 谭丹;黄建龙;王昌建;刘道新;邓国华3.一株鸭源H9亚型禽流感病毒分离株生物学特性研究 [J], 刘宇卓;魏和生;黄福林;李银;魏雪涛;张敬峰4.一株鹅源 H9 N2亚型流感病毒的分离鉴定及其 HA 基因的遗传进化分析 [J], 孙晓军;李霞;董以雷5.一株绿鹭源H9 N2亚型禽流感病毒全基因组序列分析 [J], 杨勇; 段博芳; 曾邦权; 肖望成; 曾维欢; 黄翠琴; 代飞燕因版权原因,仅展示原文概要,查看原文内容请购买。



有机磷农药中毒的治疗论文(共2篇)本文从网络收集而来,上传到平台为了帮到更多的人,如果您需要使用本文档,请点击下载按钮下载本文档(有偿下载),另外祝您生活愉快,工作顺利,万事如意!第1篇:有机磷农药中毒的认识与进展综述有机磷农药(organophosphoruspesticides,OPS)是我国目前使用最广、使用量最大的杀虫剂,在有机磷农药的生产、运输、保管和使用过程中,稍有不慎,就可发生急性有机磷农药中毒(acuteorganophosphoruspesticidespoisoning,AOPP).有机磷农药对人的毒性主要是对乙酰胆碱酯酶的抑制,引起乙酰胆碱蓄积,使胆碱能神经受到持续冲动,导致先兴奋后衰竭的一系列的毒蕈碱样、烟碱样和中枢神经系统等症状,严重患者可出现呼吸肌麻瘦(respiratorymuscleparalysis,RMP)和中间综合征(intermediatemyastheniasyn-drome,IMS)而死亡.本文对有机磷农药的毒性认识、实验室检查进展做一综述.1毒性方面的相关进展关于有机磷毒作用机理的研究有机磷的胆碱酯酶抑制学说是早已公认的,但是我国徐海滨等[1,2]为了解决胆碱酯酶抑制剂能否直接作用于胆硷能神经受体,作了大量实验研究。
已知在正常情况下神经——肌肉接点神经末稍的去极化改变神经膜的通透性,使Ca2+进入末稍内,导致突触小泡破裂,放出乙酰胆碱;乙酰胆碱经过突触间隙扩散至终膜,与受体结合形成复合体,此复合体改变终膜对离子的通透性而造成去极化,产生终板电位;终板电位达到一定阈值时作用于肌膜,使其产生动作电位引起肌纤维的收缩.此过程由胆碱酯酶分解乙酰胆碱而解除.通常认为有机磷与胆碱酯酶结合,破坏这一兴奋传递过程造成一系列中毒症状.徐海滨等在非洲爪蟾胚胎神经、肌细胞上用膜片钳技术实验研究了乐果与氧乐果中毒时可兴奋细胞的生物电活动,观察到较高浓度时均降低自发微终板电流的幅度和频率,并以高幅度电流下降为主.对烟碱样乙酰胆碱受体离子通道作用为开放概率下降,开放时间缩短,提高乐果与氧乐果直接作用于突触后膜烟碱样乙酰胆碱受体离子通道,系典型的通道开放阻断剂.这一发现为解决一些胆碱酯酶抑制学说无法解释的现象提供理论依据。
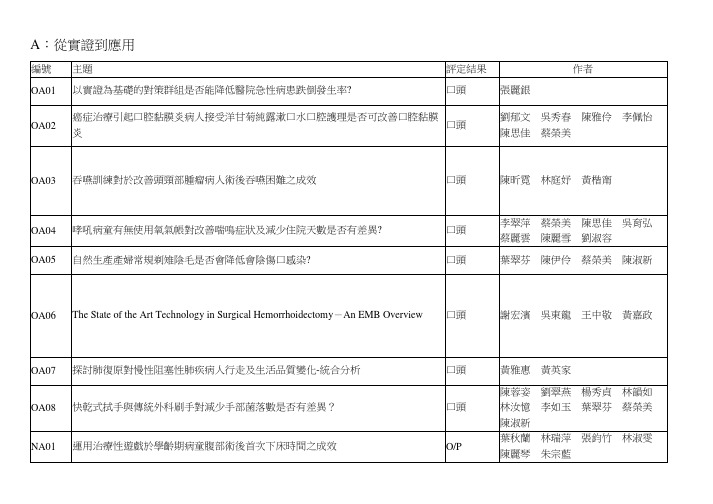
A:從實證到應用編號主題評定結果作者OA01 以實證為基礎的對策群組是否能降低醫院急性病患跌倒發生率? 口頭張麗銀OA02 癌症治療引起口腔黏膜炎病人接受洋甘菊純露漱口水口腔護理是否可改善口腔黏膜炎口頭劉郁文吳秀春陳雅伶李佩怡陳思佳蔡榮美OA03 吞嚥訓練對於改善頭頸部腫瘤病人術後吞嚥困難之成效口頭陳昕霓林庭妤黃楷甯OA04 哮吼病童有無使用氧氣帳對改善喘鳴症狀及減少住院天數是否有差異?口頭李翠萍蔡榮美陳思佳吳育弘蔡麗雲陳麗雪劉淑容OA05 自然生產產婦常規剃雉陰毛是否會降低會陰傷口感染?口頭葉翠芬陳伊伶蔡榮美陳淑新OA06 The State of the Art Technology in Surgical Hemorrhoidectomy-An EMB Overview口頭謝宏濱吳東龍王中敬黃嘉政OA07 探討肺復原對慢性阻塞性肺疾病人行走及生活品質變化-統合分析口頭黃雅惠黃英家OA08 快乾式拭手與傳統外科刷手對減少手部菌落數是否有差異?口頭陳蓉姿劉翠燕楊秀貞林韻如林汝憶李如玉葉翠芬蔡榮美陳淑新NA01 運用治療性遊戲於學齡期病童腹部術後首次下床時間之成效O/P 葉秋蘭林瑞萍張鈞竹林淑雯陳麗琴朱宗藍NA02 High Frequency Chest Wall Oscillation (HFCWO)對呼吸道清潔成效之系統性文獻回顧-以囊性纖維化病人為例O/P 彭月珠張麗銀張美玉NA03 停經婦女攝取大豆異黃酮預防骨質疏鬆O/P 黃睦升劉季花NA04 以實証為例:慢性硬腦膜下血腫術後的病人採平躺姿勢可降低復發率?O/P 彭慈恩黃怡真孫守涓陳美珠NA05 50歲以上失眠者口服褪黑激素改善睡眠品質成效之探討-統合分析O/P 許嘉紋黃英家PA01 尿失禁的婦女使用骨盆底肌肉運動訓練是否可改善尿失禁?海報孫曉芬林慕嵐錢美容PA02 以實証理論評估長期照護機構內失智症老人的營養狀態海報徐千婷田育鮮穆家芬許釗諭柯德鑫PA03 運用實證醫學手法探究內關穴按摩對噁心嘔吐之成效海報郭美珠PA04 以實證的角度探討Levetiracetam用於神經外科預防癲癇海報李美娟蘇慧真陳麗芳PA05 益生菌與呼吸器相關性肺炎之整合分析研究海報陳立偉林麗梅劉育志PA06 探討早產兒扎足跟血接受非藥物性止痛措施對生理指數的成效影響海報洪賢慧廖珍娟PA07 運用合併療法於利尿劑使用時以避免血鉀異常海報蔡宗衛PA08 以實證手法探討以電話諮商介入提升戒菸之成效海報陳玫君PA09 從實證護理角度探討冰敷對於咳血病患療效海報廖翎聿陳素容何宜美張祐泟PA10 以實證醫學方法探討使用tacrolimus外用藥膏(topical tacrolimus)治療白斑症(vitiligo)病患的效果與安全性。

㊀山东农业科学㊀2024ꎬ56(2):167~175ShandongAgriculturalSciences㊀DOI:10.14083/j.issn.1001-4942.2024.02.023收稿日期:2023-04-18基金项目:山东省自然科学基金项目(ZR2021MC060)ꎻ河北农业大学引进人才科研专项(ZD201723)作者简介:刘蓓(1998 )ꎬ女ꎬ河北廊坊人ꎬ硕士研究生ꎬ研究方向为临床兽医学ꎮE-mail:l133401@163.com肖雅清(1999 )ꎬ女ꎬ河北石家庄人ꎬ硕士研究生ꎬ研究方向为临床兽医学ꎮE-mail:1509747026@163.com∗同为第一作者ꎮ通信作者:刘明超(1987 )ꎬ男ꎬ山东青州人ꎬ博士ꎬ副教授ꎬ主要从事临床兽医学研究ꎮE-mail:liumingchao@163.com孟凯(1988 )ꎬ男ꎬ山东济南人ꎬ博士ꎬ副研究员ꎬ主要从事家禽疫病防控研究ꎮE-mail:mengkai1215@163.com益生菌对黄曲霉毒素B1的降解作用及其在家禽生产上的应用刘蓓1ꎬ2ꎬ肖雅清1ꎬ2∗ꎬ马宁1ꎬ翟向和1ꎬ刘明超1ꎬ孟凯2(1.河北农业大学动物医学院ꎬ河北保定㊀071000ꎻ2.山东省农业科学院家禽研究所ꎬ山东济南㊀250100)㊀㊀摘要:黄曲霉毒素(aflatoxinꎬAF)主要存在于污染粮油及其制品中ꎬ常见的有AFB1㊁AFB2㊁AFG1和AFG2四种类型ꎬ以黄曲霉毒素B1(AFB1)毒性最强ꎬ对全球农业和食品安全造成极大危害ꎮ目前ꎬ常用的缓解AFB1毒性的方法包括物理法㊁化学法和生物法ꎬ其中生物脱毒法中ꎬ益生菌作为绿色无污染的添加剂成为研究的热点ꎮ本文综述了黄曲霉毒素对家禽的危害ꎬ列举了对黄曲霉毒素具有降解作用的益生菌ꎬ阐述了益生菌的解毒机制以及在禽类生产中的应用ꎬ以期为利用益生菌降解AFB1的研究及应用提供借鉴和指导ꎮ关键词:黄曲霉毒素B1ꎻ益生菌ꎻ解毒机制ꎻ家禽生产中图分类号:S816.3㊀㊀文献标识号:A㊀㊀文章编号:1001-4942(2024)02-0167-09DegradationofAflatoxinB1byProbioticsandItsApplicationinPoultryProductionLiuBei1ꎬ2ꎬXiaoYaqing1ꎬ2∗ꎬMaNing1ꎬZhaiXianghe1ꎬLiuMingchao1ꎬMengKai2(1.CollegeofVeterinaryMedicineꎬHebeiAgriculturalUniversityꎬBaoding071000ꎬChinaꎻ2.InstituteofPoultryResearchꎬShandongAcademyofAgriculturalSciencesꎬJinan250100ꎬChina)Abstract㊀Aflatoxin(AF)ismainlyfoundincontaminatedgrainandoilproductsꎬandhasfourcommontypesasB1ꎬB2ꎬG1andG2.ThetoxicityofaflatoxinB1(AFB1)isthestrongestꎬwhichhasbroughtgreatharmtoglobalagricultureandfoodsafety.AtpresentꎬthecommonlyusedmethodstoalleviatethetoxicityofAFB1includephysicalꎬchemicalandbiologicalmethods.Amongthebiologicaldetoxificationmethodsꎬprobioticsasagreenandpollution ̄freeadditivehasbecomearesearchhotspot.InthispaperꎬtheharmofAFtopoultrywasreviewedꎬtheprobioticswithdegradationeffectonAFwerelistedꎬthedetoxificationmechanismofprobioticsanditsapplicationinpoultryproductionwereexpounded.ItwasexpectedtoprovideguidanceandreferenceforthescientificresearchofAFB1degradationbyprobioticsinthefuture.Keywords㊀AflatoxinB1ꎻProbioticsꎻDetoxificationmechanismꎻPoultryproduction㊀㊀黄曲霉毒素是由多株黄曲霉和寄生曲霉通过聚酮途径产生的二呋喃香豆素衍生物[1]ꎬ广泛存在于自然界中ꎮ有研究表明ꎬ采自世界不同地区的饲料样品中ꎬ有72%~79%含有真菌毒素[2]ꎬ饲料发霉后会平均损失15%的营养物质ꎬ甚至完全失去饲用价值[3]ꎬ严重威胁着全球的食品和农产品安全[4]ꎮ在已确定的20多种不同类型的黄曲霉毒素中ꎬ主要成员是黄曲霉毒素B1(AFB1)㊁B2(AFB2)㊁G1(AFG1)㊁G2(AFG2)㊁M1(AFM1)和M2(AFM2)ꎬ以AFB1的毒性最强[5]ꎮ各国针对食品和饲料中黄曲霉毒素的含量也制定了规范ꎬ人类食品中AFB1的允许限量范围约为0~40μg/kgꎬ动物饲料中允许含量最高可达300μg/kgꎬ若含量超过规定上限只能被彻底丢弃[6-8]ꎮ动物常因采食含有黄曲霉毒素的食物而发生中毒ꎬAFB1不仅会损伤内脏器官ꎬ还会影响生殖系统㊁消化系统㊁免疫系统等ꎬ从而降低动物的生产性能ꎬ给养殖户造成严重的经济损失[9-10]ꎮ人类也会通过食用带有霉菌毒素的肉㊁蛋㊁奶等农副产品而间接中毒ꎮ因此在动物养殖过程中如何减少黄曲霉毒素对其危害显得尤为重要ꎮ研究发现ꎬ一些细菌可以通过酶和挥发性有机化合物来影响AFB1及相关基因的表达ꎬ从而减少AFB1对动物机体的毒性损伤[11]ꎮ相较于其他解毒方法ꎬ利用细菌进行解毒具有无污染㊁特异性高㊁温和㊁安全㊁环保㊁益生等优势[12]ꎮ本文综述了AF对家禽的毒性损伤ꎬ对能够降解AF的细菌进行总结ꎬ详细介绍益生菌对AFB1的解毒作用和机制及其在家禽生产上的应用ꎬ为利用益生菌降低AF对动物毒性损伤的研究提供参考和方向ꎮ1㊀黄曲霉毒素对家禽的毒性损伤黄曲霉毒素最初在英国的一家农场被发现ꎬ有10万只火鸡出现不明原因的死亡ꎬ被称为 火鸡x病 ꎬ最终研究发现导致火鸡死亡的元凶是饲料发霉所产生的黄曲霉毒素[13]ꎮ1993年ꎬ黄曲霉毒素被世界卫生组织(WHO)列为Ⅰ类致癌物[14]ꎬ它的毒性相当于氰化钾的10倍ꎬ砒霜的68倍[15]ꎮ黄曲霉毒素具有致癌㊁致畸㊁致突变等作用ꎬ其对家禽的影响是全身性的ꎬ毒素可以在体内蓄积造成急性或慢性中毒ꎬ降低家禽的生长性能和饲料转化率ꎬ干扰骨代谢ꎬ引起肌肉排列改变ꎬ导致肝肾损伤㊁免疫抑制和增强性传染病的易感性[16-17]ꎮAFB1对细胞和组织的损伤包括抑制细胞增殖㊁致癌性㊁免疫抑制㊁致突变性㊁氧化应激㊁脂质过氧化和DNA损伤[18]ꎮ在众多动物中ꎬ家禽对黄曲霉毒素相对较易感ꎬ不同家禽对AFB1的敏感性表现为鸭子>火鸡>鸡[19-20]ꎮ美国食品和药物管理局(FDA)报告ꎬ家禽饮食中AF的可耐受水平为20μg/kg[21]ꎮ1.1㊀肝脏损伤肝脏是AFB1的主要靶器官ꎬAFB1可作为一种有效的化合物通过氧化损伤发挥其毒性ꎬ从而导致肝损伤和肝功能改变[22]ꎮAFB1在8ꎬ9位上有一个双键ꎬ可在肝脏中被细胞色素P450(CYP450)氧化生成黄曲霉毒素-8ꎬ9-环氧化物(AFBO)ꎬ并连接到DNA核酸酶的N7-鸟嘌呤ꎬ形成AFB1-DNA加合物ꎬ破坏DNA修复ꎬ最终导致肿瘤发生[23-25]ꎮ研究表明ꎬ连续4周给1日龄雏鸡饲喂含有1mg/kgAFB1的基础日粮ꎬ可引起其严重的肝脏损伤ꎬ包括肝门静脉周围纤维化㊁水肿性变性㊁脂肪变化㊁胆管增生等[26]ꎮ另外ꎬAFB1的代谢产物还可以损伤肝细胞的线粒体ꎬ降低线粒体膜的通透性ꎬ并诱导细胞凋亡ꎬ从而导致肝脏损伤[27]ꎮ1.2㊀免疫抑制黄曲霉毒素对家禽具有免疫毒性ꎬ可以降低家禽对病毒㊁细菌以及寄生虫的抵抗力ꎬ增加传染性疾病的易感性[28]ꎮ黄曲霉毒素可以通过多个方面引起家禽的免疫抑制ꎬ如:破坏先天免疫及细胞免疫ꎻ减少外周循环中淋巴细胞的数量而抑制机体细胞免疫ꎻ通过NK细胞以及巨噬细胞发生吞噬作用㊁产生活性氧(ROS)以及胞内杀伤而导致淋巴细胞溶解ꎻ损伤中性粒细胞的功能ꎬ降低其吞噬作用ꎬ刺激细胞内ROS的大量产生ꎻ异常调节T细胞的极化作用等[29]ꎮ脾脏作为外周免疫器官ꎬ可捕获和破坏病原体ꎬ并诱导适应性免疫反应ꎬ在宿主防御中起着核心作用[30]ꎮ有研究证明ꎬAFB1处理后的小鼠脾脏会发生萎缩ꎬ脾脏中的淋巴细胞数量减少ꎬ同时诱导免疫相关的CD3+㊁CD4+和CD8+T淋巴细胞亚群减少[31]ꎮWang等[32]研究发现ꎬAFB1通过抑制巨噬细胞ꎬ特别是M2型巨噬细胞和可分泌抗菌肽的潘氏细胞ꎬ来破坏宿主肠道免疫功能ꎬ其免疫毒性与肠道中环氧脂肪酸ꎬ特别是环氧二十碳三烯酸含量的减少和可溶性环氧化物水解酶(sEH)水平的提高有关ꎮ1.3㊀氧化应激AFB1是线粒体抗氧化功能障碍的重要诱导剂ꎬ可诱导产生大量的ROSꎬ引发氧化应激反应ꎬ861山东农业科学㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀第56卷㊀进一步诱导DNA和线粒体损伤以及炎症反应[33-34]ꎮAFB1通过解偶联线粒体氧化磷酸化ꎬ降低线粒体膜电位水平ꎬ诱导线粒体通透性增加ꎮ与氧化应激相关的线粒体的改变激活细胞色素Cꎬ调节Bcl2/Bax基因表达ꎬ激活Caspase9和Caspase3ꎬ导致细胞凋亡[24]ꎮROS引起细胞内抗氧化机制的改变ꎬ如SOD㊁GPX㊁CAT和Nrf2的表达ꎬ抑制和降低这些酶活导致脂质过氧化(LPO)增加ꎬ最终导致GSH减少和MDA水平增加[35]ꎮ氧化应激可增加体内不同类型ROS的产生ꎬ进而激活核因子-κB(nuclearfactorkappa-BꎬNF-κB)通路ꎬ导致炎性因子的产生[36]ꎮSui等[37]给绵羊灌胃1mg/kg的AFB1ꎬ24h后采样分析发现ꎬAFB1显著提高了肝脏中促炎细胞因子TNF-α和IL-6的水平ꎬ同时显著降低抗氧化相关基因(SOD-1和SOD-2)和抗炎基因IL-10的表达ꎮ1.4㊀生产性能家禽食入黄曲霉毒素后对生产性能的影响巨大ꎮ蛋鸡食用受霉菌毒素污染的饲料后ꎬ产蛋量㊁采食量㊁平均蛋重㊁增料比和蛋壳厚度明显降低ꎬ破蛋率明显上升[38-39]ꎮ黄曲霉毒素还可以在畜禽肌肉组织中蓄积影响肉质[40]ꎮ2㊀益生菌对黄曲霉毒素损伤的调节作用受到黄曲霉毒素污染的食品和饲料必须经过净化才可继续食用ꎮ黄曲霉毒素的净化主要有三种方式:物理降解㊁化学降解和生物降解[41]ꎮ与生物降解法相比ꎬ物理和化学方法普遍存在成本高㊁破坏食物的营养和味道㊁存在化学残留等缺陷[42]ꎮ生物降解法因其可靠㊁高效㊁成本低㊁易于使用且对环境和人体健康友好而广受欢迎[43]ꎮ然而ꎬ直接使用微生物仍有局限性ꎮ例如ꎬ许多食品不适合微生物的接种和增殖ꎬ或者微生物可能会释放不良的代谢产物ꎬ影响动物健康ꎮ要筛选出安全高效的益生菌ꎬ应用到农业生产ꎬ利用细胞外酶和培养上清液可能是霉菌毒素生物解毒的最佳策略ꎮ筛选出来的益生菌ꎬ应符合食品法中的相关规定ꎬ即对动物和人类是健康安全的ꎮ欧洲食品安全局(EuropeanFoodSafetyAuthorityꎬEF ̄SA)和美国食品化学品法典(FoodChemicalsCo ̄dexꎬFCC)均对食品用微生物菌种做出过明确定义和规范[44]ꎮ目前对黄曲霉毒素具有较好降解作用的益生菌主要有乳酸菌㊁酵母菌㊁芽孢杆菌㊁霉菌等ꎮ2.1㊀乳酸菌乳酸菌是一类没有芽孢的革兰氏阳性菌ꎬ能够产生脂肪酸㊁有机酸㊁过氧化氢㊁多肽和罗伊氏菌素等多种活性化合物ꎬ是理想的生物防腐剂[45]ꎮZhu等[46]从106株细菌中筛选出一株植物乳杆菌FJS003ꎬ对AFB1去除率为89.5%ꎬ对黄曲霉生长抑制率为42.8%ꎬ孢子生长抑制率高达100%ꎮAlkhalaileh[47]在肉鸡饮水中添加5%酸奶乳清(其中含有保加利亚乳杆菌㊁嗜热链球菌和乳酸乳杆菌)可以将肉鸡内脏器官和鸡不同部位肌肉组织中的AFB1残留降至低水平ꎮDeabes等[48]连续7天给雄性白化小鼠口服1ˑ1010CFU鼠李糖乳杆菌ꎬ可显著消除氧化应激并防止黄曲霉毒素诱导的遗传毒性ꎮ2.2㊀酵母菌酵母菌对多种霉菌毒素均有解毒效果ꎬ其对AFB1的影响与酵母细胞壁有关ꎮ酵母细胞壁的主要成分有酵母甘露低聚糖㊁葡甘露聚糖㊁几丁质和蛋白质等ꎬ同时具有多糖㊁蛋白质和脂类产生的特殊结构ꎬ通过氢键㊁离子键和疏水作用力对霉菌毒素产生吸附和降解作用[49]ꎮ研究发现ꎬ酿酒酵母表达的重组漆酶能有效降解AFB1ꎬ降解率最高可达91%[50]ꎮAbdel-Kareem等[51]分离的103株酿酒酵母菌株均有抑制黄曲霉生长的作用ꎬ其中101和117两个菌株对黄曲霉的抑制率分别为85%和83%ꎬ抑菌机制主要源于细菌分泌的几丁质酶ꎮ2.3㊀芽孢杆菌芽孢杆菌是一种需氧或兼性厌氧菌ꎬ在土壤㊁植物表面和动物体内均可分离得到ꎬ具有分布广㊁易获取的特点[52]ꎮ芽孢杆菌因其稳定的孢子结构及便于运输和储存等特点而被广泛应用于动物饲料生产中ꎮ芽孢杆菌对霉菌毒素的拮抗作用主要与各种具有生物活性的次级代谢产物和裂解酶的产生有关[53]ꎮBertuzzi等[54]研究发现ꎬ枯草芽孢杆菌QST713能够抑制主要产霉菌毒素真菌的生长ꎬ从而抑制主要霉菌毒素的产生ꎬ并推测这可能与枯草芽孢杆菌的不同脂肽相关ꎮ王明清等[55]从土壤中分离出一株蜡样芽孢杆菌ꎬ分别对其胞外上清液㊁菌悬液和胞内液进行黄曲霉毒素961㊀第2期㊀㊀㊀㊀刘蓓ꎬ等:益生菌对黄曲霉毒素B1的降解作用及其在家禽生产上的应用降解率测定ꎬ发现胞外上清液对AFB1的降解率高达91.7%ꎮXue等[56]从酿酒的大曲中分离得到一株能够降解AFB1的蜡样芽孢杆菌ꎬ在37ħ培养72h后ꎬ发现其对1mg/LAFB1的降解率为86.7%ꎬ降解作用源于细菌发酵液上清中的酶ꎮChen等[57]从自然发酵泡菜中分离筛选出一株解淀粉芽孢杆菌ꎬ能有效降解1~8μg/mL的AFB1ꎬ细胞上清液能够在70ħ以下对AFB1稳定降解ꎬ上清液煮沸20min后仍能降解37.16%的AFB1ꎮ2.4㊀霉菌在众多霉菌中ꎬ经过筛选并认定是安全的包括黑曲霉和米曲霉等ꎮ黑曲霉和米曲霉是黄曲霉的近亲ꎬ但不会产生黄曲霉毒素ꎬ目前广泛应用于发酵工业和食品加工ꎬ如各种有机酸㊁酶和生物活性化合物的生产ꎬ以及发酵食品感官特性的改善[58]ꎮCairns等[59]对黑曲霉蛋白进行了纯化和酶促分析ꎬ发现包括各种氧化酶㊁脱氢酶㊁水解酶㊁纤维素酶和果胶酶等活性成分ꎮ将黑曲霉RAF106在AFB1含量为0.1~4.0μg/mL的沙氏葡萄糖液体培养基(SDB)中培养ꎬ可以有效降解AFB1ꎬ其主要机制为细胞内提取物的酶促作用[60]ꎮ左瑞雨等[61]筛选出一株米曲霉ꎬ发现其对AFB1的降解率为77.05%ꎬ米曲霉中分离出的酶蛋白对AFB1的降解率可达54.33%ꎬ具有提高养殖效益的潜在应用价值ꎮ2.5㊀其他降解菌其他对黄曲霉毒素具有降解效果的细菌见表1ꎮ㊀㊀表1㊀其他对黄曲霉毒素有降解作用的细菌菌种毒素水平培养基反应时间/h解毒率/%解毒机制参考文献恶臭假单胞菌0.2μg/mLMSG2490AFB1被转化为结构不同的化合物(AFD1㊁AFD2㊁AFD3)Samuel等[62]嗜吡啶红球菌0.1μg/mLLB2483.7AFB1降解酶Deng等[63]嗜麦芽窄食单胞菌100μg/LNB7282.5未知Guan等[64]荧光假单胞菌AFB1㊁AFB2㊁AFG1和AFG2浓度分别为100㊁30㊁100μg/L和30μg/LNB7299~100未知Ali等[65]香味类香味菌100μg/LLB4893.82未知Mwakinyali等[66]链霉菌50ng/mLLB9690.50上清液中胞外酶邓盾等[67]3㊀益生菌对黄曲霉毒素的解毒机制利用益生菌对受污染的农产品进行净化主要有两种途径:一种是在体外净化ꎬ即在动物食入饲料之前ꎬ将饲料中的霉菌毒素去除ꎻ另一种是体内净化ꎬ即在动物的消化道中进行[68]ꎮ益生菌对黄曲霉毒素的解毒ꎬ主要通过生物吸附或将其降解为毒性较小的代谢物而起作用ꎬ生物转化可以通过霉菌毒素降解酶或产生这种酶的微生物来实现[69]ꎮ将霉菌毒素转化成其他化合物的过程是不可逆的ꎬ与生物吸附相比持续时间更长ꎮ3.1㊀生物吸附生物吸附是指黄曲霉毒素通过与细菌细胞壁表面特殊结构结合以达到解毒效果ꎮ乳酸菌通过细胞壁中的肽聚糖(主要成分为N-乙酰胞壁酸和N-乙酰葡萄糖胺)对AFB1进行吸附[70]ꎮ酵母菌通过存在于细胞壁中的磷壁酸㊁多糖等成分吸附霉菌毒素[71]ꎮ生物吸附会受到所添加的细菌种类和浓度㊁黄曲霉毒素浓度㊁pH值㊁温度㊁发酵时间㊁金属离子等多种因素的影响[57]ꎮShah等[72]研究了双歧杆菌和乳杆菌吸附AFB1的能力ꎬ结果表明这些细菌对AFB1的去除能力在20%~50%ꎬ用蒸馏水洗涤两次后60%~80%的结合黄曲霉毒素被去除ꎬ最终只有10%~40%的AFB1与细菌强烈结合ꎮ3.2㊀生物转化黄曲霉毒素中存在的主要毒性结构是香豆素内酯环ꎬ它极易水解ꎮ众多研究表明ꎬ细菌发挥毒素降解作用的物质多为胞外代谢产物ꎬ且不同细菌产酶种类不同(表2)ꎮ例如ꎬ漆酶降解黄曲霉毒素有两种方式:一种是直接作用于AFB1末端的呋喃环ꎬ形成AFB1环氧化物ꎬ进一步水解为AFB1二氢二醇ꎬ使AFB1处于毒性较小的状态ꎻ另一种是在AFB1的10位和11位引入羟基直接打开内071山东农业科学㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀第56卷㊀酯环[73]ꎮ㊀㊀表2㊀黄曲霉毒素降解酶及其来源降解酶来源参考文献锰过氧化物酶木质纤维素降解真菌Wang等[74]漆酶白腐菌Alberts等[75]内酯酶枯草芽孢杆菌ꎻ摩加夫芽胞杆菌ꎻ蜡样芽孢杆菌Pereyra等[76]还原酶分枝杆菌Taylor等[77]多铜氧化酶嗜热一氧化碳链霉菌Qin等[78]黄曲霉毒素氧化酶假蜜环菌Cao等[79]4㊀益生菌在禽类生产上的应用4.1㊀益生菌单独作用益生菌广泛应用于农业生产的诸多领域ꎬ益生菌的种类不同ꎬ其益生特性也有差别ꎮChen等[80]将唾液乳杆菌添加到肉鸡日粮中ꎬ发现其不仅可以有效降解AFB1ꎬ还能提高肉鸡的生长性能㊁改善肝功能和肉质ꎬ还可增强IBDV疫苗免疫后AFB1攻毒肉鸡的特异性抗体和IFN-γ的产生ꎬ促进淋巴细胞增殖ꎬ提高沙门氏菌感染抵抗力ꎮ研究发现ꎬ给予肉鸡黄曲霉素的同时添加植物乳杆菌ꎬ可以减轻黄曲霉毒素引起的毒性损伤ꎬ提高肉鸡抗氧化活性和生长性能[81]ꎮ4.2㊀益生菌的联合应用不同益生菌对黄曲霉毒素的解毒方式不同ꎬ因此将多个益生菌联合使用ꎬ可以获得更好的解毒效果ꎮHuang等[82]将枯草芽孢杆菌㊁酪蛋白乳杆菌和产朊假丝酵母3种益生菌按1ʒ1ʒ1混合ꎬ对AFB1和ZEA的降解率分别达到45.49%和44.90%ꎮ将乳酸菌和酿酒酵母组成的益生菌制剂添加到AFB1污染的肉鸡日粮中ꎬ可以减少AFB1残留物ꎬ减轻肉鸡肝脏和肾脏的退行性变化ꎬ有助于改善动物健康和肉类质量[68]ꎮ因此ꎬ复合益生菌制剂可用于减轻霉菌毒素带来的毒性损伤ꎬ保护禽类健康和食品安全ꎮ4.3㊀益生菌与代谢物酶联用研究表明ꎬ微生物降解AFB1的能力与酶促反应有关[83]ꎮ目前已经发现的可降解黄曲霉毒素的酶包括黄曲霉毒素氧化酶(AFO)㊁F420H2依赖性还原酶(FDR)㊁锰过氧化物酶(MnP)㊁漆酶㊁过氧化物酶㊁黄曲霉毒素降解酶和黄曲霉毒素-解毒酶(ADTZ)等[63]ꎮ将3种益生菌复合菌剂与米曲霉真菌毒素降解酶以3ʒ2的比例复配使用时ꎬ对AFB1和ZEA的降解率分别达到63.95%和73.51%[82]ꎮGuo等[84]利用枯草芽孢杆菌㊁粪肠球菌㊁产朊假丝酵母和乳酸杆菌混合的细菌培养液或培养液上清分别与黄曲霉毒素降解酶联用ꎬ发现可以通过激活NF-κB㊁iNOS㊁NOD1和TLR2信号通路ꎬ减轻AFB1暴露引起的细胞毒性和炎症反应ꎮ4.4㊀益生菌、酶与其他制剂联合使用益生菌和酶与其他具有解毒效果的制剂联合使用ꎬ在显著提高解毒效果的同时ꎬ还对动物具有益生效果ꎬ因而逐渐成为现在的研究热点ꎮGuo等[85]将AFB1降解酶㊁蒙脱石和复合益生菌混合饲喂肉鸡ꎬ可以保持肉鸡肠道微生物群稳定ꎬ缓解AFB1引发的组织学病变ꎬ提高生长性能ꎬ降低霉菌毒素毒性ꎮ还有研究发现ꎬ甘草提取物㊁益生菌㊁毒素粘合剂和家禽粪便生物炭混合饲养肉鸡ꎬ可减轻AFB1对肉鸡肝脏的病理损伤ꎬ改善血液指标ꎬ并具有良好的免疫效果[86]ꎮ5㊀展望黄曲霉毒素是自然界毒性最强的霉菌毒素之一ꎬ常见的饲料原料如玉米㊁小麦㊁大豆等极易受到受黄曲霉污染ꎬ严重危胁全球农业发展ꎮ家禽体型小㊁易饲养ꎬ且禽肉禽蛋是廉价㊁优质的蛋白来源ꎬ故其成为许多国家重要的动物源性食品ꎮ随着家禽饲养数量的提高ꎬ必然带动饲料消耗量的增加ꎮ然而受天气㊁湿度和饲料堆积的影响ꎬ饲料更容易出现霉变ꎮ家禽食用含有黄曲霉毒素的饲料后ꎬ毒素会在体内蓄积ꎬ进而引起肝脏损伤和机体的氧化应激ꎬ导致生产性能下降ꎬ疾病的易感性升高ꎮ针对这种现象ꎬ减少饲料的黄曲霉毒素污染显得尤为重要ꎮ相较于传统的物理化学解毒方式ꎬ利用益生菌解毒更加安全环保ꎬ益生菌在生长过程中会分泌乳酸㊁多种酶和蛋白ꎬ能够在缓解黄曲霉毒素毒性损伤的同时提高饲料的适口性ꎬ有改善家禽肉质㊁提高机体抗病能力的作用ꎮ尽管已有大量的研究证实益生菌的降解效果及解毒机制的安全性ꎬ但实际生产中仍存在成果转化率不高的现象ꎮ这种现象的出现ꎬ一方面在于筛选出的真正高效的降解菌株数量较少ꎬ对于其解毒机制以及如何提高其在体内㊁外的降解效171㊀第2期㊀㊀㊀㊀刘蓓ꎬ等:益生菌对黄曲霉毒素B1的降解作用及其在家禽生产上的应用率方面未继续深入研究ꎬ仅停留在前期试验阶段ꎻ另一方面在于使用单一细菌降解黄曲霉毒素相较于复合益生菌制剂存在一定劣势ꎮ实际应用中可将多种降解菌㊁降解酶和有机酸等联合使用ꎬ使解毒效果达到最大化的同时还能对动物产生益生作用ꎮ随着科学研究的不断深入ꎬ将益生菌制剂添加到动物日粮中以减少黄曲霉毒素对动物损伤的技术模式ꎬ在提高家禽养殖效益方面的应用前景越来越广阔ꎮ参㊀考㊀文㊀献:[1]㊀BennettJWꎬKlichM.Mycotoxins[J].ClinicalMicrobiologyReviewsꎬ2003ꎬ16(3):497-516.[2]㊀CimbaloAꎬAlonso ̄GarridoMꎬFontGꎬetal.Toxicityofmy ̄cotoxinsinvivoonvertebrateorganisms:areview[J].FoodandChemicalToxicologyꎬ2020ꎬ137:111161. [3]㊀程伟ꎬ左瑞雨ꎬ常娟ꎬ等.益生菌和黄曲霉毒素B1降解酶对肉仔鸡生长性能的影响及其作用机理[J].动物营养学报ꎬ2014ꎬ26(6):1608-1615.[4]㊀JallowAꎬXieHLꎬTangXQꎬetal.Worldwideaflatoxincon ̄taminationofagriculturalproductsandfoods:fromoccurrencetocontrol[J].ComprehensiveReviewsinFoodScienceandFoodSafetyꎬ2021ꎬ20(3):2332-2381.[5]㊀SangRꎬGeBJꎬLiHFꎬetal.TaraxasterolalleviatesaflatoxinB1 ̄inducedliverdamageinbroilerchickensviaregulationofoxidativestressꎬapoptosisandautophagy[J].EcotoxicologyandEnvironmentalSafetyꎬ2023ꎬ251:114546. [6]㊀RushingBRꎬSelimMI.AflatoxinB1:areviewonmetabo ̄lismꎬtoxicityꎬoccurrenceinfoodꎬoccupationalexposureꎬanddetoxificationmethods[J].FoodandChemicalToxicologyꎬ2019ꎬ124:81-100.[7]㊀DorsGCꎬCaldasSꎬFeddernVꎬetal.Aflatoxins:contamina ̄tionꎬanalysisandcontrol[M].Shanghai:InTechꎬ2011ꎬ20:415-438.[8]㊀中华人民共和国质量监督检验检疫总局ꎬ中国国家标准化管理委员会.饲料卫生标准:GB13078 2017[S].北京:中国标准出版社ꎬ2017.[9]㊀JiangYꎬOgunadeIMꎬVyasDꎬetal.Aflatoxinindairycows:toxicityꎬoccurrenceinfeedstuffsandmilkanddietarymitiga ̄tionstrategies[J].Toxinsꎬ2021ꎬ13(4):283.[10]FouadAMꎬRuanDꎬEl ̄SenouseyHAKꎬetal.HarmfuleffectsandcontrolstrategiesofaflatoxinB1producedbyAsper ̄gillusflavusandAspergillusparasiticusstrainsonpoultry:re ̄view[J].Toxinsꎬ2019ꎬ11(3):176.[11]RodriguesAIꎬGudiñaEJꎬAbrunhosaLꎬetal.RhamnolipidsinhibitaflatoxinsproductioninAspergillusflavusbycausingstructuraldamagesinthefungalhyphaeanddown ̄regulatingtheexpressionoftheirbiosyntheticgenes[J].InternationalJournalofFoodMicrobiologyꎬ2021ꎬ348:109207.[12]王文欣.微生物降解饲料中黄曲霉毒素的研究进展[J].饲料研究ꎬ2021ꎬ44(9):153-155.[13]PickovaDꎬOstryVꎬTomanJꎬetal.Aflatoxins:historyꎬsig ̄nificantmilestonesꎬrecentdataontheirtoxicityandwaystomitigation[J].Toxinsꎬ2021ꎬ13(6):399.[14]RajputSAꎬZhangCꎬFengYꎬetal.Proanthocyanidinsallevi ̄atesaflatoxinB1 ̄inducedoxidativestressandapoptosisthroughmitochondrialpathwayinthebursaoffabriciusofbroilers[J].Toxinsꎬ2019ꎬ11(3):157.[15]AtandaSAꎬEchenduMA.Fungiandmycotoxinsinstoredfoods[J].AfricanJournalofMicrobiologyResearchꎬ2011ꎬ5(25):4373-4382.[16]PashaTNꎬFarooqMUꎬKhattakFMꎬetal.Effectivenessofsodiumbentoniteandtwocommercialproductsasaflatoxinab ̄sorbentsindietsforbroilerchickens[J].AnimalFeedScienceandTechnologyꎬ2007ꎬ132(1):103-110.[17]MorrisonDꎬLedouxDꎬChesterLꎬetal.Alimitedsurveyofaflatoxinsinpoultryfeedandfeedingredientsinguyana[J].VeterinarySciencesꎬ2017ꎬ4:60.[18]PopescuRGꎬR dulescuALꎬGeorgescuSEꎬetal.Aflatox ̄insinfeed:typesꎬmetabolismꎬhealthconsequencesinswineandmitigationstrategies[J].Toxinsꎬ2022ꎬ14(12):853. [19]WangHꎬMuhammadIꎬLiWꎬetal.SensitivityofarboracresbroilersandchemopreventionofaflatoxinB1 ̄inducedliverinju ̄rybycurcuminꎬanaturalpotentinducerofphase ̄ⅡenzymesandNrf2[J].EnvironmentalToxicologyandPharmacologyꎬ2018ꎬ59:94-104.[20]WangLLꎬHuangQꎬWuJꎬetal.Themetabolismandbio ̄transformationofAFB1:keyenzymesandpathways[J].Bio ̄chemicalPharmacologyꎬ2022ꎬ199:115005.[21]NasiriPSꎬFazeliMRꎬLarypoorMꎬetal.DevelopinganewbiologictoxinbinderforreducingAFB1toxicityinlayinghens[J].LettersinAppliedMicrobiologyꎬ2023ꎬ76(2):ovad001. [22]DenliMꎬBlandonJCꎬGuynotMEꎬetal.EffectsofdietaryAflaDetoxonperformanceꎬserumbiochemistryꎬhistopathologi ̄calchangesꎬandaflatoxinresiduesinbroilersexposedtoafla ̄toxinB1[J].PoultryScienceꎬ2009ꎬ88(7):1444-1451. [23]LiJꎬLiuMX.ThecarcinogenicityofaflatoxinB1[M]//LongXD.AflatoxinB1occurrenceꎬdetectionandtoxicologicaleffects.IntechOpenꎬ2019.[24]AfsharPꎬShokrzadehMꎬRaeisiSNꎬetal.Aflatoxinsbiode ̄toxificationstrategiesbasedonprobioticbacteria[J].Toxiconꎬ2020ꎬ178:50-58.[25]ZhaoLꎬDengJꎬXuZJꎬetal.MitigationofaflatoxinB1hepa ̄toxicitybydietaryhedyotisdiffusaisassociatedwithactivationofNRF2/AREsignalinginchicks[J].Antioxidantsꎬ2021ꎬ10(6):878.[26]RaiputSAꎬSunLHꎬZhangNYꎬetal.Ameliorativeeffectsofgrapeseedproanthocyanidinextractongrowthperformanceꎬ271山东农业科学㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀第56卷㊀immunefunctionꎬantioxidantcapacityꎬbiochemicalconstitu ̄entsꎬliverhistopathologyandaflatoxinresiduesinbroilersex ̄posedtoaflatoxinB1[J].Toxinsꎬ2017ꎬ9(11):371. [27]GuoJꎬYanWRꎬTangJKꎬetal.Dietaryphillygeninsupple ̄mentationamelioratesaflatoxinB1 ̄inducedoxidativestressꎬin ̄flammationꎬandapoptosisinchickenliver[J].EcotoxicologyandEnvironmentalSafetyꎬ2022ꎬ236:113481.[28]NaseemMNꎬSaleemiMKꎬKhanAꎬetal.PathologicaleffectsofconcurrentadministrationofaflatoxinB1andfowlad ̄enovirus ̄4inbroilerchicks[J].MicrobialPathogenesisꎬ2018ꎬ121:147-154.[29]张妮娅.雏鸭黄曲霉毒素B1亚急性中毒肝脏损伤机制的研究[D].武汉:华中农业大学ꎬ2016.[30]MebiusREꎬKraalG.Structureandfunctionofthespleen[J].NatureReviewsImmunologyꎬ2005ꎬ5(8):606-616. [31]XuFBꎬWangPYꎬYaoQCꎬetal.LycopenealleviatesAFB1 ̄inducedimmunosuppressionbyinhibitingoxidativestressandapoptosisinthespleenofmice[J].Food&Functionꎬ2019ꎬ10(7):3868-3879.[32]WangWCꎬWangYXꎬYangJꎬetal.AflatoxinB1exposuredisruptstheintestinalimmunefunctionviaasolubleepoxidehydrolase ̄mediatedmanner[J].EcotoxicologyandEnviron ̄mentalSafetyꎬ2023ꎬ249:114417.[33]LiuYꎬWangWJ.AflatoxinB1impairsmitochondrialfunc ̄tionsꎬactivatesROSgenerationꎬinducesapoptosisandin ̄volvesNrf2signalpathwayinprimarybroilerhepatocytes[J].AnimalScienceJournalꎬ2016ꎬ87(12):1490-1500. [34]SilvaEODꎬBracarenseAPꎬOswaldIP.Mycotoxinsandoxi ̄dativestress:wherearewe?[J].WorldMycotoxinJournalꎬ2018ꎬ11:113-134.[35]WangYNꎬWuJYꎬWangLFꎬetal.EpigallocatechingallateandglutathioneattenuateaflatoxinB1 ̄inducedacuteliverinju ̄ryinducklingsviamitochondria ̄mediatedapoptosisandtheNrf2signallingpathway[J].Toxinsꎬ2022ꎬ14(12):876. [36]LiHLꎬHuangKꎬLiuXHꎬetal.LithiumchloridesuppressescolorectalcancercellsurvivalandproliferationthroughROS/GSK ̄3β/NF ̄κBsignalingpathway[J].OxidativeMedicineandCellularLongevityꎬ2014ꎬ2014:241864.[37]SuiYZꎬLuYꎬZuoSJꎬetal.AflatoxinB1exposureinsheep:insightsintohepatotoxicitybasedonoxidativestressꎬinflamma ̄toryinjuryꎬapoptosisꎬandgutmicrobiotaanalysis[J].Toxinsꎬ2022ꎬ14(12):840.[38]JiaRꎬMaQGꎬFanYꎬetal.Thetoxiceffectsofcombinedaf ̄latoxinsandzearalenoneinnaturallycontaminateddietsonlay ̄ingperformanceꎬeggqualityandmycotoxinsresiduesineggsoflayersandtheprotectiveeffectofBacillussubtilisbiodegrada ̄tionproduct[J].FoodandChemicalToxicologyꎬ2016ꎬ90:142-150.[39]ZhuFHꎬZhuLQꎬXuJDꎬetal.Effectsofmoldycornontheperformanceꎬantioxidantcapacityꎬimmunefunctionꎬmetabo ̄lismandresiduesofmycotoxinsineggsꎬmuscleꎬandediblevisceraoflayinghens[J].PoultryScienceꎬ2023ꎬ102(4):102502.[40]ElbasuniSSꎬIbrahimSSꎬElsabaghRꎬetal.Thepreferentialtherapeuticpotentialofchlorellavulgarisagainstaflatoxin ̄in ̄ducedhepaticinjuryinquail[J].Toxinsꎬ2022ꎬ14(12):843. [41]Vila ̄DonatPꎬMarínSꎬSanchisVꎬetal.Areviewofthemy ̄cotoxinadsorbingagentsꎬwithanemphasisontheirmulti ̄bind ̄ingcapacityꎬforanimalfeeddecontamination[J].FoodandChemicalToxicologyꎬ2018ꎬ114:246-259.[42]NdiayeSꎬZhangMHꎬFallMꎬetal.Currentreviewofmyco ̄toxinbiodegradationandbioadsorption:microorganismsꎬmech ̄anismsꎬandmainimportantapplications[J].Toxinsꎬ2022ꎬ14(11):729.[43]PengZꎬChenLKꎬZhuYLꎬetal.Currentmajordegradationmethodsforaflatoxins:areview[J].TrendsinFoodScience&Technologyꎬ2018ꎬ80:155-166.[44]葛媛媛ꎬ姚粟ꎬ赵婷ꎬ等.欧洲食品安全局食品用微生物菌种的管理概述[J].食品与发酵工业ꎬ2014ꎬ40(6):142-146.[45]NasrollahzadehAꎬMokhtariSꎬKhomeiriMꎬetal.Antifungalpreservationoffoodbylacticacidbacteria[J].Foodsꎬ2022ꎬ11(3):395.[46]ZhuYLꎬXuYNꎬYangQL.AntifungalpropertiesandAFB1detoxificationactivityofanewstrainofLactobacillusplantarum[J].JournalofHazardousMaterialsꎬ2021ꎬ414:125569. [47]AlkhalailehN.ReductionofAflatoxinB1residuesinmeatandorgansofbroilerchickensbylacticacidbacteria[J].PakistanVeterinaryJournalꎬ2018ꎬ38(3):325-328.[48]DeabesMꎬDarwishHꎬAbdel ̄AzizKꎬetal.ProtectiveeffectsofLactobacillusrhamnosusGGonaflatoxins ̄inducedtoxicitiesinmalealbinomice[J].JournalofEnvironmentalandAnalyti ̄calToxicologyꎬ2012ꎬ2:1-9.[49]张秀江ꎬ胡虹ꎬ张永战ꎬ等.酵母菌对饲料中黄曲霉毒素B1的降解和脱除作用研究[J].河南科学ꎬ2016ꎬ34(10):1686-1690.[50]LiuYLꎬMaoHJꎬYohannesKWꎬetal.Degradationofafla ̄toxinB1byarecombinantlaccasefromTrametessp.C30ex ̄pressedinSaccharomycescerevisiae:amechanismassessmentstudyinvitroandinvivo[J].FoodResearchInternationalꎬ2021ꎬ145:110418.[51]Abdel ̄KareemMMꎬRasmeyAMꎬZohriAA.TheactionmechanismandbiocontrolpotentialityofnovelisolatesofSac ̄charomycescerevisiaeagainsttheaflatoxigenicAspergillusflavus[J].LettersinAppliedMicrobiologyꎬ2019ꎬ68(2):104-111. [52]WuQYꎬLiHHꎬWangSXꎬetal.DifferentialexpressionofgenesrelatedtogrowthandaflatoxinsynthesisinAspergillusflavuswheninhibitedbyBacillusvelezensisstrainB2[J].Foodsꎬ2022ꎬ11(22):3620.[53]DameZTꎬRahmanMꎬIslamT.Bacilliassourcesofagrobio ̄371㊀第2期㊀㊀㊀㊀刘蓓ꎬ等:益生菌对黄曲霉毒素B1的降解作用及其在家禽生产上的应用technology:recentadvancesandfuturedirections[J].GreenChemistryLettersandReviewsꎬ2021ꎬ14(2):246-271. [54]BertuzziTꎬLeniGꎬBullaGꎬetal.ReductionofmycotoxigenicfungigrowthandtheirmycotoxinproductionbyBacillussubtilisQST713[J].Toxinsꎬ2022ꎬ14(11):797.[55]王明清ꎬ张初署ꎬ于丽娜ꎬ等.降解黄曲霉毒素B1芽孢杆菌的筛选与鉴定[J].山东农业科学ꎬ2018ꎬ50(11):71-75. [56]XueGLꎬQuYJꎬWuDꎬetal.BiodegradationofaflatoxinB1inthebaijiubrewingprocessbyBacilluscereus[J].Toxinsꎬ2023ꎬ15(1):65.[57]ChenGJꎬFangQAꎬLiaoZLꎬetal.Detoxificationofaflatox ̄inB1byapotentialprobioticBacillusamyloliquefaciensWF2020[J].FrontiersinMicrobiologyꎬ2022ꎬ13:891091. [58]ChangPꎬEhrlichKCꎬHuaST.CladalrelatednessamongAs ̄pergillusoryzaeisolatesandAspergillusflavusSandLmorpho ̄typeisolates[J].InternationalJournalofFoodMicrobiologyꎬ2006ꎬ108(2):172-177.[59]CairnsTCꎬNaiCꎬMeyerV.Howafungusshapesbiotechnol ̄ogy:100yearsofAspergillusnigerresearch[J].FungalBiologyandBiotechnologyꎬ2018ꎬ5(1):1-14.[60]FangQAꎬDuMRꎬChenJWꎬetal.Degradationanddetoxi ̄ficationofaflatoxinB1bytea ̄derivedAspergillusnigerRAF106[J].Toxinsꎬ2020ꎬ12(12):777.[61]左瑞雨ꎬ尹清强ꎬ常娟ꎬ等.降解黄曲霉毒素B1菌株的筛选及毒素降解酶的分离[J].河南农业科学ꎬ2018ꎬ47(8):128-133.[62]SamuelMSꎬSivaramakrishnaAꎬMehtaA.DegradationanddetoxificationofaflatoxinB1byPseudomonasputida[J].Inter ̄nationalBiodeterioration&Biodegradationꎬ2014ꎬ86:202-209. [63]DengDꎬTangJHꎬLiuZCꎬetal.Functionalcharacterizationandwhole ̄genomeanalysisofanaflatoxin ̄degradingRhodococ ̄cuspyridinivoransstrain[J].Biologyꎬ2022ꎬ11(5):774. [64]GuanSꎬJiCꎬZhouTꎬetal.AflatoxinB1degradationbyStenotrophomonasmaltophiliaandothermicrobesselectedusingcoumarinmedium[J].InternationalJournalofMolecularSci ̄encesꎬ2008ꎬ9(8):1489-1503.[65]AliSꎬHassanMꎬEssamTꎬetal.Biodegradationofaflatoxinbybacterialspeciesisolatedfrompoultryfarms[J].Toxiconꎬ2021ꎬ195:7-16.[66]MwakinyaliSEꎬMingZꎬXieHLꎬetal.InvestigationandcharacterizationofMyroidesodoratimimusstrain3J2MOaflatox ̄inB1degradation[J].JournalofAgriculturalandFoodChemis ̄tryꎬ2019ꎬ67(16):4595-4602.[67]邓盾ꎬ唐嘉虹ꎬ王永飞ꎬ等.AFB1降解菌的分离鉴定㊁降解条件优化及降解产物毒性评估[J].南方农业学报ꎬ2022ꎬ53(3):596-606.[68]S'liz'ewskaKꎬCukrowskaBꎬSmulikowskaSꎬetal.Theeffectofprobioticsupplementationonperformanceandthehistopatho ̄logicalchangesinliverandkidneysinbroilerchickensfeddi ̄etswithaflatoxinB1[J].Toxinsꎬ2019ꎬ11(2):112.[69]KolosovaAꎬStrokaJ.Substancesforreductionofthecontami ̄nationoffeedbymycotoxins:areview[J].WorldMycotoxinJournalꎬ2011ꎬ4:225-256.[70]李彦伸ꎬ卢国柱ꎬ曲劲尧ꎬ等.霉菌毒素检测与脱毒技术研究进展[J].食品安全质量检测学报ꎬ2020ꎬ11(12):3919-3929.[71]HamidiAꎬMirnejadRꎬYahaghiEꎬetal.TheaflatoxinB1iso ̄latingpotentialoftwolacticacidbacteria[J].AsianPacificJournalofTropicalBiomedicineꎬ2013ꎬ3(9):732-736. [72]ShahNPꎬWuXR.AflatoxinB1bindingabilitiesofprobioticbacteria[J].Bioscienceandmicrofloraꎬ1999ꎬ18(1):43-48. [73]KumarVꎬBahugunaAꎬRamalingamSꎬetal.Recenttechno ̄logicaladvancesinmechanismꎬtoxicityꎬandfoodperspectivesofenzyme ̄mediatedaflatoxindegradation[J].CriticalReviewsinFoodScienceandNutritionꎬ2022ꎬ62(20):5395-5412. [74]WangXLꎬQinXꎬHaoZZꎬetal.Degradationoffourmajormycotoxinsbyeightmanganeseperoxidasesinpresenceofadi ̄carboxylicacid[J].Toxinsꎬ2019ꎬ11(10):566.[75]AlbertsJFꎬGelderblomWCAꎬBothaAꎬetal.DegradationofaflatoxinB1byfungallaccaseenzymes[J].InternationalJournalofFoodMicrobiologyꎬ2009ꎬ135(1):47-52. [76]PereyraMLGꎬMartínezMPꎬCavaglieriLR.Presenceofai ̄iAhomologuegenesencodingforN ̄Acylhomoserinelactone ̄degradingenzymeinaflatoxinB1 ̄decontaminatingBacillusstrainswithpotentialuseasfeedadditives[J].FoodandChemicalToxicologyꎬ2019ꎬ124:316-323.[77]TaylorMCꎬJacksonCJꎬTattersallDBꎬetal.IdentificationandcharacterizationoftwofamiliesofF420H2 ̄dependentre ̄ductasesfromMycobacteriathatcatalyseaflatoxindegradation[J].MolecularMicrobiologyꎬ2010ꎬ78(3):561-575. [78]QinXꎬXinYZꎬZouJHꎬetal.Efficientdegradationofafla ̄toxinB1andzearalenonebylaccase ̄likemulticopperoxidasefromStreptomycesthermocarboxydusinthepresenceofmedia ̄tors[J].Toxinsꎬ2021ꎬ13(11):754.[79]CaoHꎬLiuDLꎬMoXMꎬetal.AfungalenzymewiththeabilityofaflatoxinB1conversion:purificationandESI ̄MS/MSidentifi ̄cation[J].MicrobiologicalResearchꎬ2011ꎬ166(6):475-483.[80]ChenXPꎬIshfaqMꎬWangJ.EffectsofLactobacillussalivariussupplementationonthegrowthperformanceꎬliverfunctionꎬmeatqualityꎬimmuneresponsesandSalmonellaPullorumin ̄fectionresistanceofbroilerschallengedwithaflatoxinB1[J].PoultryScienceꎬ2022ꎬ101(3):101651.[81]KhanianMꎬKarimi ̄TorshiziMꎬAllamehA.Alleviationofafla ̄toxin ̄relatedoxidativedamagetoliverandimprovementofgrowthperformanceinbroilerchickensconsumedLactobacillusplantarum299vforentiregrowthperiod[J].Toxiconꎬ2019ꎬ158:57-62.[82]HuangWWꎬChangJꎬWangPꎬetal.Effectofthecombinedcompoundprobioticswithmycotoxin ̄degradationenzymeonde ̄471山东农业科学㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀第56卷㊀toxifyingaflatoxinB1andzearalenone[J].TheJournalofToxi ̄cologicalSciencesꎬ2018ꎬ43(6):377-385.[83]WangLꎬHuangWꎬShaYꎬetal.Co ̄cultivationoftwoBacil ̄lusstrainsforimprovedcellgrowthandenzymeproductiontoenhancethedegradationofaflatoxinB1[J].Toxinsꎬ2021ꎬ13(7):435.[84]GuoHWꎬChangJꎬWangPꎬetal.Effectsofcompoundpro ̄bioticsandaflatoxin ̄degradationenzymeonalleviatingaflatox ̄in ̄inducedcytotoxicityinchickenembryoprimaryintestinalep ̄itheliumꎬliverandkidneycells[J].AMBExpressꎬ2021ꎬ11(1):35.[85]GuoHWꎬWangPꎬLiuCQꎬetal.Compoundmycotoxinde ̄toxifieralleviatingaflatoxinB1toxiceffectsonbroilergrowthperformanceꎬorgandamageandgutmicrobiota[J].PoultryScienceꎬ2023ꎬ102(3):102434.[86]RashidiNꎬKhatibjooAꎬTaherpourKꎬetal.Effectsoflicoriceextractꎬprobioticꎬtoxinbinderandpoultrylitterbiocharonperformanceꎬimmunefunctionꎬbloodindicesandliverhisto ̄pathologyofbroilersexposedtoaflatoxin ̄B1[J].PoultrySci ̄enceꎬ2020ꎬ99(11):5896-5906.571㊀第2期㊀㊀㊀㊀刘蓓ꎬ等:益生菌对黄曲霉毒素B1的降解作用及其在家禽生产上的应用。
年第期(总第期)犬食道阻塞是由于食入异物阻塞于食道的某一段引起的疾病[1]。
见的异物包括:骨头,金属,塑料,木头,肉块,较少见的有缝衣针,鱼钩等。
根据阻塞的程度不同分为:完全阻塞与不完全阻塞;根据阻塞部位不同分为咽喉部阻塞、颈部食道阻塞、胸部食道阻塞[2]。
根据阻塞的程度及部位的不同临床表现和治疗方法各异。
开胸手术中,手术人员良好的无菌素养对于减少病犬的术后并发症,以及病犬的尽早康复至关重要[3]。
1基本信息小白,串种犬,7月,体重4.6kg,BCS:5/9,免疫史完善。
2013年6月15日因为吃东西立即呕吐持续4天带到医院就诊.2临床检查T:38.7P140/min R32/min,精神状态良好,轻度脱水,诱咳反应阴性。
心音未见异常,腹腔触诊未见异常。
3实验室检查侧位X光片显示胸腔前段有一高密度影(如图一),气管明显受到压迫。
CBC:未见异常。
诊断为胸腔食道异物,此部位需要进行开胸术才能将异物取出,由于本院当时没有呼吸机。
做出以间歇正压供气技术施行手术。
图一4手术过程[4]4.1术前埋置静脉留置导管,乳酸林格液体150ml混合雷尼替丁10mg滴注,后生理盐水50ml混合头孢曲松250mg静脉注射。
换用100ml乳酸林格作为术中补液。
阿托品0.4ml皮下注射,盐酸曲马多20mg肌肉注射,15分钟后静脉推注舒泰50,0.4ml.肌肉注射8460.15ml。
左侧胸部大范围剃毛。
消毒。
插气管插管,保定,并铺设创巾。
4.2三四肋间作10公分左右切口,并仔细分离,依次切开背阔肌,,找到下锯肌,并沿着肌肉纤维方向分离腹外斜肌。
此犬为幼犬,可进行钝性分离。
肋骨组织比较稚嫩,所以不做肋骨切断。
仔细分离到胸膜的时候,将人工简易呼吸器接上气管插管,用手术剪在呼气末端剪开胸膜,此时立即保持人工简易呼吸器正压间歇供气,保持吸气时间在1.5秒左右,并观察肺叶充盈度,合理调整力度。
4.3观察血氧饱和度及其粘膜颜色,待平稳后轻柔扒开肺叶,找到梗阻食道。