(完整版)物理化学上热力学第一定律知识框架图总结.doc
- 格式:doc
- 大小:125.51 KB
- 文档页数:1
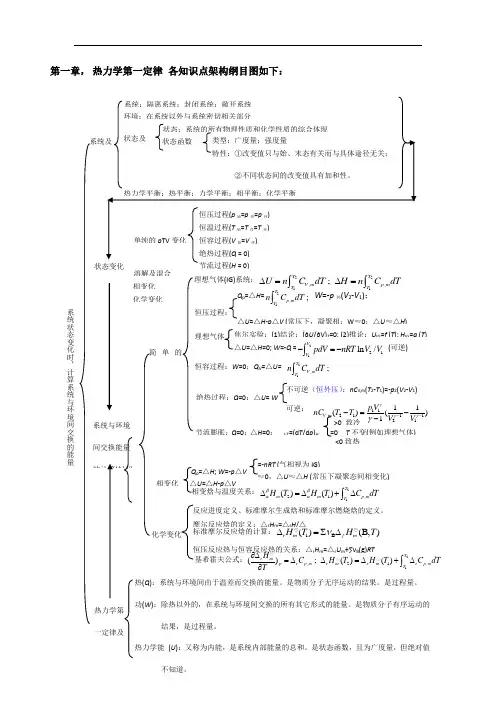
第一章, 热力学第一定律 各知识点架构纲目图如下:溶解及混合 化学变化 相变化热(Q ):系统与环境间由于温差而交换的能量。
是物质分子无序运动的结果。
是过程量。
功(W ):除热以外的,在系统与环境间交换的所有其它形式的能量。
是物质分子有序运动的结果,是过程量。
热力学能 (U ):又称为内能,是系统内部能量的总和。
是状态函数,且为广度量,但绝对值不知道。
热力学第 一定律及系统与环境间交换能量 的计算(封闭 简单的理想气体(IG)系统:2211,,;T TV m p m T T U n C dT H n C dT ∆=∆=⎰⎰理想气体 焦尔实验:(1)结论:(∂U /∂V)T =0; (2)推论:U IG =f (T ); H IG =g (T )△U =△H =0; W =-Q =2121ln /V V pdV nRT V V -=-⎰ (可逆)恒容过程:W =0;Q V =△U= 21,;TV mT n C dT ⎰ 绝热过程:Q =0;△U = W不可逆(恒外压):nC V,m (T 2-T 1)=-p 2(V 2-V 1)可逆: 11,21112111()()1V m p V nC T T V V γγγγ---=-- Q p =△H =21,;T p m T n C dT ⎰W =-p 外(V 2-V 1); △U =△H -p △V (常压下,凝聚相:W ≈0;△U ≈△H ) 恒压过程:节流膨胀:Q =0;△H =0;J-T =(d T /d p )H =0 T 不变(例如理想气体) <0致热>0 致冷 相变化 △U =△H -p △VQ p =△H ; W =-p △V ≈0,△U ≈△H (常压下凝聚态间相变化)=-nRT (气相视为IG) 相变焓与温度关系:2121,()()T m m p mT H T H T C dT ββαα∆=∆+∆⎰化学变化 摩尔反应焓的定义:△r H m =△r H /△ 恒压反应热与恒容反应热的关系:△r H m =△r U m +∑νB (g)RT 标准摩尔反应焓的计算:1B ()(B,)r m f m H T H T ν∆=∑∆反应进度定义、标准摩尔生成焓和标准摩尔燃烧焓的定义。


物理化学热力学第一定律知识点总结篇一:哇塞!同学们,你们知道吗?物理化学中的热力学第一定律可太神奇啦!先来说说什么是热力学第一定律吧。
就好像我们存钱,赚的钱加上原来有的钱,减去花掉的钱,剩下的就是我们现在拥有的钱。
在热力学里呀,能量也是这样!系统从外界吸收的热量,加上系统内能的增加量,就等于系统对外界所做的功。
这是不是有点像一个能量的“账本”?比如说,我们骑自行车。
我们用力蹬车,就相当于给车子输入了能量,这就好比系统从外界吸收热量。
车子跑得越来越快,动能增加,这就好像系统内能增加啦。
而车子克服阻力前进,这就是系统对外做功。
再想想冬天我们取暖的暖手宝。
插上电,暖手宝吸收电能转化为热能,我们握着它感觉越来越暖和,这不就是能量的转化和传递嘛!还有哦,老师给我们讲过一个实验。
一个封闭的容器里有气体,我们对气体加热,气体的温度升高,内能增加,同时气体膨胀推动活塞做功。
这难道不神奇吗?这不就完美地体现了热力学第一定律嘛!我和同桌讨论这个的时候,他还一脸迷糊呢!我就跟他说:“你想想啊,要是没有能量的输入和转化,这世界得多无聊啊!”他听了,恍然大悟地点点头。
在我们日常生活中,到处都有热力学第一定律的影子。
像汽车发动机燃烧汽油产生动力,发电厂利用燃料发电,甚至我们吃饭获得能量来活动,都是遵循这个定律的呀!所以说,热力学第一定律真的超级重要!它让我们明白了能量是不会凭空产生和消失的,只会从一种形式转化为另一种形式。
我们一定要好好学习它,这样才能更好地理解这个神奇的世界!篇二:哇塞!同学们,你们知道吗?物理化学里的热力学第一定律可太神奇啦!咱们先来说说什么是热力学第一定律。
就好像我们兜里的零花钱,花出去多少,剩下多少,总得有个说法吧?热力学第一定律就是这么个道理!它说的是能量不会凭空产生,也不会凭空消失,只会从一种形式转化成另一种形式。
这就好比我们玩的积木,从搭成小房子变成搭成小汽车,积木的数量可一点儿没变,只是样子变啦!那怎么理解这个定律呢?想象一下,我们骑自行车,我们用力蹬车,消耗了身体里的能量,车就跑起来啦!这时候,身体里的化学能就变成了车的动能,这不就是能量的转化吗?再比如,冬天我们搓搓手,手会变热,这是因为摩擦产生了热能,这不也是能量在变来变去吗?老师给我们讲这个定律的时候,还举了好多例子。

物理化学上热力学第一定律知识框架图总结公司内部档案编码:[OPPTR-OPPT28-OPPTL98-OPPNN08]
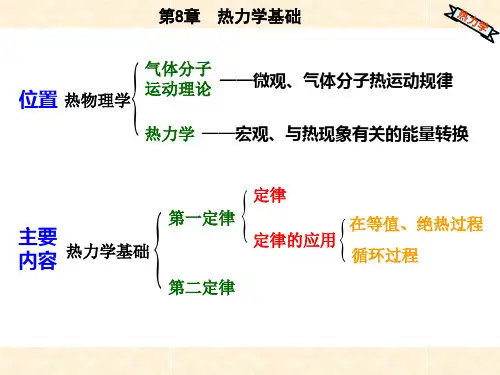
第一章, 热力学第一定律 各知识点架构纲目图如下:
溶解及混合
化学变
相变
热(Q ):系统与环境间由于温差而交换的能量。
是物质分子无序运动的结果。
是过程量。
功(W ):除热以外的,在系统与环境间交换的所有其它形式的
能量。
是物质分子有序运动的结果,是过程量。
热力学第
系统与环
境
简单的
理想气体(IG)系统:理想气焦尔实验:(1)结论:(U /V)T =0; (2)推△U =△H =0; W =-Q =21
21ln /V
V pdV nRT V V -=-⎰ 恒容过程:W =0;Q V =△U= 绝热过程:Q =0;△U = 不可逆(恒外压):nC V,m (T 2-T 1)=-p 2(V 2-V 1)
Q p =△H =21
,;T p m T n C dT ⎰W =-p 外(V 2-V 1); △U =△H -p △V (常压下,凝聚相:W ≈恒压过
节流膨胀:Q =0;△H =0;J-T =(d T /d p )H =0 T <0致>0 致相变化 △U =△H -p △Q p =△H ; W =-p △V
≈0,△U ≈△H (常压下凝聚
=-nRT (气相视
相变焓与温度关系:
化学变摩尔反应焓的定义:△恒压反应热与恒容反应热的关系:△r H m =标准摩尔反应焓的计算:
反应进度定义、标准摩尔生成焓和标准摩基希霍夫公式:
系统状态变化时,计算系统与环境。


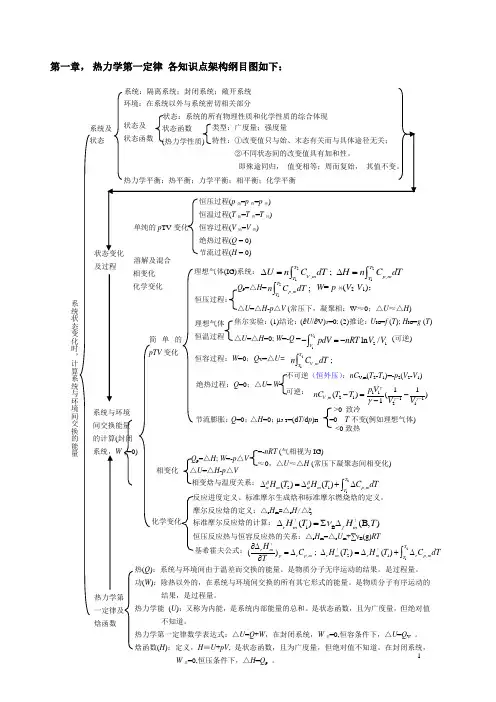
1第一章, 热力学第一定律 各知识点架构纲目图如下:及过程 溶解及混合 化学变化 相变化 热(Q ):系统与环境间由于温差而交换的能量。
是物质分子无序运动的结果。
是过程量。
功(W ):除热以外的,在系统与环境间交换的所有其它形式的能量。
是物质分子有序运动的结果,是过程量。
热力学能 (U ):又称为内能,是系统内部能量的总和。
是状态函数,且为广度量,但绝对值不知道。
热力学第一定律数学表达式:△U =Q +W ,在封闭系统,W 非=0,恒容条件下,△U =Q V 。
焓函数(H ):定义,H ≡U +pV , 是状态函数,且为广度量,但绝对值不知道。
在封闭系统,W 非=0,恒压条件下,△H =Q p 。
热力学第一定律及 焓函数系统与环境间交换能量 的计算(封闭 系统,W 非=0)简单的pTV 变化 理想气体(IG)系统:2211,,;T TV m p mT T U n C dT H n C dT ∆=∆=⎰⎰ 理想气体 恒温过程 焦尔实验:(1)结论:(∂U /∂V)T =0; (2)推论:U IG =f (T ); H IG =g (T ) △U =△H =0; W =-Q =2121ln /VVpdV nRT V V -=-⎰ (可逆)恒容过程:W =0;Q V =△U= 21,;TV mT n C dT ⎰绝热过程:Q =0;△U = W 不可逆(恒外压):nC V ,m (T 2-T 1)=-p 2(V 2-V 1) 可逆: 11,21112111()()1V m p V nC T T V V γγγγ---=-- Q p =△H =21,;T p m T n C dT ⎰W =-p 外(V 2-V 1); △U =△H -p △V (常压下,凝聚相:W ≈0;△U ≈△H )恒压过程: 节流膨胀:Q =0;△H =0;μJ-T =(d T /d p )H =0 T 不变(例如理想气体) <0致热 >0 致冷 相变化 △U =△H -p △VQ p =△H ; W =-p △V≈0,△U ≈△H (常压下凝聚态间相变化)=-nRT (气相视为IG) 相变焓与温度关系:2121,()()Tm m p mT H T H T C dT ββαα∆=∆+∆⎰化学变化 摩尔反应焓的定义:△r H m =△r H /△ξ 恒压反应热与恒容反应热的关系:△r H m =△r U m +∑νB (g)RT标准摩尔反应焓的计算:1B ()(B,)r m f mH T H T ν∆=∑∆!!反应进度定义、标准摩尔生成焓和标准摩尔燃烧焓的定义。

热一定律总结一、 通用公式ΔU = Q + W绝热: Q = 0,ΔU = W 恒容(W ’=0):W = 0,ΔU = Q V恒压(W ’=0):W =-p ΔV =-Δ(pV ),ΔU = Q -Δ(pV ) → ΔH = Q p 恒容+绝热(W ’=0) :ΔU = 0 恒压+绝热(W ’=0) :ΔH = 0焓的定义式:H = U + pV → ΔH = ΔU + Δ(pV )典型例题:3.11思考题第3题,第4题。
二、 理想气体的单纯pVT 变化恒温:ΔU = ΔH = 0变温: 或或 如恒容,ΔU = Q ,否则不一定相等。
如恒压,ΔH = Q ,否则不一定相等。
C p , m – C V , m = R双原子理想气体:C p , m = 7R /2, C V , m = 5R /2 单原子理想气体:C p , m = 5R /2, C V , m = 3R /2典型例题:3.18思考题第2,3,4题书2.18、2.19三、 凝聚态物质的ΔU 和ΔH 只和温度有关或典型例题:书2.15ΔU = n C V , md T T 2T1∫ ΔH = n C p, md T T2 T1∫ ΔU = nC V , m (T 2-T 1) ΔH = nC p, m (T 2-T 1)ΔU ≈ ΔH = nC p, m d T T 2T 1∫ΔU ≈ ΔH = nC p, m (T 2-T 1)四、可逆相变(一定温度T 和对应的p 下的相变,是恒压过程)ΔU ≈ ΔH –ΔnRT(Δn :气体摩尔数的变化量。
如凝聚态物质之间相变,如熔化、凝固、转晶等,则Δn = 0,ΔU ≈ ΔH 。
101.325 kPa 及其对应温度下的相变可以查表。
其它温度下的相变要设计状态函数不管是理想气体或凝聚态物质,ΔH 1和ΔH 3均仅为温度的函数,可以直接用C p,m计算。
或典型例题:3.18作业题第3题五、化学反应焓的计算其他温度:状态函数法Δ H m (T ) = ΔH 1 +Δ H m (T 0) + ΔH 3α ββ α Δ H m (T )α βΔH 1ΔH 3Δ H m (T 0)α β可逆相变298.15 K:ΔH = Q p = n Δ H m αβΔr H m ө =Δf H ө(生) – Δf H ө(反) = y Δf H m ө(Y) + z Δf H m ө(Z) – a Δf H m ө(A) – b Δf H m ө(B) Δr H m ө =Δc H ө(反) – Δc H ө(生) = a Δc H m ө(A) + b Δc H m ө(B) –y Δc H m ө(Y) – z Δc H m ө(Z)ΔH = nC p, m (T 2-T 1)ΔH = n C p, m d TT 2T1∫ΔU 和ΔH 的关系:ΔU = ΔH –ΔnRT (Δn :气体摩尔数的变化量。

1 热力学第一定律1.1 重点与难点严格区分状态函数与非状态函数(Q 、W ),并熟练掌握状态函数的数学特征 状态的定义,状态函数性质及数学特征。
体系始终态一旦确定,其状态函数改变量可通过设计途经而求算。
体系状态发生变化,其状态函数值可能发生变化,但并不一定全部状态函数都一定发生变化。
求算过程的热与功,不能随意设计途径。
唯有在特定条件下 Q,W 能与状态函数改变量相关联(如等压无其他功 Q p =ΔH ),才与途径无关。
体系状态函数具备五个数学特征。
1.1.1 热力学第一定律数学表达式及其在理想气体中的应用表达式()'V UQ W Q W W ∆=-=-+,只适用于封闭体系,随着条件变化,存在 ΔU 与 Q 、W 之间的转换关系。
一定量理想气体 U 和 H ,均决定于温度(但若有相变发生,或并非自始至终为理想气体,则不属此列)。
故它无论发生 p,V 怎样变化,只要有 T 变化,可直接引用2211T T vm pm T T U nC dTH nC dT∆=∆=⎰⎰或 。
弄清节流过程与绝热过程的区别。
明确理想气体绝热可逆过程方程与状态方程的实质;前者指某过程进行中各参量间的关系,后者指体系达平衡状态时各参量间的关系。
在 p ~V 图上绝热线的陡度比等温线的大,两线只能相交一点。
自同一始态出发,经绝热可逆与绝热不可逆过程是不能达到相同的终态,但计算绝热体积功时可用同一式:,1122,(1p m a V mC p V p V W C γγγ-==-为热容商,即)1.1.2 掌握比较热力学可逆过程与不可逆过程的定义,特点。
热力学第一定律在热化学中的应用热总值不变定律,意味着固定始终且指定同一条件(全部恒压,或全部恒容,决非恒压恒容混相)下,ΔH 或 ΔU 可自设计各步途径热值之加和而求算。
基尔霍夫(Kirchhoff)定律:()()2121T r m r m Tr pm H T H T C dT θθ∆=∆+⎰∆ 有积分号"∫"意指可逆,故中间若有相变,则另添加焓变值。
物理化学---知识点总结《物理化学学习要点》热⼒学第⼀定律⼀、本章框架⼆、本章要求1、了解热⼒学基本概念:系统、环境、功、热、平衡状态、状态函数、可逆过程等;2、明确热⼒学第⼀定律和热⼒学能的概念;3、明确焓、标准摩尔反应焓、标准摩尔⽣成焓和燃烧焓的定义;4、熟练掌握在理想⽓体单纯pVT 变化、相变化及化学变化过程中计算热、功、△U 、△H 的原理和⽅法;三、考核要求:1.热⼒学概论1.1 热⼒学的⽬的、内容和⽅法(了解) 1.2 热⼒学的⼀些基本概念1.2.1 体系与环境,体系的性质(理解)温过程压过程容过程 pVT都变化过程热过程逆相变过程可逆相变过程准摩尔反应焓准摩尔燃烧焓准摩尔⽣成焓等温反应流膨胀1.2.2 热⼒学平衡态和状态函数(理解)2.热⼒学第⼀定律2.1 热和功(掌握)2.2 热⼒学能(掌握)2.3 热⼒学第⼀定律的表述与数学表达式(应⽤)3.体积功与可逆过程3.1 等温过程的体积功(应⽤)3.2 可逆过程与最⼤功(理解)4.焓与热容4.1 焓的定义(了解)4.2 焓变与等压热的关系(应⽤)4.3 等压热容和等容热容(理解)5.热⼒学第⼀定律对理想⽓体的应⽤5.1 理想⽓体的热⼒学能和焓(掌握)5.2 理想⽓体的C p与C v之差(理解)5.3 理想⽓体的绝热过程(掌握)6.热⼒学第⼀定律对实际⽓体的应⽤6.1 节流膨胀与焦⽿-汤姆逊效应(了解)7.热⼒学第⼀定律对相变过程的应⽤(掌握)8.化学热⼒学8.1 化学反应热效应8.1.1 等压热效应与等容热效应(掌握)8.1.2 反应进度(了解)8.2 赫斯定律与常温下反应热效应的计算8.2.1 赫斯定律(应⽤)8.2.2 标准摩尔⽣成焓与标准摩尔燃烧焓(掌握)8.3 标准反应焓变与温度的关系—基尔霍夫定律(应⽤)四、重要概念1、系统与环境;2、隔离系统、封闭系统、敞开系统;注意:隔离系统Q=0,W=03、⼴度性质(加和性:V ,U ,H ,S ,A ,G )强度性质(物质的量,T ,p ); 4、功W 和热Q ;注意W 与Q 的符号;W 与Q 均为途径函数(⾮状态函数) 5、热⼒学能; 6、焓; 7、热容;8、状态与状态函数; 9、平衡态; 10、可逆过程;11、节流过程; 12、真空膨胀过程; 13、标准态;14、标准摩尔反应焓,标准摩尔⽣成焓,标准摩尔燃烧焓五、重要公式与适⽤条件1. 体积功:W = -p 外dV (封闭系统,计算体积功)2. 热⼒学第⼀定律:? U = Q +W , d U =Q +W (封闭系统) 3.焓的定义: H =U + pV4.热容:定容摩尔热容 C V ,m =Q V /dT =(? U m /? T )V 定压摩尔热容 C p ,m = Q p /dT =(? H m /? T )P 理想⽓体:C p ,m - C V ,m =R ;凝聚态:C p ,m - C V ,m ≈0理想单原⼦⽓体C V ,m =3R /2,C p ,m = C V ,m +R =5R /2 5. 标准摩尔反应焓:由标准摩尔⽣成焓?f H B (T )或标准摩尔燃烧焓?c H B (T )计算 ? r H m = ∑ v B ? f H B (T )= -∑ v B ? c H B (T )6. 基希霍夫公式(适⽤于相变和化学反应过程)r H m(T 2)= ? r H m(T 1)+21T r pm T C dT7. 等压摩尔反应热与等容摩尔反应热的关系式Q p -Q V = ? r H m (T )-? r U m (T )=∑ v B (g )RT 8. 理想⽓体的可逆绝热过程⽅程:γγ2211V P V P = 122111--=γγV T V T γγγγ/)1(22/)1(11-=-P T P Tγ=Cvm Cpm /六、各种过程Q 、W 、? U 、? H 的计算1、理想⽓体:等温过程dT =0, ? U =? H =0, Q =W ;⾮等温过程,? U = n C V ,m ? T , ? H = n C p ,m ? T ,单原⼦⽓体C V ,m =3R /2,C p ,m = C V ,m +R = 5R /2 2、对于凝聚相,状态函数通常近似认为与温度有关,⽽与压⼒或体积⽆关,即 ? U ≈? H = n C p ,m ? T3.等压过程:p 外=p =常数,⾮体积功为零W '=0 (1) W = -p 外(V 2-V 1), ? H = Q p =dTnC T Tm p ?2,, ? U =? H -?(pV ),Q =? U -W(2)真空膨胀过程p 外=0,W =0,Q =? U理想⽓体结果:d T =0,W =0,Q =? U =0,? H =0 (3)等外压过程:W = -p 外(V 2-V 1) 4. 等容过程:d V =0 W =0,Q V =? U =dTnC T Tm v ?2,, ? H =? U +V ? p5.绝热过程:Q =0 (1)绝热可逆过程 W =dVp T T ?2= ? U =dTnC T Tm v ?2,,? H =? U +? pV理想⽓体:γγ2211V P V P = 122111--=γγV T V T γγγγ/)1(22/)1(11-=-P T P T(2)绝热⼀般过程:由⽅程WdVp T T外2= ? U = dTnC T Tm v ?2, 建⽴⽅程求解。
第一章,热力学第一定律各知识点架构纲目图如下:
系统:隔离系统;封闭系统;敞开系统
环境:在系统以外与系统密切相关部分
状态:系统的所有物理性质和化学性质的综合体现系统及状态及状态函数类型:广度量;强度量
状态状态函数
(热力学性质 ) 特性:①改变值只与始、末态有关而与具体途径无关;
②不同状态间的改变值具有加和性。
即殊途同归,值变相等;周而复始,其值不变。
热力学平衡:热平衡;力学平衡;相平衡;化学平衡
单纯的 pTV 变化
状态变化
溶解及混合
及过程
相变化
化学变化
系
统
状
态
变
简单的化
时
pTV 变化,
计
算
系
统
与
环
境
系统与环境
间
交间交换能量
换
的计算 (封闭
的
能
恒压过程 (p 始 =p 终 =p 环 )
恒温过程 (T 始=T 终=T 环 )
恒容过程 (V 始=V 终)
绝热过程 (Q = 0)
节流过程 (H = 0)
理想气体 (IG) 系统:U T2 C V ,m dT ; H n T2
n C p,m dT
T2 T1 T1
Q p =△ H= n C p ,m dT ;W=-p外(V2-V1);
恒压过程:T1
△U=△ H -p△ V ( 常压下,凝聚相: W ≈ 0;△ U≈△ H)
理想气体焦尔实验: (1)结论: (?U/?V) T=0; (2)推论: U IG=f ( T); H IG=g (T) 恒温过程
△U=△H=0; W=-Q =
V2
nRT lnV2 /V1 (可逆 )
V pdV
1
恒容过程:W=0; Q V =△ U=
T2
n C V ,m dT ;
T1
绝热过程: Q=0;△ U= W
不可逆(恒外压):nC V,m( T2 -T1)=- p2(V2-V1)
可逆:p1V1 1 1
T1 ) (
nC V , m (T2
1
1 1 )
>0
V 2 V1
致冷
节流膨胀: Q=0 ;△H=0;J-T=(d T/dp) H =0 T 不变 ( 例如理想气体 )
<0 致热
量系统, W 非 =0)
相变化Q p =△ H; W=-p△V
△U= △H- p△ V
=-nRT (气相视为IG)
≈0,△ U≈△ H (常压下凝聚态间相变化)
相变焓与温度关系:T2
H m (T2 )H m (T1 ) C p,m dT
T1
热力学第一定律及焓函数
反应进度定义、标准摩尔生成焓和标准摩尔燃烧焓的定义。
摩尔反应焓的定义:△r H m=△ r H/△
化学变化
标准摩尔反应焓的计算:
!
B
!
r H m (T1 ) f H m (B, T )
恒压反应热与恒容反应热的关系:△r H m=△ r U m+∑νB(g)RT
!
T2
基希霍夫公式:( r H m ) C ; H ! (T ) H ! (T ) C dT
p r r r p, m
T r p ,m m 2 m 1 T1
热(Q):系统与环境间由于温差而交换的能量。
是物质分子无序运动的结果。
是过程量。
功
(W) :除热以外的,在系统与环境间交换的所有其它形式的能量。
是物质分子有序运动的
结果,是过程量。
热力学能 (U):又称为内能,是系统内部能量的总和。
是状态函数,且为广度量,但绝对值不知道。
热力学第一定律数学表达式:△ U=Q+W,在封闭系统, W 非 =0,恒容条件下,△ U=Q V。
焓函数 (H):定义, H≡ U+pV, 是状态函数,且为广度量,但绝对值不知道。
在封闭系统,
1 W非 =0,恒压条件下,△H=Q p。