氯气的实验室制法及氯离子的检验-人教版高一化学寒假作业
- 格式:doc
- 大小:250.50 KB
- 文档页数:8

课时作业13 氯气的试验室制法氯离子的检验[学业达标]1.试验室制取氯气后,产生的尾气选用下列哪种方法处理最好( )2.为了证明氯酸钾晶体中含有氯元素,选用下面给出的试剂和操作进行验证。
其操作依次正确的是( )①滴加AgNO3溶液②加水溶解③过滤、取滤液④与二氧化锰混合加热⑤加稀硝酸⑥与浓盐酸反应⑦与NaOH溶液混合加热A.⑥⑦①⑤B.⑥⑦C.④②③①⑤ D.②①⑤3.(双选)利用下列装置可以制备无水氯化铁。
下列有关说法正确的是( )A.烧瓶B中制备氯气的反应物为二氧化锰和稀盐酸B.装置C、D中分别盛有浓硫酸、饱和食盐水C.装置E和装置F之间须要增加一个干燥装置,才能制得无水氯化铁D.装置F是尾气汲取装置4.[2024·河北正定段考](双选)某同学用以下装置制备并检验Cl2的性质。
下列说法不正确的是( )A.Ⅰ图:若MnO 2过量,则浓盐酸可全部消耗完B .Ⅱ图:证明新制氯水具有酸性和漂白性C .Ⅲ图:产生了棕黄色的烟雾D .Ⅳ图:验证Cl 2无漂白性5.[2024·重庆云阳中学高一检测]下列关于试验室用二氧化锰和浓盐酸制取氯气的说法中错误的是( )A .该反应是一个氧化还原反应,其中二氧化锰是氧化剂B .HCl 表现还原性和酸性C .该反应的离子方程式为MnO 2+4H ++4Cl -=====△MnCl 2+2H 2O +Cl 2↑D .该方法是瑞典化学家舍勒最先发觉的6.[2024·三亚一中高一检测]试验室用下列两种方法制氯气:①用含HCl 146 g 的浓盐酸与足量的MnO 2反应;②用87 g MnO 2与足量浓盐酸反应。
所得的氯气( )A .①比②多B .②比①多C .一样多D .无法比较7.检验氯化氢气体中是否混有Cl 2,可采纳的方法是( )A.用干燥的蓝色石蕊试纸检验B .用干燥有色布条检验C .将气体通入硝酸银溶液检验D .用潮湿的淀粉KI 试纸检验8.现有盐酸、NaCl 溶液、NaOH 溶液和新制氯水,可用来区分它们的一种试剂是( )A .AgNO 3溶液B .酚酞溶液C.紫色石蕊溶液 D.饱和食盐水9.下列关于试验室制取氯气的说法正确的是( )A.盛浓盐酸的分液漏斗可用长颈漏斗代替B.为了便于学生视察氯气的制备试验,可在讲台上干脆做氯气的制备试验C.可用饱和食盐水汲取尾气D.可在集气瓶口放一张潮湿的淀粉碘化钾试纸,视察氯气是否收集满10.已知KMnO4在常温下与浓盐酸反应生成Cl2,下图是用KMnO4与浓盐酸反应制取Cl2的简易装置,下列叙述不正确的是( )A.在试管①中盛有饱和食盐水,用试管②收集Cl2B.用试管①收集Cl2,试管②可防止NaOH溶液倒吸到试管①中C.③用于汲取多余的Cl2,防止污染环境D.用该装置收集到的Cl2中会混有HCl气体和水蒸气11.已知KMnO4与浓盐酸在常温下反应能产生Cl2。
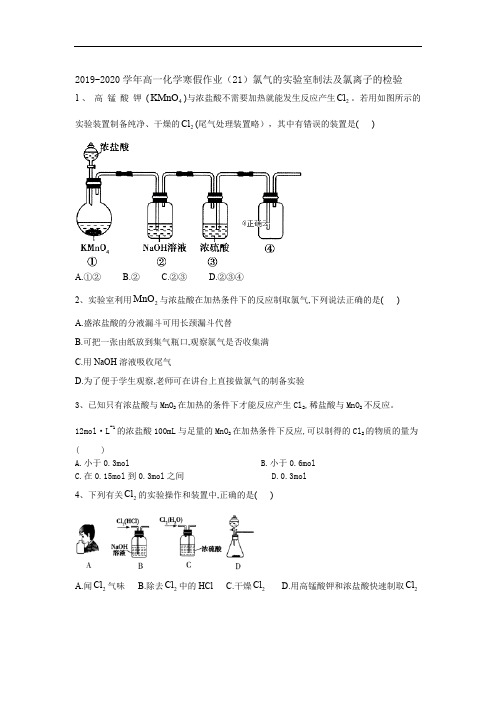
2019-2020学年高一化学寒假作业(21)氯气的实验室制法及氯离子的检验1、高锰酸钾(4KMnO )与浓盐酸不需要加热就能发生反应产生2Cl 。
若用如图所示的实验装置制备纯净、干燥的2Cl (尾气处理装置略),其中有错误的装置是( )A.①②B.②C.②③D.②③④2、实验室利用2MnO 与浓盐酸在加热条件下的反应制取氯气,下列说法正确的是( ) A.盛浓盐酸的分液漏斗可用长颈漏斗代替B.可把一张由纸放到集气瓶口,观察氯气是否收集满C.用NaOH 溶液吸收尾气D.为了便于学生观察,老师可在讲台上直接做氯气的制备实验3、已知只有浓盐酸与MnO 2在加热的条件下才能反应产生Cl 2,稀盐酸与MnO 2不反应。
12mol·L -1的浓盐酸100mL 与足量的MnO 2在加热条件下反应,可以制得的Cl 2的物质的量为( )A.小于0.3molB.小于0.6molC.在0.15mol 到0.3mol 之间D.0.3mol 4、下列有关2Cl 的实验操作和装置中,正确的是( )A.闻2Cl 气味B.除去2Cl 中的HClC.干燥2ClD.用高锰酸钾和浓盐酸快速制取2Cl5、实验室制备2Cl 时有如下操作:①连好装置,检查气密性;②缓缓加热;③加入2MnO 粉末;④向分液漏斗中加入浓盐酸;⑤多余的氯气用氢氧化钠溶液吸收;⑥用向上排空气法收集氯气。
下列操作顺序正确的是( ) A.①②③④⑤⑥ B.③④②①⑥⑤ C.①④③②⑥⑤ D.①③④②⑥⑤6、某实验小组要进行Cl 2的制取并回收MnCl 2的实验.下列装置能达到实验目的的是( )A.用装置甲制取Cl 2B.用装置乙出去Cl 2中的少量HCl 气体C.用装置丙分离MnO 2和MnCl 2溶液D.用装置丁蒸干MnCl 2溶液制MnCl 2 •4H 2O7、检验-Cl 所用的试剂为3AgNO 溶液和稀硝酸,稀硝酸的作用是( )A.防止2-3CO 等离子的干扰B.防止-Cl 的干扰 C.生成3AgNO 沉淀 D.防止-3NO 的干扰8、下列检验-Cl 的方法正确的是( )A.在某溶液中滴加3AgNO 溶液,若产生白色沉淀说明该溶液中有-ClB.在某溶液中先滴加盐酸,再滴加3AgNO 溶液,若产生白色沉淀,说明溶液中有-ClC.在某溶液中先滴加3AgNO 溶液,产生白色沉淀,再滴加盐酸,沉淀不消失,说明溶液中有-ClD.在某溶液中滴加用HNO 3酸化的3AgNO 溶液,若产生白色沉淀,说明溶液中有-Cl9、广州的自来水是采用氯气消毒的,为了检验Cl -的存在,最好选用下列物质中的( )A.石蕊溶液B.四氯化碳C.氢氧化钠溶液D.稀硝酸和硝酸银溶液10、下述实验现象能确定试样中一定有Cl-的是()A.滴加AgNO3溶液有白色沉淀B.滴加硝酸酸化的Ba(NO3)2有白色沉淀C.滴加硝酸酸化的AgNO3溶液有白色沉淀 D.滴加硫酸酸化的AgNO3溶液有白色沉淀11、能证明某溶液中含有NaCl的是( )A.焰色反应是黄色B.溶液有咸味C.取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀D.焰色反应是黄色,同时又能与稀硝酸酸化的硝酸银溶液反应生成白色沉淀12、化学反应的利用是化学研究的重要内容。
2021-2022学年高一化学人教版(2019)必修第一册同步课时作业2.2.2氯气的实验室制法及氯离子的检验一.选择题(共有14题)1.如图为实验室制取干燥、纯净的Cl2的装置,其中合理的是(气体流向从左到右)( )A.制Cl2B.净化Cl2C.收集Cl2D.尾气处理2.实验室制氯气时有如下操作,操作顺序正确的是( )①连接好装置,检查气密性②缓缓加热③在烧瓶中加入少量的MnO,向分液漏斗中加入浓盐酸2④通过分液漏斗慢慢向烧瓶中注入浓盐酸⑤将多余氯气用浓NaOH溶液吸收⑥当有连续气泡出现时,开始用向上排空气法收集氯气A.①②③④⑤⑥B.③④②①⑥⑤C.①④③②⑥⑤D.①③④②⑥⑤3.下列方法能证明某溶液中含有氯化钠的是( ) A.焰色试验是黄色 B.溶液有咸味C.取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀D.焰色试验是黄色,同时又能与硝酸酸化的硝酸银溶液反应生成白色沉淀4.某溶液中含有大量的23Cl CO OH ---、、种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序中,正确的是( ) ①滴加过量()32Ba NO 溶液 ②过滤③滴加过量()32Mg NO 溶液 ④滴加3AgNO 溶液 A.①②④②③ B.④②①②③ C.①②③②④ D.④②③②①5.如图是用3KClO 与浓盐酸反应制取氯气的简易装置。
下列说法正确的是( )A.A 中固体也可以用高锰酸钾、重铬酸钾、二氧化锰等代替B.装置A 发生反应的化学方程式为322KClO 6HCl()3Cl KCl 3H O +↑++浓C.待没有气泡产生后,向A 中加入足量3AgNO 溶液,根据沉淀质量可求出剩余HCl 的量D.装置A 中分液漏斗可以换为长颈漏斗6.有23Na CO 、3AgNO 、2BaCl 、HCl 及43NH NO 五种无标签溶液,为鉴别它们,取四支试管分别装入一种溶液,向上述四支试管中加入少许剩下的一种溶液,下列结论错误的是( )A.若有三支试管出现沉淀,则最后加入的是3AgNO 溶液B.若全部没有明显现象,则最后加入的是43NH NO 溶液C.若一支试管出现气体,两支试管出现沉淀,则最后加入的是HCl 溶液D.若只有两支试管出现沉淀,则最后加入的可能是2BaCl 溶液 7.用如图各装置制备并检验2Cl 的性质,下列说法正确的是( )A.甲:实验室制氯气,即使2MnO 过量,盐酸也不能全部反应完B.乙:充分光照后,溶液充满量筒C.丙:生成蓝色的烟,若在集气瓶中加入足量水,所得溶液呈绿色D.丁:干燥的有色布条不褪色,湿润的有色布条褪色,说明2Cl ,有漂白性 8.下列有关实验的操作正确的是( ) 选项 实验 操作A 配制稀硫酸先将浓硫酸加入烧杯中,后倒人蒸馏水B 排水法收集4KMnO 分解产生的2O 先熄灭酒精灯,后移出导管C 浓盐酸与2MnO 反应制备纯净2Cl气体产物先通过浓硫酸,后通过饱和食盐水 D4CCI 萃取碘水中的2I先从分液漏斗下口放出有机层,后从上口倒出水层A.AB.BC.CD.D9.自来水厂常用2Cl 消毒,市场上有的不法商贩用自来水充当纯净水出售,下列可用来鉴别自来水和纯净水的试剂是( )A.()2Ba ClO 溶液B.KOH 溶液C.酚酞试液D.3AgNO 溶液10.下列说法正确的是( )①向某溶液中加盐酸,有能使澄清石灰水变浑浊的气体生成,则原溶液中有2-3CO②向某溶液中加氯化钡溶液,生成白色沉淀,再加盐酸沉淀不溶解,则原溶液中有2-4SO ③向某溶液中加硝酸银溶液,生成白色沉淀,则原溶液中有-Cl A.①②B.①③C.②③D.都不正确11.氯仿(3CHCl )可用作麻醉剂,常因保存不慎而被空气氧化,产生剧毒物质2COCl (光气)和氯化氢,为了防止事故发生,使用前要检验氯仿是否变质,所选用的检验试剂可以是( ) A.水B.硝酸银溶液C.氢氧化钠溶液D.碘化钾溶液12.检验氯化氢气体中是否混有2Cl ,可采用的方法是( ) A.用干燥的蓝色石蕊试纸 B.用干燥的有色布条 C.将气体通入硝酸银溶液 D.用湿润的淀粉碘化钾试纸13.下列关于氯气制备的叙述正确的是( )A.通常情况下氯气比空气重,可以用向上排空气法收集2ClB.氯气能溶于水,因此不能用排液体的方法收集C.常用干燥的淀粉碘化钾试纸检验氯气D.液氯可存贮于钢瓶中,因此氯水也可贮存于钢瓶中 14.检验某溶液中是否含有-Cl ,正确的操作是( ) A.取样,滴加3AgNO 溶液,看是否有白色沉淀生成B.取样,先加盐酸酸化,再加入3AgNO 溶液,看是否有白色沉淀生成C.取样,先加稀硫酸酸化,再加入3AgNO 溶液,看是否有白色沉淀生成D.取样,加少量3AgNO 溶液,有白色沉淀;再加稀硝酸,看白色沉淀是否消失二.非选择题(共有2题)15.某校化学实验兴趣小组欲采用如图所示的实验装置制备2Cl ,同时进行与氯气有关的某些实验,按要求回答问题。



第2课时 氯气的实验室制法 氯离子的检验一、氯气的制法氯气的实验室制法(1)反应原理:实验室用MnO 2和浓盐酸加热反应制取Cl 2,反应的化学方程式为MnO 2+4HCl(浓)=====△ MnCl 2+Cl 2↑+2H 2O ,离子方程式为MnO 2+4H ++2Cl -=====△ Mn 2++Cl 2↑+2H 2O 。
(2)实验装置装置A B C 作用制备氯气 收集氯气 尾气吸收 仪器名称仪器a 的名称分液漏斗 / 仪器b 的名称圆底烧瓶 (1)Cl 2的收集方法是向上排空气法。
(2)尾气吸收:利用NaOH 溶液吸收多余的Cl 2、以防污染环境。
二、Cl -的检验实验探究实验现象 离子方程式加入AgNO 3溶加入稀硝酸液稀盐酸产生白色沉淀沉淀不溶解Ag++Cl===AgCl↓NaCl溶液产生白色沉淀沉淀不溶解Ag++Cl===AgCl↓Na2CO3溶液产生白色沉淀沉淀溶解,放出无色气体2Ag++23CO ===Ag2CO3↓、Ag2CO3+2H+===2Ag++CO2↑+H2O氯离子的检验方法1.判断下列说法是否正确:(1)制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体。
(×)提示:饱和NaHCO3溶液与Cl2反应生成CO2,引入新杂质。
(2)尾气Cl2可以用澄清石灰水吸收。
(×)提示:澄清石灰水的浓度太小。
(3)Cl2中的HCl可以通过NaOH溶液除去。
(×)提示:Cl2也能与NaOH溶液反应。
(4)溶液中加AgNO3溶液,有白色沉淀产生,说明溶液中一定含Cl-或CO2-3。
(×)提示:加AgNO3溶液能够产生白色沉淀的离子除Cl-、CO2-3外,还有OH-等离子。
2.阅读教材“方法导引”,归纳总结实验室制取气体装置的设计模型。
提示:3.家中有一碗水,姐姐说是蒸馏水,弟弟说是盐水,想一想如何证明这碗水是否含有NaCl?提示:利用焰色试验为黄色证明Na +的存在;加入硝酸酸化的硝酸银溶液生成白色沉淀,证明Cl -的存在。
4.2.2氯气的实验室制法及氯离子的检验1.在制氯气时有如下操作:操作顺序正确的是( )①连接好装置,检查气密性②缓缓加热,加快反应,使气体均匀逸出③在圆底烧瓶中加入二氧化锰粉末④从盛有浓盐酸的分液漏斗中将浓盐酸缓缓滴入烧瓶中⑤将多余的Cl2用NaOH溶液吸收⑥用向上排空气法收集氯气A.①②③④⑤⑥B.③④②①⑥⑤C.①③④②⑥⑤ D.①③②④⑥⑤解析实验室制取气体的操作顺序应注意:①连接好装置后,要先检查气密性,后装药品;②装药品的顺序是先加固体,后加液体;③对于有毒的气体,一定要有尾气处理装置。
答案 C2.在未知溶液中加入硝酸银溶液,有白色沉淀生成;加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成;将气体通入澄清石灰水中,石灰水变浑浊。
由此判断溶液中含有( )A. Cl-、SO2-4B. Cl-、NO-3C. Cl-、CO2-3D. Cl-、OH-解析加入硝酸银溶液,有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,说明沉淀中含AgCl,原溶液含Cl-;将无色无味气体通入澄清石灰水,石灰水变浑浊,说明该气体为CO2,说明原溶液中含CO2-3。
答案 C3.氯在自然界中以化合物形态存在,18世纪70年代,首先发现并制得氯气的化学家是( )A.汉弗莱·戴维B.舍勒C.阿伏加德罗D.侯德榜答案 B4.在MgCl2、( )、Ca(ClO)2、HClO2、KClO3、Cl2O7当中,氯元素的化合价是有规律排列的,括号内应填入的物质是( )A.Cl2B.HClC.HClO D.Cl2O3解析MgCl2中Cl为-1价,Ca(ClO)2中Cl为+1价,HClO2中Cl化合价为+3价,KClO3中Cl为+5价,Cl2O7中Cl为+7价,则化合价由低至高排列,故选A项。
答案 A。
第2课时氯气的实验室制法及氯离子的检验基础过关练题组一氯气的实验室制法1.(江苏如皋中学高一期末)下列氯气的制取、净化、收集并验证其某些性质的装置和原理能达到实验目的的是( )2.(辽宁辽南协作体高一上期中)某化学兴趣小组欲在实验室探究氯气的氧化性并模拟工业制取漂白粉,设计如图装置进行实验:(1)圆底烧瓶中发生反应的离子方程式为。
(2)装置的连接顺序为(填接口字母)。
(3)饱和NaCl溶液的作用是,淀粉KI溶液中的现象为。
(4)与石灰乳反应制取漂白粉的化学方程式为,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是。
3.(2019湖南衡阳八中高一上期末)纯净干燥的氯气与熔融金属锡反应可制备SnCl4,某化学小组的同学设计了如下实验装置进行制备。
已知:①金属锡熔点为231 ℃,化学性质活泼,在加热条件下可与氧气反应;②SnCl4的沸点为114 ℃;③SnCl4易与水反应。
请根据上图装置回答下列问题:(1)装置Ⅳ中发生反应的化学方程式为。
(2)装置Ⅱ中的试剂是,装置Ⅴ的作用是。
(3)装置Ⅵ最好选用下列装置中的(填标号)。
(4)实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的分离方法是。
(5)为了顺利完成实验,点燃酒精灯的正确操作是(填字母)。
A.先点燃Ⅰ处酒精灯,后点燃Ⅳ处酒精灯B.先点燃Ⅳ处酒精灯,后点燃Ⅰ处酒精灯C.同时点燃Ⅰ、Ⅳ两处酒精灯题组二氯离子的检验4.检验某未知溶液中是否含有氯离子(Cl-),正确的操作是( )A.向未知溶液中加入AgNO3溶液,有白色沉淀产生B.向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失C.向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生D.向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生5.自来水常用Cl2杀菌消毒,不法商贩用自来水冒充蒸馏水出售,为辨真伪,可用下列哪一种试剂鉴别( )A.酚酞溶液B.FeCl3溶液C.AgNO3溶液D.NaOH溶液6.有一包白色固体,它的成分可能是KCl、K2CO3、KNO3中的一种或几种,进行下列实验:①溶于水,得到无色溶液;②在所得溶液中滴入AgNO3溶液,生成白色沉淀;③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成。
氯气的制取1.下列叙述正确的是( )A.氯气的性质很活泼,它与氢气混合后立即发生爆炸B.可以用氢氧化钙溶液吸收实验室制取氯气时多余的氯气C.检验Cl2中是否混有HCl方法是将气体通入硝酸银溶液D.除去Cl2中的HCl气体,可将气体通入饱和食盐水【答案】D【解析】氯气与氢气混合只有点燃或强光照射才会发生反应甚至爆炸,A项错误;由于氢氧化钙的溶解度比较小,所以实验室制取氯气时,多余的氯气不用氢氧化钙溶液吸收,而是用氢氧化钠溶液吸收,B项错误;Cl2溶于水也会产生Cl-,所以C项错误;HCl气体易溶于水,也易溶于饱和食盐水,而Cl2在饱和食盐水中的溶解度极小,D项正确。
2.下列离子方程式错误的是( )A.实验室制Cl2:MnO2+4H++2Cl-Mn2++Cl2↑+2H2OB.在NaCl溶液中滴入AgNO3试液:Ag++Cl-===AgCl↓C.Cl2溶于水:Cl2+H2O===2H++Cl-+ClO-D.用NaOH溶液吸收Cl2∶Cl2+2OH-===Cl-+ClO-+H2O【答案】C【解析】本题中HClO是弱电解质应写成分子形式,C项错误。
3.检验某未知溶液中是否含有氯离子(Cl-),正确的操作是( )A.向未知溶液中加入AgNO3溶液,有白色沉淀产生B.向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失C.向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生D.向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生【答案】C【解析】A操作不正确,它不能排除CO2-3的干扰;B操作不正确,因为Ag2CO3跟HCl反应时,生成的AgCl仍是白色沉淀;C操作正确;D操作用盐酸酸化,加入了Cl-,无法确定原溶液中是否有Cl-。
4.某同学用下列装置制备并进行有关Cl2的实验。
下列说法中正确的是( )A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗B.Ⅱ图中:闻Cl2的气味C.Ⅲ图中:生成蓝色的烟D.Ⅳ图中:若气球干瘪,证明Cl2可与NaOH反应【答案】B【解析】MnO2与浓盐酸反应时,会出现酸变稀而导致反应中止的情况,因此A中浓盐酸不可能全部消耗;Cl2有毒,闻其气味时应用手轻轻在瓶口扇动,仅使极少量气体飘入鼻中;Cu丝在Cl2中燃烧生成棕黄色烟;若Cl2能与NaOH溶液反应,瓶内压强减小,气球就会鼓起。
2019-2020学年人教版(2019)高一化学寒假作业(10)氯气的实验室制法及氯离子的检验1、实验室制备2Cl 时有如下操作:①连好装置,检查气密性;②缓缓加热;③加入2MnO 粉末;④向分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中;⑤多余的氯气用氢氧化钠溶液吸收;⑥用向上排空气法收集氯气。
下列操作顺序正确的是( )A.①②③④⑤⑥B.③④②①⑥⑤C.①④③②⑥⑤D.①③④②⑥⑤ 2、漂白粉的有效成分是( ) A .HClOB .HClC .Ca(ClO)2D .CaCl 23、氯仿(3CHCl )可用作麻醉剂,常因保存不慎而被空气氧化,产生剧毒物质2COCl (光气)和氯化氢,为了防止事故发生,使用前要检验氯仿是否变质,所选用的检验试剂可以是( ) A.水B.硝酸银溶液C.氢氧化钠溶液D.碘化钾溶液4、向某未知溶液中加入3AgNO 溶液,有白色沉淀生成;再加入足量稀硝酸后,沉淀部分溶解,且有无色无味的气体生成;将该气体通入澄清石灰水,澄清石灰水变浑浊,由此可判断出该未知溶液中含有( )A.-2-4Cl SO 、B.--3Cl NO 、C.-2-3Cl CO 、D.--Cl OH 、5、下列关于漂白粉和漂白液的说法中正确的是( ) A.漂白粉是纯净物,漂白液是混合物 B.漂白粉的有效成分是Ca(ClO)2C.工业上将氯气通入澄清石灰水中制取漂白粉D.漂白液的有效成分是Na 2O 26、NaCl 是一种化工原料,可以制备一系列物质(见下图)。
下列说法正确的是( )已知 :2NaCl+2H 2O2NaOH+H 2↑+Cl 2↑;NaCl+NH 3+CO 2+H 2O=NaHCO 3↓+NH 4Cl 。
A.25℃时, NaHCO3在水中的溶解度比Na2CO3的大B.图中所示转化反应都是氧化还原反应C.常温下,干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应D.H2与Cl2在点燃条件下反应时产生苍白色火焰并形成白雾7、下列物质能使干燥的蓝色石蕊试纸先变红后退色的是( )①氯气②液氯③新制的氯水④氯气的酒精溶液⑤盐酸⑥盐酸酸化的漂白粉溶液A.①②③B.①②③⑥C.③⑥D.②④⑤⑥8、氧气是无色无味的气体,但用氯酸钾与二氧化猛加热制得的气体却有异常的气味,将用这种方法制得的气体通入蒸馏水中,然后滴加含硝酸的硝酸银溶液,产生了白色沉淀。
根据上述事实,得出下列结论:①这种方法制得的气体不是纯净物,而是混合物;②这种方法制得的气体中含有氯元素;③这种方法制得的气体中至少有一种含氯元素的物质;④这种方法制氧气的实验中至少发生了两个化学反应。
以上结论正确的是( )A.①②③④B.①②C.①②③D.①③9、如图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )A.a—b—c—d—e—f—g—hB.a—e—d—c—b—h—i—gC.a—d—e—c一b—h—i—gD.a—c—b—d—e 一h—i—f10、碘在自然界中有很多存在形式,在地壳中主要以NaIO3形式存在,在海水中主要以I-形式存在,几种粒子与Cl2之间有以下转化关系:以下说法不正确的是( )A.①中发生的反应是2I-+Cl 2I2+2Cl-IO+6Cl-+6H+B.I-与过量Cl 2发生的反应是I-+3Cl2+3H2O-3C.以上反应中,氯气都体现氧化性,具体表现为氯元素由0价降低为-1价D.通过以上信息,可预测:若在加入淀粉的KI溶液中逐滴滴加氯水,不能观察到溶液变蓝的现象11、漂白粉在空气中容易变质的原因是( )A.CaCl2易吸收空气中的水分B.Ca(ClO)2易与盐酸反应C.Ca(ClO)2见光易分解D.Ca(ClO)2易与空气中的CO2和水作用12、下列关于氯及其化合物说法正确的是( )A.氯气溶于水的离子方程式:Cl2+H2O=2H++Cl-+ClO-B.洁厕灵不能与“84”消毒液混用,原因是两种溶液混合产生的HClO易分解C.漂白粉在空气中久置变质是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3D.氯气可以使湿润的有色布条褪色,实际起漂白作用的物质是次氯酸,而不是氯气13、用如图装置制备并检验Cl2的性质,下列说法正确的是( )A.图甲中:如果MnO2过量,浓盐酸能全部反应完B.图乙中:生成蓝色的烟,加入少量水,溶液呈红棕色C.图丙中:充分光照后,量筒中剩余气体约15 mL(条件相同)D.图丁中:干燥的有色布条不褪色.湿润的有色布条褪色14、实验室欲用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,所用仪器如图所示:(1)连接上述仪器的正确顺序(填各接口处的字母):_______接_______;_______接_______;_______接_______;_______接_______。
(2)装置中,饱和食盐水的作用是____________________________;NaOH溶液的作用是____________________________________。
(3)气体发生装置进行的反应的化学方程式为_______________________________;用化学方程式表示NaOH溶液的作用:________________________________________。
15、Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O(1)浓盐酸在反应中显示出来的性质是______(填写字母)A.只有还原性B.还原性和酸性C.只有氧化性D.氧化性和酸性⑵产生0.3mol Cl2,则转移的电子的物质的量为_________;⑶该反应中氧化产物与还原产物的质量比为__________;⑷用双线桥法表示该氧化还原反应中电子转移的方向和数目_____________________.(5)铊(Tl)盐与氰化钾(KCN)被列为A级危险品。
已知下列反应在一定条件下能够发生:①Tl3++2Ag=Tl++2Ag+,②Ag++Fe2+=Ag+Fe3+,③Fe+2Fe3+=3Fe2+,下列离子氧化性比较顺序正确的是________(填写字母)A.Tl3+>Fe3+>Ag+B.Fe3+>Ag+>Tl3+C.Tl+>Ag+>Fe2+D.Tl3+>Ag+>Fe3+答案以及解析1答案及解析: 答案:D解析:实验室制备氯气的实验步骤:连接好装置,检査气密性→在烧瓶中加入二氧化锰粉末→往分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中→缓缓加热,使气体均匀逸出→用向上排空气法收集氯气→尾气导入吸收剂中,故正确的操作顺序是①③④②⑥⑤,即选D 项。
2答案及解析: 答案:C 解析:3答案及解析: 答案:B解析:根据已有知识和题给信息可知,要检査3CHCl 是否变质,只要检验是否有HCl 生成即可。
HCl 溶于水得盐酸,含有氯离子,所以可用硝酸银溶液来检验。
4答案及解析: 答案:C解析:能使澄清石灰水变浑浊的无色无味气体应是2CO ,故该未知溶液中含有2-3CO ,又因为加入足量稀硝酸后沉淀部分溶解,故该未知溶液中除含有2-3CO 外,还含有-Cl 。
5答案及解析: 答案:B解析:A 项,漂白粉和漂白液都是混合物,错误;C 项,工业上,用氯气和石灰乳来制取漂白粉,错误;D 项,漂白液的有效成分为NaClO,错误。
6答案及解析: 答案:D解析:由题图转化关系可知,氯化钠溶液与氨气、二氧化碳反应析出碳酸氢钠,则25℃时,NaHCO 3在水中的溶解 度比Na 2CO 3的小,故A 错误;氯化钠和水、氨气、二氧化碳的反应以及碳酸氢钠的分解反应都不是氧化还原反应,故B 错误;3Cl 2+2Fe2FeCl 3,故C 错误;氢气与氯气反应时产生苍白色火焰并生成HCl,HCl与空气中的水蒸气形成盐酸小液滴,形成白雾,故D正确。
7答案及解析:答案:C解析:8答案及解析:答案:A解析:由“氧气是无色无味的气体,但用氯酸钾与二氧化锰加热制得的气体却有异常的气味”可知,制得的气体不是纯净物,而是混合物;将用这种方法制得的气体通入蒸馏水中,然后滴加含硝酸的硝酸银溶液,产生了白色沉淀,是因为氯离子与银离子反应生成了氯化银白色沉淀,则气体中含有氯元素,至少有一种含氯元素的物质;这种方法制氧气的实验中至少发生了两个化学反应。
9答案及解析:答案:B解析:装置连接顺序:制氯气、除杂(HCl、水蒸气)、反应制备FeCl3 ,尾气处理,注意洗气瓶中导管应“长进短出”。
10答案及解析:答案:D解析:①中碘离子被氯气氧化生成的X是单质碘,发生的反应是2I-+Cl2I2+2Cl-,A正确; 单质碘可以继续被氯气氧化为碘酸根离子,则I-与过量Cl2发生的反应是I-+3Cl2+3H2O IO3-+6Cl-+6H+,B正确;以上反应中,氯气都体现氧化性,具体表现为氯元素由0价降低为-1价,C正确;由题知,当加人适量Cl2时I-被氧化为I2,因此在加入淀粉的KI溶液中逐滴漓加氯水,能观察到溶液变蓝的现象D错误11答案及解析:答案:D解析:12答案及解析: 答案:D 解析:13答案及解析: 答案:D解析:二氧化锰只能与浓盐酸反应,当盐酸浓度降低时, 反应会停止,即盐酸不能完全反应,A 项错误;氯气与铜反 应生成棕黄色的烟,加少量水后所得溶液呈蓝色,B 项错 误;量筒中剩余气体约为10 mL ,C 项错误;干燥的氯气不 具有漂白性,氯气与水反应生成的HClO 具有漂白性,所以只有湿润的有色布条褪色,D 项正确。
14答案及解析:答案:(1)E; C; D; A; B; H; G; F(2)除去氯气中的HCl 杂质; 吸收过量的氯气 (3)2222MnO +4HCl()MnCl +Cl +2H O ∆↑浓; 222NaOH+Cl =NaCl+NaClO+H O解析:(1)装置连接顺序为反应装置→净化装置→收集装置→尾气处理装置。
(2)题述装置中饱和食盐水的作用是除去2Cl 中的HCl 杂质; 浓硫酸的作用是除去2Cl 中的水;NaOH 溶液的作用是吸收过量的2Cl 。
15答案及解析: 答案:(1)B (2)0.3mol (3)1:1 (4)(5)D 解析:。