高三化学第一轮复习—碳族部分
- 格式:doc
- 大小:232.50 KB
- 文档页数:5
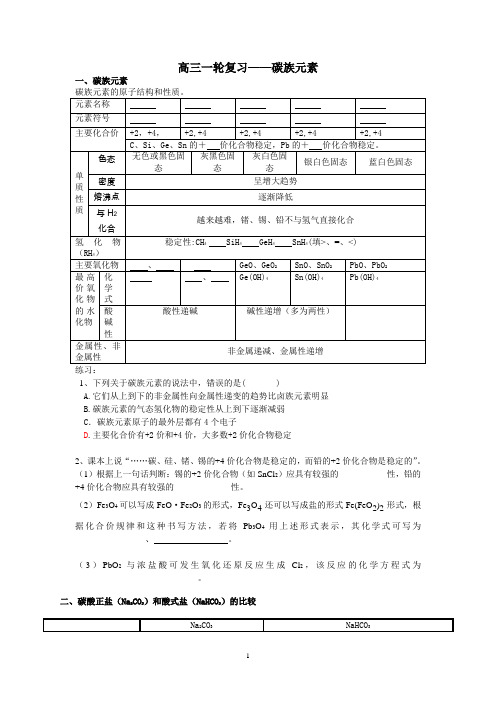
高三一轮复习——碳族元素一、碳族元素1、下列关于碳族元素的说法中,错误的是( )A.它们从上到下的非金属性向金属性递变的趋势比卤族元素明显B.碳族元素的气态氢化物的稳定性从上到下逐渐减弱C .碳族元素原子的最外层都有4个电子D .主要化合价有+2价和+4价,大多数+2价化合物稳定2、课本上说“……碳、硅、锗、锡的+4价化合物是稳定的,而铅的+2价化合物是稳定的”。
(1)根据上一句话判断:锡的+2价化合物(如SnCl 2)应具有较强的___________性,铅的+4价化合物应具有较强的_____________性。
(2)Fe 3O 4可以写成FeO ·Fe 2O 3的形式,Fe 3O 4还可以写成盐的形式Fe(FeO 2)2形式,根据化合价规律和这种书写方法,若将Pb 3O 4用上述形式表示,其化学式可写为______________ 、 。
(3)PbO 2与浓盐酸可发生氧化还原反应生成Cl 2,该反应的化学方程式为____________________________。
二、碳酸正盐(Na 2CO 3)和酸式盐(NaHCO 3)的比较23a、用酚酞做指示剂,达到滴定终点时发生的反应为:b、用甲基橙做指示剂,达到滴定终点时发生的反应为:,典型例题[例1]下列关于碳族元素的说法正确的是()A.单质都是无色晶体B.单质中硅单质熔点最高C.碳族元素形成的化合物种类最多D.在化合物中最稳定的化合价都是+4价[例2]门捷列夫在19世纪中叶,曾根据他所发现的周期律,预言过第四周期第ⅣA族元素X(当时称为类硅)。
下列有关类硅的元素性质,不正确的是()A.XH4不稳定,但有强还原性B.可用焦炭在高温下从XO2中冶炼XC.X单质的熔点比硅高D.X(OH)4的酸性比H2SiO3强[例3]若发现了114号新元素X, 则有关X元素及其化合物的叙述正确的是: ( )(A)X有稳定的气态氢化物(B)X的最高正价氧化物的化学式为XO2(C)X为非金属元素(D)X的低价氧化物是酸性氧化物[例4]下列饱和溶液中,通入过量二氧化碳气体,肯定没有沉淀产生的是()①氢氧化钠②碳酸钠③硅酸钠④次氯酸钙⑤氯化钙A、①⑤B、①②C、④⑤D、③④[例5]某种混合气体,可能含有N2、HCl、CO,常温下,把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都有没有变化,再将其通过足量的过氧化钠固体,气体体积减小,最后混合气体通过红热的铜丝网,经充分反应后气体体积又减少,但仍有剩余气体,以下对混合气体组成的判断正确的是()A、一定没有氮气,至少有一氧化碳和氯化氢中的一种B、一定有氮气,一氧化碳和氯化氢C、一定有氮气,一氧化碳和氯化氢至少有其中的一种D、一定有氮气和氯化氢,没有一氧化碳【真题演练】1.(2002上海15)将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是()A B C D2、(2003全国理综8)某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。

碳族元素无机非金属材料第一课时碳族元素【考纲要求】1.掌握碳族元素在元素周期表中的特殊位置导致性质上的特殊性。
2.能熟练运用碳族元素原子结构的递变规律解释其性质的递变规律3.掌握CO2与CO、CO2与SiO2、NaHCO3与Na2CO3这三组物质在物理性质、化学性质、制法、用途等方面的不同。
4.自主建立碳族元素的知识网络。
教与学方案【自学反馈】一、概念辨析碳族元素:(1)在周期表中的位置(由原子结构中的决定)。
(2)包含元素的名称、符号、原子结构简图、原子半径、化合价等比较元素名称元素符号原子结构简图原子半径化合价单质性质变化碳硅锗锡铅(3)相似性:、(4)递变性:。
(5)特殊性:难形成离子化合物,易形成共价化合物。
(6)用原子结构知识解释(3)(4)(5):。
碳单质:(1)同素异形体:;无定形碳:。
(2)性质:稳定性,比如;还原性:;可燃性:;弱氧化性:。
含碳化合物:(1)CO2:物理性质;化学性质;实验室制法:原料、原理、装置、步骤。
(2)CO:物理性质;化学性质;实验室制法:原料、原理、装置;(3)碳酸正盐:稳定性、溶解性;(4)酸式盐:稳定性、溶解性;(5)其它含碳化合物、有机化合物、金属碳化物候氏制碱法的主要反应中用到上述哪些物质中的哪些性质?。
二、碳元素知识网络:写出化学方程式实现下列转化:.Si O2 Ca(HCO3)2 CaCO3SiC C CO2 Na2CO3SiO2 CO Fe MgO NaHCO3【例题解析】[例1] 门捷列夫在19世纪中叶,曾根据他所发现的周期律,预言过第四周期第ⅣA族元素X (当时称为类硅)。
下列有关类硅的元素性质,不正确的是()A.XH4不稳定,但有强还原性B.可用焦炭在高温下从XO2中冶炼XC.X单质的熔点比硅高 D.X(OH)4的酸性比H2SiO3强解题思路: 。
易错点: 。
[例2] 最近,科学家研制得一种新的分子,它具有空心的类似足球状结构,分子式为C60,下列说法正确的是()A.C60是一种新型的化合物B.C60和石墨都是碳的同素异形体C.与C60结构类似的还有C60分子D.C60的相对分子质量是720g/mol解题思路: 。
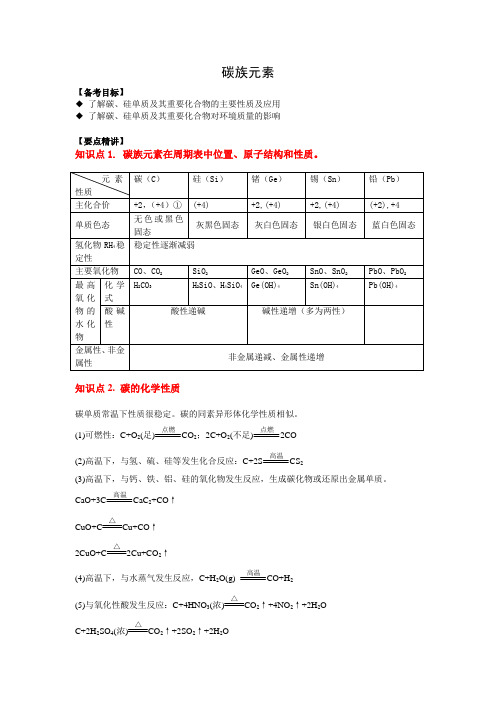
碳族元素【备考目标】◆了解碳、硅单质及其重要化合物的主要性质及应用◆了解碳、硅单质及其重要化合物对环境质量的影响【要点精讲】知识点1. 碳族元素在周期表中位置、原子结构和性质。
知识点2. 碳的化学性质碳单质常温下性质很稳定。
碳的同素异形体化学性质相似。
(1)可燃性:C+O2(足)点燃CO2;2C+O2(不足)点燃2CO(2)高温下,与氢、硫、硅等发生化合反应:C+2S高温CS2(3)高温下,与钙、铁、铝、硅的氧化物发生反应,生成碳化物或还原出金属单质。
CaO+3C高温CaC2+CO↑CuO+C △Cu+CO↑2CuO+C △2Cu+CO2↑(4)高温下,与水蒸气发生反应,C+H2O(g)高温CO+H2(5)与氧化性酸发生反应:C+4HNO3(浓)△2↑+4NO2↑+2H2OC+2H2SO4(浓)△CO2↑+2SO2↑+2H2O知识点3. 碳及其化合物规律小结(2)除杂质问题3NaHCO (4)碳酸根离子和碳酸氢根离子的检验方法①-23CO 的检验方法:向待检溶液中滴加过量的CaCl 2溶液。
若生成白色沉淀,再加入稀盐酸或稀硝酸。
若白色沉淀又溶解,且生成无色、无味的气体,则检得溶液中有-23CO 。
注意:试剂CaCl 2溶液也可用Ca(NO 3)2、BaCl 2、Ba(NO 3)2等的溶液代替,但不可用Ca(OH)2溶液或Ba(OH)2溶液,原因是无法排除-3HCO 的干扰。
对白色沉淀要加入稀盐酸或稀硝酸溶解,以排除Ag +、-23SiO 等的干扰。
但不可用硫酸溶液,原因是H 2SO 4溶解CaCO 3或BaCO 3的效果不佳。
白色沉淀溶解之后还要通过气体及其气味来进一步排除-23SO 等的干扰。
②-3HCO 的检验方法:向待检溶液中滴加足量的Ca 2+或Ba 2+的可溶性盐溶液。
若无明显现象,再向溶液中加入足量的酸(如盐酸、硝酸、醋酸等)溶液。
若溶液中逸出无色、无味的气体,则待检溶液中有-3HCO 。
碳族元素复习第一节碳族元素【考点解读】1.根据碳族元素在周期表中的位置及其结构特点,了解其性质的相似性和递变性。
2.了解碳的核外电子排布,三种重要的同素异形体及导致它们物理性质有较大差别的原因。
了解碳的多样性。
3、CO、CO2的性质,碳的氧化物对大气的污染4、碳酸盐的性质及CO32-的检验【学习指导】复习策略:本章主要采用对比的方法复习碳硅及化合物的主要性质,同时注意碳硅及化合物的某些特殊性,在元素推断题中形成物质种类最多的元素之一有碳,原因是碳元素最外层4个电子,可以进行sp、sp2、sp3杂化及形成三键、双键、单键。
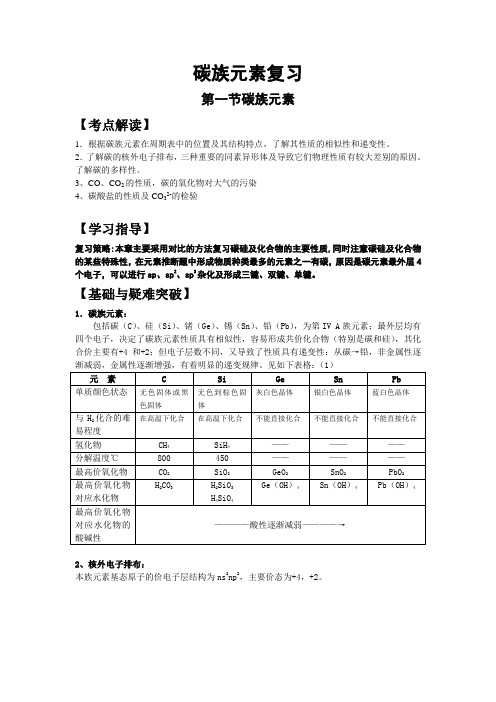
【基础与疑难突破】1.碳族元素:包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb),为第IV A族元素;最外层均有四个电子,决定了碳族元素性质具有相似性,容易形成共价化合物(特别是碳和硅),其化合价主要有+4和+2;但电子层数不同,又导致了性质具有递变性:从碳→铅,非金属性逐渐减弱,金属性逐渐增强,有着明显的递变规律。
见如下表格:(1)2、核外电子排布:本族元素基态原子的价电子层结构为ns2np2,主要价态为+4,+2。
碳的同素异形体的比较:(表2)碳元素不仅可以形成多种同素异形体,而且还可以形成多种无机化Array合物和有机化合物,是形成化合物种类最多的元素。
例题1:(1)质量相等的石墨与足球烯(C60)所含质子数()A.前者多 B. 相等 C. 后者多 D. 无法确定(2)设计一个实验证明金刚石、石墨和C60都是由碳元素组成的。
答案:(1)B (2)分别将三种物质在氧气充足的条件下燃烧,若三者产生的都是无色无味的气体且将所得气体通入澄清石灰水中,若气体都使澄清的石灰水变浑浊,则说明它们都是由碳元素组成的。
解析:(1)等质量的石墨与足球烯含有相同物质的量碳原子,所含质子数也相等3、碳单质及重要化合物的主要性质、制法及应用的比较一、碳单质:(1)物理性质:碳元素形成的同素异形体由于碳原子的排列方式不同,导致物理性质有较大的差别。

第25讲碳、硅无机非金属材料[复习目标] 1.了解碳、硅及其化合物的组成和成键特点。
2.了解碳、硅两种元素单质及其重要化合物的性质及应用,能用化学方程式表示其主要化学性质。
3.了解无机非金属材料的组成、分类及其应用价值。
考点一碳族元素碳1.碳族元素(1)碳、硅、锗、锡、铅均属于第ⅣA族元素,又称碳族元素,其价层电子排布式为________。
(2)碳单质的存在形式有金刚石、石墨、无定形碳、足球烯,它们互为____________。
2.金刚石、石墨、C60的物理性质金刚石石墨C60晶体类型共价晶体混合型晶体分子晶体物理性质熔点高,硬度大,不导电熔点高,硬度____,____导电熔点低,不导电主要用途钻石制作,切割工具,钻探机的钻头等做电极、润滑剂、铅笔芯广泛应用于超导、医学领域3.CO2在自然界中的循环(1)CO2的主要来源:大量含碳燃料的燃烧。
(2)自然界消耗CO2的主要反应:①溶于江水、海水中:CO2+H2O H2CO3;②光合作用将CO2转化为O2;③岩石的风化:CaCO3+H2O+CO2===____________。
1.金刚石、石墨、C60都是由碳元素组成的单质()2.水墨画可长久保存不变色是因为在常温下碳的化学性质不活泼() 3.二氧化碳能使紫色石蕊溶液变红,说明二氧化碳具有酸性()4.低碳环保中的“碳”是指二氧化碳()5.石墨转变为金刚石的反应属于氧化还原反应()6.向空气中排放二氧化碳会形成酸雨()7.向CaCl2溶液中通入CO2气体,溶液变浑浊,继续通入CO2至过量,浑浊消失() 8.向氨化的饱和食盐水中通入足量的CO2气体,会析出晶体()1.中国力争在2030年前实现碳达峰、2060年前实现碳中和,关于碳及其化合物,下列说法不正确的是()A.金刚石和石墨是碳元素的两种不同单质,二者互称为同素异形体B.在100 kPa时,1 mol石墨转变为金刚石要吸收1.895 kJ的热量,故金刚石比石墨稳定C.考古时常用于测定文物年代的是碳元素的一种核素14 6C,该核素的中子数为8D.引起温室效应的气体之一CO2中含极性共价键2.中国努力争取2060年前实现碳中和。

碳族元素碳及其化合物1.复习重点1.碳族元素原子结构的特点、碳族元素化合价为正四价和正二价;2.碳族元素的性质及其递变规律;3.碳和硅的性质、用途。
2.难点聚焦2.二氧化碳和二氧化硅的结构、性质比较(见表7—7)3. 硅及其化合物的特性1. Si 的还原性大于C ,但C 却能在高温下还原出Si :↑++CO Si C SiO 222高温2. 非金属单质跟碱液作用一般无2H 放出,但Si 却放出H 2:↑+=++232222H SiO Na O H NaOH Si ↑+↑=+2424H SiF HF Si3. 非金属单质一般不跟非氧化性酸作用,但Si 能与HF 作用:4. 非金属单质一般为非导体,但Si 为半导体。
5. SiO 2是的酸酐,但它不溶于水,不能直接将它与水作用制备H 2SiO 3。
6. 非金属氧化物的熔沸点一般较低,但SiO 2的却很高。
7. 酸性氧化物一般不与酸作用,但SiO 2能跟HF 作用:↑+↑=+24224H SiF HF SiO 8. 无机酸一般易溶于水, 却难溶于水。
9. 因H 2CO 3的酸性大于H 2SiO 3,所以在Na 2SiO 3溶液中通入CO 2能发生下列反应:32322232CO Na SiO H O H CO SiO Na +↓=++,但在高温下↑++232232CO SiO Na SiO CO Na 高温也能发生。
10. Na 2SiO 3的水溶液称水玻璃,但它与玻璃的成分大不相同,硅酸钠水溶液(即水玻璃)俗称泡花碱,但它却是盐的溶液,并不是碱溶液。
4.硅与碱溶液的反应特点硅与强碱溶液反应的实质是什么?究竟哪种物质是氧化剂?根据化学方程式:↑+=++232222H SiO Na O H NaOH Si进行分析,似乎NaOH 和O H 2都是氧化剂,其实不然。
上述反应实际分两步进行↑+∆+244224H SiO H OH Si ①OH SiO Na NaOH SiO H 2324432+=+ ②其中反应①为氧化还原反应,反应②为非氧化还原反应。
△碳族元素复习一、要点精讲1、碳族元素的组成和结构①碳族元素包括:碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅( Pb)5种元素,位于元素周期表的ⅣA族。
②碳族元素原子最外层有4个电子,其最高正价为+4价,最高价氧化物及其水化物的化学式分别表示为RO2、H2RO3或H4RO4或R(OH)4,气态氢化物的化学式表示为RH4。
随着原子序数的增大,碳族元素的原子半径依次增大。
③碳族元素由于位于活泼的金属向活泼的非金属过渡的中间位置,故在化学反应中不易得到或失去电子,易形成共价键,难形成离子键。
碳元素形成的单质(金刚石)硬度最大;碳元素形成的种类最多;在所有非金属形成的气态氢化物中,甲烷中氢元素的质量分数最大;硅在地壳中的含量仅次于氧,其单质的晶体是一种良好的半导体材料。
2、碳族元素性质的递变规律随着原子序数的增大,碳族元素由非金属元素逐渐转变为金属元素,即金属性逐渐增强,非金属性逐渐减弱,最高价含氧酸的酸性逐渐减弱,碱性逐渐增强;气态氢化物的稳定性逐渐减弱,还原性逐渐增强。
3、碳族元素的特殊性①碳族元素的主要化合价有+2和+4,其中碳和硅有负价。
碳族元素在化合物中多以+4 价稳定,而铅在化合物中则以+2价稳定。
铅的+4价化合物在化学反应中易得到电子,具有强氧化性,PbO2+4HCl(浓) PbCl2+Cl2↑+2H2O。
而+2价锡的化合物具有较强的还原性,例实验室保存的SnCl2溶液易被空气氧化,故制时常加入金属锡。
②单质铅的颜色为蓝白色,其熔点比锡高。
铅的金属性比锡强,但铅的金属活动性比锡弱。
这两者本质上没有矛盾,因金属活动性顺序表中,金属的活泼性是指金属从酸或水中置换H+的能力,因此单质锡的活泼性比单质铅强,表明锡从酸或水中置换出氢气的能力比铅强;而锡元素的金属性比铅弱是指锡元素的原子失去电子的能力比铅元素的原子弱。
4.硅及其化合物的特性1. Si的还原性大于C,但C却能在高温下还原出Si:↑++COSiCSiO222高温2. 非金属单质跟碱液作用一般无2H放出,但Si却放出H2:↑+=++232222HSiONaOHNaOHSi↑+↑=+2424HSiFHFSi3. 非金属单质一般不跟非氧化性酸作用,但Si能与HF作用:4. 非金属单质一般为非导体,但Si为半导体。
2009届高三化学第一轮复习—碳族部分29.碳和碳族元素1.二氧化碳是否为大气污染物有不同观点。
认为“二氧化碳不是大气污染物”的理由是( )①二氧化碳是重要的化工原料;②二氧化碳是植物光合作用的必需原料;③二氧化碳是无色、无味、无毒的气体;④除二氧化碳外,甲烷、一氧化二氮也是温室气体A.①②B.②③C.③④D.①④2.为使以面粉为原料的面包松软可口,通常用碳酸氢钠作发泡剂,因为它()①热稳定性差②增加甜味③产生二氧化碳④提供钠离子A.②③B.①③C.①④D.③④3.科学家成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2原子晶体的说法正确的是()A.CO2原子晶体和CO2分子晶体互为同素异形体B.一定条件下,CO2原子晶体转化为分子晶体是物理变化C.CO2原子晶体和CO2分子晶体具有相同的物理性质D.在CO2原子晶体中,每一个碳原子周围结合四个氧原子,每一个氧原子跟两个碳原子相结合4.①碳酸钙与水、二氧化碳作用可得到碳酸氢钙,②碳酸氢钙加热分解可以得到碳酸钙、水和二氧化碳。
以下关于碳酸氢钙的说法中正确的是()A.上述①②两过程互为可逆反应B.碳酸氢钙可以使pH试纸变红C.将碳酸氢钙溶液小心加热、蒸干高温灼烧最终产物是碳酸钙D.碳酸氢钙溶液与少量NaOH溶液或澄清石灰水混合,二者可用同一离子方程式表示5.对于IV A族元素,下列叙述中不正确...的是A.SiO2和CO2中,Si和O、C和O之间都是极性键B.Si、C、Ge的最外层电子数都是4,次外层电子数都是8C.SiO2和CO2中都是酸性氧化物,在一定条件下都能和氧化钙反应D.该族元素的主要化合价是+4和+26.将CO2通入下列物质的溶液中不与其反应的是①Na2CO3②Na2SiO3③NaAlO2④C6H 5⑤Ca(ClO)2⑥CaCl2⑦CaCO 3A.①③④⑤⑥B.①和⑥只有① D.只有⑥7.下面关于碳族元素的叙述,不正确的是( )A.碳族元素主要以共价键形成化合物B.碳族元素由非金属性向金属性递变趋势很明显C.碳族元素都以+4价化合物稳定D.自然界中存在碳族元素中某元素的气态气态氢化物8.X、Y、Z分别是三种单质,它们都是常见的金属或非金属.M、N、R是常见的三种氧化物.其中一种具有高熔点,而且有如下反应(条件未标出,方程未配平):⑴X + Z → N;⑵M+X → N;⑶ M+Y→ R+X 。
若X是非金属,则组成Y单质的元素在周期表中的位置是()A.第二周期ⅣA族B.第二周期ⅥA族C.第三周期ⅡA族D.第三周期ⅣA族9.气体A只含X、Y两种短周期元素,X的原子序数大于Y,B、D、E是中学化学中常见图29-1请回答下列问题:(1)若气体A中X与Y的质量比小于3:1 ,则气体A中肯定有__________(写化学式),B的结构式为______________。
(2)若气体A的分子为直线型结构,且X与Y的质量比在数值上等于X的相对原子质量,则A的化学式为_______________。
(3)若乙和F都是红色固体,写出D与乙反应的化学方程式_______________________。
(4)D、E在一定条件下反应得到相对分子质量最小的有机物,写出该反应的化学方程式______________________________________________________。
10.铅的氧化物主要有三种:PbO、PbO2和Pb3O4。
请回答下列问题:(1)铅位于元素周期表中第周期族;与锡比较,铅的金属活动性________(填“较强”或“较弱”)。
(2)PbO2是一种两性氧化物,试写出PbO2和NaOH反应的离子方程式:;(3)Pb3O4可以写成两种氧化物的形式,它表示为_________________,它有较强的氧化性,能将盐酸氧化而产生Cl2,同时得到还原产物PbCl2。
若将Pb3O4投入HNO3中,只有部分的Pb元素进入溶液,写出该反应的化学方程式_____________________________________。
11.为了测定氢氧化钠固体混合物m g中碳酸钠的质量分数,甲、乙两位同学分别设计了如下的实验方案:(一)甲同学方案:将样品溶解,加过量氧化钡溶液,过滤、洗涤、烘干,称量得固体n g。
(1)混合物中碳酸钠的质量分数为(用m、n表示)。
(2)甲同学洗涤沉淀的操作是。
(3)Ca2+、Ba2+都可使CO32-沉淀完全,但使用氯化钡溶液比氯化钙溶液所得结果具有更高的精确度,原因是:①;②;(二)乙同学的方案如图29-2所示:(1)根据乙同学的实验装置图分析,在每次实验中,完成测定过程至少要进行次称量操作。
(2)他重复正确操作了三次,结果数据出现图29-2 了较大的偏差,你认为主要原因可能是(任写两个):①;②。
12.将一定量CO2通入500mLNaOH溶液中,充分反应后,将溶液低温蒸干,得到不含结晶水的白色固体A,取3份质量不同A分别与50mL同浓度的盐酸反应,得到气体的体积(标准状况)(1)上表中第______组数据表明加入的50mL盐酸反应后有剩余,其理由是______。
(2)请通过计算、讨论,判断固体A是什么物质?其成分的质量分数各是多少?(3)参加第1组反应的NaOH的物质的量是多少?30.硅及化合物 硅酸盐工业 和无机非金属材料1.下列关于硅的叙述中,错误的是 ( )A.自然界中,硅主要以游离态存在B.晶体硅的结构类似于金刚石,硬度也很大C.常温下硅很稳定,但能与强碱反应D.含硅的钢具有良好的导磁性和耐酸性2.下列物质:(1)水玻璃溶液(2)Na 2SO 3溶液(3)碱石灰(4)石灰水,若长时间存放在敞口瓶里,发生变质的是( )A.(1)(2)(3)B.(1)(2)(4)C.(2)(3)(4)D.(1)(2)(3)(4)3.对于化学反应Si +2NaOH +H 2O =Na 2SiO 3+2H 2↑,下列叙述正确的是 ( )A.硅是还原剂,NaOH 是氧化剂B.1mol 硅能还原2molNaOHC.1mol H 2O 能氧化0.25mol 硅D.1mol 硅能还原1mol 水4.某化工厂按如下步骤进行生产:①以煤为燃料煅烧石灰石,②用饱和碳酸钠溶液吸收步骤①中产生的CO 2,③使步骤①中产生的氧化钙与水反应,④消石灰跟碳酸钠反应。
该厂生产过程中涉及的物质有:①石灰石 ②纯碱 ③小苏打 ④烧碱 ⑤二氧化碳 ⑥消石灰,下列叙述正确的是 ( )A.起始原料是①②B.起始原料是②⑥C.最终产品是④⑤D.最终产品是③⑥5.石棉是一类廉价的硅酸盐材料,但有毒,能使人患肺癌。
一种叫矿青石棉的化学式为:Na 2Fe 5Si 8O 22(OH)2。
它用稀硝酸溶液处理时,还原产物只有NO ,下列说法正确的是( )A.该物质中Fe 元素的化合价为+2价,它属于硅酸盐B.该物质的化学组成可表示为:Na 2O·3FeO·Fe 2O 3·8SiO 2·H 2OC.1mol 该物质能和18molHNO 3反应,也能与18mol 盐酸反应D.这种石棉属于新型无机非金属材料6.下列叙述正确的是( )A. 1mol SiO 2含有的Si —O 键个数为1.204×1024B.Na 2SiO 3+CO 2+H 2O =Na 2CO 3+H 2SiO 3↓,Na 2CO 3+SiO 2 Na 2SiO 3+CO 2↑说明温度是物质酸性强弱决定因素 C.2C+SiO Si+2CO↑说明碳的非金属性比硅强D.Si 和SiO 2都属于原子晶体,但SiO 2熔点更高7.已知硼与硅性质相似,其化合物也与硅相应化合物相似,以下说法中不正确的是( )A.B 的单质可能为有较高的熔沸点B.B 与NaOH 溶液作用产生氢气C.BCl 3属于非极性分子D.H 3BO 3是比碳酸酸性稍强的弱酸8.人造骨是一种具有生物功能的新型无机非金属材料。
它类似于人骨和天然牙的性质和结构。
人造骨可以从人体液中补充某些离子形成新骨。
可在骨骼接合界面产生分解、吸收、析出等反应,实现骨骼牢固结合。
人造骨植入人体内形成新骨需要吸收人体中的离子是( )A.Ca 2+B.Cl -C.Na +D.PO 43-、Cl -9.H 由两种非金属元素组成,它是一种超硬物质,具有耐腐蚀、耐磨、抗氧化等特点,A 、B 为中学常见的两种单质,G 为难溶于水的白色固体,已知:NH 3和H 2O ,NH 2-和OH -的化 高温 高温请回答下列问题:(1)H 可能所属的晶体类型是(2)写出物质的化学式:C : M : G :(3)写出下列反应的离子反应方程式⑥ ⑧(4)写出③和④的化学方程式 ③④10.硅氧四面体可以用图30-1a 表示,图b 、c 是硅氧四面体结合成环状结构的两个例子。
请回答下列问题: (1)若在环状结构中硅的原于数为n ,写出环状结构中硅酸根离子的通式 。
(2)己知绿柱石是由环状硅氧四面体构成的硅酸盐。
它是含有铍、铝两种元素的复盐,酸根中含有6个硅原子,铍、铝结合的酸根离子数相等。
写出绿柱石的化学式 ,并在此基础上改写成氧化物相结合的形式 。
11.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:①高温下用碳还原二氧化硅制得粗硅 ②粗硅与干燥HCl 气体反应制得SiHCl 3:Si +3HCl SiHCl 3+H 2 ③SiHCl 3与过量H 2在1000~1100℃反应制得纯硅。
已知SiHCl 3,能与H 2O 强烈反应,在空气中易自燃。
请回答下列问题:(1)写出硅的原子结构示意图 。
(2)粗硅与HCl 反应完全后,经冷凝得到的SiHCl 3(沸点33.0℃)中含有少量SiCl 4(沸点57.6℃)和HCl (沸点-84.7℃),提纯SiHCl 3采用的方法为 。
(3)用SiHCl 3与过量H 2反应制备纯硅的装置如下(热源及夹持装置略去):①装置B 中的试剂是浓H 2SO 4,其作用是________________,在上述装置中需要加热的是 (填序号)。
②反应一段时间后,装置D 中观察到的现象是 ,已知反应②每生成1molH 2时放热381kJ ,请写出装置D 中反应的热化学方程式______________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是 。
a.碘水b.氯水c.NaOH 溶液d.KSCN 溶液e.Na 2SO 3溶液12.地球化学中,通常用热重分析研究矿物在受热时的质量变化以确定其组成。