氯离子的检验 卤素
- 格式:doc
- 大小:226.00 KB
- 文档页数:4

检验氯离子的方法氯离子的检验方法主要包括以下几种:一、银离子法利用氯离子和银离子生成微溶性的氯化银,根据产生的白色沉淀判断样品中是否含有氯离子。
一般步骤如下:1.取少量待检测的溶液样品,加入少量已知浓度的硝酸银溶液。
2.观察是否生成白色沉淀,若有沉淀则含有氯离子。
3.可以进一步验证结果,通过氨水的加入,若溶液呈现溶解的现象,则证明生成的白色沉淀是氯化银。
二、溴水法利用氯离子和溴水进行氯离子的检验。
具体步骤如下:1.取少量待检测的溶液样品,加入少量溴水(溴水溶液混有氢溴酸,酸性较强)。
2.观察溶液的颜色变化。
若发生变红,则证明存在氯离子。
三、硝酸银溶液和铁氰化钾试液法利用氯离子和硝酸银溶液以及铁氰化钾试液进行氯离子的检验。
具体步骤如下:1.取少量待检测的溶液样品,加入硝酸银溶液。
2.若生成沉淀,加入少量铁氰化钾试液。
3.观察沉淀颜色的变化。
若从白色变为红色,则证明存在氯离子。
四、氯化钡试液法利用氯离子与氯化钡试液反应生成沉淀进行检验。
具体步骤如下:1.取少量待检测的溶液样品,加入氯化钡试液。
2.观察是否生成沉淀,若有白色沉淀则证明存在氯离子。
五、氯气饱和法将待检测的溶液与氯气接触,利用氯离子和氯气在水中生成氯化亚氯离子的反应来检测氯离子。
具体步骤如下:1.取少量待检测的溶液样品,倒入试管中。
2.在试管中通入氯气,使之与溶液接触。
3.观察溶液的颜色变化,若生成黄色或淡绿色沉淀,则证明存在氯离子。
在实际应用中,根据需要可以选择其中一种或者多种方法进行氯离子的检验。
不同的方法具有不同的灵敏度和特异性。
同时,应注意在进行实验时要注意安全,避免接触到有毒或腐蚀性的化学试剂。


4-2-2 氯离子的检验、卤素教学目标1、巩固氯气的化学性质,初步掌握Cl―的检验方法。
2、了解卤族元素的性质与氯的相似之处。
3、引导学生自主学习、合作探究Cl―的检验方法,学习科学家研究化学的科学态度和研究方法。
4、培养学生辩证唯物主义的观点,养成关注化学在生产、生活中的应用的习惯,培养创新能力教学重点Cl―的检验方法教学难点卤族元素单质的氧化性教学过程〖复习提问〗1.灼热的铜丝伸入盛有氯气的集气瓶里,有何现象?写出反应的化学方程式。
2.在空气中点燃氢气,然后伸入盛有氯气的集气瓶里,有何现象?写出反应的化学方程式。
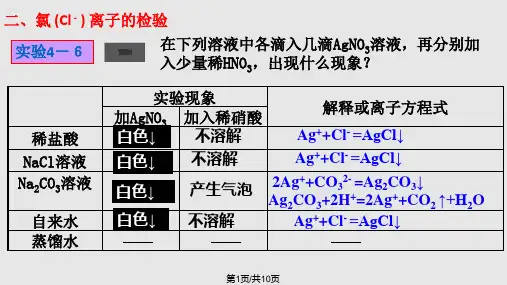
3.Fe、S、C在O2中燃烧,以及H2、Cu在Cl2中燃烧,有何共同特点?〖板书〗二、氯离子(Cl-)的检验〖实验4-6〗检验盐酸、NaCl溶液中的Cl-,并用Na2CO3溶液做对比实验,并填表。
〖强调〗先加几滴硝酸银溶液,再加几滴稀硝酸。
〖问〗为什么检验Cl-时,先加几滴硝酸银溶液,再加几滴稀硝酸?(防止CO32―的干扰)〖练习〗写出上述反应的离子方程式〖板书〗Ag+ + Cl- = AgCl↓2Ag+ + CO32- = Ag2CO3↓Ag2CO3+2H+ = 2Ag++CO2↑+H2O〖投影小结〗检验Cl―的方法(1)在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl―。
(2)在被检验的溶液中滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl―。
〖讲〗氯原子的最外层是7个电子,在化学反应中易得一个电子,成为8电子的稳定结构,和氯原子结构相似的元素还有F、Br、I等,统称为卤族元素—卤素。
〖板书〗三、成盐元素—卤素〖讲〗氟单质是淡黄绿色气体,氯气是黄绿色气体,溴是深红棕色液体,易挥发,用水封,溴水是橙红色。
碘是紫黑色固体,易升华,碘水是棕黄色,碘遇淀粉变蓝色。
〖思考与交流〗卤素原子结构有何相似点和不同点?由此推测它们化学性质有何相似性和递变性?〖投影〗〖投影小结〗〖问〗氯气可以与金属反应,那溴和碘哪?请写出溴与碘和铁反应的化学方程式〖板书〗1.与金属反应〖讲〗F2、Cl2、Br2的氧化性强,能把可变化合价的金属氧化成高价的金属卤化物,I2的氧化能力最弱,跟铁反应只夺取铁的2个电子,生成FeI2。




氯离子的检验方法氯离子是指氯原子失去一个电子后形成的离子,具有-1的电荷。
氯离子是常见的无机离子之一,其检验方法主要包括化学法、物理法和仪器分析法等。
一、化学法1.沉淀法氯离子与银离子(加入硝酸银溶液)反应形成白色沉淀,即氯化银沉淀(AgCl)。
可通过观察溶液中是否产生白色沉淀来检验氯离子的存在。
2.化合物法氯离子与亚硝酸钠反应会产生氯气,用该氯气使苯酚溶液呈现绿色,从而检验氯离子。
3.氯离子红法又称苯甲酸法,将待测样品中的氯化物转化为对甲酸苯酯,加入溴水后转化成醌产生红色物质,通过测定红色物质的吸光度来检验氯离子。
4.比色显色法将甲基橙指示剂加入样品溶液中,氯离子会与甲基橙形成络合物,从而改变溶液的颜色。
通过观察溶液颜色的变化来检验氯离子的存在与否。
二、物理法1.氯化银电极法利用氯化银电极检测溶液中的氯离子浓度。
将氯化银电极和参比电极浸泡在待测溶液中,通过测量电极之间的电位差来推断氯离子浓度的大小。
2.铬酸根离子法氯离子与铬酸根离子反应生成亚硝基氯酸根离子,可通过紫外-可见吸收光谱检测亚硝基氯酸根离子的吸光度来推断氯离子的浓度。
三、仪器分析法1.氯离子选择电极法利用氯离子选择电极,通过测量电极之间的电位差来间接测定溶液中的氯离子浓度。
2.离子色谱法离子色谱法是一种高效液相色谱技术,在色谱柱中使用特殊的分析柱和流动相,通过分离和检测样品中的氯离子来测定其浓度。
以上仅是氯离子检验方法中的一部分,具体的选择与使用需要根据实际情况和要求来确定。
同时,需要根据样品的特点和要求选择合适的方法,以保证准确性和可靠性。


4-2-2 氯离子的检验、卤素1.可以证明次氯酸是弱酸的事实是A.可与碱反应 B.有漂白性C.见光能分解 D.次氯酸钙溶液与碳酸反应生成次氯酸【答案】D2.下列说法正确的是A.Cl2和NaCl中均含有氯元素,它们的化学性质相同B.欲除去Cl2中的大量HCl气体,可将此混合气体通过盛有饱和食盐水的洗气瓶C.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+D.能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2【答案】B【解析】A项,Cl2和NaCl中均含有氯元素,但化合价不同,Cl2具有强氧化性,NaCl不具有强氧化性,故A错误;B项,氯气不溶于饱和食盐水,HCl易溶于其中,所以可用饱和食盐水除杂,B正确;C项,某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该沉淀可能是AgCl或BaSO4,该溶液不一定含有Ag+,故C错误;D项,碘单质遇淀粉显蓝色,所以具有强氧化性的物质均能使湿润的淀粉KI试纸变成蓝色,如双氧水、臭氧等,故D错误。
3.为了防止吸入氯气中毒,可以用浸有某种物质水溶液的毛巾捂住鼻子,这种物质可以是A.NaOH B.Na2CO3 C.NH3 D.NaCl【答案】B4.用试剂Z来检验含有Y离子的溶液中是否含有X离子,正确的是【答案】C【解析】A项,NH3·H2O和Al3+、Mg2+都会反应生成白色沉淀,故A错误;B项,AgNO3和Cl−、CO32−都会生成白色沉淀,故B错误;C项,Ba2+和Cl−不反应,Ba2+和SO42-反应生成白色沉淀,故C正确;D项,稀盐酸与CO32-和SO32-都能反应产生气体,无法检验SO32-的溶液中是否含有CO32-,D错误。
5.检验HCl气体中是否混有Cl2,可采用的方法是A.用干燥的蓝色石蕊试纸 B.用干燥的有色布条C.将气体通入硝酸银溶液 D.用湿润的淀粉-碘化钾试纸【答案】D【解析】A项,HCl和氯气都不能使干燥的蓝色石蕊试纸变色,则无法检验,A错误;B项,HCl和氯气都不能使干燥的有色布条褪色,则无法检验,B错误;C项,HCl与氯气在溶液中都含有H+、Cl-,都能与硝酸银溶液生成沉淀,则无法检验,C错误;D项,因氯气具有强氧化性,用湿润的淀粉碘化钾试纸检验时试纸变蓝,则说明置换出了碘单质,使淀粉变蓝,则能够检验混有氯气,D正确。

氯离子的检验方法
文/樊越
加稀硝酸,无现象,再加硝酸银,产生白色沉淀,即有氯离子。
检验氯离子的时候,可以用酸化的硝酸银溶液(其实,检验卤素的离子都可以用酸化的硝酸银溶液)。
氯离子和硝酸银溶液反应的时候,生成不溶于硝酸的白色沉淀——氯化银。
氯离子的作用
氯离子起着各种生理学作用。
许多细胞中都有氯离子通道,它主要负责控制静止期细胞的膜电位以及细胞体积。
在膜系统中,特殊神经元里的氯离子可以调控甘氨酸和伽马氨基丁酸的作用。
氯离子还与维持血液中的酸碱平衡有关。
肾是调节血液中氯离子含量的器官。
氯离子转运失调会导致一些病理学变化,最为人熟知的就是囊胞性纤维症,该病症由质膜上一个氯离子转运蛋白CFTR的突变导致。
卤代烃中卤素原子的检验卤代烃是指一类分子中含有卤素原子的有机化合物,例如氯代烃、溴代烃和碘代烃等。
卤素原子的存在会对卤代烃的性质产生影响,因此在化学实验中常常需要对卤素原子进行检验。
本文将介绍几种常见的卤素原子检验方法。
一、氯离子的检验氯离子是氯代烃中常见的卤素离子,大多是硫酸盐或氯化物的形式存在。
以下是氯离子的几种常见检验方法:1.氯离子与银离子反应氯离子常常可以通过其与银离子反应生成白色的沉淀物来进行检验。
处理样品的方法是:将一小部分样品溶解于水中,在不断搅拌的情况下加入少量硝酸银溶液。
如果样品中含有氯离子,则会产生白色的沉淀(AgCl),该沉淀可从溶液中过滤并进行称量以确定氯离子的含量。
2.氯离子与铁离子反应氯离子可以与铁(III)离子发生反应,生成深蓝色的沉淀物(FeCl3)。
处理样品的方法是:将少量的样品溶解于水中,在加入几滴酚酞指示剂和适量的盐酸后,再一滴一滴地加入一定量的硝酸铁(III)溶液。
如果样品中含有氯离子,则会生成深蓝色的沉淀物,其颜色越深代表氯离子含量越高。
二、溴离子的检验溴离子是溴代烃中常见的卤素离子,溴离子与银离子反应生成的沉淀物也是淡黄色的。
以下是几种常见的溴离子检验方法:1.溴离子与银离子反应与氯离子相类似,溴离子也可以通过其与银离子反应生成淡黄色的沉淀物来进行检验。
处理样品的方法是:将少量的样品溶解于水中,在加入少量的盐酸以酸化后,一滴一滴地加入硝酸银溶液。
如果样品中含有溴离子,则会形成淡黄色的沉淀物 AgBr)。
2.溴离子与氯化铁反应溴离子可与氯化铁发生反应,生成棕红色的沉淀物( FeBr3)。
处理样品的方法是:将少量的样品溶解于水中,并加入适量的氢氧化钠溶液,然后再加入少量氯化铁溶液。
如果样品中含有溴离子,则会生成棕红色的沉淀物。
三、碘离子的检验碘离子是碘代烃中常见的卤素离子,与银离子反应生成的沉淀物为深红褐色。
以下是几种简单的碘离子检验方法:1.碘离子与银离子反应碘离子与银离子反应生成深红褐色的沉淀物 AgI)。
氯离子的检验卤素一、选择题1.检验某未知溶液中是否含有氯离子,正确的操作是()A.向未知溶液中加入硝酸银溶液,有白色沉淀产生B.向未知溶液中加入硝酸银溶液,有白色沉淀产生,加入盐酸后,沉淀不消失C.向未知溶液中加入稀硝酸酸化后,再加入硝酸银溶液,有白色沉淀产生D.向未知溶液中加入稀盐酸酸化后,再加入硝酸银溶液,有白色沉淀产生2.向下列溶液中分别加入AgNO3溶液和稀HNO3,能生成不溶于稀HNO3的白色沉淀的是()A.氯水 B.氯酸钾C.次氯酸钠D.四氯化碳3.氯化碘(ICl)的化学性质跟Cl2相似,预计它跟水反应的最初生成物是()A.HI和HClO B.HCl和HIOC.HClO3和HIO D.HClO和HIO4.自来水是用Cl2杀菌消毒的,不法商贩用自来水冒充纯净水出售,为辨真伪,可用下列哪一种试剂鉴别()A.金属钠B.FeCl3溶液C.AgNO3溶液D.NaOH溶液5.已知常温下氯酸钾与浓盐酸反应放出氯气,现按如图进行卤素的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是()6.下列说法正确的是()A.Cl-和Cl2都有毒B.将AgNO3溶液滴入甲溶液中,若出现白色沉淀,则说明甲溶液中含有Cl-C.将NaCl溶液滴入AgNO3溶液中或将Cl2通入AgNO3溶液中均会出现白色沉淀D.含Cl-的溶液和氯水一样均呈浅黄绿色7.(2011·福州模拟)将氯水分别滴入下列各选项所述的溶液中,由实验现象得出的结论完全正确的是()二、非选择题8.(2009·海南高考题改编)有关物质存在如图所示的转化关系(部分产物已省略).通常C 为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.请回答下列问题:(1)反应①的化学方程式为________________________________________________.(2)反应②的离子方程式为________________________________________________.(3)写出另外一种实验室制取H的化学方程式________________________________________________________________________________________________________.9.某固体混合物可能由KNO3、K2SO4、KI、NaCl、CuCl2、CaCl2和Na2CO3中的一种或几种组成,依次进行下列五步实验,观察到如下现象:①混合物加水得无色透明溶液;②向上述溶液中滴加足量的BaCl2溶液,有白色沉淀生成,将该沉淀滤出,并将滤液分成两份;③上述白色沉淀可完全溶于稀HNO3;④往一份滤液中滴加氯水并加入CCl4,振荡后静置,CCl4层无色;⑤在另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸.根据以上实验,可以判断出该混合物中肯定含有______,但不能判断出其中是否含有________________.10.根据下图所示的实验过程填空:(1)写出a、b、c、d处的颜色:a________、b________、c________、d________.(2)写出图中反应的化学方程式:①________________________________________________________________________;②________________________________________________________________________; ③________________________________________________________________________.11.某校化学实验兴趣小组为了探究在实验室制备Cl 2的过程中有水蒸气和HCl 挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)若用含有0.2 mol HCl 的浓盐酸与足量的MnO 2反应制Cl 2,制得的Cl 2体积(标准状况下)总是小于1.12 L 的原因是_____________________________________________________________________________________________________________________ ________________________________________________________________________.(2)①装置B 中盛放的试剂名称为________,作用是_____________________________ ________________________________________________________________________ 现象是_______________________________________________________________. ②装置D 和E 中出现的不同现象说明的问题是__________________________________ ________________________________________________________________________. ③装置F 的作用是_________________________________________________________. ④写出装置G 中发生反应的离子方程式_______________________________________ ________________________________________________________________________.(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO 3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO 3溶液中的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在________与________(填装置字母序号)之间,装置中应放入______________________(填写试剂或用品名称).详解答案1.选C A 的操作不正确,它不能排除碳酸根的干扰;B 的操作也不正确,因为碳酸银与盐酸反应时,生成的是氯化银,仍为沉淀.D 中用盐酸,引入了氯离子,所以也不正确.2.选A 凡含有Cl -的物质,均可与AgNO 3溶液反应,生成不溶于稀HNO 3的白色沉淀.A 中Cl 2与H 2O 反应生成的HCl 可电离出Cl -;C 中NaClO 是离子化合物,在溶液中能电离出ClO -;B 中KClO 3溶于水后电离出ClO -3,B 、C 中无Cl -;D 中CCl 4不溶于水,更不能电离出Cl -.3.选B Cl 2跟H 2O 反应生成含-1价氯的无氧酸和含+1价氯的含氧酸:Cl 2+H 2O HCl +HClO ;ICl 跟H 2O 反应也应生成类似于HCl 和HClO 的两种酸.在Cl 2中氯元素的化合价是0价,在ICl 中氯元素的化合价是-1价,碘元素的化合价是+1价.因此,ICl 跟H 2O 反应后,Cl -1生成HCl ,I +1生成HIO.4.选C 自来水中的Cl -、Cl 2、HClO 都是微量的,要鉴别,就必须有明显的现象,D选项虽有反应但无明显现象,A 选项Na 与水反应具有同样现象,而Ag +与Cl -的反应灵敏,可看到浑浊现象.5.选A 在锥形瓶中,KClO 3与浓盐酸反应产生Cl 2,所以①处为黄绿色(排除B 项).Cl 2在②处与Br -反应生成Br 2,②处为橙色(排除D 项).Cl 2(可能还有挥发的Br 2)在③处与I-反应,淀粉遇I 2变蓝,所以③处为蓝色;Cl 2(及可能挥发的Br 2)全部被NaOH 溶液吸收:Cl 2+2NaOH===NaCl +NaClO +H 2O ,所以④处是白色棉球的本色(可能析出的NaCl 、NaClO 固体均为白色),可排除C 项.6.选C A 项,Cl -无毒,B 项,无法排除CO 2-3干扰,D 项,Cl -无颜色.7.选D A 项,Cl 2将Fe 2+氧化为Fe 3+,表现氧化性,B 项,HClO 具有漂白性,C 项,说明Cl 2溶于水生成的HCl 显酸性,生成的HClO 显示漂白性.8.解析:首先突破框图,G 为紫黑色固体单质,一般可预测为碘单质,可推得C 物质为氯气,则A 为盐酸,B 为二氧化锰;E 在二氧化锰的催化下制取H ,则E 为氯酸钾、H 为氧气;F 为氯化钾;于是D 一定为碘化钾.所以推出A 盐酸、B 二氧化锰、C 氯气、D 碘化钾、E 氯酸钾、F 氯化钾、G 碘、H 氧气.答案:(1)MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O(2)6I -+ClO -3+6H +===3I 2+Cl -+3H 2O(3)2H 2O 2=====催化剂2H 2O +O 2↑或2KMnO 4=====△K 2MnO 4+MnO 2+O 2↑(其他合理答案也给分)9.解析:由①知,混合物溶于水得无色透明溶液,则一定不含CuCl 2,由②、③分析知含Na 2CO 3而不含K 2SO 4,因含Na 2CO 3则一定不含CaCl 2,由④知不含KI ,由于②中引入Cl -所以⑤中虽然有白色沉淀,也不能确定含有NaCl ,KNO 3也不能确定.答案:Na 2CO 3 NaCl 、KNO 310.(1)棕黄色 橙色 蓝色 紫褐(2)2FeBr 2+3Cl 2===2FeCl 3+2Br 2Cl 2+2KI===2KCl +I 2Br 2+KI===2KBr +I 211.(1)盐酸的浓度随着反应的进行逐渐变小,变稀以后将不再与MnO 2反应,另外加热时浓盐酸因挥发而损失 (2)①无水CuSO 4 证明有水蒸气产生 白色粉末变蓝 ②Cl 2无漂白性、HClO 有漂白性 ③吸收Cl 2④Ag ++Cl -===AgCl ↓(3)F G 湿润的淀粉KI 试纸。