第1章物质及其变化思维导图
- 格式:docx
- 大小:126.64 KB
- 文档页数:7
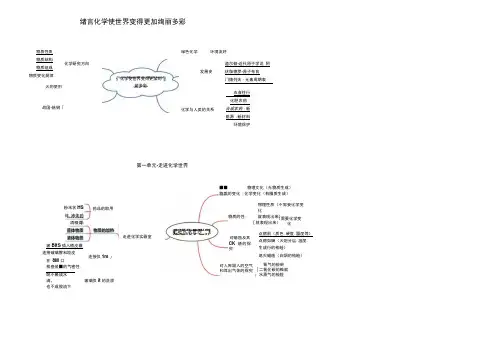
绪言化学使世界变得更加绚丽多彩物质性质 物质结构物质组成 物质变化规律 化学研究方向火的使用 战国•炼钢「化学与人类的关系化学使世界变得更加的丽多彩绿色化学 环境友好发展史道尔顿•近代原子学说 阿伏伽德罗•原子布良 门搐列夫・元素周期表衣食住行 化肥农药 ]合成农药 :新能源 :新材料环境保护第一单元•走进化学世界药品的取用粉末状HS 体 液体药品 酒精灯走迸化学实器室玻BltS 插入植皮褰 连接破璃管和跤皮 在 8M 口检查装■的气密性, 连接仪1m j既不聚成水滴,也不成股流下物质的性:对人库吸入的空气和耳出气体的探究 对蜡蚀及其 CK 烧的探究■■ 物理文化(无物质生成)物质的变化(化学变化(有腼质生成)物理性质(不需要化学变化就表现出来) [就表现出来) (需要化学变化玻璃仅it 的洗渗走进化学世界点燃前(质色.硬度.蜃度等)点燃如斓(火炮分层.温度. 生成行的检睑)熄灭蜡烛(白烟的检睑)氧气的检蛉 [二氧化碳的椎就;水蒸气的检险认识第二单元•我们周围的空气无色.无味物质性质难溶于水供给呼吸、支持燃烧氢气的用途氧气的性质化工原料、制造低温器断气的用途asia®®稀有气体制造低温.」及其用途电光源空气的保护•空气质・日报/混合物、物质的分类绻»物}化合反应化学反应类型分解反应>木炭燃烧硫的燃烧铁隹燃烧蜻烛燃烧红磷燃烧高钱竣钾分解我们周围的空气氧气的制取实胎室制取过敏化氢分解氯酸钾分解催化剂了譬黑不变・不变工业制取,分两液态空气法T限分商技术人类拥有的水资源做巴和农药的过度使用工业废水的排放水体污染生活i亏水的任意排放污水处理节约用水爰护水灸源J改进工艺和技术加紫凝剂沉淀一贴二低过渡三靠吸附)蒸馈消毒第四单元-自然界的水氢气的性质水的组成物质分类爱护水资源化学式自然界的水化合价水的净化阳极•氧气,燃本-I阳极-氢与化合物氧化物(单质化学式的书写化学式的怠义常见化学式化合价顺口溜,化学式中化合价代数和为零’单质的化合价蕨[根据化合价写化学式\根据化学式求化合价相对分子质量的计算计算相对分子质量元素质量比元素的质量分数化学反应茎^5^M 反应物大两加一宏观意义质定律 朦子种类相同,原子个数相等 微观意义J客观事实 写出反应物、生成物的化学式 写质量守恒定律配平化学方程式 配;客观事实 注明反应条件、生成物状态 注卜一 质量守恒定律画上等号以客观事实为依据 遵守质量守恒定承) 书写原则—— --------- 化学方程式计算 化学方程式一 -------------------------设未知量写出化学方程式’写出相关的量一[列比例式、求解写出答案第六单元•碳和碳的化合物2HCI+CaCO3=CaCI2 + H2O+CO2 制取原理检直气能性加入大理石仪器组装加入稀盐酸气体收集制取步球金刚石不IS用浓献酸代替稀盐酸不翻用AUK岫代替石灰石制取注j■事项J不能用m心一无色无味的气体.密度比空气大物理性质和水.澄清石灰水反应化学性质/稣生活温室效应对人类的影峋无色无味的气体物理性质碗卷还原住化学件屋一叔化碳毒性化学演分子形似足球有可能应用于离科技播域斤和%的化合物无定形碳导电优山电极木炭吸附性活性炭吸附性焦炭还原住炭黑一稳定住,无色透明的ID\面体硬度大切割装饰品灰黑色固体沸点高硬度小的笔芯第七单元~燃料及其利用可燃物氧气、燃烧着火点隔期可燃物口气降低温度灭火原理干粉灭火制二氯化碳灭火81)灭火器水基型灭火端7安全标识存放注18事项】运输注意事项:火灾处理注意事项J易燃物和易爆物的安全知识黑黑)当反应中的能■变化物料及口利用化石燃料的利用主要含碳元素煤的综合利用― 主要含碳.氢元素'{石油的综合利用可燃性I天的(利用合理利用和开发化石能源使燃料充分燃烧c开发可燃冰使用燃料对环境的影峋粉尘污染有害气体污染[温室效应能源的利用和开发r氢能.风能.太阳能——{地热能、核能.潮汐能…ggjggg .春秋•冶铁现在产■第一 标 \--一-二 隔年而向正量以三铝Ta种重壁蛆町有光;乐能够弯曲有延展性能导电、导热II 金厦的物理性和 硬度较大:熔点较低.耐腐蚀性较好 钛合金・21世纪•要金1 特殊台金•记忆合金镁和氧气「铁和氯气 金属和氧气反应11铝和氧气 '铜和组一镁锌铁铜与盐限反应 a ・u"um if 隹悴铁铜与硫酸反应 金IB 与酸反E5 I ---------------反应奥型•置换反应 铁矿石:赤铁矿、磁铁矿等 =^1匚原料:铁矿石、焦炭.石灰石 钱削遒J 「冶铁一氧化碳还原氧化铁地壳含■最高间.人体含・最高•钙 导电导热性最好•银、硬度最高而丁点一高•钩.嫡点<11低•滴:I 金H 之墨 卜一一♦度最大•镀、密度最小•锲合金是金J ■熔合其他金属或 非金属形成,是混合物金属和金属材料第八单元•金属和金n 材料新节点前面金属单质可・换 后面化合物中金属_____________ 金属的腐蚀与防护 金属资源保护](金属资源保护仲钙讷镁铝锌铁钱恰也 倒汞保笆金第面比后面金■活动性强 氢前金属能置换酸中的融 合金饱和溶液与不饱和溶液浓溶液和稀溶液)|溶液的分类吸热:硝酸筱放热:浓硫酸[氢加化钠)[溶解时的能量变化卜、第九单元•溶液物质的溶解性溶剂溶质一)1溶液的组成溶解度一定温度下100克溶剂达到饱和状态易溶:大于10g可溶:土竺2【微溶:0.01.lg难溶:小于0.01g固体颗粒一液体悬浊液小液滴一液体九浊液分子.液体溶液7囱邈在一定温度下能否言黑鬻蠹中溶视和与否的确定因素溶液乳化现象温度对溶解度影响蛟大•硝酸押的,如父温度对溶解度影响蛟小一的化钠固体物质溶解度独线―…—R “b ------ 1\程度上升,溶解度下降•热石灰温度越大,溶解度喇、气体物质的溶解度压强越大,溶解度越大一体积水溶解的气体的体枳数溶质的质量分数溶液的浓度IC配置一定质量分散的溶液计舞.称量.溶解第十单元•酸和画色氧化钠白色蜡状、易潮解石君(紫色)一遇酸变红、遇碱变蓝酚歆(无色)一遇酸不变色、遇碱变红)1酸碱指示剂无色」易挥发.有刺激性气味盐酸色无味相B状皿无色易挥发分解.有强氧化性硝酸II常见的酸易挥发,有剌激性气味醋酸用作干燥剂吸水性RZM3E腐蚀性沿•烧杯壁浓硫酸到入水中搅拌浓硫酸性质一_ I浓硫酸的稀释与酸碱指示剂作用与金属单质.金属氧化物反应、与碱反应: 与盐反应J常见的碱酸碱性酸的性质氢氧化钙白色粉末氢氧化押,氨水(易挥发.刺激性气味)与酸碱指示剂作用J与非金属氧化物反应时的化学性质II与酸反应〔与盆反应酸:电离时阳离子全部是氢置子的化合物zg H5rt if M:电商时阴商于全是巴吧氢氧根离子的化合物酸碱指示剂检测一定性询/ 蛔测一定・实质:酸中的氢圈子和碱中的氢氧根离子结合中和反应I\应月中和酸性故酸性污水的中和胃酸过多的中和蚊虫叮咬的中和I第十一单元•盐化肥无色晶体、易溶于水调味品.生理盐水、消除积雪氯化钠白色粉末二易溶于水 33 与睡Mg化钙最) --------------------- --白色粉末、易溶于水受热易分解、与酸域反应' 发酵粉、治疗胃酸过多/ 白色粉末、雉溶于水与瓯反应,阳剂,制取生石灰、建筑材料碳酸氢钠.E 破酸氨技、尿素等I------ (促进植物茎、叶生大茂超、叶色浓漫/ 磷二粉、过磷酸钙等^(促进生长,增强抗磨抗草能力…草木灰,氯化怦等c-C促进生长,增强抗病虫害、抗倒伏能力农家肥肥分种类多、肥分含量较少, 含两种或两种以上营养元素~c硝酸钾、磷酸二氢综、琮酸氢二钱[化学农药两种化合物相互交换成分,生成两种新的化合物判断依据:生成水、沉淀、气体发分解反应化肥的简易箍别1•外观:213 •溶解性’4一加入熟石灰I 5 •加入硝酸钢16•加入硝酸银组成人体雷白质尿素.水. A »»«三«化碳和能,_/ A蛋白质蜜白质变性•化学变化J水.二氧化碇水解生成和能■— «fiQt 淀粉人体供能的60・7逋,一固态一88肪;液态•油水.二氧化碳和能・_甘油和相肪酸、油施,人体供能的2015% J 胡萝卜.附而_«»_»缺乏装菜水果/血病VC缺乏 ) 」吗一或化破.二M化BM 即增、高口酸钾等无机化合物鬻十二单元•化学与生活骨质疏松.钙.骨胳——脂(奶.豆类.虾皮甲烷、乙睥.修酸、境白质、油脂、螳生素等六大.本营养累化合榭忤元案例机合成材料国合材料钠,钾一水绅pHai肝成芹菜,瘦肉.蛋发西不发海产品.肝蚯甲状腺甲大.一呆4喧海产品.加碘盐化学与生活引起咫症、表皮角质化・产生餐(qu)齿热量性迈料. 柒料热合成纤惟合成械濠轮、锦轮等。
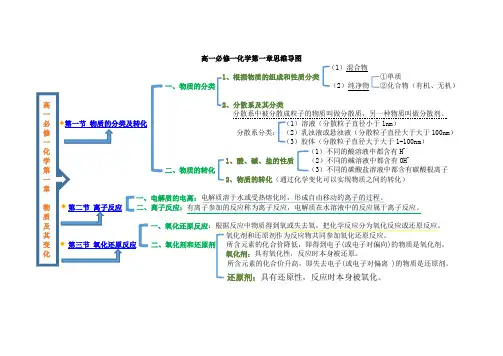
高一必修一化学第一章思维导图
(1)混合物
1、根据物质的组成和性质分类①单质
一、物质的分类(2)纯净物②化合物(有机、无机)
2、分散系及其分类
分散系中被分散成粒子的物质叫做分散质,另一种物质叫做分散剂。
(1)溶液(分散粒子直径小于1nm)
分散系分类:(2)乳浊液或悬浊液(分散粒子直径大于大于100nm)
(3)胶体(分散粒子直径大于大于1-100nm)
(1)不同的酸溶液中都含有H+
1、酸、碱、盐的性质(2)不同的碱溶液中都含有OH-
二、物质的转化(3)不同的碳酸盐溶液中都含有碳酸根离子
2、物质的转化(通过化学变化可以实现物质之间的转化)
电解质溶于水或受热熔化时,形成自由移动的离子的过程。
有离子参加的反应称为离子反应,电解质在水溶液中的反应属于离子反应。
一、氧化还原反应:根据反应中物质得到氧或失去氧,把化学反应分为氧化反应或还原反应。
氧化剂和还原剂作为反应物共同参加氧化还原反应。
二、氧化剂和还原剂所含元素的化合价降低,即得到电子(或电子对偏向)的物质是氧化剂。
氧化剂:具有氧化性,反应时本身被还原。
所含元素的化合价升高,即失去电子(或电子对偏离 )的物质是还原剂。
还原剂:具有还原性,反应时本身被氧化。

化学必修一思维导图一、物质及其变化1. 物质的结构原子结构:由原子核和核外电子组成,原子核由质子和中子组成。
分子结构:由原子通过化学键连接而成。
晶体结构:由原子、分子或离子按照一定的规律排列而成。
2. 物质的分类纯净物:由同种元素或化合物组成,具有固定的组成和性质。
3. 物质的性质物理性质:不涉及物质组成和结构变化的性质,如颜色、状态、密度等。
化学性质:涉及物质组成和结构变化的性质,如可燃性、氧化性等。
二、化学键与化学反应1. 化学键离子键:由正负离子之间的静电作用力形成。
共价键:由原子间共享电子对形成。
金属键:由金属原子间的自由电子云形成。
2. 化学反应化学反应类型:合成反应、分解反应、置换反应、复分解反应等。
化学反应条件:温度、压力、催化剂等。
化学反应速率:反应物浓度、温度、催化剂等。
三、元素周期表1. 元素周期律元素周期表按照原子序数排列,具有周期性变化的规律。
元素周期表中,同一周期的元素具有相似的化学性质,同一族的元素具有相似的物理性质。
2. 元素周期表的应用元素周期表可以用于预测元素的化学性质和物理性质。
元素周期表可以用于解释元素的电子结构和化学键的形成。
四、化学计量学1. 物质的量物质的量:表示物质中含有的基本粒子数,单位为摩尔。
摩尔质量:表示1摩尔物质的质量,单位为克/摩尔。
2. 化学反应的计量关系化学方程式:表示化学反应的物质及其量的关系。
化学方程式的平衡:反应物和物的物质的量保持一定的比例。
3. 化学反应的热力学焓变:表示化学反应中能量的变化,单位为焦耳。
反应热:表示化学反应中吸收或释放的热量,单位为焦耳。
五、溶液与胶体1. 溶液溶液的定义:由溶质和溶剂组成的均匀混合物。
溶液的浓度:表示溶液中溶质的含量,单位为摩尔/升。
2. 胶体胶体的定义:由分散相和分散介质组成的混合物,分散相粒子的大小介于分子和宏观粒子之间。
胶体的性质:具有丁达尔效应、布朗运动等特性。
六、酸碱反应1. 酸碱理论酸碱质子理论:酸是质子(H+)的供体,碱是质子的受体。


九年级化学上册思维导图第一单元:走进化学世界化学研究的对象是物质的组成(物质都是由元素组成的〉(一.mχL结构(分子、原子、离子及其内部结构)砺底⅛⅛债;役花:、菱性质(物理性质、化学性质〉.............物理变化l*Γ⅛Q刖化学变化Tt合.分解.置换、复分解j本质区别变化规律化学学习的特点是关注化的过程及其现象。
研究化学的重要途径是科学探究,而其重要手段是化学实验提出间题设计实验方案,确定飓步骤进行实验fgL描述和记录分析与讨论结论{交流t体验间题及建议ftll; I熄灭后:人们呼出气体的探究τ⅛it⅛增多I水蒸气增多化学世界r认识常用的九种仪器(名称、实物、示意图,用途及其注意事项)药品的取用规则(三不原则.节约原则、剩余药品处理原则)化学实验基本操作「块状固体(綴子)固体•粉末状固体(药匙)I定量(托盘天平:精确到0.1g)「多重T倾倒(标签、容器口).液体,少量_>用胶头滴管(垂直、悬空,不能横放或倒置)I定量T量筒(平稳、平视)(注意规格的选择)(0. In I L)使用方法(火柴点燃,外焰加热〉注意事项(使用前、使用时、使用启)物质的加热■E H试管.蒸发皿、烧杯、烧瓶〉液体(1/3.短柄、移动.管口〉固体(管口〉顷(都要预热、外壁擦干等等)「方法(水洗、刷洗.酸洗或洗涤剂)J洗涤仪器彳注意事项(热的玻璃仪器不能用冷水洗、不能用力刷洗等〉•玻璃仪器洗涤干净的标准:不聚水滴、不成股流下第二单元:我们周围的空气/氮气伽气麟际靱羸偏、噹馭泼'-般稀有气体(Hf N e X AT等):占0. 94% O很不活泼,作保护气,通电发不同颜色光。
二氧化碳(CO2):占0∙03% o详见第六单元。
其他气体和杂质:占0∙ 03% 0物理性质:\氧气(占21%〉化学性质√Λ活有,的、较具性用剂比,化常化{泼氧是氧无色、无味、气体,密度比空气略大,不易溶于水。
+ O2 = 匹(白光、放热、澄清石灰水变浑浊)2C + O2 = 2 CO占燃S + °2 ⅛,s°2(蓝紫色火焰、放热、刺激性气味气体)=2P2O5(白光、放热、浓厚白烟、白色固体)=Fe3O4(火星四射、放热、黑色固体桶刊=2MgO (耀眼白光、放热、白色固体)盪Q=2A12O3<耀眼白光、放热、白色固体〉占燃=2H20占燃=2C02占烬4P + 5023Fe+2C∣22 Mg + O24AI +3 O2 2H2+ O22CO + O2=CO2+2H20(淡蓝色或蓝色火焰,放热,干冷烧杯壁有无水滴,沾石灰水的烧杯壁是否浑浊)厂工业制法:分离液态空气。

化学必修一思维导图一、物质及其变化1. 物质物质是构成宇宙的基本实体,具有质量和体积。
物质由分子、原子和离子等基本粒子组成。
物质可以分为纯净物和混合物。
2. 变化变化是指物质在时间和空间上的状态改变。
变化可以分为物理变化和化学变化。
物理变化是指物质的形态、状态或性质发生改变,但化学组成不变。
化学变化是指物质的化学组成发生改变,新的物质。
二、物质的分类与性质1. 纯净物纯净物是指由一种物质组成的物质。
纯净物可以分为元素和化合物。
2. 混合物混合物可以分为均匀混合物和非均匀混合物。
3. 物质的性质物质的性质是指物质所具有的特定属性。
物质的性质可以分为物理性质和化学性质。
物理性质是指物质在不发生化学变化的情况下所表现出来的性质,如颜色、气味、密度等。
化学性质是指物质在发生化学变化时所表现出来的性质,如可燃性、氧化性等。
三、物质的量与计量1. 物质的量物质的量是指物质所含有的粒子数目的多少。
物质的量可以用摩尔(mol)来表示。
2. 计量计量是指对物质的量进行测量的过程。
计量可以采用天平、量筒等工具进行。
四、化学反应与能量1. 化学反应化学反应是指物质在化学变化过程中发生的原子、离子或分子之间的相互作用。
化学反应可以分为合成反应、分解反应、置换反应和复分解反应。
2. 能量能量是物质所具有的做功的能力。
能量可以分为内能、热能、电能等。
五、溶液与溶解度1. 溶液溶液是指一种或多种物质分散在另一种物质中形成的均匀混合物。
溶液可以分为饱和溶液和不饱和溶液。
2. 溶解度溶解度是指在一定条件下,溶质在溶剂中达到饱和时所能溶解的最大量。
溶解度受到温度、压力等因素的影响。
六、酸碱反应与中和1. 酸碱反应酸碱反应是指酸和碱在溶液中发生的化学反应。
酸碱反应可以分为酸碱中和反应、酸碱盐反应等。
2. 中和中和是指酸和碱在反应中相互抵消,水和盐的过程。
中和反应是酸碱反应的一种特殊情况,是酸碱反应的典型代表。
七、氧化还原反应与电子转移1. 氧化还原反应氧化还原反应是指物质在化学反应中发生电子转移的过程。

浙教版九年级科学上册思维导图引言本文档是针对浙教版九年级科学上册的思维导图。
思维导图是一种图形化的工具,可以帮助学生更好地理解和记忆知识点,同时也能够帮助学生建立知识之间的关联,提高学习效率。
在本文档中,将对浙教版九年级科学上册的各个章节进行思维导图的整理和总结,希望能够帮助学生更好地掌握这些知识。
第一章:物质的组成1.1 物质的分类•物质的宏观分类:纯物质和混合物•物质的微观组成:元素和化合物1.2 元素与化合物•元素:由相同类型的原子组成的纯物质•化合物:由不同类型的原子组成的纯物质1.3 物质的变化•物理变化:物质发生变化,但其组成不变•化学变化:物质发生变化,其组成也发生改变第二章:分子和离子2.1 分子的组成和命名•分子组成:原子之间通过化学键连接形成的粒子•分子命名:根据元素符号和元素个数进行命名2.2 离子的组成和命名•离子组成:正离子和负离子通过电荷吸引力相互结合•离子命名:根据离子的类型和电荷进行命名2.3 离子化合物的性质•离子间的相互作用:离子间的静电力相互作用强•离子化合物的性质:通常具有高熔点和高沸点,易溶于水第三章:反应与方程式3.1 化学反应•化学反应的定义:物质之间发生的化学变化3.2 化学方程式•化学方程式的表示:化学反应的简化表示形式•化学方程式的平衡:反应物和生成物的物质量必须平衡3.3 反应类型•合成反应:两个或多个物质结合成一个新物质•分解反应:一个物质分解成两个或多个新物质•置换反应:两个物质互相置换,形成两个不同的物质•还原反应:物质失去氧化剂而发生变化结论通过对浙教版九年级科学上册的各个章节进行思维导图的整理和总结,我们可以清晰地了解物质的组成、分子和离子的结构、化学反应及其方程式等知识点。
思维导图能帮助学生建立知识之间的关联,提高学习效率,同时也能够帮助学生更好地理解和记忆知识点。
希望这份思维导图能对学生的学习有所帮助。
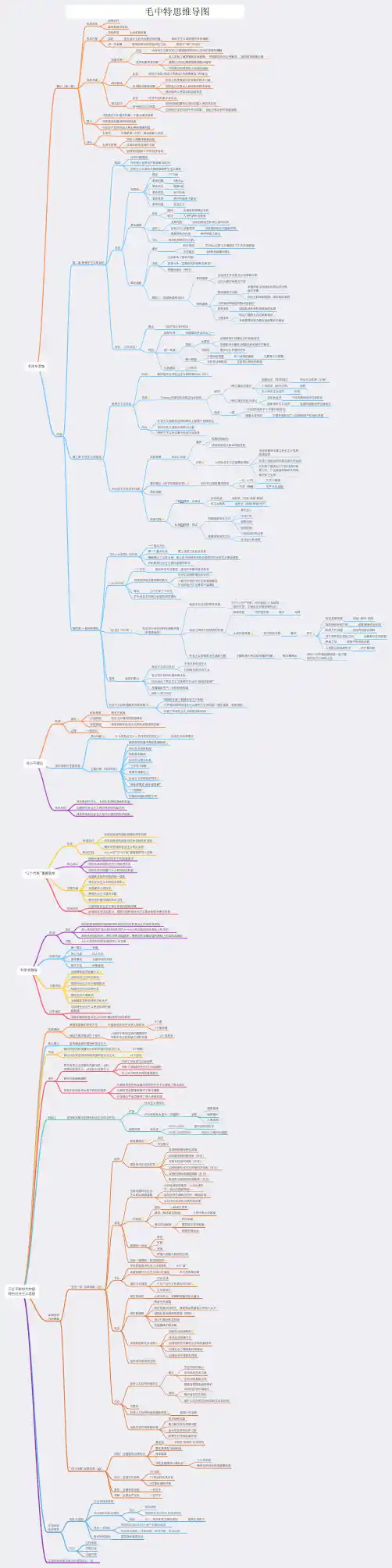
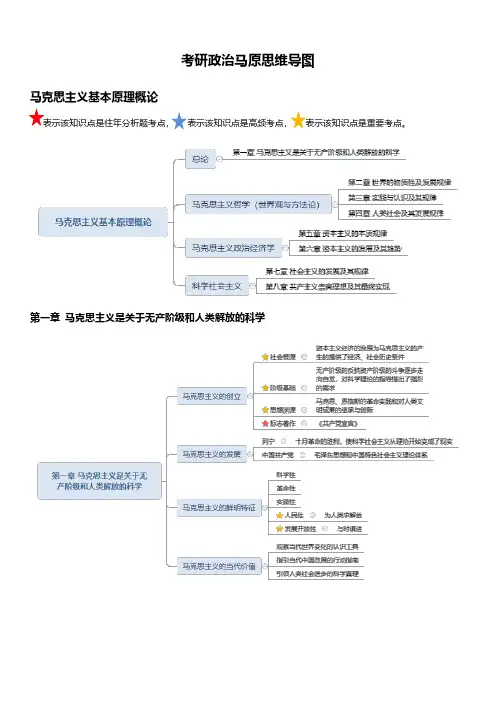
考研政治马原思维导图马克思主义基本原理概论表示该知识点是往年分析题考点,表示该知识点是高频考点,表示该知识点是重要考点。
第一章马克思主义是关于无产阶级和人类解放的科学第二章世界的物质性及其发展规律第一节世界多样性与物质统一性一、物质及其存在形态二、物质与意识的辩证关系三、世界的物质统一性第二节事物的联系和发展一、联系和发展的普遍性二、联系和发展的基本环节三、对立统一规律是事物发展的根本规律四、量变质变规律和否定之否定规律第三节唯物辩证法是认识世界和改造世界的根本方法第三章实践和认识及其发展规律一、实践的本质与基本结构二、认识的本质与过程三、实践与认识的辩证运动及其规律第二节真理与价值一、真理的客观性、绝对性和相对性二、真理的检验标准三、真理与价值的辩证统一第三节认识世界和改造世界第四章人类社会及其社会发展规律第一节社会基本矛盾及其运动规律一、社会存在与社会意识二、生产力与设国产关系的矛盾运动及其规律三、经济基础与上层建筑的矛盾运动及其规律四、社会形态更替的一般规律及特殊形式第二节社会历史发展的动力一、社会基本矛盾在历史发展中的作用二、阶级斗争和社会革命在阶级社会发展中的作用三、改革在社会发展中的作用四、科学技术在社会发展中的作用一、人民群众是历史的创造者二、个人在社会历史中的作用第五章资本主义的本质及规律第一节商品经济和价值规律三、商品的二因素四、生产商品的劳动二重性五、商品价值量的决定六、价值形式的发展与货币的产生;货币的本质和职能七、价值规律及其作用八、以私有制为基础的商品经济的基本矛盾第二节资本主义经济制度的本质一、资本主义经济制度的产生二、劳动力成为商品与货币转化为资本三、资本所有制四、生产剩余价值是资本主义生产方式的绝对规律五、资本积累六、资本的循环周转与再生产七、工资和剩余价值的分配八、资本主义基本矛盾与经济危机一、资本主义国家的职能和本质二、资本主义意识形态及其本质第六章资本主义的发展及其趋势第一节垄断资本主义的形成与发展一、资本主义从自由到垄断二、垄断资本主义的发展三、经济全球化及其影响第二节正确认识当代资本主义的新变化二、2008年国际金融危机以来资本主义的矛盾与冲突第三节资本主义的历史地位和发展趋势第七章社会主义的发展及其规律第一节社会主义五百年的历史进程第二节科学社会主义一般原则第三节在实践中探索现实社会主义的发展规律第八章共产主义崇高理想及其最终实现。
第 1 章物质及其变化
思维导图目录
硝酸铅和碘 化钾亦
Pb(NO 5)2 ÷2KI = PbIJ {÷ 2 K^O 5
无色黄色 溶液 渚液沉淀
颜色的变化、沉淀生成
无色
化学变化的实质是构 成物质分子的原子重 新进行组合f 形成了 新的分子
化学变化 没有生成新的物质 物理变化 常见的
变化
化学变化 的例证
化学变化一走伴随着物理变化 物理变化中不一走有化学变化堡 氯化铁沿 液j 師漓 化钾溶液
琉乐化<T I
*
J
S
氨化挾
玖亀化钾氯化快 淳浪 津液
加入玖鼠化 钾潯浪后
黄色沿茨变成了红色潘液
水的电解-有气体产生,产生了新的物质
生成沉淀、颜色改变、气体产 生、温度变化、性质变化、发 光发热、PH 变化、状态变化等 变化
在变化过程中I 以沉 淀、气体、变色等形式 产生了新的物质•就判I 断为发生了化学变化 /
在变化过程中,物质 仅仅发生形状.状 态、位置的改变 < 则 雇于物理变化 物质变化 的证据
澄清石灰水 滴加碳酸钠 溶液
变化规律的应用
澄清石灰水中出现白色沉淀
推测物质性质和用途
白色硫酸铜粉未 可以检测水分
寻找发现未知物质 建立物质变化模型
酹、胃液等θ酸性物质盐酸:HCI = ;H1 +f CP ■■: 硫
酸:H2SO4 = 2H*: + ∙SO42^:^ 硝
酸:HNO3 = ⅛+ LNO√ j
电离时生成的阳离子全部是氢离子的化合物酸溶液*战性溶液酸溶液显酸性,
一走是酸性溶液显酸性的溶液不一
走雇于酸溶液。
如硫酸氢羿溶液
碱性物质・熟石灰、肥皂、洗涤液等e辨析
PH值反映物质酸碱性强弱
用洁净的玻璃棒Si取破测试的溶
液;滴在PH试纸上;将试纸显示PH试纸
的颜色与标准比色卡对照;与哪种'使用方法J 颜色最接近■从而确走溶液的PH J -----------------
可使用酸度计O精确的测试]-酸性
物质的
酸碱性
氢氣化钠:NaOH = Na÷ + OH1:氢氧化
钙:Ca(OH)2 = Ca2* + 20H*;畝水:
NH3 出0 = NH4* ÷ JOHj 电离时生成的
阴离子全部是氢氧根离子的化合物
辨析■/碱溶液*附隣液(纯碱是碱性溶
液,但不是碱溶液
在酸性或碱性酒液里能显示出不同颜色的物质
酸碱性
的强弱
酸碱指
示剂
指示剂
酸性滨液
(PH<7)
緘性港液
(PH>7)
酚吐试液(无色)
蓝色石茨试纸
红色蓝色
无色
红色
不变色
红色
不变色
蓝色
无色、粘稠、油状的液体I 帛见的浓硫酸的 质量分数为98% f 言度为1.84克每立方厘米
能使紫色石洗试液
变红I 无色诙试P 能与掲示剂反应
@盐酸是氯化氢(HCl)气体的水溶液 打开浓盐酸的试剂瓶,会挥发出有剌 浓盐酸具\ 激性气味的塔体,在瓶□有白雾形成’有挥发性)
盐酸
个性 硫酸 个性 /浓硫酸具有很强的腐蚀性
Ar
I 浓硫酸具有脱水性
浓硫酸具有吸水性
液不变色 ) ------------------ ®跆铁钉反应 ------------- e 會猖全雇反应 ⑥ ------------------------ g>帥锈融 ■昭金雇氧 毎与氧化臓
分未反应F 化物反应
θ青猖氢氧化铝反应 + ≡⅛⅛⅛⅛⅛>⅛⅛-AV ®育猖礎钙反应 能使紫色石蕊试
能与指示剂反应二液变红■无色酚 ----------------- [猷试液不变色
G 肖猖碱融 θ
晦盐. 盐酸的
化学性
纯硝酸是无色、易挥发、有剌激性气味的液休 浓硝酸具有挥发性;硝酸具有很强的氧化性和 腐蚀性;浓硝酸见光易分解(棕色的瓶保存)
4 HNO3 垄 4 NO?] + 2 H 2θ ÷ °2 ↑
用途
硫酸的 吐与泣虫又应
能与详吆又竺+
化学性
r
能与金雇氧
站氧化铁粉 化物融
e
f
粘氧化铜粉
-
晦≡M 化铜融®
[能与- 粘氯化顿溶液融
÷
土满 重要化工产品•用于金雇表面除锈、制造 泄「药物,
人休胃液中含有盐酸,可帮助消化
重要化工料,用于生产化肥、农药、火 咖
药.染料以及冶炼全雇、精炼石油和全雇 吨 .除锈等.浓硫酸有吸水性■在实验室中常
用它做干燥剂
浓硫酸溶于水会放出大呈的热©
隔溶液能使紫色石茨试液变蓝 色f 能使无色酚猷变红色
Ca(OH)2 + 2HCI = CaCI 2 + 2 H 2O Ca(OH)2 + 乍0产 CaSO4 +2战0 二:
劉牛
CuCI 2 + 2NaOH = Cu(OH)21÷ 2NaCl
FeCI 3 + 3NaOH = Fe(OH)3 ∣+ 3 NaCI \
θ
氢氧化
钠易潮解r
易溶于水■ 溶解时会放出大量的热r 氢氧 化钠有较强的腐蚀性
-种重要的化工原料r 广泛 用于
月隨、石油、造纸、纺 织、印染等工业
白色粉末状回体r 微溶于水f 溶解 度随溫
度的升离而减小r 具有一走 的腐蚀性 建筑上做粉刷材斜r 农业上改良酸性 土壤,
工业上制备漂白粉r 实验室制 少呈
NaOH .配制农药波尔多液SO 3+ 2 NaOH = Na 2SO 4+H 2Oj
A
丙能与非金属 "氧化
物反应 CO 2 + Ca(OH)2= CaCO 31+H 2O 1 SiO 2+2 NaOH = Na 2SiO 3+H 2O λ
条件:非金雇氧化物为酸性气体
NaOH
A
氢氧化钠
与酸溶液 发生反应
酸碱指示別
常见的碱画
Ca(OH)2 —
Ca(OH)2 + Na 2CO 3 = CaCO 31+ 2 NaOH 条件:反应物均可溶r 生成物至少一种难溶
不溶性嗨酸溶液发
不溶性碱• 的
共性
CU(OH)2 4 CUO + H 2O 2 Fe(OH)3 ≈ Fe 2O 3 +3 H 2O 不
溶性題瞬解
熟石灰或消石灰
SO 2 +2 NaOH = Na 2SO 3+ H 2O
能与某 些盐溶 液反应
烧碱、火觀、苛性钠
酸+≡=盐+水
HCl + NaOH = NaCl + H2O
IOlnl氢I讹钠
帧
酚猷试液由红色变为无色来判断
实验
土壤取样
取1克左右土样放入试
管中r加入5毫升蒸徭
水,振荡30秒钟后静置。
待土壤微粒下沉后r 清液作为待测液待测液的准备
土壤酸碱
性测定
H++ OH- = H2O
酸碱反应的本质
农业上用施加熟石灰方法来降彳氐土壤的酸性
用碱处理酸性的工业废水
精制石油时,用氢氧化钠来中和过呈的酸用氢氧
化铝来中和胃中过量的酸
PH劇测试J
[肥皂水等弱碱性物质的药水来中和蚁酸
指一类金屋离子或技根离子与酸根
韶子或全雇离子结合的化合物
NaCl K2SO4 CaCO3正盐
NaHCO3 KHSO4酸式盐分类
Cu2(OH)2CO3碱式盐
茎叶生长茂盛•叶综苗R(D 素
的重要元素,I上
促进农作物根系发达r促进SSH P 作物種
数増多、籽粒诲满丄竺盐与化肥
茎秆粗壮,增强抗病虫書能iffifl p
力r促进糖和淀粉的生成Z-E
®侯氏制碱法盐的制取
盐+酸-新盐+新酸
反应物至少一种可溶
盐+碱一新盐^新碱
反应物两种均可溶
盐+盐一新盐+新盐
反应物两种均可溶霍驚S⅛二W 化学性质
几种重姜
的盐
碳酸钠晶体:Na2CO3∙ IOH2O
Na2CO3,碳酸钠的水溶液呈碱性©
碳酸钠^∣
,能与酸融©
I I化学宓 -/能与某些碱融©
俗名:纯鹹苏打•白色粉末状回体
与某些盐反应Φ
CaCO3
碳酸钙
NaCl
孰化钠
碳酸钙是一种难涪的盐r量大理石、
石灰石、贝壳、蛋壳的主要成分
与酸反应Φ
用途
重要的建筑装饰材料 f
石灰石新石灰和水泥
可以食用、制生理盐水
(0.9%) r典有防腐作用f能
用途G清洗伤口起杀菌作用
工业上可以制礪、盐酸、氯代等
化学HCl + AgNO3= AgCl ∣+ HNO3
产生不涪于稀硝酸的白色沉淀。