高一化学卤族元素(1)
- 格式:pdf
- 大小:1.16 MB
- 文档页数:10

高一化学教案:《卤族元素》教学设计(学习版)编制人:__________________审核人:__________________审批人:__________________编制学校:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的学习资料,如语文资料、数学资料、英语资料、历史资料、地理资料、化学资料、生物资料、物理资料、政治资料、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides various types of learning materials for everyone, such as language materials, mathematics materials, English materials, historical materials, geographic materials, chemical materials, biological materials, physical materials, political materials, other materials, etc. Please pay attention to the data format and writing method!高一化学教案:《卤族元素》教学设计高一化学教案:《卤族元素》教学设计一、教材分析以卤素的制备和加碘盐的鉴别及含量测定作为卤族元素复习的载体,本内容可以作为卤素知识综合应用的专题讲座。
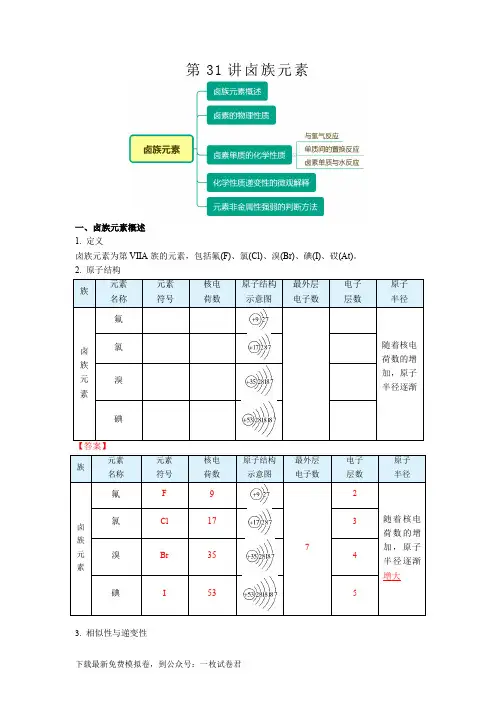
第31讲卤族元素一、卤族元素概述1. 定义卤族元素为第VIIA族的元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)。
2. 原子结构3. 相似性与递变性下载最新免费模拟卷,到公众号:一枚试卷君①相似性:最外层电子数都是_____,容易______一个电子。
②递变性:随着核电荷数逐渐增大,电子层数逐渐________,原子半径逐渐________。
【答案】7 得到增多增大增多增大二、卤素的物理性质都有颜色,有毒,在水中溶解度不大。
2.递变性随着核电荷数逐渐增大,颜色逐渐加深,熔、沸点逐渐______,密度逐渐______。
【答案】升高增大三、卤素单质的化学性质1.与氢气反应H2+I22HI①与氢气反应的难易程度:_________________2. 卤素单质间的置换反应22222I2Cl2>Br2>I2 I->Br->Cl-3. 卤素单质与水反应①卤素单质与水发生的反应可用通式表示:X2 + H2O === HX + HXO(X表示Cl、Br、I)②F2与水反应的化学方程式为:2F2+ 2H2O=== 4HF + O2四、卤素化学性质递变性的微观解释核电荷数减少→电子层数减少→对电子引力增强→越容易得到电子→元素的非金属性增强→单质的氧化性增强。
五、元素非金属性强弱的判断方法1. 与H2化合越_______,非金属性越强。
2. 与H2生成的气态氢化物越_______,非金属性越强。
3. _______氧化物对应水化物的酸性越_____,非金属性越强。
4. 单质氧化性越______或阴离子还原性越______,非金属性越强。
【答案】容易稳定最高价强强弱题型一:卤素单质的结构与性质【例1】(2021·莎车县第一中学高一期中)氯、溴、碘单质的化学性质相似,主要原因是( ) A.单质均有颜色B.均为双原子分子C.原子最外层电子数均为7D.均为非金属元素【答案】C【解析】A项,单质均有颜色,属于物质的性质,故A不符;B项,均为双原子分子,属于物质的组成,故B不符;C项,原子最外层电子数均为7,属于物质结构,结构上有相似,决定了氯、溴、碘单质的化学性质相似,故C符合;D项,均为非金属元素,属于物质的组成,故D不符;故选C。

象对市爱好阳光实验学校高一化学卤素【同步信息】一. 本周教学内容:卤素二. 教学目标:1. 卤素结构的相似点和递变性。
2. 卤素单质的物理性质。
3. 卤素单质的化学性质及递变性。
4. 卤化银和含碘化合物的主要性质。
5. 了解可逆反的含义。
三. 教学、难点::卤素性质变化规律。
难点:可逆反的涵义。
四. 知识分析:〔一〕卤素原子结构及性质推测:相同点⎪⎩⎪⎨⎧-+1)(717,负价为除外最高正价均为具有较强的氧化性个电子达到稳定结构,容易得个最外层电子都为F不同点:F Cl Br I−−−−→−核电荷数增大 −−−−→−电子层数增多 −−−−→−原子半径增大−−−−→−得电子能力减弱−−−−→−单质氧化性减弱 −−−−−→−阴离子还原性增强〔二〕卤素单质的物理性质:状态〔熔沸点〕气 气 液 固 熔沸点升高颜色 浅黄绿色 黄绿色 深红棕色 紫黑色 颜色加深 密度 密度增大水中溶解度 反 溶解 溶解 微溶 在水中溶解度减小说明:1. 卤素单质在不同溶剂的颜色:2. 液溴的保存:由于液溴极易挥发,具有强腐蚀性,因而室通常将液溴装入磨砂玻璃塞的试剂瓶,并参加一量水。
3. 碘的升华:固态物质不经液态而直接变成气态的现象。
四. 卤素单质的化学性质:1. 卤素都能与金属反生成金属卤化物。
说明:〔1〕这些反均是卤素单质得电子,表现氧化性。
〔2〕2I 的氧化性最弱,只能将Fe 氧化为2+价。
〔3〕自然界里,也存在着许多的金属跟卤素的化合物,如氟化钙、氯化钠、氯化镁、溴化钾、碘化钾卤化物。
2. 卤素都能跟氢气起反生成卤化氢。
HFF H 222=+冷暗处,爆炸HBr Br H 222∆+C ︒500较慢进行可逆反:在同一条件下,既能向正反方向进行,同时又能向逆反方向进行的反。
注意:〔1〕2F 、2Cl 、2Br 、2I 都能与2H 反生成卤化氢。
〔2〕2F 、2Cl 、2Br 、2I 与2H 反条件越来越严格,剧烈程度越来越差。
第四章卤素本章目标1.通过对卤素代表性元素——氯的学习,掌握氯气的化学性质和实验室制法。
了解卤素性质随着核电荷数的增加、原子半径的增大而递变的性质。
2.掌握氯、溴、碘和卤化物的鉴别。
初步了解卤化银的性质、用途及碘与人体健康等知识。
3.了解可逆反应的涵义。
4.掌握物质的量、物质的量浓度、气体摩尔体积应用于化学方程式的计算方法和格式。
5.通过观察、分析演示实验的现象,培养观察和分析问题的能力;通过对卤素结构、性质的对比,培养比较、分析、归纳问题的能力。
本章重点卤族元素性质变化规律本章难点物质的量应用于化学方程式的计算课时分配§4-1 氯气教学目的:1. 了解氯气的物理性质和用途;2. 掌握氯气的化学性质及在实验室中制取氯气的原理和方法;3. 掌握氯离子的检验方法;4. 通过观察、分析实验现象,培养观察和分析问题的能力。
教学重点:氯气的化学性质学习方法:实验探索——研讨总结——练习提高教学过程:第一课时[引言] 前面我们学习了碱金属元素,知道碱金属元素是几种在原子结构和性质上都具有一定相似性的金属元素。
这一章我们将要学习几种在原子结构和性质上都具有一定相似性的非金属元素——卤素,它包括F、Cl、Br、I、At等五种元素。
卤素及其化合物的用途非常广泛。
卤素中最主要的单质是氯气。
这一节我们学习氯气的性质和用途。
一、氯气的性质和用途(一)物理性质:氯气是色、味、态单质,易(在101kPa、-34.6℃时,氯气液化成液氯,将温度继续冷却到-101℃时,液氯变成固态氯)。
注意:闻气体方法:。
(二)化学性质:氯气的化学性质是否活泼呢?物质的宏观性质是由物质的微观结构决定的,请回忆氯的原子结构示意图:。
[提问] 1.根据氯的原子结构,推断氯气的化学性质是否活泼?它具有强还原性还是强氧化性?为什么?2.写出金属钠和氯气反应的化学方程式,并指出哪个是氧化剂?哪个是还原剂?1.与金属反应氯气与金属钠(活泼金属)反应方程式:[实验4-1] 氯气与金属铜反应现象:氯气与金属铜(不活泼金属)反应方程式:[介绍] CuCl2溶于水,可观察到不同的颜色,这与溶液浓度有关。

卤素知识(高一)复习指要《卤素》章节中涉及到的元素及其化合物知识“零散繁多”,为了有效地掌握本部分知识。
使之系统化、熟练化,复习中可以采取“四抓”方法,提高学习效率。
一、抓“四性”⒈系统性:以氯元素的单质及化合物的性质、用途、制法为例,编织知识网络,并以此为参照模式,扩展到其它几种元素的单质及化合物中去,较系统地掌握卤族知识。
知识网络图如右:⒉相似性:按“事实→规律→本质”程序去理解和记忆。
以卤素单质为例,主要事实包括:①均易溶于有机溶剂;②跟金属反应生成金属卤化物;③跟氢气反应生成卤化氢;④跟水反应生成氢卤酸与次卤酸(氟除外);⑤跟碱反应生成金属卤化物和含氧酸盐;⑥卤素中较活泼的单质把较不活泼的卤素从它们的卤化物溶液中置换出来等。
大家可以试着归纳一下卤化氢的相似性。
⒊递变性:经常讲到的递变规律有:半径(原子、离子)、溶沸点、状态、单质颜色、氧化性(或还原性)、卤化氢的对热稳定性等。
具体表述可以自己展开。
⒋特殊性:①氟元素只有–1价,没有正价;②氟单质与水反应生成氧气;③氢氟酸是弱酸,其余三种为强酸;④氟化银溶于水,其余三种不溶于水也不溶于硝酸;⑤氟化钙不溶于水,其余三种可溶于水;⑥液溴易挥发,固体碘易升华;⑦碘单质遇淀粉溶液显蓝色;⑧因为I–的强还原性,碘与铁形成的化合物只有FeI2。
二、抓重点⒈抓重要物质:主要是两种。
⑴氯水:①成分:强调分析方法,再扩展到久置、新制的情况,最后引申到实验室使用问题(只能现配现用,并盛放在棕色试剂瓶中)。
②性质:从成分角度看其多重性质,要结合具体问题具体分析。
如:Ⅰ、Cl2参与反应:与Br–、I–、S2–、Fe2+等具有还原性的离子反应,分别生成Br2、I2、S、Fe3+;与KCl–淀粉溶液(或试纸)作用。
Ⅱ、Cl–参与反应:遇硝酸银溶液时起主要作用。
Ⅲ、H+与Cl2能同时参与反应:如在新制的氯水中加入镁粉,发生Mg+Cl2=MgCl2和Mg+2HCl= MgCl2+H2↑反应。

第四章 卤素本章视点一、本章内容分析1.本章位于碱金属之后,元素周期律之前,是第一次系统地学习非金属族元素.在学习中要注意对物质的性质、有关概念和方法等知识的归纳、整理.积累丰富的感性材料,是学好本章内容的关键.学好了本章内容,也为学习下一章“元素周期律”打下了坚实的基础.本章内容也是高考内容的热点,希望大家能学好本章内容.2.本章内容分为氯气、卤族元素、物质的量在化学方程式计算中的应用三节必学内容和含卤化合物的主要用途、海水资源及其综合利用两节选学内容.这些内容主要分为三个部分,一是卤素单质的性质,包括第一节和第二节的前两部分,以氯为代表,介绍了卤素单质的相关知识,二是第二节的后一部分和选学内容,本部分内容注重理论联系实际,以便开阔视野、丰富知识;第三部分即第三节,通过学习物质的量应用于化学方程式的计算,加深对物质的量的概念的理解,巩固所学的元素化合物知识,培养学生的计算能力和严谨的学习态度.3.本章重点:卤族元素性质的变化规律.本章难点:物质的量应用于化学方程式的计算.二、学法指导在本章学习过程中,要充分应用化学实际对元素的单质及其化合物知识进行探索、研究或验证.要注意应用分析、综合对比、联想、归纳、整合等思维方法,使知识系统化,从而形成较完整的知识体系,既提高学习效率,又便于灵活应用,同时还要掌握学习元素化合物知识的一般模式:1.对于每一族元素可以从下面几个方面归纳:2.对于某一种元素(典型代表元素),可以从以下几个方面进行整理:⎪⎪⎪⎩⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎩⎨⎧重要的盐其他化合物非金属含氧酸金属碱氧化物对应水化物氧化物化合物单质元素)()( 3.对于某一种物质(典型代表物质),可以从以下几个方面进行研究:⎪⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎪⎨⎧工业保存法实验室保存法贮存由性质特征决定检验理的方法根据物质的性质采用合液化工业帛法实验室帛法制取性质决定用途用途在在自然界中是否稳定存存在盐等的反应碱酸水氧化物分别与单质化学性质溶解性等方面沸点熔密度硬味态色物理性质电子式等结构式结构物质;②①:;②①:::::、、、、、:,、,、、、、:、:。

芯衣州星海市涌泉学校物探中心第一分校高中化学卤素复习教案[高考要求分析]1.卤族元素是典型的非金属元素,氯元素是卤族元素的代表。
所以,氯及其化合物往往是每年高考的热点。
经常涉及到氯气、氯化氢、次氯酸盐和次氯酸等物质。
2.要纯熟掌握氯气的性质、用途和制法〔工业制法和实验室制法〕。
纯熟掌握氯化氢的构造、性质、用途和制法。
在中学化学课本中对次氯酸和次氯酸盐的性质表达不多,但在复习中也要作为重点加以挖掘和推广。
3.从Cl2的构造和性质入手理解F2、Br2、I2等卤素单质的性质和用途等,理解卤素性质的变化规律。
4.从氯化氢的构造和性质入手理解卤化氢的性质和用途,理解卤化氢的性质变化规律及其它卤素化合物性质的变化规律。
5.理解Cl-、Br-、I-等卤素离子的性质变化规律和检验方法,理解金属卤化物的性质。
熟记F2、I2、HF、CaF2、AgF等卤素单质和化合物的特性,能从卤素单质及化合物性质的变化规律中理解某些物质的特性。
6.掌握利用化学方程式的计算,掌握利用离子方程式计算,利用热化学方程式的计算。
7.能根据氧化复原方程式、电极反响式进展有关电子得失、化合价升降等计算。
8.利用化学方程式进展是高考试题中必考内容之一。
计算中要注意灵敏应用物质的量、质量守恒定律。
[知识综合脉络]氯及其化合物联络网络[根底知识梳理]一.氯气1.化学性质Cl原子最外层有7个电子,表现强氧化性。
〔1〕与金属反响Cl2与绝大多数金属能反响〔除极少数不活泼金属〕,且变价金属〔如Fe〕一般能氧化到最高价。
〔2〕与非金属的反响氯气除与H2反响外,还能与P、S、Si等非金属反响〔3〕与化合物的反响①跟水反响:Cl2+H2O HCl+HClO〔歧化反响〕水溶液称氯水,氯水存在的微粒,分析一下其中存在哪些分子、哪些离子?②跟碱反响:Cl2+2NaOH=NaCl+NaClO+H2O〔实验室中常利用该反响用来吸收多余Cl2〕2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O〔工业上用来制取漂白粉〕。

高一化学:卤族元素的物理性质教案一、教学目标1、了解卤族元素的性质及它们的分布规律。
2、了解卤族元素的分子特性和物理性质,掌握它们物理性质的关键点。
3、能够运用所学知识,去理解和解释实际生活中与卤族元素有关的现象。
二、教学重点难点1、卤族元素的物理性质。
2、卤族元素在实际生活中的应用。
三、教学内容1、卤族元素的概述卤族元素包括氟(F)、氯(Cl)、溴(Br)、碘(I)和石碳(At)五种元素。
它们的原子核外层电子结构相同,都是ns²np⁵。
这五种元素在自然界种分布极广泛,其中氯和钠离子的结合体-氯化钠是在海水中的最主要成分。
而氟、碘等元素也分别广泛地存在于人体液体、地下水、岩石中。
2、卤族元素的分子特性卤族元素的分子中,原子间的相互作用较弱,分子都是单质状态,且能形成不同形态。
其中,氯和溴都可以形成蓝色气体,而碘则是紫红色晶体。
3、卤族元素的物理性质卤族元素是具有活泼性的非金属,其物理性质包括密度、熔点、沸点等,下面对每一个物理性质逐一进行讲解。
(1)密度卤族元素的密度由小到大排列为:氟<氯<溴<碘<石碳,且都小于水。
(2)熔点和沸点卤族元素的熔点和沸点大小顺序为氟<氯<溴<碘<石碳,呈现出逐渐升高的趋势。
可以根据这个趋势判断元素的相对分子量。
(3)电子亲和能电子亲和能指的是一个元素原子获得一个外层电子形成束缚离子所需要的能量。
在卤族元素中,它的大小来自于原子的大小,越小的原子电子亲和能越大,反之亦然。
卤族元素的电子亲和能由小到大排列为:碘<溴<氯<氟<石碳。
(4)电导率由于大部分卤族元素都是不良导体,在常温常压下无法导电。
仅当这些元素被加热至很高的温度时才会有极少量的离子产生,才能形成电导。
四、应用技术卤族元素在实际生活中有多种应用技术,这里简单介绍常用的几个。
(1)氧化铁的生产氯化铁是制造氧化铁的原料,其最佳生产条件需在高温状态下,将氯化铁注入高档烤箱中,在通风的条件下无氧加热。


族元素包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)等,它们最外层电子数都是7个电子,是元素周期表中的第ⅦA 元素。
第二节氯及其化合物一、氯气的性质及用途:[要点1]物理性质:常温下,氯气是黄绿色、有刺激性、能溶于水、比空气重、易液化的有毒气体。
[要点2]化学性质:氯气(Cl2)是双原子分子,原子的最外层有七个电子,是典型的非金属元素,单质是强氧化剂。
自然界中不存在游离态的氯,所有的氯元素均以化合态存在,主要以氯化钠的形式存在于海水或陆地的盐矿中。
氯气是化学性质很活泼的非金属单质。
(1)与金属反应(与变价金属反应,均是金属氧化成高价态)如:①2Na+Cl22NaCl(产生白烟)②Cu+Cl2 CuCl2(产生棕黄色的烟)③2Fe+3Cl22FeCl3(产生棕色的烟)注:常温下干燥的氯气或液氯不与铁反应,所以液氯通常储存在钢瓶中。
(2)与非金属反应如:①H2+Cl22HCl(发出苍白色火焰,有白雾生成)——可用于工业制盐酸H2+Cl22HCl(会发生爆炸)——不可用于工业制盐酸②2P+3Cl22PCl3(氯气不足;产生白雾)2P+5Cl22PCl5(氯气充足;产生白烟)磷在氯气中剧烈燃烧,产生大量的烟、雾。
雾是PCl3,烟是PCl5(3)与水反应:Cl2+H2O = HCl+HClO(4)与碱反应 Cl2+2NaOH = NaCl+NaClO+H2O(用于除去多余的氯气)2Cl2+2Ca(OH)2 = Ca(ClO)2+CaCl2+2H2O(用于制漂粉精)Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO(漂粉精的漂白原理)将氯气通入Ca(OH)2溶液中制备漂白粉,漂白粉的主要成份是CaCl2、Ca(ClO)2,其有效成份是Ca(ClO)2。
工作原理:Ca(ClO)2 + H2O+CO2 ===CaCO3↓+ 2HClO(5)与某些还原性物质反应如:①2FeCl2+Cl2 = 2FeCl3 ②2KI+Cl2 = 2KCl + I2(使湿润的淀粉-KI试纸变蓝色,用于氯气的检验)③SO2+Cl2+2H2O = 2HCl + H2SO4(6)与某些有机物反应如:①CH4+Cl2 CH3Cl + HCl(取代反应)②CH2=CH2+Cl2→ CH2ClCH2Cl(加成反应)[要点3]氯水的成分及性质:氯气溶于水得黄绿色的溶液----氯水。

高一化学卤族元素知识点总结
嘿,同学们!今天咱就来好好唠唠高一化学里超重要的卤族元素知识点!
先来说说氟,氟这家伙可厉害啦!就好比是一个小霸王,超级活泼,几乎能和所有东西发生反应。
还记得老师给我们做的那个实验吗,氟气一遇到氢气,“嘭”地一下就爆炸了,那威力可吓人了!
氯呢,它就像是一个勤劳的小蜜蜂,用途广泛得很呐!咱平时用的自来水不就是用氯气消毒的嘛!“哎呀,要是没有氯消毒,那水得有多脏啊!”
溴呢,它是个挺特别的存在。
它的颜色,哎呀,那深棕红色,可太有辨识度啦!就像人群中那个特别显眼的人一样。
碘也很有意思呀!碘遇淀粉会变蓝,这可太神奇啦!“嘿,这不就像是变魔术一样嘛!”想想看,要是你用这个小魔术逗逗小伙伴,肯定能让他们大吃一惊呢!
卤族元素它们之间也有联系呀,从上到下,氧化性逐渐减弱,这就好像爬楼梯一样,越往下走越累。
那它们的化学性质呢,也各有千秋。
氟的活泼,
氯的广泛应用,溴的颜色,碘的神奇反应,组合在一起,哇塞,这就是一个精彩的化学世界!
在学习卤族元素的时候,可不能死记硬背哦,要多动手做实验,多观察,多思考。
“这不就跟咱玩游戏一样吗,得去探索,才能发现乐趣呀!”只要咱们认真对待,肯定能把卤族元素的知识点都掌握好。
总之呢,卤族元素是化学世界里非常有趣又重要的一部分,它们的存在让化学变得更加丰富多彩!同学们,加油去探索吧!。
学科教师辅导讲义学员编号:年级:高一课时数:3 学员姓名:辅导科目:化学学科教师:课题卤族元素专题授课日期及时段教学目的1、了解氯及其重要化合物的主要性质2、理解卤素单质的化合物的相似性和递变性3、掌握X-的检验方法教学内容一、卤族元素的“原子结构——性质”的关系结论:结构决定性质,性质反映结构。
二、卤族元素的“性质——制备”的关系卤族元素的化学性质活泼,所以在自然界中以化合态的形式存在。
1、卤素单质的制备(Cl2)——氧化还原法⑴工业制法:电解饱和食盐水2NaCl+2H2O−−−→电解2NaOH+H2↑+Cl2↑电解熔融氯化钠2NaCl−−−−→电解熔融2Na+ Cl2↑⑵实验室制法:强氧化剂+浓盐酸反应制取氯气:原理与装置:MnO2+4HCl(浓)−−−→加热MnCl2+Cl2↑+2H2O2、卤化氢的制备——难挥发酸制挥发性酸微热NaHSO4+HCl↑NaCl(固)+H2SO4(浓)−−−→强热Na2SO4+2HCl↑2NaCl(固)+H2SO4(浓)−−−→三、卤族元素的“一般——特殊”的归纳卤族元素的单质及其化合物有许多共性,但也存在诸多特殊之处。
(一)单质1、物理性质化学式F2Cl2Br2I2颜色淡黄绿色黄绿色深红棕色紫黑色状态气体气体液体固体密度逐渐增大熔沸点逐渐升高水溶液浅黄绿色橙色黄色CCl4溶液黄绿色橙红色紫红色毒性剧毒有毒剧毒有毒Cl2、Br2、I2在水中的溶解能力比较小,但较易溶于有机溶剂中,常见的有机溶剂有:汽油、苯、四氯化碳、酒精等。
2、化学性质(主要体现强氧化性)⑴与金属反应:Fe、Cu等,但由于氧化能力不同,产物不完全相同点燃2FeCl32Fe+3Cl2−−−→点燃2FeBr32Fe+3Br2−−−→点燃FeI2Fe+I2−−−→⑵与非金属反应:H2、P等都可以与氢化合生成相应的氢化物HX,但卤族元素按原子序数递增的顺序从上至下,与氢化合的难易程度逐渐增大,产生的气态氢化物的稳定性逐渐减弱,其水溶液的酸性逐渐增强。
卤族元素复习一、卤族元素的相似性、递变性和特殊性二、基础知识梳理一、卤素的原子结构和单质的物理性质 随卤素核电荷数增加,电子层数依次递增,原子半径渐增大,其原子结构的递变而使卤素单质的物理性质呈规律性变化. 从F 2I 21.颜色渐加深,状态从气 液 固,密度从小 大,熔沸点由低 高(分子晶体)2.单质的溶解性——除氟外(与水剧烈反应)在水中溶解度都较小,且由大 小,都易溶于有机溶剂,下表列出Cl 2、Br 2、I 2在不同溶剂中的颜色.二、卤素的化学性质由于最外层均为7个电子,极易得一个电子,因此卤素都是强氧化剂,在自然界均只以化合态存在.但随着电子层数递增,原子半径渐增大,核对外层电子的引力渐减弱,得电子能力渐减弱,其氧化性逐渐减弱,主要表现:1.都能与金属反应①F 2和所有金属都能反应. ②Cl 2和绝大多数金属反应.③Br 2和较活泼金属反应.④I 2只和活泼金属反应.2.都能与H 2、P 等非金属反应.①F 2和H 2在暗处即爆炸②Cl 2和H 2需光照爆炸③Br 2和H 2需加热且缓慢化合(不爆炸)④I 2(蒸气)和H 2持续加热且仍为可逆反应. 3.特性:易升华①I 2 ②溴——唯一的常温呈液态的非金属,易挥发保存时加水封.③F 2——最强氧化剂,不能用氧化剂将F -氧化为F 2(只能用电解法)F 元素无正价.且能与稀有气体化合.④卤化氢——均易溶于水,在空气中形成白雾,其中只有HF 剧毒,但HX 都是大气污染物,水溶液均呈酸性,只有氢氟酸是弱酸,从HF →HI ,酸性逐渐增强.⑤NaX ——只有NaF 有毒可用作农药.⑥CaX 2——只有CaF 2不溶于水,CaCl 2作干燥剂.⑦AgX ——只有AgF 可溶,AgX 均具感光性,AgBr 作感光材料,AgI 作人工降雨材料。
⑧HClO 、HClO 2、HClO 3、HClO 4酸性逐渐增强,氧化性逐渐减弱卤素的性质○1卤素能溶于水,易溶于有机溶剂(酒精、苯、四氯化碳、丙酮等)。